Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zebra balığı Beyin Etiketleme ve Görüntüleme Hücreleri
Bu Makalede
Erratum Notice
Özet
Erken embriyo şekli morfogenetik süreçleri anlamanın anahtarı, yüksek çözünürlükte görüntü hücrelerinin yeteneği. Biz burada tüm zebrafish embriyolar membran hedefli Yeşil Floresan Protein hücrelerin tek hücreler veya küçük kümeler etiketleme için kullanılan bir tekniktir açıklar.
Özet
Anahtar erken omurgalı embriyo şekli morfogenetik süreçleri anlamak için yüksek çözünürlükte görüntü hücrelerinin yeteneği. Zebra balığı embriyosu, enjeksiyon, mozaik ifade plazmid DNA sonuçlarının tek hücreler veya küçük hücre kümeleri görünüm için izin
Protokol
1.Microinjection
- Sulandırınız plazmid kodlama membran hedefli Yeşil Floresan Protein (mGFP Richard Harland nezaket) 40 ng / ml 'lik bir konsantrasyon. DNA Qiagen Maxi Hazırlık Seti kullanarak saflaştırılmış plazmid (Richard Harland mGFP/PCS2 +, nezaket) doğrusallaştırma tarafından hazırlanmıştır. Çözümü için fenol kırmızısı (1 / 10 toplam hacmi seyreltilmiş) eklenmesi çözüm görselleştirmek için tercih edilir. Buz üzerinde DNA çözüm tutun.
- Kademeli bir slaytta iğne hizalayarak ve yavaşça temiz bir jilet kullanarak çapı 1 mikrona kadar iğne vurma, stereomikroskop altında, enjeksiyon iğnesi (Cat No. NA-GD-1 Narishinge Bilimsel, 90mm cam kılcal damarlar) kalibre bıçak (uygun büyüklükte bir ipucu elde etmek için).
- Bilinen bir hacmi (2nl) enjekte etmek için iğne kalibre için, mikroenjeksiyon aparatı iğne bağlamak (PCI 100 mikroenjektör; Harvard Apparatus) ve ön bir parça yerleştirilir fenol kırmızısı ve su içeren bir çözüm 0.5μl iğne doldurmak parafin. Çözüm, bir ayak pedalı kullanılarak reçete edilebilir. 7 KPa basınç ayarlama ve çözüm 0.5μl dağıtmak için 250 pedallar alır, böylece (10msec 30msec) zaman değişebilir.
- Nemlendirilmiş bir 100 mm Petri kabında balmumu bir şerit kalibre iğne dikkatlice yerleştirin. Çanak nemlendirmektir, kenarlarda ıslak Kimwipes (iğne çözüm buharlaşmasını önler) koyun.
- Mikropipet iğne sonunda (kalibre değildi sonu) içine DNA 0.5-1μl yüklemek için kullanın.
- Çözüm iğne ucu ulaştığında, mikroenjeksiyon aparat yüklemek için kullanılan iğnenin ucunu. Ayak pedalı ile yaklaşık 2 nl / enjeksiyon sunmak için mikroenjektör ayarları yapın.
- Embriyo Orta (1.0 ml Hank Kullanıcı Stok # 1, 0.1 ml Hank Kullanıcı Stok # 2, 1.0 ml Hank Kullanıcı Stok # 4, 95.9 ml GKD 2 O, 1.0 ml Hank Kullanıcı Stok # 5 dolu bir Petri çanak ortasında Sonraki, pozisyon zebrafish embriyolar 1.0 ml taze Hank Stock # 6, pH 7,2 - 10 damla 1 M NaOH hakkında kullanın).
- Embriyoların istenilen aşamaya geliştirilen sonra, yavaşça ince forseps ile koryon kavrama ve enjeksiyon için hedeflenen bölgeye iğne bulunurdu. Geniş mGFP ifade 1cell aşamada yumurta sarısı ya da sitoplazma içine DNA enjekte edilir. Küçük bir bölgeye mGFP ifade kısıtlamak, tek bir hücrenin sitoplazmasında içine 4 (veya daha fazla) hücreleri aşamasında DNA enjekte etmek.
- Mikroenjeksiyon cihazların ayak pedalına basın ve yaklaşık 2 nl teslim çözüm (fenol kırmızı ek nedeniyle görünür) düzgün bir şekilde enjekte edilir sağlamak.
- Embriyo iğne dikkatlice çıkarın.
- Petri kabındaki bütün embriyolar için yineleyin.
- Embriyolar 28.5 ° C istenilen aşamaya geliştirmek için izin verin.
- Yavaşça ince forseps (embriyolar embriyo hayatta kalma oranını artıran bir cam Petri kabındaki dechorionating, 24hpf daha genç iseniz) kullanarak koryon sıyrılarak Dechorionate embriyolar.
- Petri kabı cam bir pipet kullanarak boş koryon çıkarın.
2. Görüntüleme mGFP etiketli vibratome bölümleri
- 1X fosfat tampon solüsyonu (PBS) sabitleştirici (% 4 paraformaldehid içine embriyolar taşımak için bir cam pipet kullanın. 4 ° C gecede embriyolar Fix.
- 1X PBS embriyoların 3 kez her biri için 5 dakika yıkayınız.
- Petri kabı ve güzel forseps kullanarak embriyoların yerleştirin, yumurta sarısı embriyonun zarar vermeden çıkarın. Mümkün olduğunca çok sarısı çıkarın.
- H 2 O% 4 düşük erime agaroz hazırlayın
- Erimiş agaroz, plastik bir kesit kalıp içine yerleştirin.
- Petri kabı enjekte embriyo kaldırmaya ve ince forseps agaroz yer ve yönlendirmek için kullanın. Embriyo kalıp sonuna doğru yerleştirilmelidir.
- Agaroz sertleştikten sonra agaroz blok, kalıptan çıkarmak için, düz bir yüzey aracı, bir spatula gibi kullanın.
- Hatta böylece bir jilet ile agaroz bloğunun alt ucundan kesin.
- Vibratome sahne süper yapıştırıcı bir damla ekleyin ve agaroz bloğu (ustura ile tesviye blok yan tutkal bakmalıdır) yerleştirin. Birden fazla embriyoların kesit için, sahnede birkaç agaroz gömülü dokulardan monte edin.
- (Vibratome A.Ş.), sahne vibratome vibratome takın.
- (Kalınlık-50μm hız-3 ortak ayarları) vibratome parametreleri ayarlayın. Eğer birden fazla embriyoların kesit, sahnede agaroz bloklar hizalayın ve (aynı embriyo ilgili bölümler bir araya kalacağını gibi) bıçak agaroz bloklar tüm genişliği ile tüm embriyo geçer ama o sağlamak.
- Vibratome aşamasında 1X PBS dökün.
- Bölümü.
- Embriyolar sectio.ned, vibratome aşamasından agaroz blok (ler) kaldırmak.
- Her bölüm, agaroz blok (ler) in arka kesim tarafından dikkatle ayırın.
- 1X PBS dolu çok iyi çanak (farklı embriyolar karşılık bölümleri için farklı kuyu kullanmak) istenilen bölümleri ve yer seçmek için ince forseps kullanın.
- Her embriyo için tekrarlayın.
- Antikor etiketleme ile devam mGFP görüntüleme (bölümler hazırlık, bir veya iki gün içinde görüntülü eğer bu adım gerekli olmayabilir) geliştirmek için olsa 23 19 adım.
- Non-spesifik bağlama engellemek için 1X PBS engelleme çözümü ile oda sıcaklığında 30 dakika için bölümler davranın.
- Birincil antikor (tavşan-GFP, Invitrogen Cat No A11122) 4, 5 saat oda sıcaklığında veya gece için bir çalkalayıcı engelleme çözümü @ 1:200 seyreltilmiş ° C ile inkübe bölümler
- % 1, BSA/1X PBS /% 1 DMSO çözüm dört kez (10 dk, 15 dk, 30 dk ve 60 dk, her) yıkayın.
- 4 5 saat oda sıcaklığında veya gece için engelleme çözümü uygun ikincil antikor ile bölümleri davranın ° C.
- % 1, BSA/1X PBS /% 1 DMSO çözüm dört kez (10 dk, 15 dk, 30 dk ve 60 dk, her) yıkayın.
- Çekirdeklerin leke 30 dakika; DAPI (Invitrogen Cat No D1306 50ml 1X PBS içinde% 0.1 DAPI) bölümleri davranın.
- Her 5 dakika için 1X PBS içinde üç kez yıkayın.
- Mount slaytta.
- Konfokal mikroskobi kullanarak görüntü.
3. Canlı görüntüleme
- Bunlar istenen gelişimsel aşamaya ulaşmak Dechorionate canlı, enjekte edilen embriyolar 30 dakika önce. 15 dakika için sedatif çözüm embriyolar (0.01% Tricaine Embriyo yılında Orta) yerleştirin.
- (Parça No P35G-o-20-C Mattek) 35mm cam alt kültür tabağına% 1 agaroz bir damla yerleştirin.
- Agaroz katılaşmasını sağlayın.
- 3 delik agaroz (mikropipet ipuçları gibi diğer nesnelerle delik açmak için kullanılan olabilir) yapmak için ateşte Isı kılcal tüp. Hiçbir kalıntı agaroz delik altında olduğuna emin olun.
- Embriyo Orta Petri kabı doldurun.
- Delik embriyo bir cam pipet kullanın.
- Daha sonra, şark alanı (dorsal baş) görüntülü böylece ince forseps kullanılarak embriyo cam ile temas halinde.
- Dikkatlice mikroskop aşamasında (buharlaşmasını önlemek için Petri kabı kapağı üzerinde yer) Petri kabı taşımacılık.
- Görüntüleme ederken, embriyoların 28.5 ° C olduğunu olun
4. Sonuçlar
Burada mozaik ifade kullanarak zebrafish nöral tüp görüntü tek hücre için basit bir yaklaşımdır açıklar. Zebrafish embriyo optik şeffaflık rağmen, sinir hücrelerinin görselleştirme vibratome kullanılarak elde edilen kesitler büyük ölçüde gelişmiş olduğunu bulduk. Bu bölümler konfokal mikroskop kullanarak farklı odak düzlemleri belirli bir hücre, hücresel uzantısı görüntüleme için izin kalın (50 mm). Sonuçlar bu yöntemi kullanarak başka bir yerde 2 yayınlandı, ama bir WT embriyo (Şekil 1) ve N-kaderin (N-cad) nöral tüp hücreleri temsilcisi görüntüleri mutant (Şekil 2) verilmektedir. İkincisi, mutantlar (Şekil 2) orta hatta doğru düzgün bir şekilde yönlendirmek için başarısız N-cad nöral plaka lateral bölgelerde hücrelerin ortaya koymaktadır. Bu mozaik etiketleme aksine, beta-katenin gibi genel bir hücre yüzey işaretleyici ile neuroepithelium immün tek tek hücrelerin morfolojisi (Şekil 3) görüntülenebilmekte izin vermez.
Canlı embriyo zaman atlamalı görüntüleme neurulation sırasında yer alan hücresel dinamiklerinin daha iyi anlaşılmasını sağlayan, sabit örneklerinin mozaik etiketleme tamamlanmaktadır. Movie 1 WT hücreleri aktif mediale odaklı membran çıkıntılar uzanan orta hatta doğru göç ettiğini ortaya çıkardı.
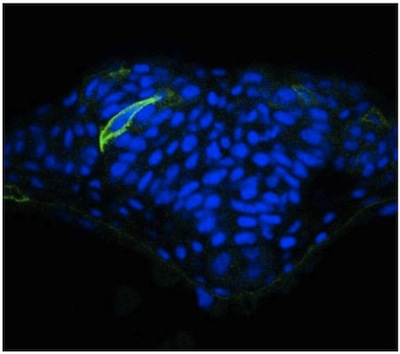
WT zebrafish embriyo nöral tüp Şekil 1. mGFP ifade.

Şekil 2 N-kaderin zebrafish embriyo nöral tüp mGFP ifade.
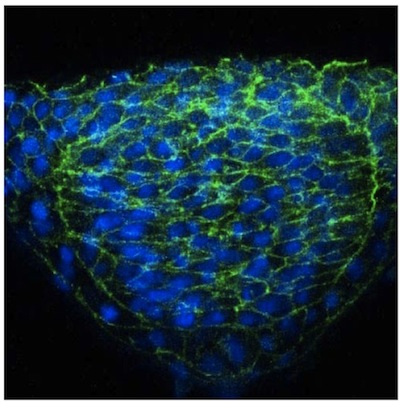
Neuroepithelium Şekil 3-katenin immün boyama.
Tartışmalar
Sonuç olarak, etiketleme teknikleri zebrafish embriyo morfogenetik süreçleri tek bir hücre analizi için izin olarak tanımlanmıştır. Bu protokolün temel vurgu nöral tüp kontrolü altındaki her yerde bir organizatörü mGFP kullanarak görüntüleme etiketli hücreleri için yöntemler. Andersen ve arkadaşları tarafından yeni bir kağıt bu geçici ifade test okuyucuların ek uygulamalar için başvurmalıdır. 3.
Açıklamalar
Teşekkürler
Bu çalışma, R. Brewster (1R01GM085290-01A1) verilen bir NIH hibe ile desteklendi.
Malzemeler
Çözümler
- Hank Stock # 1: 8.0 g NaCl, 0,4 g KCl 100 ml dd H 2 O
- Hank Stock # 2: 0,358 g Na 2 HPO 4 Susuz, 100 ml GKD 2 O 0.60 g KH 2 PO 4
- Hank Stock # 4: 50 ml GKD 2 O 0.72 g CaCl 2
- Hank Stock # 5: 50 ml dd H 2 O 1.23 g MgSO 4 x7H 2 O
- 1 X Fosfat Tamponu:% 0.8 NaCl,% 0,02 KCl 0,02 M PO4, pH 7,3
- Engelleme Çözüm:% 2 normal keçi serumu,% 1 sığır serum albumini (BSA),% 1 dimethysulfoxide (DMSO)
Referanslar
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish Practical approach series. , (2002).
- Hong, E., Brewster, R. N-cadherin is required for the polarized cell behaviors that drive neurulation in the zebrafish. Development. 133, 3895-3905 (2006).
- Andersen, E., Asuri, N., Clay, M., Halloran, M. Live Imaging of Cell Motility and Actin Cytoskeleton of Individual Neurons and Neural Crest Cells in Zebrafish Embryos. J Vis Exp. , (2010).
Erratum
Formal Correction: Erratum: Labeling and Imaging Cells in the Zebrafish Hindbrain
Posted by JoVE Editors on 9/16/2010. Citeable Link.
A correction was made to Labeling and Imaging Cells in the Zebrafish Hindbrain. There was an error in the authors affiliations. The authors have been corrected to:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster1
1Department of Biological Sciences, University of Maryland, Baltimore County
2Center for Neuroscience, Children's National Medical Center
instead of:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster2
1Center for Neuroscience, Children's National Medical Center
2Department of Biological Sciences, University of Maryland Baltimore County
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır