Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Genetik olarak tadil edilmiş hücre transplantasyonu için Micropatterned kültür plakalarında Sferoid hücrelere karşı gene
Bu Makalede
Özet
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Özet
Hücre nakli terapötik etkinliğini artırmak için, genetik olarak tadil edilmiş, enjekte küremsi bir transplantasyon sistemi geliştirilmiştir. Hücre sferoidler bir ısıya duyarlı bir polimer ile kaplanmış micropatterned plakalar üzerinde bir kültür sistemi içinde hazırlanır. Sferoidlerin bir dizi, bir polietilen glikol (PEG) matris ile kaplanır yapıştırıcı olmayan bölgeler tarafından sarılmış düzenli olarak iki boyutlu bir şekilde dizilmiş olan 100 um çaplı hücre yapışma alanları, tekabül eden plakalar üzerinde oluşturulur. sferoidler kolay plakaların sıcaklığın düşürülmesiyle, bir sıvı süspansiyon olarak elde edilebilir, ve bunların yapısı iyi (27 g fazla) yeteri kadar büyük bir kalibreye sahip enjeksiyon iğneleri içinden geçirilerek muhafaza edilmektedir. Genetik modifikasyonlar küremsi yapıyı bozmadan hücrelerine gen dahil etme yeteneğine sahip olan, orijinal viral olmayan gen taşıyıcı, Polyplex nanomicelle, kullanılarak gen transfeksiyonu ile elde edilir. Prim içinalbümin ekspresyonu ile gösterildiği gibi, bir lusiferaz sentezleyen bir gen ile transfekte ary hepatosit sferoidler, lusiferaz sürdürülebilir, korunmuş hepatosit işlevi ile birlikte, nakledilen hayvanlarda elde edilir. Bu sistem, mezenkimal kök hücreleri dahil olmak üzere hücre tiplerinin çeşitli uygulanabilir.
Giriş
Hücre nakli tedavisi çeşitli inatçı hastalıkların tedavisi için yaygın ilgi gördü. nakledilen hücreler tarafından salgılanan aktivite ve biyolojik olarak aktif faktörlerin yarı-ömrü, bir hücre transplantasyonu sisteminin geliştirilmiş bir terapötik etkinliği için önemlidir. Transplantasyon öncesinde hücrelerin genetik modifikasyon düzenleyen ve biyolojik olarak aktif faktörlerin salgılanması da dahil olmak üzere hücresel fonksiyonları, işlemek için faydalı bir tekniktir. Bu hücre ölümünü ya da hücre aktivite kaybını önlemek için bir hücre için uygun bir mikro-ortam sağlamak için de önemlidir. Hücre-hücre etkileşimleri iyi korunmuş olan üç boyutlu (3D) küremsi hücre kültürü, (primer hepatosit albümini sekresyonu iyileştirilmesi ve mezenkimal kök hücrelerinden çok soyundan farklılaşmasını teşvik etmek için, örneğin, bu amaç için MKH'lerin umut verici ) 1-7.
Spheroi Bu çalışmada, yeni bir kombinasyon sistemid kültürü ve gen transfeksiyon genetiği değiştirilmiş hücre nakli için bir platform olarak hizmet için kullanılır. Küremsi hücreleri oluşturmak için, micropatterned kültür plakaları üzerinde küremsi kültür sistemi kullanılır. Bu plakalar halinde, 100 um çapında hücre yapışma alanları düzenli olarak iki boyutlu bir şekilde dizilir ve bir PEG matrisi 3 ile kaplanmış yapışkan olmayan bölgelerde ile çevrilidir. Hücrelerin yeterli sayıda tohum olarak, çapı 100 um 3D sferoitlerin dizileri micropatterned kültür yatağı tekabül oluşturulur.
sferoidler bir ısıya duyarlı bir polimer, poli (izo-propylacrylamide) ile kaplanmıştır ısıya duyarlı hücre-kültür plakaları kullanılarak, 3B yapısına (PIPAAm) 8-10 bozmadan geri kazanılır. micropatterned mimari termosensitif plakalar üzerinde inşa edilmiştir (özel yapım). Sadece plakaların sıcaklığını düşürerek, sferoidler kültür yatağı ayrılır ve dağıtmak vardırfosfat D salin (PBS) tamponlu. Bu durumda, 100 um muntazam bir boyutu olan sferoitlerin çok sayıda enjekte edilebilir bir süspansiyon formunda elde edilebilir.

Şekil 1. micropatterned plaka üzerinde küremsi kültür sisteminin şematik temsili. Genetik değişiklik, orijinal viral olmayan gen taşıyıcı, Polyplex nanomicelle kullanılarak gen transfeksiyonu ile elde edilir. Bu plasmid DNA (pDNA) ve polietilen glikol (PEG) -polycation blok kopolimerleri 11 oluşmaktadır. Bunlar karakteristik çekirdek-kabuk yapısını, PEG kabuk ve yoğunlaştırılmış pDNA bir iç çekirdekten oluşan tedavi amaçlı 11 hücre içine güvenli ve etkili gen tanıtım izin var. Thi büyük halini görmek için tıklayınızs rakam.
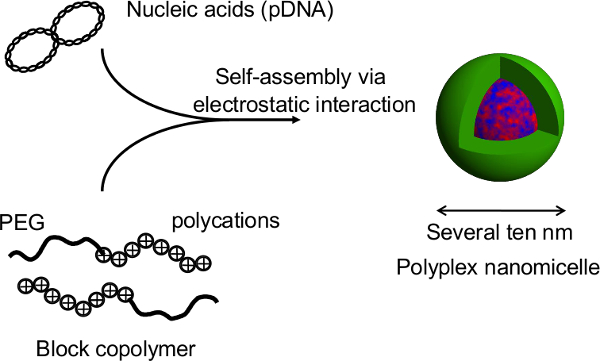
Şekil nükleik asitler ve PEG-blok-polikatyon blok kopolimerlerinin kompleks oluşturduğu Polyplex nanomicelle 2. yapısı. Bu çalışmada, bu tekniğin önemli avantajı, sferoid yapısı nanomicelles gen transfeksiyon sırasında bozulmamasına olmasıdır. Sıçan primer hepatosit küremsi nanomicelle aracılı transfeksiyonlar sonra, uzun süreli bir transgen sentezleme transfekte edilmemiş küremsi 12 ile karşılaştırılabilir bir seviyede hepatosit sürekli albümini sekresyonu fazla bir ay elde edilir. sferoidlerin gelen transgen ifadesi ve albumin salgısı da termosensitif plakalardan iyileştikten sonra sürdürülür. Bu nanomicelles güvenle HEP doğuştan fonksiyonlarını bozmadan gen tanıtım kolaylaştırabilir açıktıratocytes. Böylece, gen tanıtım nanomicelles kullanarak genetiği değiştirilmiş hücre nakli için umut verici bir platformdur ile termosensitif micropatterned plakalar üzerinde kültüre sfero hücrelerin kombinasyonu. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm hayvan çalışmaları, Tokyo Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi, Tokyo, Japonya onayı ile yürütülmüştür.
1. Hücre Hazırlanması
- Birincil hepatosit için, bir tadil edilmiş, iki basamaklı bir kollajenaz digestiyonu işlemi 13,14 sıçan hepatosit izolasyonu için protokol takip edin.
- Izofluran ile inhalasyon anestezi altında Sprague Dawley (SD) sıçanları (erkek, 5 haftalık) anestezisi. Bölmesi için izofluran sağlamak için bir anestezi makinesine bağlı bir odasında bir sıçan yerleştirin. Uykuya dalmakta sonra sıçan dışarı atın ve bir maske kullanarak havalandırma ile ameliyat masasında ayarlayın. Sıçan koşullarını kontrol ederek 0,7 L / dk - izofluran 0,4 yaklaşık akış kontrol edin. 8 g / L sodyum klorid oluşan özel bir çözeltisi (NaCl), 400 mg / L potasyum klorid (KCl), 78 mg ile hepatik portal ven Sprague Dawley (SD) sıçanları (erkek, 5 haftalık) karaciğerler serpmek / Lsodyum dihidrojen fosfat dihidrat (NaH 2 PO 4 · 2H 2 O), 151 mg / L disodyum hidrojen fosfat dodekahidrat (Na 2 HPO 4 · 12H 2 O), 2.38 g / L 2- [4- (2-hidroksietil) -1 piperazinil] etansülfonik asit (HEPES), 190 mg / L etilen glikol tetraasetik asit (EGTA), 350 mg / L sodyum hidrojen karbonat (NaHCO3) ve 900 mg / L glikoz.
- Karaciğerden kolajenaz çözeltisi sirküle.
NOT: Çözelti 500 mg / L kolajenaz, 9.8 g / L Hank tamponlu tuz, oluşan 2,38 g / ml HEPES, 556 mg / ml kalsiyum klorür hidrat (CaCl2 · H2O), 350 mg / L NaHCO 3, ve pH değeri ile 50 mg / L tripsin inhibitörü, 7.2 olacak şekilde ayarlanır. - Dikkatli bir şekilde karaciğer çıkarın ve bir bisturi bıçağını kullanarak bir tabak üzerine yavaşça kıyma, ekleme Dulbecco Modifiye Eagle Ortamı,% 10 fetal sığır serumu (FBS) ile desteklenmiş (DMEM), ve 100 um hücre süspansiyonu filtrenaylon örgü. Ek enkaz kaldırmak için, 1 dakika boyunca 20 × g hücre süspansiyonu santrifüj. Bu adımda, hepatositler süpernatan içinde bulunmaktadır.
- Iki kez santrifüj adımı (üç santrifüj toplam) tekrarlayın. 3 dk pelet formunda onları kurtarmak için Nihayet, 50 × g hepatositler santrifüj.
- % 10 FBS ile takviye edilmiş DMEM içinde oluşan özel bir kültür ortamı içinde 4 x 10 5 hücre / ml'lik bir konsantrasyonda,% 1 Pen-Strep-Glut (PSQ),% 1 dimetil sülfoksit, hepatositlerin yeniden askıya (DMSO), 0.1 umol / L deksametason, / ml insülin, 0.5 ug, 10 mmol / L nikotinamid, 0.2 mmol / L fosforile askorbat (ASC-2P), ve 10 ng / ml insan epidermal büyüme faktörü (hEGF) 15. Bu özel ortam in vitro koşullarda karaciğer fonksiyon korumak için zorunludur.
- Sıçan MKH'lerin elde etmek için, isoflur aşın uygulanması ile Sprague Dawley (SD) sıçanları (erkek, 5 haftalık), ötenaziane. Uyluk ve kaval kemiklerinden rezeke ve DMEM, 10 ml% 10 FBS ile takviye edilmiş bunu temizlemek için kemik şaftı bir 22 G iğne sokarak, kemik iliği toplamak. 100 mikron naylon elekle filtrelenmiştir hücreleri toplamak.
- DMEM,% 10 FBS ve% 1 penisilin / streptomisin içeren kullanarak 10 cm'lik kültür tabakları üzerine hücreleri tohumu. Sfero deneyleri için, 5 pasajlar içinde MKH'lerin kullanın.
3D Hücre sferoidlerin 2. Hazırlık
- Ticari olarak, hücre yapışkan alanlar düzenli PEG matris ile kaplanmış yapışkan olmayan alanlar tarafından çevrelenmiş, iki boyutlu bir şekilde, 100 um çapında dizilmiş edildiği micropatterned kültür plakaları elde.
Not: Hücre nakli için, ısıya duyarlı bir polimer PIPAAm bir ilave kaplama plakaları, soğutma hücre çıkarılabilmesi için gerekli olan (adım 5.1). Sıcaklık dalgalanmaları bu polimerin kimyasında değişikliklere neden olabilir8-10. 37 ° C'de, PIPAAm hücreler normal koşullar altında kültürlenebilir sağlayan, hafif hidrofobiktir. Hücrelerin spontan dekolmanı gelen polimerin hızlı hidrasyon 32 ° C sonuçları aşağıda sıcaklığında bir azalma. - De,% 5 CO2 içeren nemli bir atmosferde 37 ° C 'de bunları andincubate / 4 x 10 5 hücre yoğunluğunda 12 oyuklu plakalar üzerinde micropatterned hepatositleri ve mezenkimal tohumu. Hücreler micropatterned yapışma alanlarda birikir ve yavaş yavaş 2 gün içinde yuvarlak parçacıklarının oluşturacaktır.
NOT: Bir tek tabakalı kültürü, kontrol hücreleri hazırlamak için, normal bir 12 gözlü levhalar kullanmak, yukarıda tarif edilene benzer bir prosedür takip edilerek, aynı yoğunlukta hücreler tohum.
Polyplex Nanomicelles 3. hazırlanması
- (PEG Mw = 12, bir blok kopolimer, PEG-PASP (DET) (poli [(2-aminoetil) -2-aminoetil] aspartamit - - [N- N ']) sentez0.00, polimerizasyon derecesi PASP (DET) segmentin (DP) = 59) ve daha önce yazarlar 11 tarafından tarif edilen prosedürler takip edilerek, yalnızca katyonik segmenti [PASP (DET)] (DP = 55) oluşan bir homopolimer, 16, 17.
- 33.3 ug polimer konsantrasyonunun ayarlanması ile 10 mM HEPES tamponu (pH 7.3) artık amino grupları arasında eşit bir molar oranda, PEG-PASP (DET) blok kopolimer karışık çözeltisi ve PASP (DET) homopolimer hazırlanması / ml sırasıyla, 19.1 ug / mL olduğunu göstermiştir.
Not: Yukarıda tarif edilen polimer konsantrasyonları değişebilir 10. N / P oranı, pDNA (N / P oranı) fosfat grupları iki polimerden toplam amino grupları bir artık mol oranı nanomicelles hazırlamak için temsili değerler (detaylar için, Tartışma) hücre tipine ve amacına bağlı olarak. İki polimerlerin birlikte kullanımı endozomal geliştirmek için etkili PEG kalkan ve PASP (DET) işleyişini hem elde edebilirsinizkaçış 18 (detaylar için, tartışma bakınız). - PCAG-GS plazmide ilgili genleri eksprese eden bir segment (http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html klonlanmasıyla pDNA kodlayan Gaussia lusiferaz, GL4 lusiferaz veya eritropoietin hazırlanması ) kullanılarak üreticinin protokolüne göre, ticari bir kit kullanılarak CAG promoter / güçlendirici altında açığa çıkışı elde edildi. Yetkin bir Escherichia coli içinde pDNA yükseltmek ve bir endotoksin içermeyen plazmid DNA arıtma sistemi kullanarak saflaştırılması. 10 mM HEPES tamponu (pH 7.3) ve 150 ug / ml bir solüsyon elde etmek için 260 nm 'lik bir emişteki pDNA konsantrasyonunun belirlenmesi.
- (Hacim ile) 1: Polyplex nanomicelles hazırlamak için iyice pDNA çözeltisi (10 mM HEPES tampon içinde, 150 ug / ml) ve 2 oranında iki polimerin önceden karıştırılmış çözeltisi karıştırılır.
Sferoidlerin içine 4. Gen Transfeksiyon
- (Hepatositleri hücreleri inkübeOlgun sferoidlerin oluşumuna izin vermek için micropatterned plakalar üzerine tohumlama sonra 72 saat boyunca ya da MSC'ler). Gen Transfeksiyon için, taze ortam içinde 1 ml kültür ortamı değiştirilmesinden sonra her bir oyuğa (pDNA 10 ug içermektedir) Polyplex nanomicelle çözeltisi 100 ul ilave edin. 24 saat süre ile nanomicelle çözeltisi ile inkübasyon devam edin.
- Bir lipid-bazlı transfeksiyon ayıracı kullanılarak, bir kontrol için, lipit bazlı bir reaktif ve nanomicelle yöntemleri için eşit olması pDNA nihai dozu ayarlama 3 bir ağırlık oranı, reaktif / pDNA ile bir reaktif ile pDNA çözümler karıştırın.
Hücre sferoidlerin 5. Kurtarma ve Transplantasyon
- Soğutulmuş PBS içinde 200 ul kültür ortamı yerine ve buz üzerinde plakaları yerleştirin.
Not: Genellikle, sferoidler, yaklaşık 15 dakika içinde ayırmak ve nakli için bir süspansiyon formunda elde edilebilir. - Yavaşça 200 ul hücreler aspirein vivo enjeksiyonu için 23 G veya 27 G iğne ile bir şırınga kullanılarak süspansiyon.
Transjen 6. Değerlendirme
- Tam olarak 24 saat taze ortam ile değiştirildikten sonra ortam, 100 ul - Kültür ortamında salgılanan Gaussia lusiferaz ekspresyonu in vitro olarak değerlendirilmesi için, 50 toplar. Ticari bir Renilla lusiferaz deney sistemi ve üreticinin protokolüne uygun olarak, bir luminometre kullanılarak lusiferaz ekspresyonunu tahmin.
NOT: Gaussia lusiferaz, bir haftadan fazla bir kültür ortamı içinde dengeli olarak kalır. Bu durumda, transgen ekspresyonunun gerçek zamanlı etkinliğinin değerlendirilmesi örnek ortamın toplanması öncesinde taze bir orta yerine. Orta değişimin zamanlaması esnek olabilir. - Hücre transplantasyonu, aşağıdaki ana hayvanlarda transgen ekspresyonu in vivo olarak değerlendirilmesi için, BALB / c çıplak fareler (dişi anestezi; 7 haftaizofluran ile inhalasyon anestezi altında eski).
- Bölmesi için izofluran sağlamak için bir anestezi makinesine bağlı bir odasında bir fare yerleştirin. Uykuya dalmakta sonra fareyi dışarı atın ve bir maske kullanarak havalandırma ile ameliyat masasında ayarlayın. Fare şartlarını kontrol ederek 0,5 L / dk - izofluran 0,2 yaklaşık akış kontrol edin.
- Karın bölgesi içinde deri altı dokuya (4.1'de tarif edildiği gibi) GL4 lusiferaz sentezleyen pDNA ile transfekte kürecikler içeren hücre süspansiyonu 200 ul enjekte edilir.
- (150 mg / kg; damar içi yol ile) hemen D-luciferase enjekte sonra, üreticinin protokolüne uygun olarak IVIS görüntüleme sistemi kullanılarak lusiferaz ekspresyonunu ölçer.
- Hücre nakli tedavi edici etkilerini değerlendirmek için, içine eritropoetin kodlayan pDNA ile transfekte sferoitleri içeren hücre süspansiyonu 200 ul enjekteKarın bölgesi subkutan doku.
- Kan 19 yaklaşık 200 ul elde etmek submandibüler kanama kan örnekleri toplamak. Bir kan örneği analiz cihazı kullanılarak hemoglobin ve hematokrit ölçün.
Not: nakli için hücre sayısı tabakalarına tohumlanmış ile regüle edilir. Ne yazık ki, sferoitler içindeki sayı ölçülen olamaz, çünkü tam hücre sayısını belirlemek zordur.
- Kan 19 yaklaşık 200 ul elde etmek submandibüler kanama kan örnekleri toplamak. Bir kan örneği analiz cihazı kullanılarak hemoglobin ve hematokrit ölçün.
- Deneylerden sonra, anestezi uyanıyor kadar sıcaklık kontrolörü ile bağlı bir ısıtma yastığı fareler yerleştirin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Gaussia lusiferaz sentezleyen pDNA gene Polyplex nanomicelles veya kontrol lipit bazlı transfeksiyon reaktifi 12'yi kullanarak hepatositlere ya da MSC tarafından oluşturulan sferoidler uygulandı. kontrol reaktif anlamlı transfeksiyon (Şekil 3) bir gün sonra bir yapı kesintiye ise nanomicelles micropatterned tabakalarına transfekte-olmayan sferoidler kıyasla küremsi yapısı hemen hemen herhangi bir değişiklik neden olmuştur. Nanomicelles tutarlı albümini sekresyonu ve tran...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, gen girişi ve küremsi iyileşme aşamaları sırasında sferoitlerin 3 boyutlu yapısını muhafaza etmek önemlidir. Hücreler, hücre ölümünü ya da hücre aktivitesi kaybını önlemek için bir uygun mikroçevrelerde korumak için esastır. Geleneksel tek katmanlı kültürdeki hepatositler, hızla 12 tohumlamadan sonra, bir kaç gün kendi salgılama kapasitesini kaybeder Örneğin, albümin salgılama, hepatositlerin temsili bir doğuştan gelen işlevi, iyi, hepatosit sferoidler korun...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Biz derin termosensitif micropatterned kültür plakaları yanı sıra bilimsel danışmanlık sağlamak için Toyo Gosei, Tokyo, Japonya'da Dr Takeshi Ikeya ve teknik personel için teşekkür ederiz. Biz de hayvan deneyleri ile teknik yardım için Sayın Satomi Ogura, Bayan Sae Suzuki, Bayan Asuka Miyoshi ve Bayan Katsue Morii teşekkür ederiz. Bu eser mali JSPS KAKENHI Grant-Aid Bilimsel Araştırma tarafından kısmen desteklenen, İnovasyon (ÇÇ) Programı Merkezi ve Japonya Bilim ve Teknoloji Kurumu (JST) den S yenilik programı ve JSPS core için Çekirdekli Programı, A. İleri Araştırma Ağları.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
Referanslar
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır