このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
遺伝的に改変された細胞移植のためのマイクロパターン培養プレート上スフェロイド細胞に対する遺伝子導入
要約
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
要約
細胞移植の治療効果を改善するために、遺伝的に改変された、注射可能なスフェロイドの移植システムを開発しました。細胞スフェロイドは、感熱性ポリマーでコーティングされたマイクロパターン上でプレート培養系で調製されます。スフェロイドの数は、ポリエチレングリコール(PEG)マトリックスによって被覆されている非接着性領域によって囲まれ、定期的に二次元的に配列された直径100μmの細胞接着領域に対応する、プレート上に形成されています。スフェロイドは、容易にプレートの温度を低下させることにより液体懸濁液として回収することができ、その構造は、ウェル(27 G上の)十分に大きな口径の注射針に通して維持されます。遺伝子改変は、球状構造を破壊することなく細胞に遺伝子を導入することが可能である元の非ウイルス遺伝子キャリア、ポリプレックスナノミセルを用いた遺伝子導入によって達成されます。プリムのためのアルブミンの発現によって示されるように、ルシフェラーゼを発現する遺伝子でトランスフェクト進肝細胞スフェロイドは、ルシフェラーゼは持続、保存肝細胞機能と共に、移植動物において得られます。このシステムは、間葉系幹細胞を含む種々の細胞型に適用することができます。
概要
細胞移植療法は、様々な難治性疾患を治療するために広く注目を集めています。移植された細胞によって分泌される生物活性因子の活性及び半減期は、細胞移植システムの改良された治療効果のために不可欠です。移植前の細胞の遺伝子改変は、生物活性因子の分泌などの細胞機能を調節して操作するための有益な技術です。これは、細胞死または細胞活性の喪失を回避するための細胞のための良好な微環境を維持することも重要です。細胞間相互作用が十分に保持された3次元(3D)スフェロイド細胞培養物は、(初代肝細胞のアルブミン分泌を改善し、間葉系幹細胞の多系列分化を促進するために、例えば、この目的のためにMSCを約束しています)1-7。
spheroiのこの研究では、新規な組み合わせシステムD培養および遺伝子トランスフェクションは、遺伝的に改変された細胞移植のためのプラットフォームとして機能するように使用されます。スフェロイド細胞を作成するための、マイクロパターン培養プレート上でスフェロイド培養系を用いています。これらのプレート上で、100ミクロン直径の細胞接着領域が規則的に二次元的に配列され、PEGマトリックス3によって被覆された非接着性領域によって囲まれています。細胞の十分な数を播種することにより、直径100μmの3Dスフェロイドのアレイは、マイクロパターン培養ベッドに対応して形成されています。
スフェロイドは、感熱性細胞培養プレートを使用して、3D構造を破壊せずに回収される感熱性ポリマー、ポリ(イソ-プロピル)(PIPAAm)8-10でコーティングしたもの。マイクロパターンアーキテクチャは、感熱板(カスタムビルド)上に構築されています。単にプレートの温度を下げることにより、スフェロイド培養ベッドから離脱して分散されていますリン酸中のdは、緩衝生理食塩水(PBS)。従って、100μmの均一なサイズを有する球状の多数の注射懸濁液の形態で得ることができます。

図1マイクロパターンプレート上でスフェロイド培養システムの概略図。遺伝的改変は、元の非ウイルス遺伝子キャリア、ポリプレックスナノミセルを用いた遺伝子導入によって達成されます。これは、プラスミドDNA(pDNAを)およびポリエチレングリコール(PEG)-polycationブロック共重合体11で構成されています。これらは、治療目的のために11細胞への安全かつ効果的な遺伝子導入を可能にする、PEGシェルと凝縮pDNAの内部コアからなる特徴的なコア-シェル構造を有している。 THIの拡大版を表示するには、こちらをクリックしてくださいのフィギュア。
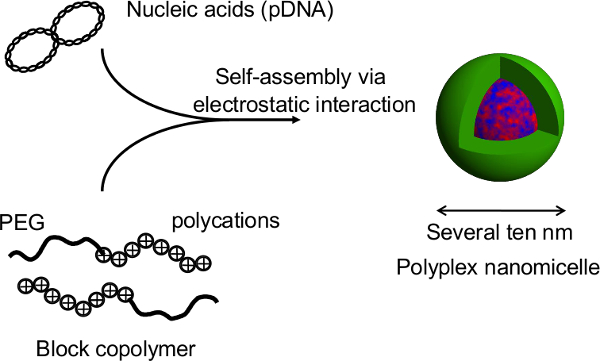
核酸およびPEG-ブロック-ポリカチオンブロック共重合体の複合体によって形成された。本研究ではポリプレックスナノミセルの図2の構造は 、この技術の主な利点は、回転楕円体の構造はナノミセルによる遺伝子トランスフェクションの際に破壊されないことです。ラット初代肝細胞スフェロイドのナノミセル媒介性トランスフェクションの後、長期の導入遺伝子の発現は、トランスフェクトしていないスフェロイド12のそれに匹敵するレベルで肝細胞からの連続アルブミン分泌と1ヶ月以上得られます。スフェロイドからの導入遺伝子発現およびアルブミン分泌も感熱プレートからの回復後も維持されています。これは、ナノミセル安全HEPの生来の機能を損なうことなく、遺伝子導入を容易にすることができることは明らかですatocytes。このように、ナノミセルを用いた遺伝子導入と感熱マイクロパターンプレート上で培養したスフェロイド細胞の組み合わせは、遺伝的に改変された細胞の移植のための有望なプラットフォームです。 この図の拡大版を表示するには、こちらをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての動物実験は、東京大学の動物実験委員会、東京、日本の承認を得て実施しました。
1.細胞の調製
- 初代肝細胞の場合は、変更された二段階コラゲナーゼ消化プロセス13,14によってラットから肝細胞を単離するためのプロトコルに従ってください。
- イソフルラン吸入麻酔下でのスプラーグドーリー(SD)ラット(雄、5週齢)を麻酔。チャンバーのためにイソフルランを提供するために、麻酔装置に接続されたチャンバ内にラットを置きます。眠りに落ちる後のラットを取り出し、マスクを使用して換気を手術台の上に置きます。ラットの条件をチェックすることにより、0.7リットル/分 - イソフルランが0.4で約フロー制御。 8グラム/ L塩化ナトリウムからなる特殊な溶液(NaCl)で、400 mg / Lの塩化カリウム(KCl)、78ミリグラムで肝門脈のスプラーグドーリー(SD)ラット(雄性、5週齢)の肝臓を灌流/ Lリン酸二水素ナトリウム二水和物(のNaH 2 PO 4·2H 2 O)、151 mg / Lのリン酸水素二ナトリウム十二し(Na 2 HPO 4·12H 2 O)、2.38グラム/ Lの2- [4-(2-ヒドロキシエチル)-1-ピペラジニル]エタンスルホン酸(HEPES)、190 mg / Lのエチレングリコール四酢酸(EGTA)、350 mg / Lの炭酸水素ナトリウム(NaHCO 3)、および900 mg / Lのグルコース。
- 肝臓を通してコラゲナーゼ溶液を循環させます。
注:溶液を、500 mg / Lのコラゲナーゼで構成されている、9.8グラム/ Lハンクス緩衝塩2.38グラム/ mlのHEPES、556 mg / mlの塩化カルシウム水和物(のCaCl 2·H 2 O)、350ミリグラム/ LのNaHCO 3、そしてpHが50 mg / Lのトリプシン阻害剤は、7.2に調整しました。 - 慎重に肝臓を取り出し、手術用メスの刃を使用して皿に静かにミンチ、追加ダルベッコ改変イーグル培地、10%ウシ胎児血清(FBS)を補充した(DMEM)、および100ミクロンを介して細胞懸濁液をフィルタリングナイロンメッシュ。追加の破片を除去するために、1分間20×gで細胞懸濁液を遠心してください。このステップでは、肝細胞は、上清中にあります。
- 二回(3遠心分離の合計)遠心分離工程を繰り返します。最後に、遠心3分間50×gで肝細胞をペレットの形でそれらを回収します。
- 10%FBSを補充したDMEMから成る特殊な培養培地中に4×10 5細胞/ mlの濃度、1%ペニシリン-ストレプトマイシン-供給過剰(PSQ)、1%ジメチルスルホキシドに肝細胞を再懸濁(DMSO)、0.1モル/ Lのデキサメタゾン、0.5 / mlのインスリン、10ミリモル/ Lのニコチンアミド、0.2ミリモル/ Lのリン酸化アスコルビン酸(ASC-2P)、および10 ngの/ mlのヒト上皮増殖因子(hEGF)15。この特別な培地は、 インビトロ条件下で肝機能を維持するために必須です。
- ラットMSCを得るためには、isoflurの過剰投与によりスプラーグドーリー(SD)ラット(雄、5週齢)を安楽死させますANE。大腿骨と脛骨を切除し、DMEM 10mlでそれをフラッシュするために、骨の軸に22 G針を挿入することによって、骨髄を収集し、10%FBSを補充しました。 100μmのナイロンメッシュを通して濾過することにより細胞を収集します。
- 10%FBSおよび1%ペニシリン/ストレプトマイシンを含むDMEMを用いて10cmの培養皿に細胞をシード。回転楕円体の実験のために、5通路内でMSCを使用します。
3Dスフェロイドの作製
- 市販の細胞接着性領域は規則的にPEGマトリックスによりコーティング非接着性領域によって囲まれ、二次元的に直径100μmで配列されたマイクロパターン培養プレートを得ます。
注:細胞移植のために、感熱性ポリマーPIPAAmと追加のコーティングは、プレートを冷却することにより、細胞剥離を可能にするために必要である(ステップ5.1参照)。温度変動は、このポリマーの化学的性質の変化を誘導することができます8-10。 37℃では、PIPAAmは、細胞が正常な条件下で培養することができるように、わずかに疎水性です。 32℃以下の温度の低下は、細胞の自発的な離脱につながる、ポリマーの急速な水和になります。 - ウェル5%CO 2を含む加湿雰囲気中で37℃でそれらをandincubate / 4×10 5細胞の密度で12ウェルマイクロパターンプレート上の肝細胞やMSCをシード。細胞は、マイクロパターンの接着領域に蓄積され、徐々に2日間で丸スフェロイドを形成することになります。
注:単層培養で対照細胞を調製するために、通常の12ウェルプレートを使用し、上記と同様の手順に従って、同一の密度で細胞を播種。
ポリプレックスナノミセルの調製
- ブロック共重合体を合成し、PEG-PASP(DET)(ポリ[N ' - [N - (2-アミノエチル)-2-アミノエチル]アスパルトアミド])(PEG Mwは12、000、重合度PASP(DET)のセグメント(DP)= 59)、および以前に著者ら11によって記載された手順に従って、唯一のカチオン性セグメント[PASP(DET)(DP = 55)から構成されているホモポリマー、 16、17。
- 33.3μgのにポリマーの濃度を調整することにより、10mMのHEPES緩衝液(pH 7.3)中の残留アミノ基の等モル比でPEG-PASP(DET)ブロック共重合体の混合溶液とPASP(DET)ホモポリマーを準備/ mlおよびそれぞれ19.1μgの/ mlで、。
注:上述のポリマー濃度変化させることができる10 N / P比のpDNA(N / P比)中のリン酸基への2つのポリマーの全アミノ基の残存モル比でナノミセルを調製するための代表的な値であります細胞のタイプと目的に応じて(詳細については、議論を参照)。 2つのポリマーの併用は、エンドソームを高めるために効果的なPEGシールドとPASP(DET)の機能の両方を達成することができますエスケープ18(詳細については、説明を参照)。 - pCAG-GSプラスミドにそれぞれの遺伝子を発現するセグメントをクローニングすることによりpDNAをコードするガウシアルシフェラーゼ、GL4ルシフェラーゼ、またはエリスロポエチンの準備(http://www.cdb.riken.jp/pcs/protocol/vector/map/m36.html )を製造者のプロトコールに従って市販のキットを用いてCAGプロモーター /エンハンサー下式を得ます。コンピテント大腸菌株でのpDNAを増幅し、エンドトキシンフリーのプラスミドDNA精製システムを使用して精製します。 10mMのHEPES緩衝液(pH 7.3)で150 / mlの溶液を得た260 nmでの吸光度でのpDNAの濃度を決定します。
- (体積比)1:ポリプレックスナノミセルを調製するために、十分のpDNA溶液(10mMのHEPES緩衝液中の150μgの/ mlで)および2の比率で2つのポリマーのプレミックス溶液を混合します。
スフェロイドに4遺伝子のトランスフェクション
- 細胞(肝細胞をインキュベート成熟したスフェロイドの形成を可能にするためにマイクロパターンプレート上に播種後72時間、またはMSCS)。遺伝子トランスフェクションのために、新鮮な培地1 mlの培養液を交換した後、各ウェルに(pDNAを10μgのを含む)ポリプレックスナノミセル溶液100μlを添加します。 24時間ナノミセル溶液でインキュベーションを続けます。
- 脂質ベースのトランスフェクション試薬を使用して制御するために、3の重量比試薬/のpDNAで試薬とのpDNA溶液を混合脂質ベースの試薬とナノミセル法の両方のために等しくなるようにpDNAの最終用量を調整します。
スフェロイドの5回復と移植
- チルド200μlのPBSと培地を交換し、氷上にプレートを配置します。
注意:一般的に、スフェロイドは、約15分で取り外すことができ、移植のための懸濁液の形態で回収することができます。 - ゆっくり200μlの細胞を吸引in vivoでの注射用23 Gまたは27 G針で注射器を使用してサスペンション。
導入遺伝子発現の6評価
- 正確に24時間新鮮な培地と交換した後、培地100μL -培養液中に分泌型ガウシアルシフェラーゼの発現の in vitroでの評価のために、50を収集します。商業ウミシイタケルシフェラーゼアッセイシステムと製造業者のプロトコルに従って、ルミノメーターを用いてルシフェラーゼ発現を推定します。
注:ガウシアルシフェラーゼは、1週間以上培養培地中で安定なままです。このように、導入遺伝子発現のリアルタイムの効率を評価するためのサンプル媒体を収集する前に、新鮮なものを含む培地を交換してください。培地交換のタイミングは柔軟であることができます。 - 細胞移植後の宿主動物における導入遺伝子発現の in vivo評価のために、BALB / cヌードマウス(雌を麻酔; 7週間イソフルラン吸入麻酔下に古いです)。
- チャンバーのためにイソフルランを提供するために、麻酔装置に接続されたチャンバ内にマウスを置きます。眠りに落ちる後にマウスを取り出し、マスクを使用して換気を手術台の上に置きます。マウスの状態をチェックすることによって、0.5リットル/分 - イソフルランは0.2で約フロー制御。
- 腹部の皮下組織に(4.1で説明したように)GL4ルシフェラーゼ発現のpDNAをトランスフェクトしたスフェロイドを含む200μlの細胞懸濁液を注入します。
- (150ミリグラム/ kgで、静脈内経路)直後D-ルシフェリンを注入した後、製造業者のプロトコルに従ってIVISイメージングシステムを使用して、ルシフェラーゼ発現を測定します。
- 細胞移植の治療効果を評価するために、中にエリスロポエチンをコードするpDNAを用いてトランスフェクトされたスフェロイドを含む200μlの細胞懸濁液を注入腹部の皮下組織。
- 血液19の約200μLを得るために、顎下出血によって血液サンプルを収集します。血液サンプル分析装置を用いてヘモグロビンおよびヘマトクリット値を測定します。
注:移植のための細胞数をプレート上に播種した数によって調節されます。スフェロイド内の数字は測定できないので、残念ながら、それは、正確な細胞数を決定することは困難です。
- 血液19の約200μLを得るために、顎下出血によって血液サンプルを収集します。血液サンプル分析装置を用いてヘモグロビンおよびヘマトクリット値を測定します。
- 実験の後、麻酔から覚醒するまで、温度コントローラーに接続された加熱パッドの上にマウスを置きます。
Access restricted. Please log in or start a trial to view this content.
結果
ガウシアルシフェラーゼを発現するpDNAの遺伝子トランスフェクションは、ポリプレックスナノミセルまたは対照脂質ベースのトランスフェクション試薬12を使用して、肝細胞またはMSCのことで形成された球状体で実施しました。対照試薬が大幅にトランスフェクション( 図3)の翌日の構造を破壊し、一方ナノミセルは、マイクロパターンプレート上の非トランスフェク?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルでは、遺伝子導入及びスフェロイド回収工程中のスフェロイドの3次元構造を維持することが重要です。細胞が細胞死または細胞活性の損失を回避することが有利な微小環境を維持するために不可欠です。従来の単層培養中の肝細胞が急速に数日12を播種した後、それらの分泌能力を失いつつ例えば、アルブミン分泌、肝細胞の代表的な先天性機能は、よく、肝細胞ス?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors declare that they have no competing financial interests.
謝辞
私たちは深く感熱マイクロパターン培養プレートと同様に科学的助言を提供するための東洋合成工業、東京、日本の博士武池谷と技術スタッフに感謝します。また、動物実験での技術支援のためにさんさとみ小倉さん沙鈴木さんあすか三好さんとかつえ森井に感謝します。この作品は、財政的に日本学術振興会科研費科学研究費補助金によって部分的にサポートされていた、イノベーション(COI)プログラムのセンターと独立行政法人科学技術振興機構(JST)からのS-イノベーションプログラム、およびJSPSコア - のコアプログラム、A.先端研究ネットワーク。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| Collagenase | Wako Pure Chemical Industries | 639-00951 | |
| Trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| Blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
参考文献
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved