Method Article
Hücre dışı Matrix Glycoproteomics: Kütle Spektrometresi kullanarak Sağlam GLİKOPEPTİT Analizi için Bir Yöntem
Bu Makalede
Özet
Bu kağıt, ECM protein bileşiminin (1) analizi, glikozilasyon yerleri (2) tespit edilmesi ve glıkan formlarının (3) yapısal karakterizasyon için sağlar, MS analizi için kardiyovasküler doku örnekleri hazırlamak için bir yöntem anlatılmaktadır. Bu metodoloji, diğer dokularda ECM'nin çalışma, minör modifikasyonlarla, uygulanabilir.
Özet
Fibroz birçok kardiyovasküler hastalık bir özelliğidir ve hücre dışı matrisi (ECM) şiddetli bir sekresyon ve birikimi ile bağlantılıdır. Kullanma proteomik, daha önce 150'den ECM belirledik ve kardiyovasküler dokularda protein ECM ile ilişkili. Özellikle, bir çok ECM proteinler glikosillenmiş. Bu post-translasyonel modifikasyon, protein katlanması, çözünürlük, bağlanması ve bozulmasını etkiler. Biz daha sonra sıvı kromatografisi tandem kütle spektrometresi sağlam glıkopeptıtlerın (LC-MS / MS) analizi ile uyumlu ECM proteinleri için ardışık çıkarma ve zenginleştirme bir yöntem geliştirdik. strateji ECM proteinlerinin çözünürleştirilmesi için doku hücresizleştirme ve guanidin hidroklorid NaCl, SDS ile sıralı inkubasyon dayanır. LC-MS / MS son gelişmeler bu olanak yüksek enerjili çarpışma ayrışma kombinasyonları (HCD) ve elektron aktarım ayrışma (ETD) gibi parçalanma yöntemler bulunurECM proteinlerinin glıkopeptıtlerın doğrudan kompozisyon analizi. Mevcut yazıda, doku örneklerinden ECM'nin hazırlanması için bir yöntem tarif eder. yöntem, protein profili, aynı zamanda, MS analizi ile değerlendirme ve glikosilasyon karakterize edilmesine imkan verir, sadece.
Giriş
Fibrozis birçok hastalığın bir özelliğidir. Fibroblastlar çoğalır ve hücre dışı matrisi (ECM) 1 artmaktadır, sekresyon ve birikmesi ile bağlantılı olan yüksek sentetik fenotipleri doğru farklılık göstermektedir. Aşırı ECM çökeltme işlevsel bozukluklara neden ilk yaralanma kaybolana sonra bile devam edebilir. Kullanma proteomik, daha önce 150'den ECM tanımlamışlardır ve kardiyak doku 2, 3 proteinleri ECM ile ilişkili. Bunlar, sürekli yeniden modellenmesi ve kalp dinamik uyum katkı sadece yapısal proteinler, aynı zamanda matricellular proteinleri ve proteazlardır. Özellikle, bir çok ECM proteinleri 4 glikosile olmaktadır. Bu post-translasyonel modifikasyon (PTM) bazı amino asit pozisyonlarına şeker kalıntılarının eklenmesini içerir ve bağlayıcı, protein katlanmasını, çözünürlüğünü etkiler ve bozunma 5 Yukarı.
memelilerde meydana iki ana glikosilasyon türü vardır. (1) N-glikosilasyon Xaa, prolin hariç herhangi bir amino asittir konsensüs dizisi, Asn-Xaa-Thr / Ser, içindeki asparagin kalıntılarının (Asn) arasında karboksamido, nitrojen meydana gelir. (2) O-glikosilasyon olarak, şeker artıkları hidroksiproline ve hidroksilisin için, çok daha az ölçüde serin ve treonin kökleri (Ser, Thr) ya da, ekleyin. O-glikosilasyon proteini çeşitli gruplar ortaya çıkarabilirler, N-glikosilasyon salgılanan proteinler veya zar proteinleri 5 hücre dışı alan ile sınırlandırılmıştır. ECM okuyan bu N-glikosilasyon çekici bir hedef yapar.
Proteomiks hastalığında protein değişikliklerinin analizi için yeni bir standart ayarlar. Bu zamana kadar en proteomik çalışmalar, hücre içi proteinlerin 6 üzerinde yoğunlaşmış bulunmaktadır. Bu, aşağıdaki nedenlerden kaynaklanmaktadır. İlk olarak, çok hücre içi proteinlerdir IDENTI engelkıt ECM bileşenlerinin Zehirsizleştirilmesi. Bu mitokondriyal ve Myofilament proteinler protein içeriğinin 7'nin büyük bir bölümünü oluşturmaktadır ki burada kalp dokusunda, özellikle önemlidir. İkinci olarak, yekpare ECM proteinleri büyük ölçüde çapraz bağlı ve çözündürülmesi zordur. Son olarak, bol PTMS (örneğin glikozilasyon) varlığı ayırma ve sıvı kromatografisi tandem kütle spektrometresi (LC-MS / MS) ile kimlik etkileyecek, moleküler kütle, yükü ve peptidlerin elektroforetik özelliklerini değiştirir. Son yıllarda, geliştirdik ve daha sonraki kütle spektrometrisi (MS) analizi ile uyumlu ECM proteinleri için ardışık çıkarma ve zenginleştirme yöntemini sunmaktır. strateji olarak inkübasyonlarla dayanır.
İlk adım, NaCl, ECM ile ilişkili ve gevşek bağlı ECM proteinlerinin çıkarma, hem de yeni sentezlenmiş ECM proteinlerini kolaylaştıran bir iyonik tampon ile gerçekleştirilir. Bu idaha fazla biyokimyasal tahlillerde 8 hücre membranlarının bozucu olmayan şekilde ve müsait s deterjan içermeyen, denatüre edici olmayan,. Daha sonra, hücresizleştirme sodyum dodesil sülfat (SDS) ile elde edilir. Bu adımda, düşük SDS konsantrasyonu zar destabilizasyonunu ve daha çözünür entegre olmayan ECM bileşenlerinin bozulmasını önlemek iken, hücre içi proteinlerin salgılanmasını sağlar. Son olarak, ECM proteinleri bir guanidin hidroklorür tamponu (GuHCl) ile ekstre edilmiştir. GuHCl tendon 9, kıkırdak 10, damar 11, 12, 13 ve kalp 2, 3 gibi dokulardan yoğun çapraz bağlı proteinler ve proteoglikanlar ayıklanması etkilidir. Biz kardiyovasküler hastalık 2'de ECM yenileme keşfetmek için LC-MS / MS ile birlikte, bu biyokimyasal ayrımlaştığını uygulanan , 3, 11, 12, 13, 14. MS son gelişmeler intakt glikopeptidler 3, 15 doğrudan analizi için izin yüksek enerjili çarpışma ayrışma (HCD) ve elektron aktarım ayrışma (ETD) kombinasyonları gibi yeni parçalanma yöntemler bulunur.
Burada protein bileşimi, glikosilasyon mevkilerini belirlenmesine ve glıkan formları karakterizasyonu analiz sağlar MS analizi için ECM'nin hazırlanması için bir yöntem tarif eder. ECM, glikosilasyon 16 önceki analizler ile karşılaştırıldığında, bu yöntem, MS kullanılarak bir site-spesifik bir şekilde glikosilasyon profillerinde bileşik değişikliklerinin doğrudan değerlendirilmesi için izin verir. Biz kardiyovasküler dokulara bu yöntemi uyguladık. Bununla birlikte, mümkün arkböylece diğer doku örneklerinde ECM'nin çalışma, minör modifikasyonlarla uygulanabilir ECM biyolojisi benzeri bilgiler sağlayabilir.
Protokol
Çalışma Wandsworth Yerel Araştırma Etik Komitesi tarafından onaylandı (referans numarası: 06 / Q0803 / 37) araştırma ve geliştirme dairesinden alınan kurumsal onayı. Tüm hastalar yazılı izin verdi.
Ekstrasellüler Matriks Proteinleri 1. Ekstraksiyon
NOT: Bu deneyler için kullanılan insan atriyal dokular sadece kalbin kardiyoplejik tutuklanmasının ardından, kardiyopulmoner bypass esnasında atriyal eklerle elde edilmiştir. Tüm numuneler St George Hastanesi, Londra, İngiltere toplandı. Tüm doku numuneleri -80 ° C 'de dondurulur. Örneğin paraformaldehid gibi fiksatif, korunmuş örnekleri kullanmak çapraz bağlanma proteinleri bu verme.
- Ekstraksiyon aşamaları arasında zamanı en aza indirmek için, Tablo 1 'deki gibi, deney öncesinde her ekstraksiyon tampon hazırlayın. sıcaklık-kontrollü bir ortamda, oda sıcaklığında (RT) her inkubasyon gerçekleştirmek(Yani, ~ 20 ° C) ekstraksiyon arasında tutarlılığı sağlamak için.
- doku 20-50 mg tartılır. çeşitli örnekleri, ekstre kesilir ve bunları tek tek ağırlık edilecek ise dokuların tamamen çözülme önlemek için. Bir neşter kullanılarak, 3-4 küçük parçalar (örneğin, 2-3 mm) halinde doku zar ve 1.5 ml tüpler içinde bir araya yerleştirmek.
- (PBS; Tablo 1 ve Malzemelerin Tablo) buz soğukluğunda fosfat tamponlu tuzlu su, 500 ul ilave edin ve kan kirlenmesini en aza indirmek için, beş yıkama yapar.
- Ekstraksiyon Aşama 1: NaCI Tamponu ile inkübasyon
- PBS ile yıkandıktan sonra, vida kapaklı 1.5 ml tüpler içine örnekleri yer. NaCI tampon ekleme doku ağırlığı: 10 kere (h) (Tablo 1 e bakınız). Girdap minimum hızda (yani, 600 rpm) 1 saat boyunca oda sıcaklığında borular.
NOT: Düşük girdap hızı bu adımı sırasında doku mekanik kesintileri önlemek için çok önemlidir.ekstraksiyon sırasında tüm tüpler yerleştirmek için bir köpük adaptörü kullanın. - 4 ° C'de 10 dakika 16,000 x g'de yeni tüplere ve santrifüj özler aktarın. kullanılana kadar -20 ° C 'de özleri saklayın. Kısaca, taze NaCI tamponu ile kalan doku peletleri yıkayın. Tampon aynı tip (örneğin, NaCI tamponu, 100 uL) Yıkama için farklı çözünürlüklere (NaCI ile ekstre değil, yani, protein) birlikte olan diğer proteinlerin çıkmasını önlemek için.
- Yıkama işleminden sonra, bir sonraki ekstraksiyon adımları ile protein içeriği örtüşme en aza indirmek için tampon tam olarak çıkarılmasının sağlanması. yıkama için kullanılan NaCl tamponu atılır.
Not: tampon hacmi ve doku ağırlığı arasındaki oran, bir yeniden üretilebilir ekstraksiyon için önemlidir. 10: 1 oranında (hacim: ağırlık) NaCI ve SDS ekstraksiyon için ve 5: 1 GuHCl adımı için tampon doyurmaksızın proteinin yeterli miktarda bulunur. Protein konsantrasyonları, yaklaşık ext sonra 1-2 ug / ml olanreaksiyona karşı.
- PBS ile yıkandıktan sonra, vida kapaklı 1.5 ml tüpler içine örnekleri yer. NaCI tampon ekleme doku ağırlığı: 10 kere (h) (Tablo 1 e bakınız). Girdap minimum hızda (yani, 600 rpm) 1 saat boyunca oda sıcaklığında borular.
- Ekstraksiyon Adım 2: SDS Tamponu ile Hücresizleştirme
- On kat (hacim: ağırlık) SDS tamponu (Tablo 1) ilave doku ağırlığı; Düşük SDS konsantrasyonlarda (yani,% 0.1) kullanımı, hücresizleştirme esnasında ECM protein kaybını önlemek için önemlidir. Girdap minimum hızda (yani, 600 rpm) 16 saat boyunca oda sıcaklığında borular.
NOT: Düşük girdap hız ECM mekanik bozulması en aza indirir. - Yeni tüplere özler aktarın. 4 ° C'de 10 dakika boyunca 16,000 x g'de santrifüje tabi tutulur; kullanılana kadar -20 ° C'de saklayın. Kısaca SDS'yi temizlemek için dd, H2O ile geri kalan doku peletleri yıkayın. Yıkama sonrası sıvının tam olarak çıkarılmasının sağlanması.
- On kat (hacim: ağırlık) SDS tamponu (Tablo 1) ilave doku ağırlığı; Düşük SDS konsantrasyonlarda (yani,% 0.1) kullanımı, hücresizleştirme esnasında ECM protein kaybını önlemek için önemlidir. Girdap minimum hızda (yani, 600 rpm) 16 saat boyunca oda sıcaklığında borular.
- Ekstraksiyon Adım 3: GuHCl Tamponu ile inkübasyon
- (: H) doku ağırlığı beş kez GuHCl tamponu (Tablo 1) ekleyin. Vorteks yani maksimum hızda 72 saat (oda sıcaklığında tüpler 3,200 rpm); kuvvetlice vorteksleme ECM mekanik bozulması kolaylaştırır.
- Yeni tüplere özler aktarın. kullanılana kadar -20 ° C 'de 10, 4 ° C'de dakika ve mağaza 16,000 x g'de santrifüjleyin.
2. Protein Niceleme ve Yağış
Not: deterjanların varlığı nedeniyle, SDS tampon maddesi 280 nm'de absorbans ölçümlerinden göre doğrudan protein miktar ile uyumlu değildir. Tekrarlanabilir ölçümü sağlamak için, tüm protein ekstrelerinin 17 için kolorimetrik tahlilleri kullanabilir.
- Niceleme.
- Seri uygun ekstraksiyon tamponu (yani, NaCl, SDS veya GuHCl) 17 içinde seyreltilmiş sığır serum albümini (BSA) kullanılarak bir kalibrasyon eğrisi için standartlar hazırlayın. Bu süre boyunca, örnek özler Çözülme.
- içindeki konsantrasyonlarını elde etmek için ekstraksiyon tamponu örnekleri seyreltinabsorbans lineer aralığı; 1:10 seyreltisi (hacim: hacim) tatmin edici sonuçlar elde edilir. Kolorimetrik deney> 4 M GuHCl konsantrasyonları ile uyumlu olmadığı için, GKD 2 miktarının belirlenmesi için O eşit miktarda GuHCl örnekleri seyreltin.
- Bir bisinkoninik asit (BCA) kullanarak 96-yuvalı plakalar içinde deneyleri için, imalatçının talimatları izlenerek, kolorimetrik tahlil 17 (Malzemelerin Tablo) tabanlı; en azından yinelenen ölçümler yapmak için tavsiye edilir.
- 30 dakika boyunca kuluçkaya bırakıldıktan sonra, BSA standart kalibrasyon eğrisi 17 kullanılarak protein konsantrasyonu hesaplamak için 570 nm bir dalga boyunda emme ölçümleri alır.
- Protein Yağış
- Çözülme GuHCl oda sıcaklığında ayıklar. Kısım yeni borulara her bir numune için protein 10 ug. doğrudan bir glikopeptit analizi için, kısım 50 ug. etanol ve incu 10 kat hacim ekleyinkesmek gece boyunca -20 ° C'de karıştırıldı.
NOT: GuHCl ileri enzimatik reaksiyonlar ve en elektroforetik uygulamalarla uyumlu değildir. GuHCl çıkarılması deglikozilasyon ve tripsin sindirim önce gereklidir. Etanol içinde GuHCl ve çözünürlüğünün, proteinlerin düşük çözünürlüğü yaklaşık proteinleri 18% 98'lik bir iyileşme elde edilir ise GuHCl etkili bir şekilde çıkarılması için izin verir. - 4 ° C'de 30 dakika boyunca 16,000 x g'de santrifüj örnekleri ve süpernatan aspire. çöktürülmüş pelet rahatsız etmemek için özen gösterin. Oda sıcaklığında bir vakum konsantre edici (Malzemelerin Tablo) kullanılarak 15 dakika boyunca pelet kurutulur.
Not: Protokol burada durdurulabilir ve kurutuldu peletler kullanılana kadar -20 ° C'de saklandı. - İsteğe bağlı olarak, (İlave Yöntemler, QC) kalite kontrolü gibi bir jel elektroforezi çalıştırın.
- Çözülme GuHCl oda sıcaklığında ayıklar. Kısım yeni borulara her bir numune için protein 10 ug. doğrudan bir glikopeptit analizi için, kısım 50 ug. etanol ve incu 10 kat hacim ekleyinkesmek gece boyunca -20 ° C'de karıştırıldı.
3. Sıralı deglikosilasyonN-glikosilasyon Sitesi Kişiler Değerlendirilmesi
- Numune kurutulmuştur (adım 2.2.2 bakınız) sırasında, Tablo 1 'deki gibi, deglikosilasyon debranşlı enzimler içeren deglikosilasyon tampon hazırlanması. Ürün detayları için Malzemelerin Tablo bakınız.
- Her bir örnek için enzimler ihtiva eden deglikosilasyon tampon maddesi, 10 ul ekle. Hızlı bir girdap ve numunelerin Spin-down gerçekleştirerek uygun pelet tabanda sağlamak.
Not: dallara ayrılmayı giderme enzimi kullanılarak şeker monomerlerinin çıkarılması O-bağlı kompleks sakkaritlerin sonraki ve tamamen uzaklaştırılması için gerekli olan ve PNGaz-F ile N-bağlı şekerlerin daha sonra bölünme kolaylaştırır. - 37 ° C'ye kadar sıcaklıkta II.Increase heparinaz heparan sülfatın uzaklaştırılması için izin ve hafif çalkalama ile 36 saat boyunca inkübasyona 25 ° C'de 2 saat süreyle inkübe edin.
Not: düşük reaksiyon hacimleri ve uzun inkübasyon süreleri, kullanım kuluçka Shakers göz önüne alındığında ve sıkı bir şekilde birden fazla 1.5 mL küvet paketiyaklaşık 45 ° 'de inkübatör içinde dayanan bir 50 mL konik tüp içine es. - 36 saat sonra, 16,000 x g'de 1 dakika için örnekleri santrifüj ve buharlaşması Yaklaşık 45 dakika boyunca oda sıcaklığında bir vakum konsantratör kullanılarak örneklerinden H2O.
- 50 U / ml PNGaz F, ihtiva eden H, 2 18 O 10 uL ile kurutuldu örnekleri tekrar süspansiyon olarak bölen bir deamidasyon reaksiyonunun tüm asparajin bağlı glikanları.
Not: Elde edilen aspartik asit MS analizi sırasında, N-glikosilasyon varlığının göstergesidir 2.98 Da'lık bir fazla kütle, taşır. - kuluçka çalkalayıcı içinde sabit çalkalama altında 37 ° C'de 36 saat inkübe edilir.
4. olarak çözeltisi tripsin Sindirim
Not: Bu adım (her ikisi de-deglikosile (yani doğrudan glikopeptid analizi için kullanılan) ve deglikosile numuneler için gerçekleştirilmiştir olmalıdır, yani, glıkan oc değerlendirilmesi için kullanılancupancy).
- N-glikosilasyon sitesi doluluk değerlendirilmesinde (bir önceki aşamada gösterildiği gibi) için toplam proteinin 10 ug kullanın. Doğrudan glikopeptid analiz için tasarlanmıştır numuneler için, başlangıç miktarı gibi proteinin 50 ug kullanılır.
Not: Aşağıdaki adımları proteinin 10 ug tarif edilmiştir. Gerekli olan inci evolumes (yani, 5 kez 50 ug için) ölçeğinin. - Sırasıyla 6 M üre, 2 M tioüre, nihai konsantrasyonları ile, 9 M üre ve 3 M thiourea kullanılarak her numune tam bölünür üzerinde proteinleri denatüre (10 uL numunesi için, örneğin, üre / tiyoüre 20 uL).
- 100 mM ditiotreitol (: 10 mM DTT, 3.33 uL, nihai konsantrasyon) ilave etmek suretiyle proteinler azaltır. 240 rpm'de çalkalanarak 1 saat boyunca 37 ° C'de inkübe edilir.
- (50 mM son konsantrasyon 3.7 uL,), 0.5 M iodoasetamid ekleyerek alkilasyonu gerçekleştirmeden önce oda sıcaklığına örnekleri soğutun. 1 saat boyunca karanlıkta inkübe edin.
- -20 (önceden soğutulmuş kullanın° C) aseton (örnek 6 kat hacim) 20 ° C'de bir gece boyunca inkübe etmek örnekleri. 4 ° C'de 25 dakika boyunca 14,000 x g'de santrifüj ile hızlandırabilir.
- Süpernatant aspire. çöktürülmüş pelet rahatsız etmemek için özen gösterin. Oda sıcaklığında 30 dakika için bir vakum konsantratör kullanılarak protein pelet kurutulur.
- 0.1 M trietilamonyumbikarbonat (TEAB) tampon, pH 8.2, 20 uL içinde süspanse içeren tripsin (0.01 ug / ml) ve 37 ° C'de ve 240 rpm'de gece boyunca sindirimi.
- (% 1 TFA bir son konsantrasyon için TFA, 2 uL),% 10 trifloroasetik asit ile örnekleri asitleştirilerek sindirim durdurun.
C18 sütunlar kullanma 5. Peptid Temizleme
Not: sindirim sonra peptid karışımı kirletici maddeleri müdahale çıkarılması iyon bastırma azaltır ve sinyal-gürültü oranları ve dizi kapsamı artırır. Bu aşama, hem sigara deglikosile ve deglikosile sa yapılmalıdırörnek olarak şunlar verilebilir.
- 1 dakika için 1000 x g'de oyuk ve santrifüj başına metanol 200 uL kullanılarak C18 eğirme plakası üzerinde reçinesi (Malzemelerin Tablo) aktif hale getirin.
- 1 dakika için 1000 x g'de H2O Santrifüj içinde% 80 asetonitril (ACN) ve% 0.1 TFA, oyuk başına 200 uL eklenmesiyle yıkayın.
- 1 dakika için 1000 x g'de H2O Santrifüj içinde% 1 ACN ve% 0.1 TFA, oyuk başına 200 uL eklenmesiyle dengelenmesi. Bu adımı iki kez daha tekrarlayın.
- 1 dakika için 1500 x g'de reçine ve santrifüj içeren kuyu içine Aşama 4'deki örnekleri (tüm hacim) yükleyin. akış yoluyla ikinci kez yükleyin ve santrifüjleme tekrarlanır.
- 1 dakika için 1500 x g'de H2O Santrifüj içinde% 1 ACN ve% 0.1 TFA, oyuk başına 200 uL eklenmesiyle yıkayın. Bu adımı iki kez daha tekrarlayın.
- 1 dakika için 1500 x g'de H2O Santrifüj içerisinde% 50 ACN,% 0.1 TFA içerisinde oyuk başına 170 uL numune Zehir. önceki adımı tekrarlayınve toplanan elüatı birleştirir.
- Oda sıcaklığında 2 saat boyunca vakumlu bir konsantratör kullanılarak eluatın kurutun. hemen kullanılan değilse, kullanıma kadar, -80 ° C de kurutulur örnekleri tutmak.
Not: Protein belirlenmesi için tasarlanmıştır Deglikolize örnekler sadece bu aşamadan sonra, LC-MS / MS için kullanıma hazırdır. Adım 6 ve 7, bu örnekler için gerekli değildir. - Çözülme ve 0.5 ug / uL nihai bir protein konsantrasyonuna kadar H2O içinde% 2 ACN ve% 0.05 TFA içinde deglikosile örnekleri tekrar süspansiyon. olmayan deglikosile numunelerin doğrudan glikopeptid analizi Aşama 6 devam edin.
- İsteğe bağlı olarak, önceden, tandem kütle etiketleri (TMT) ile etiketleme peptidler filtre; Peptid soma için ek Yöntemler.
TMT 6. Etiketleme (doğrudan glikopeptit Analiz için sadece)
- Çözülme ve 1 ug / ml bir konsantrasyon elde etmek için, 50 mM TEAB 50 uL kurutulmuştur pelet tekrar süspansiyon.
- Resusped TMT Sıfır 0.8-mg tüp ACN 41 uL tepkime maddesi (TMT 0, Malzemeler Tablo). yeniden süspanse edilmesi için üreticinin recommendantions izleyin.
- (TMT 0 20,5 uL, peptidlerin, yani, 50 uL), 0.4 mg TMT 0 50 ug peptidlerin bir oranda peptid örnekleri etiketleyin. 1 saat oda sıcaklığında inkübe edin.
- Bir oranda 6% 5 hidroksilamin ilave etiketleme reaksiyonu söndürün: 100 (% 5 hidroksilamin, yani, 4.23 uL). 15 dakika boyunca oda sıcaklığında inkübe edin.
- Bir vakum konsantratör kullanılarak oda sıcaklığında 1 saat için TMT 0 -etiketli peptid örnekleri kurutun. GKD 2 O 10 uL içinde süspanse
Not: nedeniyle glıkan kalıntılarına bağlı olarak, glikopeptidler glikosile peptidler daha yüksek bir moleküler kütleye gösterir. TMT 0 glikopeptitlerin şarj durumunu arttırır. Bu (m / z) oranı şarj etmek için nispi ağırlığını azaltır ve ETD parçalanma kolaylaştırır.
7. gLİKOPEPTİT Zenginleştirme
- Kiti (Malzemelerin Tabloya bakınız) sağlanan reaksiyon tampon kullanın.
- Adım 6.5 her biri 10 uL numuneye bağlama tamponu 50 uL ekleyin. homojen hale gelinceye kadar glycocapture reçine çözeltisi karıştırın. 15 yakalama merkezli bir zwitteriyonik hidrofilik interaksiyon sıvı kromatografisi (Zici HILIC) kullanın.
- Yeni 1.5 ml tüpler reçine süspansiyonu kısım 50 uL. 2.500 x g'de 1 dakika için Spin ve supernatant çıkarın. Örnek 60 uL ekleyin (yani, bağlanma tampon maddesi ile numunesi) reçine peletleri içeren tüplere. bir pipet kullanılarak karıştırılır ve 1.200 rpm'de çalkalama içinde 20 dakika için oda sıcaklığında inkübe edilir.
- 2.000 x g'de 2 dakika süre ile santrifüj ve yeni tüplere süpernatant aktarın. Tüpleri tutun. Reçine tüplerine yıkama tamponu 150 uL ekleyin. bir pipet kullanılarak karıştırılır ve 1.200 rpm'de çalkalama içinde 10 dakika süreyle oda sıcaklığında inkübe edin.
- 2.500 x g'de 2 dakika süre ile spin. transfer(Adım 7.4) aynı tüplere yüzer. Yıkama adımları iki kez tekrarlayın.
- elüsyon tamponu 75 uL ekleyin ve bir pipet kullanarak karıştırın. Oda sıcaklığında 5 dakika boyunca 1200 rpm'de karıştırın ve daha sonra 2,500 x g'de 2 dakika süre ile tüpler santrifüj. Yeni 1.5 ml tüpler için süpernatanlar aktarın. Yıkama adımları tekrarlayın, sonra aynı tüp eluat süpernatant aktarın.
- X g, 2,500 2 dakika boyunca eluatın (örneğin glikopeptidler) içeren tüpler santrifüjleyin. Önceki adımlardan kalan reçine kaldırılmasını sağlamak için yeni tüplere süpernatant aktarın.
- Oda sıcaklığında yaklaşık 2 saat boyunca vakumlu bir konsantratör kullanılarak sıyırma sıvısı, toplam 150 uL kurutun. GKD 2 O içinde% 2 ACN 15 uL ve% 0.05 TFA içinde kurutuldu aşağı glıkopeptıtlerı yeniden süspanse
- glikopeptid karakterizasyonu için HCD ve ETD parçalanma kullanılarak ECM protein bileşimi analiz etmek için HCD parçalanma kullanılarak LC-MS / MS gerçekleştirmek için devam edilir ve LC-MS / MS. bölüm 8 bakınız.
8. kütle spektrometri analizi
- ECM protein bileşimi analiz etmek için HCD parçalanma kullanılarak LC-MS / MS gerçekleştirir; Ayrıntılar için Ek Yöntemleri bkz.
- (Daha fazla bilgi için ek Yöntemler) glikopeptid karakterizasyon için HCD ve ETD parçalanma kullanılarak LC-MS / MS gerçekleştirir; zenginleştirilmiş örnek olmayan zenginleştirilmiş giriş maddesinin 15 karşılaştırılmalıdır.
Not: dolaylı glikopeptid analizi, doğrudan glikopeptid analizi ve veritabanı arama için LC-MS / MS yöntemleri ayrıntılı tanımları İletişim Yöntemleri verilmiştir. Kütle spektrometrisi kullanılarak ECM protein ve glıkan kompozisyonunu tanımlama ile ilgilenen araştırmacılar önceki yayınların 3, 11, 15 bakınız için teşvik edilir.
Sonuçlar
Protokol şematik bir iş akışı, Şekil 1 'de sağlanmıştır.
ECM, ekstraksiyon protokolü
ekstraksiyon etkinliği alikoları Bis-Tris akrilamid jelleri üzerinde her ekstratının oluşturulması çalışan ve görselleştirme için gümüş boyama kullanılarak izlenebilir. Şekil 2A, NaCI, SDS tamamlayıcılığı göstermektedir GuHCl sıralı özütleme sonrasında ayıklar. Bu QC örneğin aşırı protein yıkımı numunenin kalitesine sahip olası sorunların tanımlanması için gereklidir. Ekstraksiyon işleminden sonra, ECM glikoproteinler GuHCl ekstreleri (Şekil 2B) bol miktarda bulunmaktadır.
deglikozilasyon
deglikozilasyondan verimliliğini değerlendirmek için, olmayan bir deglikosillenmiş kontrol pa içinde çalıştırılmalıdırrallel. Deglikosilasyon kez Şekil 3A'da örneklendiği gibi, şeker kalıntılarının tam ve homojen bir kaldırma ulaşmak için uygun olması gerekmektedir. Şekil 3B, etkin bir şekilde daha küçük bir N- ve O-bağlı oligosakkaritlerin hedef GAG çıkarma ve deglikosilasyon enzimleri için enzim ilave edilerek, deglikosile numune temsili bir örneğini göstermektedir.
Glycoproteomics
NXT / S sequons doluluk değerlendirilmesi için protokol, MS (Şekil 3C) sonra, ECM glikoproteinler için protein sekansı kapsamı artırır ve glikoproteinlerin varlığının bir başlangıç tarama sağlar. veritabanları önceden belirlenen glikoproteinler içerecek şekilde özelleştirilebilir gibi bu glikopeptidler için arama süresini azaltmak için yardımcı olur. HCD-ETD parçalanma ECM g bağlı oligosakaritlerin tanımlanması ve kompozisyon karakterizasyon için kullanılır lycoproteins. Şekil 4A, deglikosilasyon (dolaylı glikopeptid analizi) sonra 18 O ile etiketlenmiş bir peptit için elde edilen temsili bir spektrumunu gösterir. Şekil 4B, ECM ekstrelerinden sağlam glikopeptidler (doğrudan glikopeptid analizi) analizinden sonra elde edilen bir spektrumunu temsil eden bir örnektir.
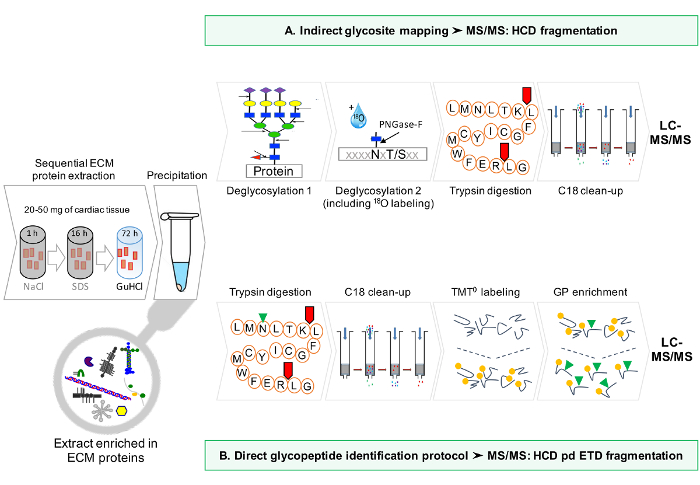
Şekil 1: Yöntem genel bir bakış. (A), ECM proteinleri için sıralı zenginleştirme işlemlerinden sonra, LC-MS / MS analizleri deglikosile özleri üzerinde gerçekleştirilir. (B) Buna alternatif olarak, sigara deglikosillenmiş ECM ekstraktlar daha glikopeptidler için zenginleştirilmiştir. Bu rakamın büyük halini görmek için buraya tıklayın.
2" src = "/ files / ftp_upload / 55674 / 55674fig2.jpg" />
Şekil 2: ECM proteinlerinin çıkarımı. (A), sıralı özütleme prosedürü ( "İngilizce Quickstep") 3 farklı ekstreler protein içeriğinde tamamlayıcıdır. SDS ayrıkları hücre içi proteinleri açısından oldukça zenginleşmiş iken, GuHCl ekstreler ECM proteinlerinin çoğunluğu ihtiva etmektedir. Başarılı fraksiyonasyon farklı gümüş boyama paterni ile görüntülenir. (B), ECM proteinleri, küçük lösin açısından zengin proteoglikanlar dekorin, biglikan ve mimecan ağırlıklı olarak, SDS ve NaCl ekstrelerinde küçük varlığı ile, GuHCl özütlerinde görülmüştür. Bu rakamın büyük halini görmek için buraya tıklayın.
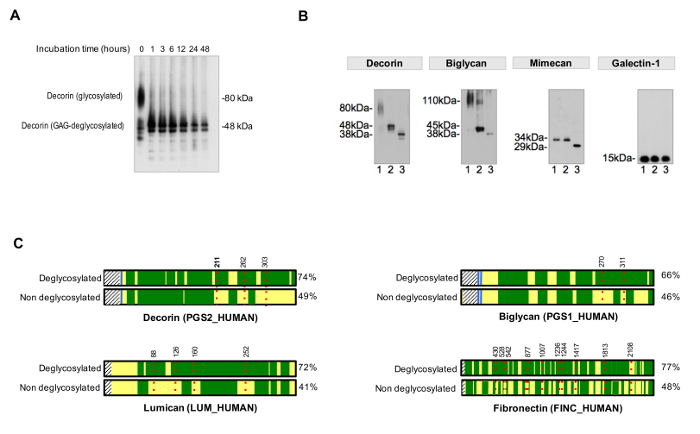
Şekil 3. glisin Analiziosylation. (A), uygun inkübasyon süreleri tamamen Deglikosilasyondan için gereklidir. Örnek glikoprotein dekorin gelen glikozaminoglikan zincirleri çıkarılması sırasında inkübasyon süresi etkisini göstermektedir. (B), ECM glikoproteinler büyük ve glikozaminoglikan tekrarlanan zincir ve kısa ve çeşitli N- ve O-bağlı oligosakkaritlerin süslenmiştir. imüno her biri üzerinde Şerit 1 tedavi edilmemiş kalp özler temsil eder. Şerit 2 glikozaminoglikanların sindirmek enzimleri ile muamele özler ihtiva etmektedir. şerit 3 numuneler ek olarak, N- ve O-bağlı oligossacharides çıkarılması için enzimleri içerir. Galektin-1 böylece protein boyutunda bir kayma olduğunu, glikosile değildir. Lynch M, ve diğ uyarlanmıştır. H2 18 O mevcudiyetinde PNGaz F ile muamele edilmiş 4 (C) 'de, LC-MS / MS analizi, örnekler olmayan deglikosile numunelerine kıyasla (sağ tarafta%) daha iyi bir dizi kapsam temin edebilir. DArk yeşil alan LC-MS / MS ile sekans kapsama temsil eder. Kırmızı, noktalı çizgiler, amino asit konumunu gösteren numaraları ile, glycosites temsil eder. Pozisyonda dekorin glikosilasyon Algılama 211, Asn (N, kalın olarak gösterilmiştir), Şekil 4'te, örnek olarak ayrıntılı olarak gösterilmiştir , bu şekil büyük halini görüntülemek için tıklayın.
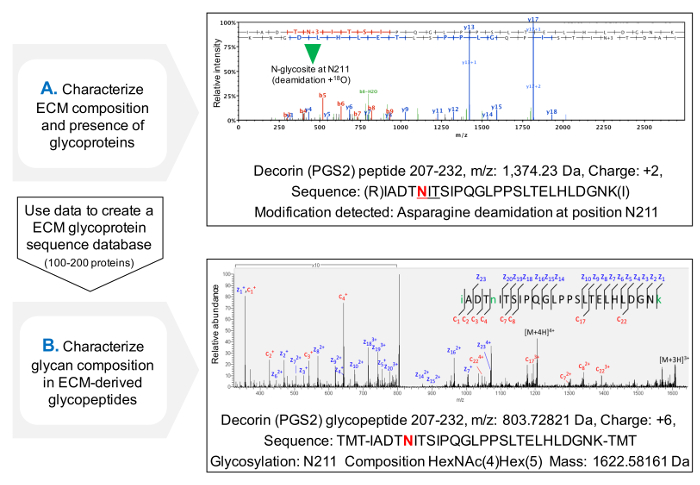
Şekil 4. MS ile glikopeptit analizi. (A), ECM zenginleştirilmiş ekstrelerin bir av tüfeği proteomik yaklaşımı kullanarak, glikopeptidler NXT / S sequons içinde deamidatlı asparajinlere mevcudiyeti ile tanımlanır ve 18 O ile etiketlenebilir örneğin içeren dekorin bir peptit için bir HCD MS / MS spektrumunu gösterir Daha önce Asn 211 glikosillenir. Elde edilen veriler kullanılabilirECM glikoproteinlerinin özelleştirilmiş veritabanı oluşturmak için. (B) HCD-ETD parçalanma glikopeptid zenginleştirilmiş ECM özü analiz etmek için kullanılır. ETD MS / MS spektrumudur glıkan bileşimin karakterizasyonu sağlar. Bu rakamın büyük halini görmek için buraya tıklayın.
| A. stok çözeltileri | |
| DTT (Ditiyotreitol, Cı-4H 10 O 2S 2) | GKD 2 100 mM DTT O. 1 |
| EDTA (Etilendiamintetraasetik asit, C 10 H 16 N2 O 8) | 250 GKD 2, O, pH 8.0 mM EDTA. |
| GuHCl (Guanidin hidroklorid, CH 6 ClN 3) | 8 M GuHClGKD 2 O |
| IAA (Iyodoasetamid C2 H4 INO) | GKD 2 O 1,2 500 mM IAA |
| Na asetat (sodyum asetat, C2-H3 NaO 2) | GKD 2, O, pH 5.8 içinde 1 M Na-asetat. |
| NaCI (sodyum klorür, NaCl) | GKD 2 O. içinde 1 M NaCI |
| Na fosfat dibazik (disodyum fosfat, Na 2H 2PO 4) | Dd, H2O, pH 6.8 içinde 1 M Na-fosfat dibazik. |
| SDS (sodyum dodesil sülfat, NaCl 12H 25 SO 4) | GKD 2 O 3% 1 SDS (35 mM) |
| TFA (trifloroasetik asit, C2H F3 O 2) | % 10 GKD 2 O TFA (1.2 M) |
| TEAB (Trietilamonyum bikarbonat, Cı-7H 17 NO 3) | ddH2O, pH 8.5 içinde 1 M TEAB |
| Tioüre (Tiyoüre, CH4, N 2S) | GKD 2 O. içinde 3 M tiyoüre |
| Tris-HCI (Tris-hidroklorür (NH 11C 4 O 3 [HCI]) | 100 GKD 2, O, pH 7.5 içinde mM Tris-HCI. |
| Üre (Üre, CH4 N2 O) | GKD 2 O. 9 M üre |
| B. Reaksiyon tamponlar | |
| C18 temizlik dengeleme tamponu | % 1 ACN,% 0.1 TFA GKD 2 O |
| C18 temizleme kolonu yıkama tamponu | H2O içinde% 80 ACN,% 0.1 TFA |
| C18 temizlik elüsyon tamponu | GKD 2 O içinde% 50 asetonitril,% 0.1 TFA |
| Deglikosilasyon tampon (4x) | 600 mM NaCI ve GKD 2, O, pH 6.8'de 200 mM Na fosfat. |
| GuHCl tamponu 4 | 4 M guanidin hidroklorür, 50 mM Na-asetat ve GKD 2, O, pH 5.8, 25 mM EDTA. 100 (v: v) ekleme 1 proteinaz inhibitörü kokteyl kullanımından önce. |
| NaCI tamponu 4 | 0.5 M NaCI, 10 mM Tris-HCI ve GKD 2 O, 25 mM EDTA, pH 7.5 olarak değişmiştir. 100 (v: v) ekleme 1 proteinaz inhibitörü kokteyl kullanımından önce. |
| PBS (1 x) | 1.7 mM KH2 PO 4, 5 mM Na2 HPO 4, 150 mM NaCl, pH 7.4 ile yıkanmıştır. 25 mM EDTA ve 1 ekleyin: 100 (hacim: hacim) proteinaz inhibitörleri kokteylinin kullanımından önce. |
| Numune tamponu (4x) | 100 mM Tris,% 2 SDS, GKD 2, O, pH 6.8 içinde% 40 Gliserol,% 0.02 bromofenol mavisi. Kullanmadan önce% 10 ß-merkaptoetanol ekleyin. |
| SDS tamponu 4 | 100:% 0.1 SDS ve GKD 2, 25 mM EDTA, O 1 ekleyin (hacim: hacim) proteinaz inhibitörleri kokteylinin bef arasındacevher kullanımı. |
| C. Enzimler | |
| Kondroitinaz ABC 5 | 0.5 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| keratanaz 5 | 0.1 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| Heparinaz II 5 | 0.1 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| α2-3,6,8,9-Nöraminidaz (sialidaz) 5 | 0.025 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| β1,4-Galaktosidaz 5 | 0.015 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| p-N-Asetilglukosaminidaz 5 | 0.25 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| Endo-α-N-asetilgalakto (O-glikosidaz) 5 | 0.013 U deglikosilasyon tampon maddesi içinde / ml (1 kez) |
| PNGaz F (N-glikosidaz F) 6 | 5H 0 U / mL 2 18 O |
| Tripsin | TEAB tamponu içinde 0.01 ug / ml |
| Tablo NOTLAR. | |
| 1. -20 ° C'de dondurulmuş stok çözeltisi tutun. | |
| 2 IAA ışıktan korunmalıdır tutulmalıdır. | |
| 3, SDS kolaylıkla <20 ° C 'de kristalize olur. % 1 SDS (stok çözelti) çözünmesini kolaylaştırmak amacıyla, sıcak musluk suyu altında tampon ısıtın. | |
| 4 Ekstraksiyon tampon oda sıcaklığında saklanabilir. kullanımdan önce belirtildiği gibi proteinaz inhibitörlerinin geniş spektrumlu kokteyl ekleyin. | |
| 5 Bu enzimler, birinci deglikosilasyon aşaması sırasında ilave edilmelidir. | |
| 6 PNGaz F sadece ikinci deglikosilasyon aşaması sırasında ilave edilmelidir. | |
Tablo 1: Stok Çözümleri Reaksiyon Tamponlar ve Enzimler. Bu tablo, MS analizi öncesinde kardiyak ECM proteinlerinin ekstraksiyon ve (enzimatik sindirim dahil) sonraki işlem için gerekli olan her bir stok çözeltisi ve reaksiyon tamponu bileşimi listeler.
Tartışmalar
Bu proteomik protokol laboratuvarımızda son birkaç yıldır optimize edilmiştir. Burada, kardiyak dokuyu kullanılır, ancak sadece küçük ayarlamalar diğer dokularda için uygulanması gerekli olabilir. Örneğin, ekstraksiyon protokolü dikkate doku selülarite atmalıdır. Kardiyak dokusu vasküler doku ile karşılaştırıldığında yüksek selüler bir. Vasküler doku kullanıldığında, SDS konsantrasyonu düşük (yani% 0.08) olabilir ve hücresizleştirme süresi daha kısa (yani 4 saat), 11, 12, 13'tür. deglikosilasyon enzimlerin kullanımı ECM bileşimin LC-MS / MS analizi için çok önemlidir. Bununla birlikte, inkübasyon süreleri farklı doku türleri için ayarlanması gerekebilir. (Örneğin Agrîn, perlekan) (veriler gösterilmemiştir) bazal membran protein açısından zengin olan cilt gibi örnekleri kullanarak, örneğin, 25 ° C 'de II gerekir uzatılmış inkübasyon sürelerini heparinaz. Doğrudan glikopeptid analizi kültürde 15 hücrelerden şartlı ortamın üzerinde gerçekleştirilebilir. Zenginleştirme adımlar Bu basitleştirilmiş subproteome analizi için gerekli olmayabilir. GuHCl özler benzer şekilde, NaCI ekstreleri, küçük değişikliklerle Glycoproteomics analiz için uygundurlar. ECM proteinlerinin zenginleştirilmesi için diğer ekstraksiyon protokolleri ECM glikopeptitler 19, 20 tanımlamak için adapte edilebilir.
Glikosilasyon en karmaşık PTM 5'tir. Glikopeptid dolaylı tanımlanması NXT / S sequon de dahil 18 O ile deamidatlı Asn tespiti ile elde edilir. Diğer pozisyonlarda Deamide Asn yanlış pozitif temsil edebilir. Benzer bir şekilde, N-glikosilasyon proteini ontolojilerinin bağlamında dikkate alınması gerekir: bir NXT / S sequon ihtiva eden hücre-içi proteinler glikosile edilmeyecektir ancak yanlış pozitif sebebiyet verebilir. Geçerli Searc olarakh algoritmaları önceden belirlenmiş dizileri sadece (NXT / S yani Asn) en PTMS taranması için izin vermez, verilerin manuel filtreleme gereklidir. Bu pozisyonlarda glikosilasyon varlığı / yokluğu tespit edilmesi hastalık ve kontrol numuneleri arasındaki karşılaştırılabilir. (Treonin veya serin ile bir kütle kayma sokulması örneğin) O-Deglikosilasyondan için PNGaz F enzimsiz eşdeğer bulunmaktadır. Bu nedenle, O-glikosilasyon tanıma doğrudan glikopeptid analizi ile sınırlandırılmıştır. Doğrudan glikopeptid analiz proteinlere bağlı şekerlerin bileşim bilgileri elde etmek için kullanılan, fakat glikan yapısal bilgi sağlamaz. Ayrıca, glıkan bir bileşim salgılanmasından sonra glıkan sentezi ve işlenmesi bir sonucudur.
ECM proteinleri için 3 aşamalı çıkarma yöntemi ( "İngilizce Quickstep") 6 kardiyovasküler dokularda çeşitli ECM karakterize izin verdi. doku FraksiyonuBaşka bir yerde 6 ele alındığı gibi çeşitli özler içerisine basit bir ECM Proteomun elde etmek için gereklidir. Hücre içi proteinleri başka şekilde daha az bol ECM proteinlerinin tanımlanmasına engel olacaktır özler içinde protein bolluğu aşırı dinamik aralığına katkıda bulunacaktır. Ayrıca, hücre içi protein, ECM glikopeptid zenginleştirme ve daha sonra MS analizleri karmaşık hale getireceği O-glikosilasyonları 5 taşır. Diğer yazarlar, ancak bunlar glikosilasyon analiz takip etmedi, örneğin akciğer 21 ve kıkırdak dokunun 10 karakterize etmek için benzer ekstraksiyon yöntemleri uygulanır. Glikosilasyon Önceki analizi, sadece glycosites belirlenmesi üzerinde yoğunlaşmıştır protein çekirdekten glıkan çıkarılmasını gerektirebilir, ve O-glikosilasyon 22, 23 değerlendirmek değildir. Lektin diziler ve kimyasal zenginleştirme glikan typ değerlendirilmesi için kullanılabilirBiyolojik numuneler üzerinde es kendi bağlanma özgünlükleri dayalı, ancak bu teknikler belirli proteinlerin 24 glikan türlerini atanamıyor ne de glikozilasyon yerleri değerlendirebilir.
Başlangıçta, önceden ECM proteinlerinin LC-MS / MS, jel elektroforezi kullanılmıştır. Eğer jel ayrılması LC-MS / MS analizi için uygun basitleştirilmiş protein fraksiyonları elde faydalı olsa da, son alet hızlı tarama hızları vardır. Bu nedenle, elektroforetik ayırma aşaması atlanabilir. jel üstünde tutulan büyük ECM proteinleri, daha verimli bir şekilde analiz edilmiştir gibi bu ilave bir avantaj da sağlar. Ancak, bozulmamış proteinlerin Mw ilgili bilgileri kaybolur. PNGaz F Deglikosilasyondan önce buharlaştırma adımı yanlış negatifler en aza indirmek için normal H2 O tamamen kaldırılmasını sağlar. Şeker kalıntısı (yani, değişken glıkan kütleleri) LC ile ayırma müdahale ve MS / MS ile takip eden peptid kimlik bozar. pbir-deglikosilasyon protokolü, glikozilasyon odaklanmamış ECM proteinlerinin proteomik analizi için tavsiye edilir.
Proteomiks ECM içine görülmemiş bilgiler sağlayabilir. Yapısal destek ötesinde, ECM bağlı glikanlar konukçu-patojen etkileşimi, hücre-hücre iletişimine ve immün yanıt 25, organ naklinden sonra, yani allograft reddi için esastır. Glycoproteomics glikobiyolojide önemli bir araç olacaktır.
Açıklamalar
Yok.
Teşekkürler
JBB King'in İngiltere Kalp Vakfı Merkezi'nde Kariyer Kuruluş üyesidir. AA İngiliz Kalp Vakfı Üst üyesidir (FS / 13/2/29892). Çalışmamız bir mükemmellik girişimi tarafından desteklenmiştir (Yetkinlik Merkezleri Mükemmel Teknolojileri - COMET) Avusturya Araştırma Promosyon Ajansı FFG ait: "Damar Mükemmeliyet Araştırma Merkezi Yaşlanma - Tirol, VASCage" (K-Proje numarası 843536) ve NIHR Biyomedikal Araştırma King College Hastanesi ortaklığında Guy ve St Thomas' Ulusal Sağlık Servisi Vakfı Güven ve King College London'da tabanlı Merkezi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| A. Chemicals | |||
| Acetonitrile, MS-grade (ACN, C2H3N) | Thermo Scientific | 51101 | 5.2-5.8, 6.2, 7.11, Supp 2, 3, 4 |
| Cocktail of proteinase inhibitors | Sigma-Aldrich | P8340 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Disodium phosphate (Na2H2PO4) | Sigma-Aldrich | S7907 | 3.1 |
| Dithiotreitol (DTT, C4H10O2S2) | Sigma-Aldrich | D0632 | 4.3 |
| Ethylenediaminetetraacetic acid (EDTA, C10H16N2O8) | Sigma-Aldrich | E9884 | 1.3, 1.4.1, 1.5.1, 1.6.1 |
| Ethanol (C2H6O) | VWR | 437433T | 2.2.1 |
| Guanidine hydrochloride (GuHCl, CH6ClN3) | Sigma-Aldrich | G3272 | 1.6.1 |
| Glycerol (C3H8O3) | Acros organics | 158920025 | Suppl 1.1 |
| H2O LC-MS Cromasolv | Sigma-Aldrich | 39253-1L-R | Throughout the protocol |
| H218O | Taiyo Nippon Sanso | FO3-0027 | 3.5 |
| Hydroxylamine (HA, H3NO) | Sigma-Aldrich | 467804 | 6.4 |
| Iodoacetamide (IAA, C2H4INO) | Sigma-Aldrich | A3221 | 4.4 |
| Phosphate-buffered Saline (PBS), 10x | Lonza | 51226 | 1.3 |
| Sodium acetate (C2H3NaO2) | Sigma-Aldrich | S7545 | 1.6.1 |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | 1.4.1, 3.2 |
| Sodium dodecyl sulfate (SDS, NaC12H25SO4) | Sigma-Aldrich | 466143 | 1.5.1 |
| Triethylammonium bicarbonate (TEAB, C7H17NO3) | Sigma-Aldrich | 11268 | 4.7, 6.1 |
| Trifluoroacetic acid (TFA, C2HF3O2) | Sigma-Aldrich | T62200 | 4.8, 5.2-5.8, 7.11, Supp 2, 3 |
| Thiourea (CH4N2S) | Sigma-Aldrich | T8656 | 4.2 |
| Tris-hydrochloride (Tris-HCl, NH11C4O3[HCl]) | Sigma-Aldrich | T3253 | 1.4.1, Suppl 1. |
| Urea (CH4N2O) | Sigma-Aldrich | U1250 | 4.2 |
| Name | Company | Catalog Number | Comments |
| B. Enzymes | |||
| α2-3,6,8,9-Neuraminidase (Sialidase) | EDM Millipore | 362280 (KP0012) | 3.1 |
| β1,4-Galactosidase | EDM Millipore | 362280 (KP0004) | 3.1 |
| β-N-Acetylglucosaminidase | EDM Millipore | 362280 (KP0013) | 3.1 |
| Chondroitinase ABC | Sigma-Aldrich | C3667 | 3.1 |
| Endo-α-N-acetylgalactosaminidase (O-glycosidase) | EDM Millipore | 362280 (KP0011) | 3.1 |
| Heparinase II | Sigma-Aldrich | H6512 | 3.1 |
| Keratanase | Sigma-Aldrich | G6920 | 3.1 |
| PNGase-F (N-Glycosidase F) | EDM Millipore | 362280 (KP0001) | 3.5 |
| Trypsin | Thermo Scientific | 90057 | 4.7 |
| Name | Company | Catalog Number | Comments |
| C. Reagent kits | |||
| 30 kDa MWCO spin filters | Amicon, Millipore | 10256744 | 5.9, Suppl 2 |
| Macro SpinColumn C-18, 96-Well Plate | Harvard Apparatus | 74-5657 | 5.1 |
| NuPAGE Novex BisTris Acrylamide Gels | Thermo-Scientific | NP0322PK2 | Suppl 1 |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | 2.1.3 |
| ProteoExtract Glycopeptide Enrichment Kit | Merk Millipore | 72103 | 7 |
| Tandem mass tag 0 (TMT0) | Thermo Scientific | 900067 | 6.2, 6.3 |
| Name | Company | Catalog Number | Comments |
| D. Equipment and software | |||
| Acclaim PepMap100 C18 Trap, 5 mm x 300 µm, 5 µm, 100 Å | Thermo Scientific | 160454 | Suppl 3, 4 |
| Acclaim PepMap100 C18, 50 cm x 75 µm, 3 µm, 100 Å | Thermo Scientific | 164570 | Suppl 3 |
| Byonic Search Engine | Protein Metrics | Version 2.9.30 | Suppl 5 |
| Dionex UltiMate 3000 RSLCnano | Thermo Scientific | n/a | Suppl 3, 4 |
| EASY-Spray Ion Source | Thermo Scientific | ES081 | Suppl 4 |
| EASY-Spray PepMap RSLC C18, 50 cm x 75 µm, 2 μm, 100 Å | Thermo Scientific | ES803 | Suppl 4 |
| Mascot Search Engine | Matrix Science | Version 2.3.01 | Suppl 3 |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFADBMBHQ | Suppl 4 |
| Proteome Discoverer Software | Thermo Scientific | Version 2.1.1.21 | Suppl 3, 5 |
| Picoview Nanospray Source | New Objective | 550 | Suppl 3 |
| Q Exactive HF Mass Spectrometer | Thermo Scientific | IQLAAEGAAPFALGMBFZ | Suppl 3 |
| Savant SpeedVac Concentrator | Thermo Scientific | SPD131DDA | 2.2.2, 3.4, 4.6, 5.7, 6.5, 7.11 |
| Scaffold Software | Proteome Software | Version 4.3.2 | Suppl 3 |
Referanslar
- Porter, K. E., Turner, N. A. Cardiac fibroblasts: at the heart of myocardial remodeling. Pharmacol. Ther. 123 (2), 255-278 (2009).
- Barallobre-Barreiro, J., et al. Proteomics analysis of cardiac extracellular matrix remodeling in a porcine model of ischemia/reperfusion injury. Circulation. 125 (6), 789-802 (2012).
- Barallobre-Barreiro, J., et al. Glycoproteomics reveals decorin peptides with anti-myostatin activity in human atrial fibrillation. Circulation. 134 (11), 817-832 (2016).
- Lynch, M., Barallobre-Barreiro, J., Jahangiri, M., Mayr, M. Vascular proteomics in metabolic and cardiovascular diseases. J. Intern. Med. 280 (4), 325-338 (2016).
- Varki, A., Lowe, J. B., Varki, A. Biological Roles of Glycans. Essentials of glycobiology. 2nd ed. , (2009).
- Barallobre-Barreiro, J., Lynch, M., Yin, X., Mayr, M. Systems biology - opportunities and challenges: The application of proteomics to study the cardiovascular extracellular matrix. Cardiovasc. Res. , (2016).
- Agnetti, G., Husberg, C., Van Eyk, J. E. Divide and conquer: the application of organelle proteomics to heart failure. Circ. Res. 108 (4), 512-526 (2011).
- Mason, R. M., Mayes, R. W. Extraction of cartilage protein-polysaccharides with inorganic salt solutions. Biochem. J. 131 (13), 535-540 (1973).
- Vogel, K. G., Peters, J. A. Isolation of proteoglycans from tendon. Methods. Mol. Biol. 171, 9-17 (2001).
- Wilson, R., et al. Comprehensive profiling of cartilage extracellular matrix formation and maturation using sequential extraction and label-free quantitative proteomics. Mol. Cell. Proteomics. 9 (6), 1296-1313 (2010).
- Barallobre-Barreiro, J., et al. Extracellular matrix remodeling in response to venous hypertension: proteomics of human varicose veins. Cardiovasc. Res. 110 (3), 419-430 (2016).
- Didangelos, A., Yin, X., Mandal, K., Baumert, M., Jahangiri, M., Mayr, M. Proteomics characterization of extracellular space components in the human aorta. Mol. Cell. Proteomics. 9 (9), 2048-2062 (2010).
- Didangelos, A., et al. Extracellular matrix composition and remodeling in human abdominal aortic aneurysms: a proteomics approach. Mol. Cell. Proteomics. 10 (8), (2011).
- Grandoch, M., et al. Loss of biglycan enhances thrombin generation in apolipoprotein E-deficient mice: Implications for inflammation and atherosclerosis. Arterioscler Thromb. Vasc. Biol. 36 (5), e41-e50 (2016).
- Yin, X., Bern, M., Xing, Q., Ho, J., Viner, R., Mayr, M. Glycoproteomic analysis of the secretome of human endothelial cells. Mol. Cell. Proteomics. 12 (4), 956-978 (2013).
- Parker, B. L., et al. Quantitative N-linked glycoproteomics of myocardial ischemia and reperfusion injury reveals early remodeling in the extracellular environment. Mol. Cell. Proteomics. 10 (8), (2011).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal. Biochem. 150 (1), 76-85 (1985).
- Pepinsky, R. B. Selective precipitation of proteins from guanidine hydrochloride-containing solutions with ethanol. Anal. Biochem. 195 (1), 177-181 (1991).
- de Castro-Brás, L. E., et al. Texas 3-step decellularization protocol: looking at the cardiac extracellular matrix. J. Proteomics. 86, 43-52 (2013).
- Naba, A., Clauser, K. R., Hynes, R. O. Enrichment of extracellular matrix proteins from tissues and digestion into peptides for mass spectrometry analysis. J Vis Exp. (101), e53057 (2015).
- Decaris, M. L., et al. Proteomic analysis of altered extracellular matrix turnover in bleomycin-induced pulmonary fibrosis. Mol. Cell. Proteomics. 13 (7), 1741-1752 (2014).
- Zhang, H., Li, X. J., Martin, D. B., Aebersold, R. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat. Biotechnol. 21 (6), 660-666 (2003).
- Parker, B. L., et al. Site-specific glycan-peptide analysis for determination of N-glycoproteome heterogeneity. J. Proteome Res. 12 (12), 5791-5800 (2013).
- Li, Y., et al. Simultaneous analysis of glycosylated and sialylated prostate-specific antigen revealing differential distribution of glycosylated prostate-specific antigen isoforms in prostate cancer tissues. Anal. Chem. 83 (1), 240-245 (2011).
- Rienks, M., Papageorgiou, A. P., Frangogiannis, N. G., Heymans, S. Myocardial extracellular matrix: an ever-changing and diverse entity. Circ. Res. 114 (5), 872-888 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır