Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Microprobe kılcal Elektroforez kütle spektrometresi canlı Kurbağa (Xenopus laevis) embriyo tek hücreli Metabolomics için
Bu Makalede
Özet
Biz hızlı içinde in situ örnekleme yüksek kesinlik ve en az işgal kılcal tabanlı mikro-örnekleme, kimyasal bir anlık görüntüsünü metabolik aktivite karakterizasyonu kolaylaştırmak için kullanarak tek bir hücre bulunan küçük bir bölümünün etkinleştirmek adımları tarif canlı embriyolar bir ölçüye göre tek hücre Kapiler Elektroforez ve kütle spektrometresi platformu kullanarak.
Özet
Tek Kişilik hücrelerde küçük moleküllerin miktar embriyonik geliştirme altında yatan temel süreçleri daha iyi anlamak için yeni potansiyelleri yükseltir. Doğrudan içinde canlı embriyolar, yeni analitik yaklaşımlar ihtiyaç vardır, olanaklı kılmak tek hücreli araştırmalar özellikle de hassas, seçici, nicel, güçlü ve ölçeklenebilir farklı hücre boyutu için vardır için. Burada, serbestçe Güney Afrika pençeli kurbağası (Xenopus laevis), hücre ve gelişim biyolojisi güçlü bir model embriyoların gelişmekte olan tek hücre metabolizmasında situ analizini sağlayan bir iletişim kuralı mevcut. Bu yaklaşım bir kapiller microprobe daha sonraki analiz için komşu hücreleri dokunmadan embriyo, tek tanımlanan hücreleri tanımlanmış bir kısmı Aspire için kullanır. Toplanan hücre içeriğini yüksek çözünürlüklü tandem Kütle Spektrometre birleştiğinde bir microscale kılcal Elektroforez electrospray iyonlaşma (CE-ESI) arabirimi tarafından analiz edilir. Bu yaklaşım çeşitli hücre boyutları için ölçeklenebilir ve gelişmekte olan embriyo karmaşık üç boyutlu yapısı ile uyumlu. Örneğin, tek hücreli CE-ESI-Bayan progenitör hücre embriyo gelişimi sırasında torunlarına açmaktadır gibi izlerken metabolik hücre heterojenite aydınlatma sağlar bu microprobe göstermektedir. Hücre ve gelişim biyolojisi yanı sıra, burada açıklanan tek hücreli analiz protokolleri diğer hücre boyutları, hücre tipleri veya hayvan modelleri mükellef bulunmaktadır.
Giriş
Embriyonik geliştirme kapsamlı bir anlayış gelişmekte olan organizmanın her hücrede açılmak tüm moleküler değişiklikleri karakterizasyonu gerektirir. Yeni nesil Sekanslama moleküler güçlendirme ile sağlayan tek hücreli transcriptomes1 gelişmekte olan sistemleri2,3, önemli ölçüde daha az derin ölçüm daha küçük moleküller dizisi hakkında bilinir proteinler ve, özellikle, metabolitleri gibi tek embriyonik hücrelerinde üretilen (molekül ağırlığı < ~ 1500 Da). Bir hızlı ve dinamik ile olaylara yanıt olarak içsel ve dışsal, metabolome bir hücrenin moleküler devlet güçlü bir tanımlayıcısı olarak hizmet vermektedir. Tek hücreli metabolome, bu nedenle, potansiyel hücre heterojenite erken embriyo içinde kayma ve temporal gelişimini izlemek ve fonksiyonel çalışmalar için yeni moleküller tanımlamak için yükseltir. Ancak, moleküler amplifikasyon bu moleküller için kullanılabilir olağanüstü duyarlılık metaboliti analiz için tercih edilen teknoloji olan kütle spektrometresi (MS),'ı kullanarak metabolome tespiti talepleri.
Tek hücreli MS bir metabolitleri (bakın değerlendirmeden 4,5,6,7,8,9 Tek Kişilik hücrelerde ölçmek için yeterli hassasiyetle teknolojidir ,10,11,12,13,14,15). Hücre tekrarlanabilir örnekleme ve metabolitleri verimli çıkarma metabolitleri Tek Kişilik hücrelerde başarılı tespiti için gerekli. Bütün hücre diseksiyon Xenopus embriyo tanımlı hücre küçük moleküller ve peptidler16karakterizasyonu sağlamıştır. Diğer yaklaşımlar MİKROPİPETLER tek tek canlı hücreler tarafından algılamayı electrospray iyonlaşma (ESI) MS kullanarak takip örnek istihdam. Örneğin, metabolitleri bitki veya memeli hücreleri tek hücre video MS17, basınç sonda18, tek sonda19ve sıvı güç mikroskobu20, diğer teknikleri21arasında tarafından ölçüldü, 22,23,24. Ayrıca, önce iyonlaşma tek hücreli MS iş akışı içine kimyasal ayırma birleşme verimli bir şekilde böylece potansiyel etkileşimler hafifletmek için algılama önce iyon oluşturma sırasında metabolome kolaylaştırır. Önemlisi, ayrılık da moleküler tanımlamaları yardımcı olacak bileşik özgü bilgiler verilmiştir. Kapiler Elektroforez (CE) metabolitler nöron fenotipleri arasındaki farklar küçük molekül yakalayan tek disseke25,26 veya microsampled27nöronlar, tespit edebilir kullanılmaya başlanmıştır. Biz son zamanlarda ESI tandem MS metabolitleri Xenopus laevis16,28erken embriyo disseke tek tek hücreleri içinde yüzlerce izleme düzeyi algılamasını etkinleştirmek için CE uyarlanmış. Bu çalışmalar gelişiminin erken bir aşamada embriyonik hücreler arasında şaşırtıcı metabolik farklılıklar ortaya ve metabolitleri ile daha önce keşfi bilinmeyen gelişimsel etkileri16yol açtı.
Burada doğrudan bir canlı omurgalı embriyo microprobe tek hücreli CE-ESI-Bayan29,30kullanarak Tek Kişilik hücrelerde metabolitleri algılama etkin bir protokol sağlar. Seçilen model organizma 8-için-32-hücre X. laevis embriyo, olsa da yaklaşım geliştirme ve diğer türleri canlılar sonraki aşamalarını da geçerlidir. Bu iletişim kuralı bilenmiş kılcal çok eksenli translasyonel kontrolü altında yardım ile bir yüksek çözünürlüklü görüntü sistemi tarafından tanımlanan hücreleri situ morfolojik karmaşık gelişmekte olan embriyo bir ~ 10 nL bölümünü Aspire için kullanır. Bu microprobe daha küçük hücrelere ölçeklenebilir ve saniyeler içinde hangi hücre soy embriyonun içinde izlemek için yeterince hızlı çalışır. Kutup ayıklarken ya da apolar küçük moleküllerin, metabolitleri ve peptidler, ~ 4-5'te toplanan örnekten sonra µL ayıklama çözüm, bir ~ 10 nL elde edilen ekstresinin bir ESI Kütle Spektrometre anavatanına bağlı özel olarak oluşturulmuş bir CE platform analiz. İnşaat ve CE-ESI-MS platform oluşturur başka bir bölümünde protokollerinde. 31 , 32 koaksiyel CE-ESI arabirimin başka bir yerde açıklandığı gibi inşa edilmiştir. 31 bu platform bir 4-5 günlük sipariş dinamik aralığında (göreli28,29,30 bir yeteneği miktar için izleme düzey hassasiyet elde etmek için koni-jet püskürtme rejimi saklanır ya da mutlak16). CE-ESI-MS platform algılama %8 bağıl standart sapma (MSB) ile a 60-Ekrem alt limiti Nefelometri içinde test edilmiş 10 sunmaktadır nM 1 µM küçük moleküller16 X endojen metabolitleri karakterize etmek yeterlidir için için. laevis hücreleri. Microprobed hücreleri aracılığıyla geliştirme30hücresel metabolizma geçici ve dağınık şekilde çözülmüş analiz için izin, embriyo ilerledikçe bölmek devam edin. Nitekim, tek hücreli CE-ESI-Bayan ventral dorsal16,29, hayvan bitkisel16, sol-sağ28 gelişimsel eksenleri ve hücreleri işgal hücreler arasında metabolik farkları bulun için kullanılabilir Bu ortak progenitör hücre içinde X. laevis30kaderde dorsal soyundan sinir dokusu oluştururlar. X. laevis embriyo30farklı gelişim aşamalarında bireysel embriyonik hücreler arasında metabolik farklılıklar sorgulama yanı sıra, biz burada açıklanan protokoller biomolecules geniş bir dizi ilgili tahmin ve Embriyonik geliştirme gibi diğer hücreleri ve model organizmalar türleri farklı aşamalarında gelen tek hücreler microsampled. Ayrıca, farklı bir platform minik örnekleri ile uyumlu ayırma ve/veya biomolecules karakterizasyonu için kullanılabilir gibi görünse microprobe microsampling için kullanılabilir.
Protokol
Tüm iletişim kuralları ile ilgili bakım ve Xenopus laevis işlenmesi kurumsal hayvan bakım ve George Washington Üniversitesi'nde kullanım Komitesi tarafından onaylanmış (IACUC yok. A311).
1. hazırlık örnekleme aletleri, medya, çözücüler ve yemekleri örnekleme
- 1 x Steinberg'ın çözüm (SS) ultrasaf su (~18.2 MΩ.cm 25 ° c) aşağıdaki tuzları çözülerek aşağıdaki sırayla hazırlamak ve bir standart aşağıdaki belirtilen konsantrasyonlarda33protokol: Sodyum Klorür (58.2 mM), Potasyum klorür () 0.67 mM), Kalsiyum nitrat (0,34 mM), Magnezyum sülfat (0,83 mM), Tris-hidroklorid (4.19 mM) ve Tris Bankası (0.66 mM). SS tarafından iki kat x 0.5 ve 0.1 x 1'in panolarında seyreltme tarafından SS SS ultrasaf su kullanarak x.
- Örnekleme yemekleri ilk yapım % 2 özel SS. otoklav 120 ° c x 1 için 20 dk çözülmeye hazırlayın. Ise hala sıvı, 60 mm Petri yemekler ve çözüm alt kat. Bir kez özel jel soğutmalı ve katılaşmış, bir top oluşturur ve hafifçe dokun 5-10 wells, ~ 1 mm derin, özel Künye için ısıtmalı sonuna kadar bir santimlik Pasteur pipet sonu alev.
Not: Bu kuyu embriyo örnekleme sırasında hareketsiz için kullanılır. - Metaboliti ayıklama solvent hazırlayın. Sınıflara çalışmaya ilgi vardır molekülleri çözücü (örneğin, polarizasyon ve pH) fizikokimyasal özellikleri terzi.
Not: Örneğin, biz % 40 metanol ve % 40 Asetonitril LC-MS-grade suda bir keşif yaklaşımı esas olarak kutup metabolitleri ve birkaç apolar metabolitleri ve peptidler28hedeflemek için kullanın. - Temiz saç ve başka bir yerde yavaşça Petri yemeklerinde çok az pertürbasyon ile embriyo hareket için33 açıklandığı gibi bir Pasteur pipet kullanarak saç döngüler yapmak.
- Konik uç MİKROPİPETLER Şekil 1a' gösterildiği gibi imal.
- İlk olarak, aşağıdaki ayarlarla bir yanan Brown tipi kapiller çektirmenin borosilikat kılcal damarlar (1000/500 µm dış/iç çapı) çekmek: ısı 355; = Çekme = 65, hız = 80; saat = 150.
- Sonra ara-~ 20 µm. dış çapı hassasiyet ve tekrarlanabilirlik yardım etmek için bir stereomicroscope altında bu adımı gerçekleştirmek kılcal bir ipucu elde etmek için bir çift iyi keskin forseps kullanarak çekti micropipette ucu kapalı.
Not: Kılcal küçük bir ipucu ile viskoz sitoplazma aspirasyon sırasında tıkanma yatkındır. Daha büyük bir ipucu ile kılcal kesinlikle tıkanma önlemek ve hücresel içeriğin daha fazla Aspire edin yardımcı olsa da, büyük geçişli kılcal daha küçük hücreler örnekleme sırasında sorunlar teşkil ve muhtemelen sonraki örnekleme için hücre zarar. Dikkatli basınç ayarlama ve aspirasyon zaman kısmen bu sorunları hafifletmek. Biz burada sunulan iş için ideal MİKROPİPETLER ~ 20 µm dış çap ile bulmak.
2. Microsampling tek hücreleri ve metaboliti çıkarma
- Doğal yetişkin Xenopus laevis çiftleşme gonadotropin kaynaklı aracılığıyla (döllenmiş yumurta) embriyo elde etmek ya da açıklandığı gibi vitro fertilizasyon ile başka bir yerde33,34protokolleri.
Not: Doğal çiftleşme vitro fertilizasyon tarafından elde edilen embriyolar arzında daha güvenilir olmakla birlikte embriyonik gelişim aşamalarında sendeleyerek sağlar. Ancak, vitro fertilizasyon yetişkin erkek kurbağa ödün gerektirir. - Taze ultrasaf su 200 mL sistein 4 g çözülerek % 2 sistein dejellying çözüm hazırlamak ve dropwise çözüm pH 8 10 N sodyum hidroksit çözümü kullanmak için ayarlayın.
- 2-hücre sahne içine aşağıdaki gibi ayırmak başladığınızda embriyo çevreleyen jöle kat kaldırmak: embriyo dinlenmek için 2 dk dejellying çözümünde, sonra yavaşça onları koleksiyon yüzeye kalarak embriyo önlemek ek bir 2 min için girdap izin çanak.
- Yavaşça temiz bir ölçek çanak içeriği dökün ve hızlı bir şekilde kabı dejellying çözümden dikkatle boşaltmak. Hemen kapak yumurta ile 0.1 x SS kalan kapalı durulama için çözüm, dejellying hafifçe girdap ve çözüm dikkatle boşaltmak. Bu dört kez embriyoların iyice yıkamak için tekrarlayın.
Not: embriyoların canlılığı sağlamak için 4 dk dejellying çözümü için maruz kalma sınırı. Jöle kat kaldırmak için kapsamlı iletişim kuralları bulunmaktadır, başka bir yerde33. - 1'e dejellied embriyo transferi SS bir petri x. Tabak içinde kalabalık en aza indirmek için ~ 100 embriyo 100 mm çanak33başına yerleştirin.
Not: embriyo içeren yemekler geliştirme yavaş ve embriyo kademeli gelişim dönemleri aynı ailesinden elde etmek için 14-18 ° C arasında saklanır. Büyüme ve gelişme sıcaklığı bağımlılığı daha da yönergeler Xenbase ve başka bir yerde Yayınlanan33,35,36,37. - Embriyo 2-hücre aşamada hangi klişeleşmiş pigmentasyon içinde ayrı bir çanak içine güvenle fizyon sıralama referansla kurulan hücre kader haritalar38,39,40ventral dorsal eksen işaretler.
- Midsagittal uçak demarks, ilk bölünme karık bisects sağlayarak doğru sıyırmada embriyo tanımlamak koyu (ventral) ve hafifçe (dorsal) Pigmentli hayvan kutup iki yarım ayna görüntüleri41vardır öyle ki.
- Uydurma bir micropipette bir çok eksenli micromanipulator (el ile veya uzaktan kumandalı) bağlayın. Micropipette bir microinjector için bağlayın.
- 5 ~ 8 hücreli embriyo Aspire edin ve 0,5 içeren örnekleme çanak içine aktarmak için bir plastik transfer pipet kullanın x SS.
Not: pigmentasyon ve embriyo hücre kader haritalar38,39,40referansla pozisyonda göre hücreleri tanımlamak.
Not: Örneğin, bizim rutin ~ 10-15 Aspire edin ~ 3 bakliyat-30 psi için kılcal uygulayarak hücre birimden nL. Bu tüm adım sürer ~ 5 s aspirasyon30.
- Buharlaşma önlemek ve örnekleme tamamlanana kadar şişeyi geri 4 ° C buz kovasının yerleştirmek için şişe sıkıca kapatın. Kullanılan micropipette needlestick tehlike önlemek için "Sharps" konteyner içine atın.
Not: emişli hücre içeriği belirlemek için madeni yağ nerede küresel bir şekil alır, aspiratı enjekte. Bu küre çapı bir mikroskop kullanarak ölçülebilir. Emişli güç hesaplamak: V = nerede V birimi ise r kürenin yarıçapı 4/3 π r3,.
3. CE-ESI-Bayan ölçüm
- CE-ESI-MS için standartlar ve çözümleri hazırlanması
- %1 formik asit LC-MS sınıf suda oluşan arka plan elektrolit (BGE) hazırlayın.
- LC-MS sınıf su ve %0,1 formik asit % 50 metanol içerecek şekilde kılıf çözüm hazırlamak.
- 50 nM asetilkolin çözüm kılıf çözümde CE-ESI-MS sistem performansını günlük değerlendirme için hazırlayın.
- 150 mM Sodyum Klorür çözüm kitle-kalibrasyon standart olarak pozitif iyon modunda düşük m/z aralığı için hazır olun. Bir kütle (m/z) doğruluğunu < 10 ppm tavsiye edilir. Bu adım taşımak için Kütle Spektrometre üreticisinin yönergelerini izleyin.
Not: Alternatif olarak, bilinen m/z değerleri diğer standartlara Kütle Spektrometre kitle ayarlamak için kullanılabilir.
- CE-ESI Platform inşaatı
- Hızlı dikey BGE flakon ve microvial yükleme örnek tutan bir sahne tercümesi kabil bir CE enjeksiyon platform oluşturmak. İnşaat ve platform için başvuru31ayrıntılarda bakın.
- CE-ESI arabirimi (şekil 1 c) araya. Electrospray metal emitör (130/260 µm iç/dış çap ve ~ 35 mm Uzunluk) 3-port T-Birliği monte. Ayrılık CE kılcal damar (40/105 µm iç/dış çap ve ~ 100 cm uzunluk) ~ 40-100 çıkıntı için izin electrospray verici aracılığıyla yem µm Yayıcıyı ucu ötesinde. Doğruluk yardım etmek için stereomicroscope altında çalışır.
- Kılıf çözüm kılcal (75/360 µm iç/dış çap ve ~ 100 cm uzunluk) electrospray çözüm sağlamak için kalan bağlantı noktasına bağlayın. Uygun kollu kullanın ve parmak bağlantıları sızıntısı Alerjik çalışması CE-ESI arabirimi için sıkın. Önceki iletişim kuralları31,32 derleme ve bu arabirim sorun hakkında ayrıntılı bilgi için bakınız.
Not: Kılcal boyutları sinyal-gürültü oranı (S/N) ve ayrılık süresini etkiler. Örneğin, dar Geçişli ve kısa kılcal damarlar daha yüksek ayırma gerilimleri42,43kullanarak hızlı renk ayrımları kolaylaştırmak. Ayrıca, ilgilendikleri bir çalışmada molekülleri türlerine bağlı olarak, ayrılık kılcal istenmeyen molekül-kapiller duvarı etkileşimleri44en aza indirmek/önlemek için kaplı olması.
- Kılıf çözüm kılcal (75/360 µm iç/dış çap ve ~ 100 cm uzunluk) electrospray çözüm sağlamak için kalan bağlantı noktasına bağlayın. Uygun kollu kullanın ve parmak bağlantıları sızıntısı Alerjik çalışması CE-ESI arabirimi için sıkın. Önceki iletişim kuralları31,32 derleme ve bu arabirim sorun hakkında ayrıntılı bilgi için bakınız.
- Bir plaka sahibi kullanarak, CE-ESI arabirimi üç eksenli çeviri sahneye dağ ve electrospray verici ipucu Kütle Spektrometre orifis (şekil 1 c) ~ 2 mm'den getirin.
- Arayüzü temiz bileşenleri için electrospray verici 1 µL/dk ile electrospray kılıf çözüme ve CE ayrılık kılcal damar yoluyla BGE sağlayarak durulayın. Şırınga pompalar çözücüler sabit hızda beslemek için kullanın.
- CE ayrılık kılcal her ölçü önce kılcal damar giriş sonuna kadar bir şırınga bağlanarak floş. Dolum ve solvent tedarik hatları priming en aza indirmek için yeterli büyüklükte şırınga kullanın.
Not: Deneyler genellikle 1 mL gaz geçirmez şırınga electrospray kılıf solvent ve ayrılık kılcal temizlemek için bir 500 µL şırınga sağlamak için kullanın.
- CE-ESI-MS Platform ve metabolitleri ölçümü doğrulama
Not: Bu adımın amacı her gün tek hücre özleri analiz daha önce CE-ESI-Bayan enstrüman analitik duyarlılığını emin olmaktır.
- Ayrılık kılcal ~ 5 min için durulama sonra onun giriş paslanmaz çelik şişede bulunan BGE çözüm içine aktarın.
- Electrospray verici ipucu Kütle Spektrometre orifis ~ 2 mm'den getirin ve güzel-bu mesafe electrospray istikrarlı koni-jet rejiminde süre bir stereomicroscope kullanarak sprey izleme üretmek için bir çeviri sahne kullanarak ayarlayın (bkz. Referanslar 31,45). Toplam iyon geçerli (TIC) kararlılığını izlemek için ~ 30-45 dk kararlı çalışmasını sağlamak için.
- ~ 20 uygulamak için yavaş yavaş potansiyeli üzerinde ~ 15 kadar ramping tarafından BGE şişe kV s, genellikle %1 formik asit BGE kullanarak ayırma kılcal arasında ~7.5 µA geçerli oluşturma. Her ölçü önce ~ 5-10dk TIC profil izleyerek sistem istikrarı sağlamak ve sonra step-wise alt ayırma (CE) potansiyel (toprak) 0 V.
Not: yarı otomatikleştirmek için bu işlemi, biz özel olarak yazılmış bir yazılım CE yüksek voltajlı güç kaynağı31uzaktan denetlemek için kullanın. CE-ESI-MS platform kararsız ise dikkatle istikrarsızlık kaynağı CE-ESI-MS platform ilk yalnızca ESI modunda test ederek değerlendirmek ve sonra başka bir yerde CE-ESI çalışma modunda31önerilir. Kısaca, platform salt ESI modunda sınamak için CE yüksek gerilim açmak ve TIC ~ 30 dk koni-jet püskürtme rejim için izlemek. Gerekirse, adres hataları için şu adımları izleyin: (i) Bağlantılar kaçakları; incelemek (ii) temiz su, isopropanol, su ve metanol ile electrospray verici; (iii) çözücüler de-gaz; (iv) emitör ~ 25 min için tekrar test etmeden önce sifonu çek. CE-ESI platformu yalnızca ESI modunda istikrarlı bulunur ama CE ayırma sırasında kararsız hale gelir, sistem Joule Isıtma ve/veya elektroliz inceleyin: (i) BGE ile ayırma kılcal ~ 25 min için temizleme ve tekrar deneme; (ii) bir doğrusal içinden yanıt (Yani, doğrusal CE ayrılık gerilim eğrisi geçerli); korumak için Alt ayırma potansiyelleri kullanın (iii) CE kılcal çatlaklar gibi olası zararlardan incelemek ve kılcal gerekirse değiştirin. - ~ 6 analiz nL örneği aşağıdaki gibi:
- Asetilkolin standart çözüm 1 µL enjeksiyon şişe pipet.
- Ayrılık kılcal BGE şişeyi enjeksiyon şişe aktarın.
- CE enjeksiyon sahne 15 cm 1s içinde kaldır.
- Sahne alanı 60 için yükseltilmiş tutun hydrodynamically ~ 6 enjekte için s nL örnek ayırma kılcal damar içine.
- Daha sonra geri düzeyleri (doğrultusunda kapiller çıkış) başlangıç için sahne çevirmek.
- Yavaşça hareket ettirmek BGE kılcal damar giriş son.
- Hemen sonra rampa yukarı elektroforetik ayrımı başlatmak için CE gerilim.
- Başlangıç MS veri toplama.
Not: Herhangi bir kimyasal standardını kullanarak sistem performansını karakterize. Tek hücreli CE-ESI-Bayan sunar sınırları algılama ~ 10 alt nM (~ 60 Ekrem) asetilkolin, metionin ve histidin16. Enjekte birimi (VINJ), nL, kılcal içine boy farkı (H, cm) enjeksiyon, yoğunluğu (ρ, g cm-3) ve viskozite (η, kg m-1s-1) sırasında BGE uzunluğu (L, m) ve RADIUS (r, µm) CE bağlıdır kılcal damar ve enjeksiyon süresi (tINJ, s). Bu ilişki g (m s-2) yer çekimi ivmesi nerede aşağıdaki formülle ifade edilir:
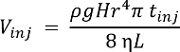
- Kez standart algılandı, veri toplama, ayrılık gerilim 0 V kademeli (toprak) alt ve ardından emitör için 2 cm delik almak. Ayrılık kılcal 5 min için hücre özü analiz daha önce sifonu çek.
- Tek hücreli ölçü 10 nL ayıklamak adımları 3.3.1-3.3.5 tekrar ederek 90 kullanarak s hydrodynamically örnek enjekte etmek.
Not: Veri işleme amacı belirlemek ve bileşikleri tek hücreler arasında ölçmek etmektir. Tek hücreli CE-ESI-MS iletişim kuralı birkaç saniyelik tipik taban genişliği olan dar electropherographic tepeler oluşturur. Yarı el ile veri analizi gerçekleştirerek, bu moleküler özellikleri (benzersiz m/z değerleri benzersiz geçiş kez) bulmak mümkündür aşağıdaki adımları kullanarak. Temsilcisi ayırma şekil 2aselect tanımlanan metabolitleri için gösterilir.
- Kitle kalibre ham veri dosyalarını veri toplama göndermek.
Not: Yerel olarak hücreleri mevcut veya embriyo kültür ortamından ayıklanan olan örnek, bol miktarda sodyum iyonları ayrılması sırasında oluşturulan sodyum formiat kümelerin sinyalleri kullanır. Bu adımın amacı yüksek kütlesi (m/z) doğruluğu, tercihen sağlayarak sonraki adımda metaboliti kimliği artırmaktır < 5 mDa, veya < m/z 50-1, 000 arasında 10 ppm. Burada, post veri edinme kalibrasyon rutin kitle doğruluğu elde etmek mümkün kılan < 1 mDa, veya < 2 ppm m/z 50-500 için. - Bir işleme komut dosyasını kullanarak, moleküler özellikleri için tespit edilen kitle aralığında arar. Kitle spectra doğru kitle belirleme ve onların karşılık gelen geçiş kere yere not her tepe üzerinde ortalama. Düşük-kütle metabolitleri m/z 50-500 aralığında tanımlanması için moleküler özellikleri ile S/N izlemek için bir 500 mDa adım pencere kullanın > 3.
- Pik alanı-altında--eğri moleküler her özellik için el ile veya otomatik olarak entegre. Sonuç alan değerlerini metaboliti bereket bir önlem olarak kullanılır.
- Aşağıdaki (Res. görmek gibi yüksek güven ile ilgi moleküler özelliklerini tanımlama
- İlk olarak, bir metaboliti veritabanında (örneğin, Metlin46 ve HMDB47) moleküler özelliklerinin doğru kitle sözde kitle eşleşmelerin listesini elde etmek için 10 ppm doğruluk ile karşılaştırın.
- Ardından, bu kitle maçlar hücreden elde onların tandem kütle spektrumu karşılaştırarak değerlendirmek özleri metaboliti veritabanları veya tandem kütle spektrumu kullanılabilir veri ile ölçülen karşılık gelen kimyasal madde için standart.
- Son olarak, hücre özleri aynı CE-ESI-Bayan enstrüman tarafından analiz ilgili kimyasal standartları ile kaydedilen moleküler özelliklerinin geçiş zaman karşılaştırarak bu atamaların sağlam temele oturtulmuş.
Not: deneysel üretilen işi artırmak için biz genellikle sadece deneysel koşullar veya hücre tipleri arasında istatistiksel olarak önemli ölçüde farklı moleküler özellikleri tanımlayın. Temsilcisi tanımlamaları Şekil 2' de gösterilmiştir. Kitle yüksek doğrulukta metabolitleri tanımlamak için biz dışarıdan günlük, Kütle Spektrometre kalibre bir iç standart kullanarak ve/veya harici her ölçüm kitle ayarlama her ölçüm sırasında gerçek zamanlı ayarlamayı yapmak tavsiye dosya sonrası veri toplama (örneğin, sodyum formiat kümeleri burada için) tavsiye edilir.
Not: bizim deneyler, online yazılım platformları47 kullanılmıştır, sonraki veri analiz, aşağıdaki adımları da dahil olmak üzere tüm adımları gerçekleştirmek için: Ben) moleküler özelliklerinin en az % 50'her örnek-set (örneğin, hücre oluşumu ile filtre uygulama türü); II) veri normalleştirme; III) istatistiksel (örneğin, t-test) ve çok değişkenli veri analizi, asıl bileşen analizi (PCA) ve hiyerarşik küme analizi (HCA) gibi. P kullandığımız < 0,05 (öğrenci t-test) istatistiksel anlamlılık işaretlemek ve kat-≥ 1,5 biyolojik önemi Not Değiştir.
Sonuçlar
Son zamanlarda microprobe tek hücreli istihdam metabolitleri serbestçe Xenopus laevis embriyo29,30gelişmekte olan bireysel tespit hücrelerdeki karakterize etmek için CE-ESI-Bayan. Microprobe hızlı sağlar (~ 5 sn/hücre), in situ aspirasyon ~ 10 nL tek bir hücre, aynı hücre birden fazla beklentileri veya canlı embriyo (Şekil 1b) geliştirilmesi aynı veya daha sonraki aş...
Tartışmalar
Microprobe CE-ESI-Bayan metabolitleri canlı, serbestçe embriyo gelişmekte olan tek hücrelere doğrudan karakterizasyonu sağlar. Yaklaşım kalbinde iki teknik alt bileşenleri, yani in situ kapiller microsampling ve yüksek-duyarlı CE-ESI-Bayan ile karşılaştırıldığında bütün hücreli diseksiyon, kapiller microsampling hızlı işlem (birkaç saniye 5 dk vs. avantajına sahiptir / hücre diseksiyon tarafından), embriyo ve ölçeklenebilirlik üstü yaşlardaki formu daha küçük hücrelere karma...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser Ulusal kurumları GM114854 sağlık hibe (için P.N.) tarafından desteklenen ve CA211635 (P.N. için) Arnold ve Mabel Beckman Vakfı Beckman Genç Araştırmacı (P.N. için), hibe DuPont genç Profesör Ödülü (için P.N.), kitle için American Society Spektrometresi Araştırma Ödülü (için P.N.) ve COSMOS Club Vakfı Bursu (için R.M.O. ve E.P.P.). Görüş ve sonuçlar bu yayında ifade sadece yazarların bulunmaktadır ve mutlaka finansman kaynakları resmi görüşlerini temsil etmemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents for Embryo Culture Media | |||
| Potasium chloride | Fisher Scientific | BP 366-1 | |
| Magnesium sulfate | Fisher Scientific | M 65-3 | |
| Calcium nitrate | Sigma Aldrich | C1396 | |
| Cysteine | MP Biomedicals | 101444 | |
| Trizma hydrochloride | Sigma Aldrich | T3253 | |
| Trizma base | Sigma Aldrich | T1503 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Name | Company | Catalog Number | Comments |
| Metabolite Extraction Solvents | |||
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Name | Company | Catalog Number | Comments |
| Solvents and Standards for CE-ESI-MS | |||
| Formic acid (LC-MS-grade) | Fisher Scientific | A11710X1-AMP | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Acetylcholine chloride | Acros Organics | 159170050 | |
| Name | Company | Catalog Number | Comments |
| Microprobe Fabrication Setup | |||
| Micropippette puller | Sutter Instrument Co. | P-1000 | |
| Borosilicate capillaries | Sutter Instrument Co. | B100-50-10 | |
| Fine sharp forceps: Dumont #5, Biologie/Dumoxel | Fine Science Tools (USA) Inc | 11252-30 | Corrosion resitant and autoclavable. |
| Name | Company | Catalog Number | Comments |
| Microprobe Sampling Setup | |||
| Micromanipulator | Eppendorf, Hauppauge, NY | TransferMan 4r | |
| Stereomicroscope | Nikon | SMZ18 | Should be vibrationally isolated. |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Glass Pasteur Pipets ( Borosilicate, disposable) | Fisher Scientific | 13-678-20A | |
| Centrifuge | Thermo Scientific | Sorvall Legend X1R | |
| Name | Company | Catalog Number | Comments |
| CE-ESI-MS Setup | |||
| High voltage power supply | Spellman | CZE1000R | The HVPS may be controlled remotely using a low-voltage program generated by a personal computer. Caution: High voltage presents electrical shock hazard; all connective parts must be grounded or carefully shielded to prevent users from accidental exposure. |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Stereomicroscope | Amscope | SM-3BZZ | Stereomicroscope capable of 4.5× magnification, equipped with an illuminator to monitor the spraying mode of the CE-ESI interface. |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-built | This platform is capable of loading nanoliter-amounts of sample into the separation capillary via hydrodynamic injection and supplying the BGE for CE. Both interfaces described in this work were able to inject 6–10 nL of sample within 1 min into a 1 m separation capillary | |
| Stainless steel sample vials | Custom-built | ||
| Stainless steel BGE vial | Custom-built | ||
| Fused silica capillary (40 µm/105 µm ID/OD; 100 cm) | Polymicro technologies | TSP040105 | |
| Fused silica capillary (75 µm/360 µm ID/OD; 100 cm) | Polymicro technologies | TSP075375 | |
| Stainless steel emitter with blunt tips (130/260 µm ID/OD) | Hamilton Co. | 21031A | For better performance, laser-cleave and fine-polish the emitter tip. |
| Syringes (gas-tight): 500 - 1000 µL | Hamilton Co. | 1750TTL | |
| Digital multimeter | Fluke | Fluke 117 | |
| High-resolution Mass Spectrometer | Bruker Daltonics | Maxis Impact HD | High-resolution tandem mass spectrometer equipped with an atmospheric-pressure interface configured for ESI |
| Tunning mixture for mass spectrometer calibration | Agilent technologies | ESI-L G1969-85000 | |
| Data Analysis ver. 4.3 software | Bruker Daltonics | ||
| Name | Company | Catalog Number | Comments |
| Ancillary Equipment | |||
| Vacuum concentrator capable of operation at 4–10°C | Labconco | 7310022 | |
| Analytical microbalance (XSE105DU) | Fisher Scientific | 01911005 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Fisher Scientific | 88300ASP | |
| Refrigerated Incubator | Fisher Scientific | 11475126 | |
| Vortex-mixer | Benchmark | BS-VM-1000 |
Referanslar
- Tang, F. C., Lao, K. Q., Surani, M. A. Development and applications of single-cell transcriptome analysis. Nat. Methods. 8 (4), S6-S11 (2011).
- Veselovska, L., et al. Deep sequencing and de novo assembly of the mouse oocyte transcriptome define the contribution of transcription to the DNA methylation landscape. Genome Biol. 16 (209), (2015).
- Tran, D. A., Bai, A. Y., Singh, P., Wu, X. W., Szabo, P. E. Characterization of the imprinting signature of mouse embryo fibroblasts by RNA deep sequencing. Nucleic Acids Res. 42 (3), 1772-1783 (2014).
- Wang, D. J., Bodovitz, S. Single cell analysis: the new frontier in 'omics'. Trends Biotechnol. 28 (6), 281-290 (2010).
- Svatos, A. Single-cell metabolomics comes of age: new developments in mass spectrometry profiling and imaging. Anal. Chem. 83 (13), 5037-5044 (2011).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nat. Methods. 8 (4), S20-S29 (2011).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat. Biotechnol. 30 (9), 858-889 (2012).
- Rubakhin, S. S., Lanni, E. J., Sweedler, J. V. Progress toward single cell metabolomics. Curr. Opin. Biotechnol. 24 (1), 95-104 (2013).
- Kleparnik, K., Foret, F. Recent advances in the development of single cell analysis: A review. Anal. Chim. Acta. 800, 12-21 (2013).
- Zenobi, R. Single-cell metabolomics: Analytical and biological perspectives. Science. 342 (6163), 1243259 (2013).
- Gholipour, Y., Erra-Balsells, R., Nonami, H. In situ pressure probe sampling and UV-MALDI MS for profiling metabolites in living single cells. Mass Spectrom (Tokyo). 1 (1), A0003 (2012).
- Comi, T. J., Do, T. D., Rubakhin, S. S., Sweedler, J. V. Categorizing cells on the basis of their chemical profiles: progress in single-cell mass spectrometry. J. Am. Chem. Soc. 139 (11), 3920-3929 (2017).
- Lombard-Banek, C., Portero, E. P., Onjiko, R. M., Nemes, P. New-generation mass spectrometry expands the toolbox of cell and developmental biology. Genesis. 55, e23012 (2017).
- Yang, Y. Y., et al. Single-cell analysis by ambient mass spectrometry. Trac-Trends Anal. Chem. 90, 14-26 (2017).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. J. Proteomics. 75 (16), 5036-5051 (2012).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proc. Natl. Acad. Sci. U. S. A. 112 (21), 6545-6550 (2015).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass Spectrom. 43 (12), 1692-1700 (2008).
- Nakashima, T., et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Anal. Chem. 88 (6), 3049-3057 (2016).
- Pan, N., et al. The single-probe: A miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Guillaume-Gentil, O., et al. Single-cell mass spectrometry of metabolites extracted from live cells by fluidic force microscopy. Anal. Chem. 89 (9), 5017-5023 (2017).
- Saha-Shah, A., Green, C. M., Abraham, D. H., Baker, L. A. Segmented flow sampling with push-pull theta pipettes. Analyst. 141 (6), 1958-1965 (2016).
- Hu, J., et al. Synchronized polarization induced electrospray: Comprehensively profiling biomolecules in single cells by combining both positive-ion and negative-ion mass spectra. Anal. Chem. 88 (14), 7245-7251 (2016).
- Zhang, L. W., Vertes, A. Energy charge, redox state, and metabolite turnover in single human hepatocytes revealed by capillary microsampling mass spectrometry. Anal. Chem. 87 (20), 10397-10405 (2015).
- Zhang, L. W., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Lapainis, T., Rubakhin, S. S., Sweedler, J. V. Capillary electrophoresis with electrospray ionization mass spectrometric detection for single-cell metabolomics. Anal. Chem. 81 (14), 5858-5864 (2009).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem. 83 (17), 6810-6817 (2011).
- Aerts, J. T., et al. Patch clamp electrophysiology and capillary electrophoresis mass spectrometry metabolomics for single cell characterization. Anal. Chem. 86 (6), 3203-3208 (2014).
- Onjiko, R. M., Morris, S. E., Moody, S. A., Nemes, P. Single-cell mass spectrometry with multi-solvent extraction identifies metabolic differences between left and right blastomeres in the 8-cell frog (Xenopus) embryo. Analyst. 141 (12), 3648-3656 (2016).
- Onjiko, R. M., Plotnick, D. O., Moody, S. A., Nemes, P. Metabolic comparison of dorsal versus ventral cells directly in the live 8-cell frog embryo by microprobe single-cell CE-ESI-MS. Anal. Methods. , (2017).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: Metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Anal. Chem. 89, 7069-7076 (2017).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nat. Protoc. 8 (4), 783-799 (2013).
- Knolhoff, A. M., Nemes, P., Rubakhin, S. S., Sweedler, J. V., Wevers, R., Lutz, N., Sweedler, J. V. . Methodologies for Metabolomics. , 119-139 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: a laboratory manual. , (2000).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods Mol Biol. 135, 331-347 (2000).
- Bowes, J. B., et al. Xenbase: a Xenopus biology and genomics resource. Nucleic Acids Res. 36, D761-D767 (2008).
- Karpinka, J. B., et al. Xenbase, the Xenopus model organism database; new virtualized system, data types and genomes. Nucleic Acids Res. 43 (D1), D756-D763 (2015).
- James-Zorn, C., et al. Xenbase: expansion and updates of the Xenopus model organism database. Nucleic Acids Res. 41 (D1), D865-D870 (2013).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. Dev. Biol. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell-stage Xenopus embryo. Dev. Biol. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Dev. Biol. 120 (1), 299-304 (1987).
- Rollman, C. M., Moini, M. Ultrafast capillary electrophoresis/mass spectrometry of controlled substances with optical isomer separation in about a minute. Rapid Commun. Mass Spectrom. 30 (18), 2070-2076 (2016).
- Moini, M., Martinez, B. Ultrafast capillary electrophoresis/mass spectrometry with adjustable porous tip for a rapid analysis of protein digest in about a minute. Rapid Commun. Mass Spectrom. 28 (3), 305-310 (2014).
- Huhn, C., Ramautar, R., Wuhrer, M., Somsen, G. W. Relevance and use of capillary coatings in capillary electrophoresis-mass spectrometry. Anal. Bioanal. Chem. 396 (1), 297-314 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal. Chem. 79 (8), 3105-3116 (2007).
- Zhu, Z. J., et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database. Nat. Protoc. 8 (3), 451-460 (2013).
- Wishart, D. S., et al. HMDB 3.0 The Human Metabolome Database in 2013. Nucleic Acids Res. 41 (D1), D801-D807 (2013).
- Liu, J. X., Aerts, J. T., Rubakhin, S. S., Zhang, X. X., Sweedler, J. V. Analysis of endogenous nucleotides by single cell capillary electrophoresis-mass spectrometry. Analyst. 139 (22), 5835-5842 (2014).
- Hubrecht, L., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1967).
- Grant, P. A., Herold, M. B., Moody, S. A. Blastomere explants to test for cell fate commitment during embryonic development. J. Vis. Exp. (71), (2013).
- Sellick, C. A., Hansen, R., Stephens, G. M., Goodacre, R., Dickson, A. J. Metabolite extraction from suspension-cultured mammalian cells for global metabolite profiling. Nat. Protoc. 6 (8), 1241-1249 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır