É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microsonda eletroforese capilar espectrometria de massa para célula única Metabolomics em embriões de viver rã (Xenopus laevis)
Neste Artigo
Resumo
Descrevemos as etapas que permitem rápida situ em amostragem de uma pequena porção de uma célula individual com alta precisão e mínima invasão usando microamostragem baseada em capilar, para facilitar a caracterização química de um instantâneo da atividade metabólica em viver de embriões utilizando uma plataforma de espectrometria de massa e eletroforese capilar Custom-Built única célula.
Resumo
A quantificação de pequenas moléculas em células únicas gera novos potenciais para melhor compreender os processos básicos que fundamentam o desenvolvimento embrionário. Para habilitar monocelulares investigações diretamente em embriões vivos, novas abordagens analíticas são necessários, especialmente aqueles que são sensíveis, seletiva, quantitativos, robusta e escalável para tamanhos diferentes da célula. Aqui, apresentamos um protocolo que permite a análise em situ do metabolismo nas células únicas no livremente desenvolvimento de embriões do Sul Africana Xenopus (Xenopus laevis), um poderoso modelo em biologia celular e do desenvolvimento. Esta abordagem usa uma microsonda capilar para aspirar uma porção definida de simples células identificadas no embrião, deixando as células vizinhas intactas para análise posterior. O conteúdo da célula coletado é analisado por uma interface de microescala eletroforese capilar electrospray ionização (CE-ESI) acoplada a um espectrômetro de massa em tandem de alta resolução. Esta abordagem é escalável para vários tamanhos de célula e compatível com a complexa estrutura tridimensional do embrião em desenvolvimento. Como exemplo, demonstramos que microsonda que monocelulares CE-ESI-MS permite a elucidação de heterogeneidade celular metabólica que se desdobra como uma célula progenitora dá origem a descendentes durante o desenvolvimento do embrião. Além de célula e biologia do desenvolvimento, os protocolos de célula única análise descritos aqui são aptos para outros tamanhos de células, tipos de células ou modelos animais.
Introdução
Uma compreensão abrangente do desenvolvimento embrionário exige caracterização de todas as alterações moleculares que se desenrolam em cada célula do organismo em desenvolvimento. Enquanto a próxima geração de sequenciamento com amplificação molecular permite medição profunda de célula única transcriptomes1 em desenvolvimento sistemas2,3, consideravelmente menos é conhecida sobre o conjunto de moléculas menores produzido em células embrionárias única, incluindo proteínas e, especialmente, metabólitos (massa molecular < Da ~ 1.500). Com uma resposta rápida e dinâmica de eventos intrínsecos e extrínsecos, o metabolome serve como um poderoso descritor de estado molecular da célula. O metabolome de célula única, portanto, aumenta o potencial para acompanhar o desenvolvimento espacial e temporal da heterogeneidade celular no embrião precoce e identificar novas moléculas para estudos funcionais. No entanto, sem amplificação molecular disponível para estas moléculas, deteção da metabolome exige sensibilidade excepcional utilizando espectrometria de massa (MS), que é a tecnologia de escolha para a análise do metabólito.
MS de célula única é uma coleção de tecnologias com sensibilidade suficiente para medir metabólitos em células individuais (ver comentários 4,5,6,7,8,9 ,10,11,12,13,14,15). Reprodutível amostragem de células e extração eficiente de metabólitos são essenciais para a detecção bem sucedida de metabólitos em células únicas. Dissecação de células inteiras de identificadas células de embriões de Xenopus permitiu a caracterização de moléculas pequenas e peptídeos16. Outras abordagens empregam micropipetas para células individuais ao vivo, seguidas de deteção usando ionização electrospray (ESI) MS da amostra. Por exemplo, metabólitos foram medidos na planta ou células de mamíferos por célula única vídeo MS17, sonda de pressão18, única sonda19e microscopia fluídico força20, entre outras técnicas21, 22,23,24. Além disso, a incorporação de separação química antes de ionização para o fluxo de trabalho MS monocelulares eficientemente simplifica a metabolome, aliviando assim, a potenciais interferências durante a geração de íon antes da detecção. Importante, a separação também fornece informações específicas do composto para auxiliar na identificação molecular. Eletroforese capilar (CE) tem sido usado para detectar metabolitos nos neurônios de2726 ou microsampled único dissecado25,, capturando pequeno-molécula diferenças entre fenótipos de neurônio. Nós recentemente adaptado CE para ESI em tandem MS para habilitar a detecção de nível de rastreamento de centenas de metabólitos em células individuais que foram dissecados de embriões adiantados do Xenopus laevis16,28. Estes estudos revelaram diferenças metabólicas surpreendentes entre células embrionárias na fase inicial de desenvolvimento e levaram à descoberta de metabólitos com anteriormente desconhecidos impactos no desenvolvimento16.
Aqui nós fornecemos um protocolo que permitiu a detecção de metabólitos em únicas pilhas diretamente em um embrião de vertebrados ao vivo usando microsonda monocelulares CE-ESI-MS29,30. O organismo modelo escolhido é a 8-a-32-célula X. laevis embrião, embora a abordagem também é aplicável aos últimos estágios de desenvolvimento e outros tipos de organismos modelo. Este protocolo usa capilares afiados com multi-eixo controle translacional sob orientação por um sistema de imagens de alta resolução para aspirar uma porção de nL ~ 10 de células identificadas em situ no desenvolvimento do embrião morfologicamente complexo. Este microsonda é escalável para células menores e opera dentro de segundos, que é suficientemente rápido para acompanhar as linhagens de células no embrião. Depois de extrair polar ou apolar pequenas moléculas, tais como metabólitos e peptides, da amostra coletada em ~ 4-5 solução de extração µ l, uma ~ 10 nL do extrato resultante é analisada em uma plataforma de CE Custom-Built hifenizada de um espectrômetro de massa ESI. Construção e operação da plataforma CE-ESI-MS baseia-se em protocolos descritos em outro lugar. 31 , 32 a interface CE-ESI co-axial é construída conforme descrito em outro lugar. 31 esta plataforma é mantida no regime de pulverização de cone-jato para atingir o nível de rastreamento sensibilidade, com uma capacidade para quantificação sobre uma gama dinâmica de log-ordem de 4-5 (relativo28,29,30 ou absoluto16). A plataforma de CE-ESI-MS oferece um limite de detecção com 8% desvio-padrão relativo (RSD) 60-amol na quantificação sobre um intervalo testado de 10 nM a 1 µM para pequenas moléculas,16, que são suficientes para caracterizar metabólitos endógenos, em X. laevis células. Microprobed células continuam a dividir-se no decorrer do embrião, através de desenvolvimento30, permitindo a análise temporal e espacialmente resolvido de metabolismo celular. De facto, única célula CE-ESI-MS pode ser usado para encontrar diferenças metabólicas entre as células que ocupam o dorso-ventral16,29, animal-vegetal,16e esquerda-direita28 eixos do desenvolvimento bem como células que formam a tecido neural predestinada linhagem dorsal de uma célula progenitora comum em X. laevis30. Além de consultar as diferenças metabólicas entre células embrionárias individuais em diferentes fases do desenvolvimento do embrião X. laevis 30, prevemos que os protocolos aqui descritos são aplicáveis a uma ampla gama de biomoléculas e microsampled de células individuais de diferentes fases do desenvolvimento embrionário, bem como outros tipos de células e organismos-modelo. Além disso, a microsonda poderia ser usada para microsampling enquanto uma plataforma diferente compatível com amostras minúsculas pode ser usada para a separação e/ou caracterização de biomoléculas.
Protocolo
Todos os protocolos relacionados à manutenção e manipulação de Xenopus laevis foram aprovados pelo Comitê de uso da Universidade George Washington e institucional Cuidado Animal (IACUC nenhum. A311).
1. preparação dos instrumentos, meios de comunicação, solventes de amostragem e pratos de amostragem
- Preparar 1 x solução de Steinberg (SS), dissolvendo os seguintes sais em água ultrapura (~18.2 MΩ.cm a 25 ° C), na seguinte ordem e nas concentrações indicadas seguindo um padrão de protocolo33: (58,2 mM) de cloreto de sódio, cloreto de potássio ( 0,67 mM), nitrato de cálcio (0,34 mM), o sulfato de magnésio (0,83 mM), Tris-cloridrato (4,19 mM) e base de Tris (0,66 mM). Fazer 0.5 x SS por duas vezes e 0.1 x SS por diluição dez vezes, do 1 x SS usando água ultrapura.
- Prepare pratos de amostragem por primeiro fazer do agarose 2% em 1 x SS Autoclave a 120 ° C por 20 min para dissolver. Enquanto ainda líquido, cubra o fundo dos pratos de Petri 60mm com a solução. Uma vez que o gel de agarose é refrigerado e solidificado, chama o fim de uma pipeta Pasteur de seis-polegada até formar uma bola e toque levemente a extremidade aquecida para imprimir 5-10 poços, ~ 1 mm de profundidade, no agarose.
Nota: Estes poços são usados para imobilizar os embriões durante a amostragem. - Prepare o solvente de extração do metabólito. Adequar as propriedades físico-químicas do solvente (por exemplo, polaridade e pH) para as classes de moléculas que são de interesse no estudo.
Nota: por exemplo, usamos metanol 40% e 40% acetonitrila em água de LC-MS-classe como uma abordagem de descoberta para metabólitos principalmente polares e apolar alguns metabólitos e peptídeos28-alvo. - Fazer laços de cabelo usando o cabelo limpo e uma pipeta Pasteur, conforme descrito em outro lugar33 para mover suavemente embriões nos pratos de Petri com mínima perturbação.
- Fabrica Micropipetas de ponta cônica, conforme mostrado na Figura 1a.
- Puxe primeiro, capilares de borosilicato (1.000/500 µm de diâmetro externo/interno) em um extrator de flamejante-marrom-tipo capilar com as seguintes configurações: calor = 355; tração = 65, velocidade = 80; tempo = 150.
- Em seguida, quebre-fora a ponta da micropipeta puxada, usando um par de Pinças afiadas bem para obter uma dica capilar diâmetro exterior de ~ 20 µm. Execute esta etapa sob um microscópio para ajudar na precisão e reprodutibilidade.
Nota: Capilares com uma ponta pequena são propensos ao entupimento durante a aspiração do citoplasma viscoso. Enquanto capilares com uma ponta maior certamente ajudam a evitar o entupimento e aspirar mais do conteúdo celular, capilares de grande diâmetro podem representar desafios durante a amostragem de células menores e possivelmente danificar a célula de amostragem subsequente. Cuidado, que regulação da pressão e do tempo de aspiração podem aliviar parcialmente estes desafios. Encontramos micropipetas com ~ 20 µm de diâmetro exterior ideal para o trabalho aqui apresentado.
2. Microsampling Single células e extração de metabólito
- Obter embriões (óvulos fertilizados) através de induzida por gonadotropina acasalamento natural adulto Xenopus laevis ou através de vitro fertilização in conforme descrito em protocolos em outro lugar33,34.
Nota: Acasalamento Natural assegura que os estágios do desenvolvimento embrionários são cambaleou enquanto embriões obtidos por fertilização in vitro são mais confiáveis no fornecimento. No entanto, a fertilização in vitro exige sacrificar o sapo macho adulto. - Recentemente, preparar 2% cisteína dejellying solução dissolvendo-se 4G de cisteína em 200 mL de água ultrapura e ajustar gota a gota a solução de pH 8 usando a solução de hidróxido de sódio 10 N.
- Remover os casacos de geleia envolvendo os embriões começam a decompor-se para a fase 2-célula como segue: Deixe os embriões descansem na solução dejellying por 2 min e, em seguida, agite suavemente-los por um adicional 2 min impedir que embriões aderindo à superfície da coleção prato.
- Despeje delicadamente prato conteúdo em um copo limpo e rapidamente decantar a solução dejellying de copo. Imediatamente, cubra os ovos com 0.1 x SS para enxaguar o restante dejellying solução, agite suavemente e em seguida decantar a solução. Repita este passo quatro vezes para lavar bem os embriões.
Nota: Limitar a exposição dos embriões para a solução de dejellying a 4 min para assegurar a viabilidade. Protocolos abrangentes para remover os casacos de geleia estão disponíveis em outro lugar33. - Transferência de embriões dejellied em 1 x SS em uma placa de Petri. Para minimizar a aglomeração dentro das placas, coloque ~ 100 embriões por 100 mm prato33.
Nota: Pratos contendo embriões podem ser armazenados entre 14-18 ° C para retardar o desenvolvimento e obter embriões em estádios de desenvolvimento escalonados dos mesmos pais. Mais orientações sobre a dependência de temperatura de crescimento e desenvolvimento são publicadas em xBase e em outros lugares33,35,36,37. - Tipo de clivagem embriões no estágio de 2 células em um prato separado no qual pigmentação estereotipada com confiança marca o eixo dorso-ventral, com referência à célula estabelecida destino mapas38,39,40.
- Identificar corretamente a chicotada embriões, garantindo que a primeira constrição, que delimita o sagital, divide o sombriamente (ventral) e levemente (dorsal) pigmentado polo animal, tal que as duas metades são imagens espelhadas41.
- Monte uma micropipeta fabricada em um micromanipulador multi-eixo (manual ou remotamente controlado). Conecte a micropipeta para um microinjector.
- Usar uma pipeta de transferência plástica para aspirar ~ 5 de 8-células embriões e transferi-los para o prato de amostragem contendo 0,5 x SS.
Nota: Identifica as células com base em pigmentação e posição no embrião, com referência à célula destino mapas38,39,40.
Nota: por exemplo, nós rotineiramente Aspire ~ 10-15 volume nL da célula aplicando ~ 3 pulsos de-30 psi para o capilar. Este passo toda dura ~ 5 s para aspiração30.
- Feche bem o frasco para evitar a evaporação e coloque o frasco de volta para o balde de gelo de 4 ° C até amostragem está completa. Descarte a micropipeta usada dentro de um recipiente de objectos cortantes para evitar o risco de picada de agulha.
Nota: Para determinar o volume do conteúdo aspirado celular, injete o aspirado em óleo mineral, onde ele obtém uma forma esférica. O diâmetro desta esfera pode ser medido usando um microscópio. Calcular o volume aspirado: V = 4/3 π r3, onde V é o volume, e r é o raio da esfera.
3. medição de CE-ESI-MS
- Preparação de padrões e soluções para a CE-ESI-MS
- Prepare o eletrólito de fundo (BGE), consistindo de 1% de ácido fórmico em água de grau de LC-MS.
- Prepare a solução de bainha para conter 50% de metanol em LC-MS série água e 0,1% de ácido fórmico.
- Prepare a solução de acetilcolina 50 nM na solução da bainha para avaliação diária do desempenho do sistema de CE-ESI-MS.
- Prepare a solução de cloreto de sódio de 150 mM como padrão de calibração de massa para a gama baixa m/z no modo de íon positivo. Uma exatidão de massa (m/z) de < 10 ppm é recomendado. Siga as instruções do fornecedor do espectrômetro de massa para realizar esta etapa.
Nota: Como alternativa, outros padrões com valores conhecidos m/z podem ser usados para massa-calibrar o espectrômetro de massa.
- Construção da plataforma de CE-ESI
- Construa uma plataforma de injeção CE capaz de rápida tradução vertical de um palco segurando o frasco BGE e a amostra microtubo de carregamento. Para construção e operação da plataforma, consulte detalhes em referência31.
- Monte a interface CE-ESI (Figura 1C) da seguinte forma. Monte o emissor metal electrospray (130/260 µm interno/externo diâmetro e ~ 35 mm de comprimento) em uma União em T 3 portas. Alimentar o capilar de separação CE (40/105 µm interno/externo diâmetro e ~ 100 cm de comprimento) através do emissor de electrospray permitindo que sobressaiem ~ 40-100 µm para além da ponta do emissor. Trabalhar sob um microscópio para ajudar com precisão.
- Conecte o capilar de solução de bainha (75/360 µm interno/externo diâmetro e ~ 100 cm de comprimento) à porta restante para fornecer a solução de electrospray. Usar luvas adequadas e dedo-aperte as ligações para operação sem vazamentos da interface CE-ESI. Consulte anteriores protocolos31,32 para obter detalhes sobre a montagem e resolução de problemas de interface.
Nota: Dimensões capilar afetam a relação sinal-ruído (S/N) e a duração da separação. Por exemplo, capilares de diâmetro estreito e curtos facilitam rápidas separações usando maior separação tensões42,43. Além disso, dependendo dos tipos de moléculas que são de interesse em um estudo, capilares de separação podem ser revestidos para minimizar/evitar indesejáveis molécula-capilar parede interações44.
- Conecte o capilar de solução de bainha (75/360 µm interno/externo diâmetro e ~ 100 cm de comprimento) à porta restante para fornecer a solução de electrospray. Usar luvas adequadas e dedo-aperte as ligações para operação sem vazamentos da interface CE-ESI. Consulte anteriores protocolos31,32 para obter detalhes sobre a montagem e resolução de problemas de interface.
- Usando um porta-placa, montar a interface CE-ESI para um palco de tradução de três eixos e posicione a ponta do emissor de electrospray ~ 2 mm do orifício espectrômetro de massa (Figura 1C).
- Para limpar os componentes da interface, enxague, fornecendo a solução de bainha de electrospray através do emissor de electrospray em 1 µ l/min e a BGE por meio da separação de CE capilar. Use bombas de seringa para alimentar os solventes a um ritmo constante.
- Irrigue o capilar de separação CE antes de cada medição conectando-se uma seringa à extremidade da entrada capilar. Use seringas suficientemente grandes para minimizar a recarga e priming de linhas de abastecimento de solvente.
Nota: Experiências normalmente usam 1 mL seringas estanques ao gás para fornecer o solvente de bainha de electrospray e uma seringa de 500 µ l para liberar o capilar de separação.
- Validação da medição de metabólitos e plataforma CE-ESI-MS
Nota: O objetivo deste passo é confirmar a sensibilidade analítica do instrumento CE-ESI-MS diariamente antes de analisar extratos de célula única.
- Após enxaguar o capilar de separação para ~ 5 min, transferi sua entrada para a solução BGE, localizada em um frasco do aço inoxidável.
- Posicione a ponta do emissor de electrospray ~ 2 mm do orifício espectrômetro de massa e fino-ajustar esta distância usando um estágio da tradução para gerar electrospray em regime estável de cone-jato enquanto monitora o spray usando um estereomicroscópio (ver referências 31,,45). Monitorar a estabilidade do íon total atual (TIC) para ~ 30-45 min para garantir uma operação estável.
- Aplicar ~ 20 kV ao frasco BGE por gradualmente aumentando o potencial de mais de 15 anos ~ s, normalmente gerando ~7.5 µA atual através do capilar de separação usando 1% de ácido fórmico como a BGE. Antes de cada medição, garantir a estabilidade do sistema, monitorando o perfil TIC para ~ 5-10 min e em seguida step-wise reduzir o potencial de separação (CE) a 0 V (terra).
Nota: Semi automatizar este processo, nós usamos um software personalizado-escritos para controlar remotamente o CE de alta tensão potência alimentação31. Se a plataforma CE-ESI-MS é instável, cuidadosamente avaliar a fonte de instabilidade, testando a plataforma CE-ESI-MS primeiro no modo somente ESI e em seguida no modo operacional CE-ESI como recomendado em outro lugar31. Brevemente, para testar a plataforma no modo somente ESI, desligue a tensão alta CE e monitorar o TIC para ~ 30 min no regime de pulverização de jato cone. Se necessário, proceda do seguinte modo para erros de endereço: (i) inspecionar as conexões para vazamentos; (ii) Limpe o emissor de electrospray com água, isopropanol, água e metanol; (iii) gás de solventes; (iv) Lave o emissor para ~ 25 min antes de testar novamente. Se a plataforma CE-ESI encontra-se estável em modo somente ESI, mas torna-se instável durante a separação de CE, inspecionar o sistema de aquecimento Joule e/ou eletrólise: (i) liberar o capilar de separação com BGE para ~ 25 min e repetir a experiência; (ii) usar mais baixos potenciais de separação para manter uma resposta ôhmica linear (isto é, atual versus curva de tensão de separação linear CE); (iii) fiscalizar o capilar de CE por danos potenciais, tais como rachaduras e se necessário, substitua o capilar. - Analisar 6 ~ nL da amostra da seguinte forma:
- Pipete 1 µ l da solução padrão de acetilcolina para a ampola de injeção.
- Transferi o capilar de separação do frasco BGE dentro do frasco de injeção.
- Levante a fase de injeção de CE 15 cm em 1s.
- Segure o palco elevado para 60 s para injetar direccionado ~ 6 nL de amostra capilar a separação.
- Posteriormente, traduza o estágio para começar os níveis (de acordo com a saída do capilar).
- Movimente suavemente o fim da entrada capilar para a BGE.
- Imediatamente após, rampa até a tensão de CE para iniciar a separação eletroforética.
- Aquisição de dados do MS de início.
Nota: O desempenho do sistema pode ser caracterizado usando qualquer produto químico padrão. A entrega de CE-ESI-MS monocelulares abaixar limites de detecção no ~ 10 nM (~ 60 amol) para acetilcolina, histidina e metionina16. O volume injetado (Vinj), para o capilar em nL, varia de acordo com a diferença de altura (H, cm) durante a injeção, densidade (ρ, g cm-3) e a viscosidade (η, kg m-1s-1) da BGE, comprimento (L, m) e raio (r, µm) da CE capilar e a duração da injeção (tinj, s). Esta relação é expressa pela seguinte fórmula, onde g (m s-2) é a aceleração gravitacional:
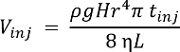
- Uma vez que a norma foi detectada, pare de aquisição de dados, reduzir a tensão de separação gradual de 0 V (terra), em seguida, recuperar o emissor a 2 cm do orifício. Purgar o capilar de separação por 5 min antes de analisar o extrato celular.
- Medida 10 nL do single-cell Extraia, repetindo as etapas 3.3.1-3.3.5 usando 90 s para injetar direccionado a amostra.
Nota: O objetivo do tratamento dos dados é identificar e quantificar os compostos entre células únicas. O protocolo de CE-ESI-MS monocelulares gera picos electropherographic estreitos com larguras de base típicas de alguns segundos. Através da realização de análise de dados semi manualmente, é possível encontrar características moleculares (valores exclusivos m/z com tempos de migração exclusivo) usando as seguintes etapas. Separação de representante é mostrada para selecionados metabólitos identificados na Figura 2a.
- Arquivos de dados brutos de massa-calibrar pós aquisição de dados.
Nota: Nós usamos sinais de sódio formiato clusters que são gerados durante a separação de íons de sódio abundante da amostra, que são originalmente presentes nas células ou extraídos dos meios de cultura de embrião. O objetivo desta etapa é melhorar a identificação do metabolito em etapas posteriores, garantindo uma precisão de alta massa (m/z), de preferência < 5 mDa, ou < 10 ppm, entre m/z 1-50, 000. Aqui, post calibração de aquisição de dados torna possível rotineiramente obter precisões de massa < 1 mDa, ou < 2 ppm m/z 50-500. - Usando um script de processamento, busca por características moleculares através da escala de massa detectada. Média de espectros de massa através de cada pico para determinar a massa exata e anote seus correspondentes tempos de migração. Para a identificação dos metabolitos de baixa massa na faixa de m/z 50-500, usar uma janela de passo 500 mDa para monitorar características moleculares com S/N > 3.
- Integre a pico área-sob-a-curva para cada característica molecular manualmente ou automaticamente. Os valores resultantes de área são utilizados como uma medida da abundância do metabólito.
- Identificar as características moleculares de interesse com alta confiança como segue (ver fig.
- Em primeiro lugar, compare a massa exata das características moleculares contra um banco de dados do metabólito (por exemplo, Metlin46 e HMDB47) com precisão de 10 ppm para obter uma lista de correspondências em massa putativos.
- Em seguida, avaliar essas correspondências em massa, comparando o seu espectro de massa em tandem obtido a partir da célula medido de extratos com dados disponíveis em bancos de dados do metabólito ou o espectro de massa em tandem para o químico correspondente padrão.
- Por último, validar essas atribuições, comparando o tempo de migração das características moleculares, gravado em extratos de células com padrões químicos relacionados, analisados pelo mesmo instrumento de CE-ESI-MS.
Nota: Para aumentar a taxa de transferência experimental, normalmente identificamos apenas características moleculares que são estatisticamente significativamente diferentes entre condições experimentais ou tipos de células. Identificações de representante são mostradas na Figura 2. Para identificar metabólitos com exatidão elevada massa, recomendamos externamente calibrando o espectrômetro de massa diariamente, realizando em tempo real recalibração durante cada medição usando um padrão interno, e/ou externamente em massa-calibrar cada medição aquisição de pós-dados arquivo (por exemplo, para clusters de formiato de sódio aqui) são recomendados.
Nota: Em nossas experiências, de plataformas de software online47 foram usados para executar todas as etapas subsequentes da análise de dados, incluindo as seguintes etapas: eu) filtragem das características moleculares com ocorrência pelo menos 50% de cada amostra-conjunto (por exemplo, célula tipo); II) a normalização dos dados; III) estatística (por exemplo, t-test) e análise de dados multivariada, como análise de componentes principais (PCA) e análise de agrupamento hierárquico (HCA). Nós usamos p < 0.05 (Student t-teste) para marcar a significância estatística e dobra-mudança ≥ 1.5 observar o significado biológico.
Resultados
Nós recentemente empregados microsonda monocelulares CE-ESI-MS para caracterizar metabólitos em células individuais identificados livremente desenvolver embriões de Xenopus laevis 29,30. A microsonda permite rápido (~ 5 seg/cell), em situ aspiração de ~ 10 nL de uma célula individual, múltiplas aspirações da mesma célula, ou várias células diferentes dentro da mesmas ou posteriores estágios de dese...
Discussão
Microprobe CE-ESI-MS permite a caracterização directa dos metabolitos em células únicas em viver, livremente desenvolver embriões. O cerne da abordagem são dois subcomponentes técnicas, nomeadamente em situ microsampling capilar e alta sensibilidade CE-ESI-MS. em comparação à dissecação de células inteiras, microsampling capilar tem a vantagem de operação rápida (alguns segundos vs 5 min pilha / por dissecação), compatibilidade com a morfologia tridimensional complexa de embriões e escalabilid...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pela National institutos de saúde subsídios GM114854 (de Parque Nacional) e CA211635 (de Parque Nacional), o Arnold e Mabel Beckman Fundação Beckman Young Investigator concedem (Parque Nacional), o prêmio DuPont jovem Professor (de Parque Nacional), a sociedade americana para a missa Prêmio de pesquisa espectrometria (de Parque Nacional) e bolsas COSMOS Club Foundation (para R.M.O e E.P.P.). As opiniões e conclusões expressadas nesta publicação são exclusivamente dos autores e não necessariamente representam a opinião oficial das fontes de financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents for Embryo Culture Media | |||
| Potasium chloride | Fisher Scientific | BP 366-1 | |
| Magnesium sulfate | Fisher Scientific | M 65-3 | |
| Calcium nitrate | Sigma Aldrich | C1396 | |
| Cysteine | MP Biomedicals | 101444 | |
| Trizma hydrochloride | Sigma Aldrich | T3253 | |
| Trizma base | Sigma Aldrich | T1503 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Name | Company | Catalog Number | Comments |
| Metabolite Extraction Solvents | |||
| Acetonitrile (LC-MS-grade) | Fisher Scientific | A955 | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Name | Company | Catalog Number | Comments |
| Solvents and Standards for CE-ESI-MS | |||
| Formic acid (LC-MS-grade) | Fisher Scientific | A11710X1-AMP | |
| Methanol (LC-MS-grade) | Fisher Scientific | A456-4 | |
| Water (LC-MS-grade) | Fisher Scientific | W6 | |
| Sodium chloride | Fisher Scientific | 5641-212 | |
| Acetylcholine chloride | Acros Organics | 159170050 | |
| Name | Company | Catalog Number | Comments |
| Microprobe Fabrication Setup | |||
| Micropippette puller | Sutter Instrument Co. | P-1000 | |
| Borosilicate capillaries | Sutter Instrument Co. | B100-50-10 | |
| Fine sharp forceps: Dumont #5, Biologie/Dumoxel | Fine Science Tools (USA) Inc | 11252-30 | Corrosion resitant and autoclavable. |
| Name | Company | Catalog Number | Comments |
| Microprobe Sampling Setup | |||
| Micromanipulator | Eppendorf, Hauppauge, NY | TransferMan 4r | |
| Stereomicroscope | Nikon | SMZ18 | Should be vibrationally isolated. |
| Illuminator e.g. Goosenecks | Nikon | C-FLED2 | |
| Microinjector | Warner Instrument, Handem, CT | PLI-100A | |
| Transfer pipettes (Plastic, disposable) | Fisher Scientific | 13-711-7M | |
| Petri dish 60 mm and 80 mm | Fisher Scientific | S08184 | |
| Glass Pasteur Pipets ( Borosilicate, disposable) | Fisher Scientific | 13-678-20A | |
| Centrifuge | Thermo Scientific | Sorvall Legend X1R | |
| Name | Company | Catalog Number | Comments |
| CE-ESI-MS Setup | |||
| High voltage power supply | Spellman | CZE1000R | The HVPS may be controlled remotely using a low-voltage program generated by a personal computer. Caution: High voltage presents electrical shock hazard; all connective parts must be grounded or carefully shielded to prevent users from accidental exposure. |
| Syringe pumps (2) | Harvard Apparatus | 704506 | |
| Stereomicroscope | Amscope | SM-3BZZ | Stereomicroscope capable of 4.5× magnification, equipped with an illuminator to monitor the spraying mode of the CE-ESI interface. |
| XYZ translation stage | Thorlabs | PT3 | |
| XYZ translation stage | Custom-built | This platform is capable of loading nanoliter-amounts of sample into the separation capillary via hydrodynamic injection and supplying the BGE for CE. Both interfaces described in this work were able to inject 6–10 nL of sample within 1 min into a 1 m separation capillary | |
| Stainless steel sample vials | Custom-built | ||
| Stainless steel BGE vial | Custom-built | ||
| Fused silica capillary (40 µm/105 µm ID/OD; 100 cm) | Polymicro technologies | TSP040105 | |
| Fused silica capillary (75 µm/360 µm ID/OD; 100 cm) | Polymicro technologies | TSP075375 | |
| Stainless steel emitter with blunt tips (130/260 µm ID/OD) | Hamilton Co. | 21031A | For better performance, laser-cleave and fine-polish the emitter tip. |
| Syringes (gas-tight): 500 - 1000 µL | Hamilton Co. | 1750TTL | |
| Digital multimeter | Fluke | Fluke 117 | |
| High-resolution Mass Spectrometer | Bruker Daltonics | Maxis Impact HD | High-resolution tandem mass spectrometer equipped with an atmospheric-pressure interface configured for ESI |
| Tunning mixture for mass spectrometer calibration | Agilent technologies | ESI-L G1969-85000 | |
| Data Analysis ver. 4.3 software | Bruker Daltonics | ||
| Name | Company | Catalog Number | Comments |
| Ancillary Equipment | |||
| Vacuum concentrator capable of operation at 4–10°C | Labconco | 7310022 | |
| Analytical microbalance (XSE105DU) | Fisher Scientific | 01911005 | |
| Freezer (-20 °C) | Fisher Scientific | 97-926-1 | |
| Freezer (-80 °C) | Fisher Scientific | 88300ASP | |
| Refrigerated Incubator | Fisher Scientific | 11475126 | |
| Vortex-mixer | Benchmark | BS-VM-1000 |
Referências
- Tang, F. C., Lao, K. Q., Surani, M. A. Development and applications of single-cell transcriptome analysis. Nat. Methods. 8 (4), S6-S11 (2011).
- Veselovska, L., et al. Deep sequencing and de novo assembly of the mouse oocyte transcriptome define the contribution of transcription to the DNA methylation landscape. Genome Biol. 16 (209), (2015).
- Tran, D. A., Bai, A. Y., Singh, P., Wu, X. W., Szabo, P. E. Characterization of the imprinting signature of mouse embryo fibroblasts by RNA deep sequencing. Nucleic Acids Res. 42 (3), 1772-1783 (2014).
- Wang, D. J., Bodovitz, S. Single cell analysis: the new frontier in 'omics'. Trends Biotechnol. 28 (6), 281-290 (2010).
- Svatos, A. Single-cell metabolomics comes of age: new developments in mass spectrometry profiling and imaging. Anal. Chem. 83 (13), 5037-5044 (2011).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nat. Methods. 8 (4), S20-S29 (2011).
- Bodenmiller, B., et al. Multiplexed mass cytometry profiling of cellular states perturbed by small-molecule regulators. Nat. Biotechnol. 30 (9), 858-889 (2012).
- Rubakhin, S. S., Lanni, E. J., Sweedler, J. V. Progress toward single cell metabolomics. Curr. Opin. Biotechnol. 24 (1), 95-104 (2013).
- Kleparnik, K., Foret, F. Recent advances in the development of single cell analysis: A review. Anal. Chim. Acta. 800, 12-21 (2013).
- Zenobi, R. Single-cell metabolomics: Analytical and biological perspectives. Science. 342 (6163), 1243259 (2013).
- Gholipour, Y., Erra-Balsells, R., Nonami, H. In situ pressure probe sampling and UV-MALDI MS for profiling metabolites in living single cells. Mass Spectrom (Tokyo). 1 (1), A0003 (2012).
- Comi, T. J., Do, T. D., Rubakhin, S. S., Sweedler, J. V. Categorizing cells on the basis of their chemical profiles: progress in single-cell mass spectrometry. J. Am. Chem. Soc. 139 (11), 3920-3929 (2017).
- Lombard-Banek, C., Portero, E. P., Onjiko, R. M., Nemes, P. New-generation mass spectrometry expands the toolbox of cell and developmental biology. Genesis. 55, e23012 (2017).
- Yang, Y. Y., et al. Single-cell analysis by ambient mass spectrometry. Trac-Trends Anal. Chem. 90, 14-26 (2017).
- Lanni, E. J., Rubakhin, S. S., Sweedler, J. V. Mass spectrometry imaging and profiling of single cells. J. Proteomics. 75 (16), 5036-5051 (2012).
- Onjiko, R. M., Moody, S. A., Nemes, P. Single-cell mass spectrometry reveals small molecules that affect cell fates in the 16-cell embryo. Proc. Natl. Acad. Sci. U. S. A. 112 (21), 6545-6550 (2015).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass Spectrom. 43 (12), 1692-1700 (2008).
- Nakashima, T., et al. Single-cell metabolite profiling of stalk and glandular cells of intact trichomes with internal electrode capillary pressure probe electrospray ionization mass spectrometry. Anal. Chem. 88 (6), 3049-3057 (2016).
- Pan, N., et al. The single-probe: A miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Guillaume-Gentil, O., et al. Single-cell mass spectrometry of metabolites extracted from live cells by fluidic force microscopy. Anal. Chem. 89 (9), 5017-5023 (2017).
- Saha-Shah, A., Green, C. M., Abraham, D. H., Baker, L. A. Segmented flow sampling with push-pull theta pipettes. Analyst. 141 (6), 1958-1965 (2016).
- Hu, J., et al. Synchronized polarization induced electrospray: Comprehensively profiling biomolecules in single cells by combining both positive-ion and negative-ion mass spectra. Anal. Chem. 88 (14), 7245-7251 (2016).
- Zhang, L. W., Vertes, A. Energy charge, redox state, and metabolite turnover in single human hepatocytes revealed by capillary microsampling mass spectrometry. Anal. Chem. 87 (20), 10397-10405 (2015).
- Zhang, L. W., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Lapainis, T., Rubakhin, S. S., Sweedler, J. V. Capillary electrophoresis with electrospray ionization mass spectrometric detection for single-cell metabolomics. Anal. Chem. 81 (14), 5858-5864 (2009).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis electrospray ionization mass spectrometry. Anal. Chem. 83 (17), 6810-6817 (2011).
- Aerts, J. T., et al. Patch clamp electrophysiology and capillary electrophoresis mass spectrometry metabolomics for single cell characterization. Anal. Chem. 86 (6), 3203-3208 (2014).
- Onjiko, R. M., Morris, S. E., Moody, S. A., Nemes, P. Single-cell mass spectrometry with multi-solvent extraction identifies metabolic differences between left and right blastomeres in the 8-cell frog (Xenopus) embryo. Analyst. 141 (12), 3648-3656 (2016).
- Onjiko, R. M., Plotnick, D. O., Moody, S. A., Nemes, P. Metabolic comparison of dorsal versus ventral cells directly in the live 8-cell frog embryo by microprobe single-cell CE-ESI-MS. Anal. Methods. , (2017).
- Onjiko, R. M., Portero, E. P., Moody, S. A., Nemes, P. In situ microprobe single-cell capillary electrophoresis mass spectrometry: Metabolic reorganization in single differentiating cells in the live vertebrate (Xenopus laevis) embryo. Anal. Chem. 89, 7069-7076 (2017).
- Nemes, P., Rubakhin, S. S., Aerts, J. T., Sweedler, J. V. Qualitative and quantitative metabolomic investigation of single neurons by capillary electrophoresis electrospray ionization mass spectrometry. Nat. Protoc. 8 (4), 783-799 (2013).
- Knolhoff, A. M., Nemes, P., Rubakhin, S. S., Sweedler, J. V., Wevers, R., Lutz, N., Sweedler, J. V. . Methodologies for Metabolomics. , 119-139 (2013).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: a laboratory manual. , (2000).
- Moody, S. A. Cell lineage analysis in Xenopus embryos. Methods Mol Biol. 135, 331-347 (2000).
- Bowes, J. B., et al. Xenbase: a Xenopus biology and genomics resource. Nucleic Acids Res. 36, D761-D767 (2008).
- Karpinka, J. B., et al. Xenbase, the Xenopus model organism database; new virtualized system, data types and genomes. Nucleic Acids Res. 43 (D1), D756-D763 (2015).
- James-Zorn, C., et al. Xenbase: expansion and updates of the Xenopus model organism database. Nucleic Acids Res. 41 (D1), D865-D870 (2013).
- Moody, S. A. Fates of the blastomeres of the 16-cell stage Xenopus embryo. Dev. Biol. 119 (2), 560-578 (1987).
- Moody, S. A. Fates of the blastomeres of the 32-cell-stage Xenopus embryo. Dev. Biol. 122 (2), 300-319 (1987).
- Dale, L., Slack, J. M. W. Fate map for the 32-cell stage of Xenopus laevis. Development. 99 (4), 527-551 (1987).
- Klein, S. L. The first cleavage furrow demarcates the dorsal-ventral axis in Xenopus embryos. Dev. Biol. 120 (1), 299-304 (1987).
- Rollman, C. M., Moini, M. Ultrafast capillary electrophoresis/mass spectrometry of controlled substances with optical isomer separation in about a minute. Rapid Commun. Mass Spectrom. 30 (18), 2070-2076 (2016).
- Moini, M., Martinez, B. Ultrafast capillary electrophoresis/mass spectrometry with adjustable porous tip for a rapid analysis of protein digest in about a minute. Rapid Commun. Mass Spectrom. 28 (3), 305-310 (2014).
- Huhn, C., Ramautar, R., Wuhrer, M., Somsen, G. W. Relevance and use of capillary coatings in capillary electrophoresis-mass spectrometry. Anal. Bioanal. Chem. 396 (1), 297-314 (2010).
- Nemes, P., Marginean, I., Vertes, A. Spraying mode effect on droplet formation and ion chemistry in electrosprays. Anal. Chem. 79 (8), 3105-3116 (2007).
- Zhu, Z. J., et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database. Nat. Protoc. 8 (3), 451-460 (2013).
- Wishart, D. S., et al. HMDB 3.0 The Human Metabolome Database in 2013. Nucleic Acids Res. 41 (D1), D801-D807 (2013).
- Liu, J. X., Aerts, J. T., Rubakhin, S. S., Zhang, X. X., Sweedler, J. V. Analysis of endogenous nucleotides by single cell capillary electrophoresis-mass spectrometry. Analyst. 139 (22), 5835-5842 (2014).
- Hubrecht, L., Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1967).
- Grant, P. A., Herold, M. B., Moody, S. A. Blastomere explants to test for cell fate commitment during embryonic development. J. Vis. Exp. (71), (2013).
- Sellick, C. A., Hansen, R., Stephens, G. M., Goodacre, R., Dickson, A. J. Metabolite extraction from suspension-cultured mammalian cells for global metabolite profiling. Nat. Protoc. 6 (8), 1241-1249 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados