Method Article
Sarkom hasta türevi xenografts tümör-başlatma hücrelerinin yalıtım ve karakterizasyonu
Bu Makalede
Özet
Tümör Başlatan hücrelerin insan sarkomu hasta türevi xenograflarından floresan-aktif hücre sıralama ile yalıtılması için ayrıntılı bir protokol tanımlayarak, insan lökosit antijen-1 (HLA-1) ' i negatif bir işaret olarak kullanarak ve daha fazla doğrulama ve Bu HLA-1-negatif tümör başlatma hücrelerinin karakterizasyonu.
Özet
Tümör Başlatan hücrelerin (Ti) varlığı ve önemi, son on yıl boyunca kanıtların artması ile destekleniyor. Bu tiklerin tümör başlatılması, metasetik ve ilaç direncinden sorumlu olduğu gösterilmiştir. Bu nedenle, mevcut kemoterapi stratejilerine ek olarak spesifik TIC-hedefleme terapisi geliştirmek önemlidir, hangi çoğunlukla non-tik toplu odaklanmak. İK malignite arkasındaki mekanizması daha da anlamak için, biz izole ve insan sarcomas içinde TICs karakterize etmek için bir yöntem açıklanmaktadır. Bu belgede, insan sarkomları için hasta türevi xenograflar (PDX) üretmek ve etik olarak aktif hücre ayrıştırma (FACS) ile insan lökosit antijen sınıfı ı (HLA-1) kullanarak ti 'leri negatif bir işaret olarak izole etmek için ayrıntılı bir protokol gösteriyoruz. Ayrıca, bir küre oluşumu tahlil ve bir tümör oluşumu tahlil de dahil olmak üzere, bu tikler işlevsel olarak karakterize nasıl tarif, ve mezenkimal yollar boyunca farklılaşma neden. PDX ti 'nin yalıtım ve karakterizasyonu, potansiyel hedefleme terapisi reaktiflerinin keşfi için ipuçları sağlar. Dahası, artan kanıtlar, bu protokol daha fazla izole etmek ve insan kanserleri diğer türlerinden TICs karakterize etmek için uzatılabilir olduğunu göstermektedir.
Giriş
İnsan kanserlerinin intratumoral hücresel heterojenitesi, son on yıl boyunca kanıt artırarak desteklenmektedir1. Normal doku benzer, kanser dokusu ti küçük bir alt nüfusu oluşur (kanser kök hücreleri olarak da adlandırılır), hangi sergileyen tümör-şekillendirme yeteneği; Bu arada, kanser hücrelerinin toplu farklılaşmış fenotürleri sergiler2. Bu tikler, bir kök hücre işaretçisinin ifadesi ve hem Self-yenilenme hem de asimetrik hücre bölünmesinin yeteneği de dahil olmak üzere kök hücre benzeri özellikleri gösterir ve böylece hücresel heterojen bir tümör3' ün oluşumunu başlatabilir. Son çalışmalar, Tikslerin sadece tümör başlatılmasından sorumlu değil, aynı zamanda tümör saldırganlığı ile ilişkili olduğunu ortaya koymuştur4, metassiyi5, ve ilaç direnci6. Bu nedenle, tik biyolojisi anlamak ve bu nedenle, bu ti hedefleyen belirli bir tedavi stratejisi geliştirmek önemlidir.
FACS tabanlı Yöntemler, CD133, CD24 ve CD441de dahil olmak üzere Tics Işaretçileri kullanarak Tics 'i tanımlamak için kullanılmıştır. Bu işaretçilerin çoğu da normal kök hücrelerinde ifade edilir7. Ancak, bu belirteçler hiçbiri sadece ti işaretler. Bu moleküllerin TICs malignite içinde oynarlar hala net değildir. Örneğin, CD133 sıklıkla DNA metilasyonu ile inaktive edilebilir ve böylece bu intertümöroral heterojenlik bu işaretçilerin doğruluğunu yapabilir8. ALDH1, ayrıca TICs9' nın sözcük köklerinin korunması için de işlev gösteren bir işaretçidir. Bu daha fazla meme kanseri etik tanımlamada etkili görünüyor ama hala diğer tümör türleri9sorgulanabilir. Bazı sinyalizasyon yolları WNT (wingless ile ilgili entegrasyon sitesi), TGF-β (dönüşüm büyüme faktörü beta) ve Hedgehog1de dahil olmak üzere kök hücre biyolojisinde önemli roller oynar. Ama bu yolların TIC-specific olduğunu kanıtlamak ve bu yolların aktivitesini primer tümörlerden ti yalıtmak için kullanmak zordur. Böylece, güvenilir bir roman TıC Marker acilen gereklidir.
İnsan MHC sınıfı ı, ayrıca HLA-1 olarak adlandırılan, neredeyse tüm çekirdekli hücrelerde ifade edilen bir hücre yüzeyi proteindir10. HLA-1, özel olarak CD8 T hücreleri tarafından tanınan bir molekül sunan bir antijen işlevi görür10. Kanser hücrelerinin HLA-1 tarafından tümör antijen sunduğunda, CD8 T hücrelerinin sitotoksisik etkisi aktive edilebilir. Bu nedenle, kanser hücrelerinin hücre yüzeyinde HLA-1 eksikliği sitotoksisik CD8 T hücrelerinden bir bağışıklık kaçış yol açabilir. HLA-1 ' in downdüzenleme insan kanserinin farklı türlerinde tarif edilmiştir ve kötü prognoz, metasük ve ilaç direnci11ile ilişkilidir. Hücre yüzeyinde HLA-1 ifadesinin kaybının, sarcomas 'taki ti 'nin yanı sıra prostat kanseri6,12' de tespit etmek için kullanılabilir olduğunu göstermiştir.
Burada, tik-1 ' i negatif bir işaret olarak kullanarak ve bu HLA-1-negatifleri daha fazla doğrulamak ve karakterize etmek için FACS tarafından insan sarkomu PDXs 'den TICs 'i izole etmek için ayrıntılı bir protokol açıklanmaktadır.
Protokol
Burada tartışılan fare deneylerinin tüm protokolleri, kurumsal yönergelere uygun ve Mount Sinai Tıp Merkezi Kurumsal Insan araştırma etiği Komitesi ve hayvan bakımı ve kullanım Komitesi tarafından onaylanmıştır.
1. sarkom doku numunesi ve PDX oluşumunun işlenmesi
- Bir kurumsal Inceleme kurulu onaylı protokol altında, patoloji servis personeli cerrahi örneklerden sarkom örnekleri hazırlamak ve hemen bir 100 mm Petri çanak buz üzerine her örnek koydu.
- Örnek bir 15 mL polistiren konik tüp içine 6 mL soğuk Roswell Park Memorial Enstitüsü (RPMı) 1640 kültür orta% 10 fetal Sığır serum (FBS) ve 1% penisilin/streptomisin ile desteklenmektedir. Doku örneğini hemen işleme atın.
-
Isteğe bağlı Sadece osteosarkom için, yumuşak doku sarkomu için atılabilir aşağıdaki adımları izleyin.
- Bir neşter kullanarak 20 mm3 adet içine doku kes. Doku parçalarını 3 ml kolagenaz çözeltisi (1 mg/ml kolajenaz ile RPMI 1640) içeren 15 ml 'lik bir tüpe aktarın.
- Tüpü 30 dakika boyunca 37 °C ' de bir su banyosuna koyun.
- İyice boru girdap ve sonra, eklemek 3 RPMI 1640 ml 10% FBS ile tamamlayıcı kolajenaz etkinliğini nötralize etmek.
- 350 x g 'de oda sıcaklığında 5 dk Santrifüjü. Süpernatant çıkarın.
- Steril Biyogüvenlik kabininde çalışma, doku örneğini 100 mm Petri tabağı içine yerleştirin. 500 ekleme μL steril 1x fosfat-tamponlu tuz (PBS) dokusuna. Steril bir neşter ile, hiçbir görünür doku parçası 0,1 mm 'den büyük olana kadar mekanik olarak dokuyu küçük parçalara ayırmaya çalışmaktadır.
- 500 μL hücreli süspansiyonu 35 μm hücreli bir filtreye aktarın ve filtrelenmiş süspansiyonu bir 50 mL polistiren tüpü ile toplayın. Bu 50 mL polistiren tüp buz üzerinde hücre süspansiyon ile koyun.
- Dokuya başka bir 500 μL PBS daha ekleyin. Triturate ikinci kez, hücre süzgeci aracılığıyla süspansiyon transferi ve aynı 50 mL tüp içine toplamak.
- Doku bölümü tamamen dissociated kadar, genellikle 6x-8X bu adımları (1,5 – 1,6 adımlar) tekrarlayın.
- Oda sıcaklığında 10 dakika 350 x g santrifüjleme ile hücre süspansiyonu Pellet. Supernatant atın, 5 ml hemoliz tampon kullanarak Pelet pelletini (0,15 M NH4CL, 10 mm KHCO3, ve 0,1 mm EDTA), ve kırmızı kan hücrelerini kaldırmak için oda sıcaklığında 5 dakika için çözüm inkük.
- 350 x g 'de oda sıcaklığında 5 dakika Santrifüjü ve hemoliz tamponunu çıkarın. 5 ml PBS ile Pelet yıkayın. 350 x g 'de 5 dakika boyunca tekrar santrifüjün ve süpernatant çıkarın.
- 1 ml PBS ile Pelet resuspend ve bir hemasitometre veya başka bir alternatif yöntem kullanarak uygun hücre numarasını saymak. 200 μL PBS 'de 1 x 107 hücrelerin son konsantrasyonuna hücreleri seyreltin. Hücre süspansiyonunu buzun üzerine bırakın.
- Bodrum membranı matrisini buzun üzerine bırakıp erimesine izin verin. 200 μL hücreli süspansiyona 200 μL Bodrum membran matrisini ekleyin. Yavaşça karıştırın ve buz üzerinde tutun.
- Subkutan hücre süspansiyon enjekte: Bodrum membran matris (1:1) karışımı İki nod SCID Gama (NSG) fareler içine onların kanatlarını içine. Her enjeksiyon için 200 μL kullanın.
- Bir hafta 2x fareler enjeksiyon site kontrol ederek PDX oluşumu izleyin. 1 cm çapı ulaştığında tümör xenograft çıkarın.
2. tümör yalıtım-PDX gelen FACS tarafından hücreleri başlatma
- Önceki12' de açıklandığı şekilde PDX 'i farelerden cerrahi olarak kaldırın.
- Tümörü ikiye keselim. Bir gecede% 4 civarında formaldehite ile xenograft yarısını düzeltin. Bu histolojik analiz için. Bir tümör hücresi süspansiyon almak için yukarıda açıklandığı gibi doku diğer yarısını (adımlar 1.3 – 1.8) işlem.
- PBS ile Pelet resuspend ve geçerli hücre numarasını saymak.
- PBS 'deki hücre süspansiyonunu, 2 x 106 hücreli/ml konsantrasyonuna% 5 FBS ile tamamlayıcı olarak seyreltin. Hücre süspansiyonunu 30 dakika boyunca buzda bırakın. hücre süspansiyonunu iki tüpün üzerine bölün. Tüplerin iZotope kontrolü ve antikor ile işaretlemek, sırasıyla. Her tüpteki hücre sayısını not alın.
- 5% FBS (1:250) ile tamamlayıcı PBS ile antikor seyreltilerek 2x HLA-1-PE antikor hazırlayın. Aynı koşulla negatif izotip kontrol antikor seyreltmeli. Son antikor seyreltme 1:500 yapmak için seyreltilmiş antikor (1:1) ile "antikor" tüp hücre süspansiyon karıştırın. Hücre süspansiyonunu izotop kontrolü (1:1) ile "iZotope kontrol" tüpünden karıştırın. 90 dk için buz üzerinde hücre süspansiyonları koyun.
- 4 °C ' de 350 x g 'de 5 dakika santrifüjün ve süpernatant çıkarın. Pelet 2x yıkamak için PBS 10 ml ekleyin.
- 10 μg/mL 'Lik son konsantrasyona PBS 'ye 4 ', 6-diamidino-2-phenylindole (DAPI) ekleyin. Bu DAPI çözüm hücre Pelet 107 hücreler/ml (adım 2,4 hücre numaralarını kullanarak) bir hücre süspansiyonu yapmak için ekleyin.
- 12 mm x 75 mm polistiren tüplere 35 μm süzgeç kapakları aracılığıyla hücre süspansiyonunu filtreleyin.
- HLA-1-negatif TIC alt nüfus6sıralamak için bir akış sitometresi kullanın. Kapı uygun hücreler (DAPı-negatif) ve her iki HLA-1-negatif ve pozitif altnüfus 2 15 mL toplama tüpleri içine toplamak, her 4 mL RPMı 1640 kültür orta içerir.
3. tümör-başlatma hücrelerinin karakterizasyonu
- Sarcosphere oluşumu
- Alfa-MEM hücre kültürü orta kullanarak sarcosphere büyüme orta olun. B-27 takviyeleri (1x), N2 takviyeleri (1x), temel fibroblast büyüme faktörü (bFGF) (20 ng/mL) ve Epidermal büyüme faktörü (EGF) (20 ng/mL) ve penisilin/streptomisin (100 ıU/mL) son konsantrasyon yapmak için takviyeleri ekleyin. Kullanmadan önce 0,2 μm hücreli kültür filtresine sahip ortamı filtreleyin.
- Sıralı HLA-1-negatif ve pozitif alt nüfus adım 2,9 ve her alt nüfus hücre numaralarını saymak Pellet.
- Seyreltme 1,5 x 106 hücreler Içine 15 ml sarcosphere büyüme orta hücre seyreltmesi yapmak için 1 x 105 hücreler/ml.
- Seri olarak, 104, 103ve 102 hücre/mL her hücre seyreltme 15 ml yapmak için taze sarcosphere büyüme orta hücreleri seyreltti. Sonra, hazırlamak 4 96-iyi Ultra-düşük ek hücre kültür plakaları, bir hücre seyreltme için her.
- Transfer 100 μL hücre süspansiyon 105 hücreler/ml seyreltme her iyi ilk 96-iyi Ultra-düşük ek hücre kültür plakası. Bu plaka her kuyunda 104 hücreye sahiptir.
- Diğer üç hücre seyreltme için diğer 3 96-Well Ultra-düşük ek hücre kültür plakaları kullanın: 104, 103, ve 102 hücreler/ml. 96-Well Ultra-düşük ek hücre kültürü plakalarının her bir kuyusu için 100 μL hücre süspansiyonu aktarın. Bu üç kültür plakaları 1.000 hücre/iyi, 100 hücre/iyi ve 10 hücre/iyi, sırasıyla var.
- Plakaları 37 °C,% 5 CO2 hücreli kültür inkükodiye yerleştirin.
- Hücre kültürü ortamına doğrudan yeni bFGF ve EGF ekleyin (son konsantrasyon 20 ng/mL) her üç günde bir ortam değiştirmeden süspansiyon kültüründe kayıp hücreleri önlemek için.
- Işık mikroskobu kullanarak, Şekil 2a'da gösterildiği gibi, üç hafta boyunca her gün sarkoküre oluşumunu izleyin.
- Üç hafta sonra, HLA-1-negatif ve HLA-1-pozitif hücreler için her hücre seyreltme sarcosphere-pozitif kuyular ve sarcosphere-negatif kuyuların sayısını saymak.
- Poisson olasılık dağılımı13temelinde küre oluşturan hücre sıklığını hesaplayın. HLA-1-negatif tikler HLA-1-pozitif toplu hücreler ile karşılaştırın.
- Seri-seyreltme tümörü-oluşum tahlil
- 2,9 adımda HLA-1-negatif ve pozitif alt nüfus saymak.
- 106, 105, 104ve 103 hücre/ml konsantrasyonları PBS ile hücrelerin seri dilüsyonları olun. 10 fareler içinde tümör oluşumu için her seyreltme 1 mL kullanın.
- Her seyreltme 1 mL hücreli süspansiyona 1 mL Bodrum membran matrisi ekleyin (1:1). Buz üzerinde her karışımı 2 mL tutun.
- Hücre 200 μL subkutan enjekte: NGS farelerin çevrelerine Bodrum membran matris karışımı, bir kanat için HLA-1-negatif hücreler ve aynı fare diğer tarafı için HLA-1-pozitif hücreler kullanılarak. Her seyreltme için 10 fare kullanın. Enjeksiyonlar için bir iğne ile 25G şırıngalar kullanın.
- Tümör oluşumu oranına bağlı olarak, dört ila sekiz hafta boyunca farelerde tümör oluşumunu izleyin.
- Farklı giriş hücresi numaralarının tümör oluşumu yüzdesi ile tümör başlatan hücre sıklığını hesaplayın. HLA-1-negatif tikler HLA-1-pozitif toplu hücreler ile karşılaştırın.
- Mezenkimal yollar boyunca indüklenen farklılaşma
- Önceki adımlarda oluşturulan sarcospheres kullanın (adım 3.1.9). Sarcospheres yeni bir 6-kuyu plaka aktarın. Kültür sarcosphere ile 2,5 mL Alfa-MEM ile tamamlayıcı 10% FBS hücreleri kültür plaka yüzeyine eklemek izin.
- İki gün için bir eki sonra, Alpha-MEM ile% 10 FBS ile% 10 FBS ve insan mesenkimal kök hücre (hMSC) büyüme orta ile tamamlayıcı Alfa-MEM 1:1 karışımı ile tamamlayıcı kültür ortamı geçiş.
- İki gün sonra, tam hMSC büyüme ortamına geçin.
- Hücreleri% 90 konfluency ulaştığında, hmsc orta Aspire ve farklılaşma ortamı ekleyin. Osteogenik farklılaşma için, osteogenik farklılaşma orta ekleyin (hMSC büyüme orta 10 nM dexametazon ile tamamlayıcı, 5 mM β-glisofosfat, 50 μg/mL L-askorbik asit, ve 10 mM Lityum klorür). Lipojenik farklılaşma için, adiposit farklılaşma orta ekleyin (hmsc büyüme orta 0,5 μm dexametazon ile tamamlayıcı, 0,5 μm isobutilmetilxanthine, ve 50 μm indometasin).
- Farklılaşma ortamını her üç günde bir değiştirin.
- Üç-dört hafta sonra, farklılaşma durdurun ve hücreleri PBS ile yıkayın. Sonra, PBS Aspire ve sabitleme için hücrelere% 10 formalin 2 ml ekleyin. Hücreler oda sıcaklığında 45 dakika otursun. Onları deiyonize suyla yıkayın. Hücreler artık alizarin Red S boyama (adım 3.3.6.1) veya Oil Red O boyama (adım 3.3.6.2) için hazırdır.
- Osteogenik farklılaşma algılamak için, alizarin kırmızı S boyama gerçekleştirin. Aspirate su ve 2 mL alizarin Red S çalışma çözeltisi ekleyin (2% alizarin kırmızı S, pH 6,0) hücrelere, ve onları boyama için 5 dakika oturup izin. Hücreleri deiyonize suyla yıkayın ve reaksiyonu mikroskobik olarak izleyin.
- Adipojenik farklılaşma tespit etmek için, yağ kırmızı O boyama gerçekleştirin.
- Bir yağ kırmızı O çözüm olun. 100 mL isopropanol için 300 mg yağ kırmızı O tozu ekleyerek bir stok çözüm hazırlayın.
- Kullanmadan önce 2 saat içinde, iki parça (20 mL) deiyonize su ile üç parça (30 mL) Oil Red O stok çözeltisi karıştırın. Karışımı oda sıcaklığında 10 dakika oturmak için izin verin.
- Kullanım öncesinde kullanarak çalışma çözümünü filtreleyin.
- Adım 3.3.6 göre hazırlanan hücrelerden su çıkarın. Hücre tek tabakalı kapsayacak şekilde 2 ml 60% izopropanol ekleyin ve hücreler 2 dakika oturmak.
- İzopropanol çıkarın ve 2 ml yağ kırmızı O çalışma solüsyonu ekleyin. Hücrelerin oda sıcaklığında 5 dakika oturmasına izin verin.
- Hücreleri deiyonize su ile durulayın ve ışık mikroskobu altında reaksiyonu gözlemlemek.
Sonuçlar
Bir insan sarkomu PDX oluşturuldu ve lekelenmiş. İntratumoral heterojenite, HLA-1 antikor kullanılarak immunhistokimya tarafından gösterildi. Xenograft iki farklı alt nüfus, yani HLA-1 pozitif ve negatif (Şekil 1a)12oluşur. Sarkom PDX, ebeveyn primer tümörü ile histolojik benzerlikleri gösterdi (Şekil 1a). Sarkom PDX TICs FACS tarafından izole edildi. Bir çift sıralama yöntemi kullanarak, HLA-1-negatif hücreler ebeveyn hücresi popülasyonundan son derece zenginleştirilmiştir (Şekil 1B)12.
Kök hücrelerde ifade edilen genler (örn., Oct4, Nanog ve MYC), HLA-1 pozitif mevkidaşı (Şekil 1C) ile karşılaştırıldığında, izole HLA-1-negatif hücrelerde yüksek ölçüde ifade edildiği bulunmuştur. Sox-9, meme karsinomunda olduğu gibi diğer kanser kök hücrelerinde önemli roller oynarken bildirilen bir gelişimsel gen, özellikle HLA-1-negatif hücrelerde ifade edildi (Şekil 1D).
Yalıtılmış HLA-1-negatif alt popülasyon doğrulamak için, hücrelerin kendini yenileme yeteneğini incelemek için bir sarcosphere oluşumu tahlil yapıldı. HLA-1-negatif hücreler 10 hücre (Şekil 1e)12kadar az bir başlangıç girişi ile küreler oluşturabildiler. Tümör şekillendirme yeteneğini incelemek için seri-seyreltme tümör oluşumu tahlil yapıldı. HLA-1-negatif ve pozitif hücrelerin aynı sayıda aynı fare her kanadında subkutan enjekte edildi. HLA-1-negatif hücreler önemli ölçüde daha yüksek tümör oluşumu yeteneği gösterdi (Şekil 1F)12, hem HLA-1-negatif ve-pozitif alt kitleler tarafından oluşturulan ksenogreft hücresel heterojen tümörlerdir (Şekil 1s).
İzole HLA-1-negatif tik12' nin gen ifadesi analizini yaptık. Normal mezenkimal hücre farklılaşması ile ilişkili genler ti12' de yükselmiştir. Bu nedenle, HLA-1 tiklerin terminalin farklılaşmasına indüklenmiş olup olmadığını test ettik ve tümör oluşumunu azalttı. Sonuçlar, HLA-1-negatif hücrelerin hem lipogenic hem de osteogenik yollar arasında ayrım yapmak ve güçlü yağ kırmızısı O ve alizarin kırmızı S boyama (Şekil 1G) gösterebilmesi için indüklenmiş olabilir gösterdi. Buna karşılık, HLA-1-pozitif hücreler aynı koşullarda farklılaştırmaz. Böylece, bu sonuçlar sarkom tikleri hedef için kullanılabilecek umut verici bir farklılaşmış tedavi stratejisi gösterir.
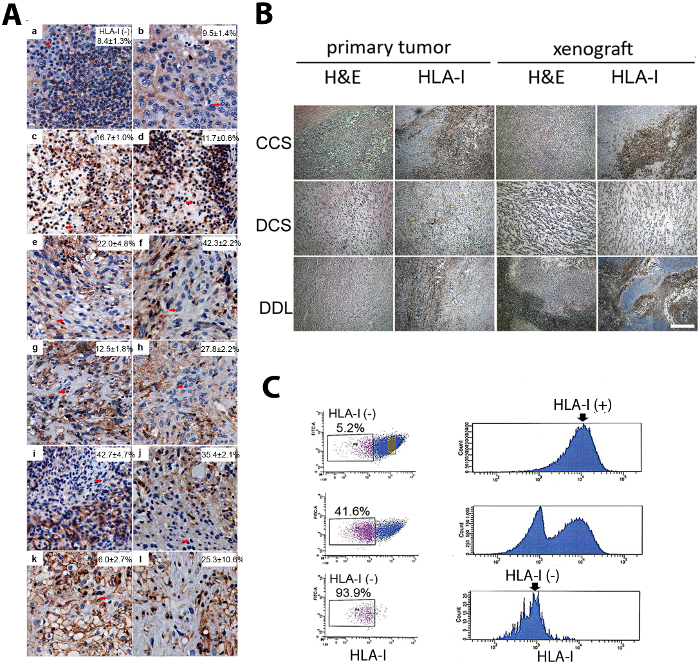
Şekil 1: HLA-1-negatif hücrelerin intratümöral heterojen sarkom pdxs izolasyonu. (A) immünhistokimya (IHC) ile insan sarkomlarının farklı alt türlerinde HLA-1-negatif hücreler (oklar) bulunmuştur. (a ve b) Şeffaf hücre sarkomu. (c ve d) Pleomorfik Liposarkom. (e ve f) Leiomyosarkom. (g ve h) Malign periferik sinir kılıfı tümörü. (i ve j) Liposarcoma, başka türlü belirtilmemiş. (k ve l) Defarklılaşmış Liposarkom. Ölçek çubuğu = 100 μm. (B) sarkom pdxs histolojik olarak ebeveyn tümörüne benzer (hematoksinlin ve eozin [H & E] lekesi) ve IFC tarafından HLA-1 ifadesinde hücresel heterojenlik gösterdi. Burada net bir hücre sarkomu (CCS), bir dediferated kondrosarkom (DCS) ve bir dedifferated Liposarkom (ddl) dahil olmak üzere sarkomu pdxs temsili resimleri gösterilir. Ölçek çubuğu = 100 μm. (C) HLA-1-negatif hücrelerin alt nüfusu, Çift sıralama yöntemiyle Akış sitometrisi ile izole edilmiştir. Yukarıdan aşağıya: ilk sıralama, ikinci sıralama ve saflık kontrolü. İzole HLA-1-negatif ve HLA-1-pozitif hücreler bir tümör oluşumu tahlil de dahil olmak üzere bir sonraki fonksiyonel analiz, maruz kaldı. Bu rakam sonuçları önceki yayın12' dir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
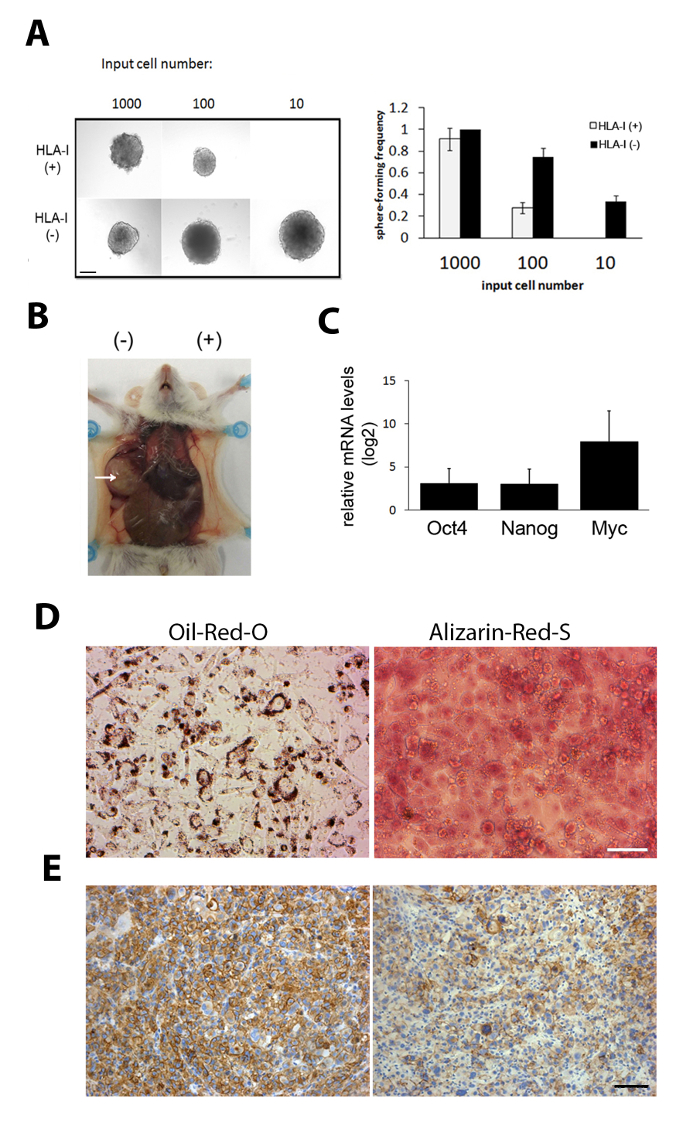
Şekil 2: HLA-1-negatif tiklerin fonksiyonel nitelikler ile karakterize edilmesi. (A) bir küre oluşumu tahlil gibi az 10 HLA-1-negatif hücreler sarkom küreler oluşturmak başardı gösterdi. Sol: sarkom küreler temsilcisi resimleri. Sağ: küre şekillendirme frekansı; Ortalama ± SD. ölçek çubuğu = 100 μm. (B) sarkoma PDX 'den izole edilen HLA-1-negatif hücreler son derece tümgendir. Burada gösterilen tümör HLA-1-negatif ve-pozitif hücrelerin DDL tarafından oluşan temsili resimleridir. HLA-1-negative ve HLA-1-pozitif DDL hücrelerinin bin hücresi aynı fareye ayrı kenarlar enjekte edildi. (C) kök hücre genler Oct4, Nanogve MYC mRNA SEVIYELERI HLA-1-pozitif hücrelere kıyasla HLA-1-negatif hücrelerde yüksek seviyelerde ifade edildi. Veriler ortalama ± SD 'yi (n = 5) temsil eder. (D) yağ kırmızı O ve alizarin kırmızı S güçlü pozitif boyama sarkom ti indüklenen lipojenik ve osteogenik yolları boyunca bir Terminal farklılaşma gösterir. (E) HLA-1-pozitif (sol) ve-negatif (sağ) alt nüfus tarafından oluşturulan PDX 'lerin immünostasyonu HLA-1. Ölçek çubuğu = 100 μm. Bu rakam sonuçları önceki yayın12' dir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Tartışmalar
İnsan sarkomu PDXs 'den tümör Başlatan hücreleri ayırt etmek ve karakterize etmek için bu protokolün başarısını sınırlayan birkaç kritik adım vardır. Insan sarkomu birçok farklı alt türü içerir. PDX oluşumunun sarkoma alt türlerine son derece bağımlı olduğunu gözlemledik. Histolojik olarak farklılaşan fenotip ile klinik agresif sarkomalar (örn., Pleomorfik undifferated sarkomlar [başarı oranı 100%, n = 2], dedifferated liposarkomlar Malin [başarı oranı 100%, n = 2], ve sinovyal sarkomlar [ başarı oranı% 100, n = 3]) yüksek başarı oranına sahip PDX oluşumu. Bu arada, farklılaşmış fenotipleri ile sarkomlar (örneğin, iyi farklılaşmış liposarkomlar Malin [başarı oranı% 0, n = 3]) daha düşük PDX oluşumu oranlarını gösterir. Tümör Başlatan hücrelerin daha fazla malign alt türlerde daha az malign, farklılaşmış alt tiplerden daha yüksek bir yüzdeye sahip olması mümkündür. Buna ek olarak, bir gün içinde herhangi bir hücre viability kaybını en aza indirmek için herhangi bir durdurma olmadan tümör başlatan hücre yalıtım prosedürü bitirmek öneririz.
HLA-1-negatif hücrelerin insan sarkomunda yaygın olarak bulunduğunu tespit ettik. Ancak HLA-1-negatif hücrelerin yüzdesi farklı hastalardaki numuneler arasında farklılık gösterebilir. Bu yöntemle, tümör Başlatan hücreleri, HLA-1-negatif hücrelere% 0,5 ' den az% 30 ' dan fazla%12' ye kadar olan örneklerden başarıyla yalıtıyoruz. HLA-1-negatif hücrelerin, izole HLA-1-negatif hücrelerin tümör başlatan hücre kimliğini onaylamak için küre oluşumu ve tümör oluşumu ile işlevsel olarak karakterize edilmesi önemlidir.
Ancak, burada sunulan protokol de sınırlamalar vardır. Önceki veriler HLA-1 ifadesinin epigenetik olarak düzenlendiği, bu da HLA-1 ifadesinin hücresel heterojenliğini aynı tümör12içinde gözlemleme ile tutarlı olduğunu gösterdi. Sarkomlar ve diğer kanser türlerinde HLA-1 genomik mutasyonlar tespit edildi. HLA-1 genlerinde mutasyonlar, tüm tümördeki hücre yüzeyine veya işlevsel olmayan mutasyona uğramış HLA-1 ' i ifade etmek için HLA-1 ' i tam kaybına yol açabilir. Her iki durumda da, HLA-1 negatifliği tümör içinde ti tanımlamak için kullanılamaz.
HLA-1 ' i negatif bir işaretleyici olarak kullanarak, çeşitli insan sarkomu alt tiplerindeki ti 'lerden başarıyla izole ettik ve sonuçlarımızı fonksiyonel analizlerle doğruladım. Bu nedenle, bu tikler hedefleyen spesifik tedavi geliştirmek için, tik üzerinde gen ifade analizi de dahil olmak üzere Moleküler çalışmalar gerçekleştirebildik.
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu araştırma, NCı-P01-CA087497 (C.C.-C için desteklenmektedir. ve mm) ve NıH-U 54-0OD020353 (C.C.-C., mm ve JD-D.), Agilent düşünce lideri Ödülü (C.C.-C.) ve Martel Vakfı (C.C.-C. ve J.D.-D.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.2 μm cell culture filter | ThermoFisher | 450-0020 | |
| 100 mm Petri dish | Falcon | 353003 | |
| 15 mL conical tube | Falcon | 352196 | |
| 35 μm cell strainer | Falcon | 352340 | |
| 50 mL polystyrene tube | Falcon | 352070 | |
| 96-well ultra-low attachment cell culture plate | Corning | 7007 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| B-27 | Gibco | 08-0085SA | |
| bFGF | Invitrogen | PHG0021 | |
| dexamethasone | Sigma-Aldrich | D4902 | |
| EGF | Invitrogen | PHG0311 | |
| HLA-1-PE antibody | Abcam | ab43545 | |
| hMSC growth medium | ATCC | PCS-500-030 | |
| indomethacin | Sigma-Aldrich | I7378 | |
| isobutylmethylxanthine | Sigma-Aldrich | I5879 | |
| isopropanol | Sigma-Aldrich | W292907 | |
| Isotype Control Antibody | Abcam | ab103534 | |
| L-ascorbic acid | Sigma-Aldrich | A5960 | |
| lithium chloride | Sigma-Aldrich | 62476 | |
| Matrigel basement membrane matrix | Corning | 354230 | |
| MEM Alpha | Gibco | 12571-063 | |
| N2 | Gibco | 17502-048 | |
| NSG mice | The Jackson Lab | 005557 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| PBS | Corning | 21-040-CM | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Syringe with needle | BD | 309626 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Referanslar
- Medema, J. Cancer stem cells: the challenges ahead. Nature Cell Biology. 15 (4), 338-344 (2013).
- Jordan, C., Guzman, M., Noble, M. Cancer stem cells. The New England Journal of Medicine. 355 (12), 1253-1261 (2006).
- Jordan, C. Cancer stem cells: controversial or just misunderstood?. Cell Stem Cell. 4 (3), 203-205 (2009).
- Bapat, S., Mali, A., Koppikar, C., Kurrey, N. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer Research. 65 (8), 3025-3029 (2005).
- Charafe-Jauffret, E. Breast cancer cell lines contain functional cancer stem cells with metastatic capacity and a distinct molecular signature. Cancer Research. 69 (4), 1302-1313 (2009).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22 (3), 373-388 (2012).
- Reya, T., Morrison, S., Clarke, M., Weissman, I. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Yi, J., et al. Abnormal DNA methylation of CD133 in colorectal and glioblastoma tumors. Cancer Research. 68 (19), 8094-8103 (2008).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Garrido, F., et al. Natural history of HLA expression during tumour development. Immunology Today. 14 (10), 491-499 (1993).
- Chang, C. C., Campoli, M., Ferrone, S. Classical and nonclassical HLA class I antigen and NK cell-activating ligand changes in malignant cells: current challenges and future directions. Advances in Cancer Research. 93, 189-234 (2005).
- Han, D., et al. Targeting sarcoma tumor-initiating cells through differentiation therapy. Stem Cell Research. 21, 117-123 (2017).
- Hu, Y., Smyth, G. K. ELDA: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunology. 347, 70-78 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır