Method Article
Isolierung und Charakterisierung tumorinitiierender Zellen aus Sarkom-Patienten-abgeleiteten Xenografts
In diesem Artikel
Zusammenfassung
Wir beschreiben ein detailliertes Protokoll zur Isolierung tumorinitiierender Zellen aus humanen Sarkom-Patienten-patienten-abgeleiteten Xenografts durch Fluoreszenz-aktivierte Zellsortierung, unter Verwendung des humanen Leukozyten-Antigens-1 (HLA-1) als negativem Marker, und für die weitere Validierung und Charakterisierung dieser HLA-1-negativen tumorinitiierenden Zellen.
Zusammenfassung
Die Existenz und Bedeutung von tumorinitiierenden Zellen (TICs) wurden in den letzten zehn Jahren durch zunehmende Beweise gestützt. Diese TICs sind nachweislich für Tumorinitiation, Metastasierung und Arzneimittelresistenz verantwortlich. Daher ist es wichtig, zusätzlich zu den aktuellen Chemotherapie-Strategien eine spezifische TIC-Targeting-Therapie zu entwickeln, die sich hauptsächlich auf den Großteil der Nicht-TICs konzentriert. Um den Mechanismus hinter der Malignität von TICs weiter zu verstehen, beschreiben wir eine Methode zur Isolierung und Charakterisierung von TICs in menschlichen Sarkomen. Hierin zeigen wir ein detailliertes Protokoll zur Generierung von patientenabgeleiteten Xenografts (PDXs) menschlicher Sarkome und zur Isolierung von TICs durch Fluoreszenz-aktivierte Zellsortierung (FACS) unter Verwendung des humanen Leukozyten-Antigens Klasse I (HLA-1) als negativer Marker. Außerdem beschreiben wir, wie diese TICs funktionell charakterisiert werden können, einschließlich eines Kugelbildungs-Assays und eines Tumorbildungs-Assays, und um eine Differenzierung entlang mesenchymaler Bahnen zu induzieren. Die Isolierung und Charakterisierung von PDX-TICs liefert Hinweise für die Entdeckung potenzieller Targeting-Therapiereagenzien. Darüber hinaus deuten immer mehr Hinweise darauf hin, dass dieses Protokoll weiter erweitert werden könnte, um TICs von anderen Arten von menschlichen Krebsarten zu isolieren und zu charakterisieren.
Einleitung
Intratumorale zelluläre Heterogenität von menschlichen Krebserkrankungen wurdedurch zunehmende Beweise in den letzten zehn Jahren 1 unterstützt. Ähnlich wie bei normalem Gewebe besteht Krebsgewebe aus einer kleinen Subpopulation von TICs (auch Krebsstammzellen genannt), die eine tumorbildende Fähigkeit aufweisen; Inzwischen weist der Großteil der Krebszellen differenzierte Phänotypenauf 2. Diese TICs zeigen stammzellähnliche Eigenschaften, einschließlich der Expression eines Stammzellmarkers und der Fähigkeit sowohl der Selbsterneuerung als auch der asymmetrischen Zellteilung, und können somit die Bildung eines zellulären heterogenen Tumors initiieren3. Jüngste Studien haben gezeigt, dass TICs nicht nur für die Tumorinitiierung verantwortlich sind, sondern auch mit Tumoraggressivität4, Metastasierung5und Medikamentenresistenz6assoziiert sind. Daher ist es wichtig, die Biologie der TICs zu verstehen und daher eine spezifische Behandlungsstrategie zu entwickeln, die auf diese TICs abzielt.
FACS-basierte Methoden wurden verwendet, um TICs mithilfe von TICs-Markern zu identifizieren, einschließlich CD133, CD24 und CD441. Die meisten dieser Marker werden auch in normalen Stammzellen7exprimiert. Keiner dieser Marker kennzeichnen jedoch nur TICs. Welche Rolle diese Moleküle bei der Bösartigkeit von TICs spielen, ist noch unklar. Zum Beispiel kann CD133 häufig durch DNA-Methylierung inaktiviert werden, und somit kann diese intertumorale Heterogenität die Genauigkeit dieser Marker8machen. ALDH1 ist ein Marker, der auch funktioniert, um die Vorbauigkeit von TICs9zu erhalten. Es scheint effektiver bei der Identifizierung von Brustkrebs-TICs zu sein, ist aber bei anderen Tumortypen9immer noch fragwürdig. Einige Signalwege spielen eine wichtige Rolle in der Stammzellbiologie, einschließlich Wnt (wingless-related integration site), TGF-' (transforming growth factor beta) und Hedgehog1. Aber es ist schwierig zu beweisen, dass diese Wege TIC-spezifisch sind und die Aktivität dieser Wege zu nutzen, um TICs von primären Tumoren zu isolieren. Daher ist ein zuverlässiger neuer TIC-Marker dringend erforderlich.
Human MHC Klasse I, auch HLA-1 genannt, ist ein Zelloberflächenprotein, das in fast allen nukleierten Zellen10exprimiert wird. HLA-1 fungiert als Antigen und präsentiert ein Molekül, das von CD8-T-Zellen10ausdrücklich erkannt wird. Die zytotoxische Wirkung von CD8-T-Zellen kann aktiviert werden, wenn Krebszellen ein Tumorantigen durch HLA-1 darstellen. Daher kann das Fehlen von HLA-1 auf der Zelloberfläche der Krebszellen zu einer Immunflucht aus den zytotoxischen CD8-T-Zellen führen. Die Downregulation von HLA-1 wurde bei verschiedenen Arten von menschlichem Krebs beschrieben und korreliert mit schlechter Prognose, Metastasierung und Medikamentenresistenz11. Wir haben gezeigt, dass der Verlust der HLA-1-Expression auf der Zelloberfläche verwendet werden kann, um TICs bei Sarkomen sowie bei Prostatakrebs zu identifizieren6,12.
Hier beschreiben wir ein detailliertes Protokoll zur Isolierung von TICs aus humanen Sarkom-PDXs durch FACS unter Verwendung von HLA-1 als negativer Marker und zur weiteren Validierung und Charakterisierung dieser HLA-1-negativen TICs.
Protokoll
Alle Protokolle für Mausexperimente, die hier diskutiert wurden, wurden in Übereinstimmung mit den institutionellen Richtlinien und vom Mount Sinai Medical Center Institutional Human Research Ethics Committee und Animal Care and Use Committee genehmigt.
1. Verarbeitung der Sarkom-Gewebeprobe und PDX-Formation
- Im Rahmen eines vom Institutional Review Board genehmigten Protokolls bereiten pathologische Servicemitarbeiter Sarkomproben aus chirurgischen Proben vor und legen jede Probe sofort in einer 100 mm Petrischale auf Eis.
- Legen Sie die Probe in ein 15 ml Polystyrol-Konusrohr mit 6 ml kaltem Roswell Park Memorial Institute (RPMI) 1640 Kulturmedium, ergänzt mit 10% fetalem Rinderserum (FBS) und 1% Penicillin/Streptomycin. Verarbeiten Sie die Gewebeprobe sofort.
-
(Optional) Nur bei Osteosarkom folgen Sie den folgenden Schritten, die bei Weichteilsarkom übersprungen werden können.
- Schneiden Sie das Gewebe in 20 mm3 Stück mit einem Skalpell. Übertragen Sie die Gewebeteile in ein 15 ml-Rohr mit 3 ml Kollagennaselösung (RPMI 1640 mit 1 mg/ml Kollagenase).
- Legen Sie das Rohr 30 min bei 37 °C in ein Wasserbad.
- Gründlich Wirbel das Rohr und, dann fügen Sie 3 ml RPMI 1640 mit 10% FBS ergänzt, um die Kollagenase-Aktivität zu neutralisieren.
- Zentrifuge für 5 min bei 350 x g bei Raumtemperatur. Entfernen Sie den Überstand.
- In einem sterilen Biosicherheitsschrank arbeiten, legen Sie die Gewebeprobe in eine 100 mm Petrischale. Fügen Sie dem Gewebe 500 l sterile 1x Phosphat-gepufferte Saline (PBS) hinzu. Mit einem sterilen Skalpell das Gewebe mechanisch in kleine Stücke trituieren, bis kein sichtbares Gewebestück größer als 0,1 mm ist.
- Übertragen Sie die 500-L-Zellsuspension auf ein 35-m-Zellsieb und sammeln Sie die gefilterte Suspension mit einem 50 ml-Polystyrolrohr. Setzen Sie dieses 50 ml Polystyrolrohr mit der Zellsuspension auf Eis.
- Fügen Sie dem Gewebe weitere 500 L PBS hinzu. Zum zweiten Mal trituieren, die Suspension durch das Zellsieb übertragen und in das gleiche 50 ml-Rohr einsammeln.
- Wiederholen Sie diese Schritte (Schritte 1.5–1.6), bis der Gewebeabschnitt vollständig getrennt ist, in der Regel 6x - 8x.
- Pellet die Zellsuspension durch Zentrifugation bei 350 x g für 10 min bei Raumtemperatur. Entsorgen Sie den Überstand, setzen Sie das Pellet mit 5 ml Hämolysepuffer (0,15 M NH4Cl, 10 mM KHCO3und 0,1 mM EDTA) wieder auf und inkubieren Sie die Lösung für 5 min bei Raumtemperatur, um rote Blutkörperchen zu entfernen.
- Zentrifugieren Sie 5 min bei 350 x g bei Raumtemperatur und entfernen Sie den Hämolysepuffer. Waschen Sie das Pellet mit 5 ml PBS. Zentrifugieren Sie wieder für 5 min bei 350 x g und entfernen Sie den Überstand.
- Setzen Sie das Pellet mit 1 ml PBS wieder auf und zählen Sie die lebensfähige Zellnummer mit einem Hämozytometer oder einer anderen alternativen Methode. Verdünnen Sie die Zellen auf eine Endkonzentration von 1 x 107 Zellen in 200 l PBS. Lassen Sie die Zellsuspension auf Eis.
- Lassen Sie die Kellermembranmatrix auf Eis, damit sie schmelzen kann. Fügen Sie der 200-L-Zellsuspension 200 L Kellermembranmatrix hinzu. Sanft mischen und auf Eis halten.
- Subkutan injizieren Sie die Zellsuspension:Kellermembranmatrix (1:1) in zwei NOD-Scid-Gamma-Mäuse (NSG) in ihre Flanken. Verwenden Sie für jede Injektion 200 l.
- Überwachen Sie die PDX-Bildung, indem Sie die Injektionsstelle der Mäuse 2x pro Woche überprüfen. Entfernen Sie den Tumor Xenograft, wenn er 1 cm im Durchmesser erreicht.
2. Isolierung tumor-initiierender Zellen durch FACS aus dem PDX
- Chirurgische entfernen Sie die PDX von den Mäusen wie zuvor beschrieben12.
- Den Tumor halbieren. Die Hälfte des Xenografts mit 4% Paraformaldehyd über Nacht fixieren. Dies ist für die histologische Analyse. Verarbeiten Sie die andere Hälfte des Gewebes wie oben beschrieben (Schritte 1.3–1.8), um eine Tumorzellsuspension zu erhalten.
- Setzen Sie das Pellet mit PBS wieder auf und zählen Sie die lebensfähige Zellnummer.
- Verdünnen Sie die Zellsuspension in PBS, ergänzt mit 5% FBS auf eine Konzentration von 2 x 106 Zellen/ml. Lassen Sie die Zellsuspension 30 min auf Eis. Teilen Sie die Zellsuspension über zwei Röhren. Markieren Sie die Rohre mit Isotopenkontrolle bzw. Antikörper. Notieren Sie sich die Anzahl der Zellen in jeder Röhre.
- Bereiten Sie 2x HLA-1-PE Antikörper vor, indem Sie den Antikörper mit PBS verdünnen, ergänzt durch 5% FBS (1:250). Verdünnen Sie den negativen Isotyp-Kontrollantikörper mit dem gleichen Zustand. Mischen Sie die Zellsuspension aus dem "Antikörper"-Rohr mit verdünntem Antikörper (1:1), um die endgültige Antikörperverdünnung 1:500 zu machen. Mischen Sie die Zellsuspension aus dem "Isotopenkontrollrohr" mit der Isotopenkontrolle (1:1). Setzen Sie die Zellsuspensionen für 90 min auf Eis.
- Zentrifuge für 5 min bei 350 x g bei 4 °C und entfernen Sie den Überstand. Fügen Sie 10 ml PBS hinzu, um das Pellet 2x zu waschen.
- 4',6-Diamidino-2-Phenylindole (DAPI) zu PBS zu einer Endkonzentration von 10 g/ml hinzufügen. Fügen Sie diese DAPI-Lösung zum Zellpellet hinzu, um eine Zellsuspension von 107 Zellen/ml zu bilden (unter Verwendung der Zellenzahlen aus Schritt 2.4).
- Filtern Sie die Zellaufhängung durch 35 m Siebkappen in 12 mm x 75 mm Polystyrolrohre.
- Verwenden Sie ein Durchflusszytometer, um die HLA-1-negative TIC-Subpopulation6zu sortieren. Gate lebensfähige Zellen (DAPI-negativ) und sammeln sowohl HLA-1-negative als auch -positive Subpopulationen in zwei 15 ml-Sammelröhren, die jeweils 4 ml RPMI 1640 Kulturmedium enthalten.
3. Charakterisierung tumorinitiierender Zellen
- Sarkosphärenbildung
- Machen Sie Sarkosphäre Wachstumsmedium, mit alpha-MEM Zellkultur Medium. Fügen Sie Ergänzungen hinzu, um eine endgültige Konzentration von B-27 Ergänzungen (1x), N2 Ergänzungen (1x), grundlegende Fibroblast wachstumsfaktor (bFGF) (20 ng/ml), und epidermale Wachstumsfaktor (EGF) (20 ng/ml) und Penicillin/Streptomycin (100 IE/ml). Filtern Sie das Medium vor der Verwendung mit einem Zellkulturfilter von 0,2 m.
- Pellet die sortierte HLA-1-negative und -positive Subpopulation aus Schritt 2.9 und zählen Sie die Zellennummern jeder Teilpopulation.
- Verdünnen Sie 1,5 x 106 Zellen in 15 ml des Sarkosphärenwachstumsmediums, um die Zellverdünnung von 1 x 105 Zellen/ml zu bilden.
- Die Zellen mit frischem Sarkosphärenwachstumsmedium verdünnen, um 15 ml jederZellverdünnung von 10 4, 103und 102 Zellen/ml zu bilden. Bereiten Sie dann vier 96-well ultra-low Attachment Zellkulturplatten vor, die jeweils eine Zellverdünnung erhalten.
- Übertragen Sie 100 l Zellsuspension aus der 105 Zellen/ml Verdünnung auf jeden Brunnen der ersten 96-Well ultra-low Attachment Zellkulturplatte. Diese Platte hat 104 Zellen in jedem Brunnen.
- Verwenden Sie die anderen drei 96-well ultra-niedrigen Befestigungszellkulturplatten fürdie anderen drei Zellverdünnungen: 10 4, 103und 102 Zellen/ml. Übertragen Sie 100 l Zellsuspension auf jeden Brunnen der 96-well ultra-low Attachment Zellkulturplatten. Diese drei Kulturplatten haben 1.000 Zellen/Well, 100 Zellen/Well und 10 Zellen/well.
- Legen Sie die Platten in einen 37 °C, 5% CO2-Zellkultur-Inkubator.
- Fügen Sie alle drei Tage neue bFGF und EGF direkt zum Zellkulturmedium (Endkonzentration von 20 ng/ml) hinzu, ohne das Medium zu ändern, um Zellverluste in der Suspensionskultur zu vermeiden.
- Überwachen Sie die Sarkosphärenbildung mit einem Lichtmikroskop drei Wochen lang täglich, wie in Abbildung 2Adargestellt.
- Zählen Sie nach drei Wochen die Anzahl der sarkosphärenpositiven Brunnen und sarkosphärennegativen Brunnen jeder Zellverdünnung für HLA-1-negative und HLA-1-positive Zellen.
- Berechnen Sie die kugelbildende Zellfrequenz basierend auf einer Poisson-Wahrscheinlichkeitsverteilung13. Vergleichen Sie die HLA-1-negativen TICs mit den HLA-1-positiven Massenzellen.
- Serial-Dilution Tumor-Formation assay
- Zählen Sie die HLA-1-negativen und -positiven Subpopulationen aus Schritt 2.9.
- Machen Sie serielle Verdünnungen der Zellen mit PBS zu Konzentrationen von 106,105, 104und 103 Zellen/ml. Verwenden Sie 1 ml jeder Verdünnung für die Tumorbildung bei 10 Mäusen.
- Fügen Sie 1 ml Kellermembranmatrix in die 1 ml Zellsuspension jeder Verdünnung (1:1) ein. Halten Sie die 2 ml jeder Mischung auf Eis.
- Subkutan injizieren Sie 200 l der Zell:Keller-Membranmatrixmischung in die Flanken von NGS-Mäusen, mit HLA-1-negativen Zellen für eine Flanke und HLA-1-positiven Zellen für die andere Flanke derselben Maus. Verwenden Sie für jede Verdünnung 10 Mäuse. Verwenden Sie 25G Spritzen mit einer Nadel für die Injektionen.
- Überwachen Sie die Tumorbildung bei den Mäusen für vier bis acht Wochen, abhängig von der Rate des Tumorwachstums.
- Berechnen Sie die tumor-initiierende Zellfrequenz anhand des Prozentsatzes der Tumorbildung bei unterschiedlichen Eingangszellzahlen. Vergleichen Sie die HLA-1-negativen TICs mit den HLA-1-positiven Massenzellen.
- Induzierte Differenzierung entlang mesenchymaler Wege
- Verwenden Sie die Sarkokas, die in den vorherigen Schritten gebildet wurden (Schritt 3.1.9). Übertragen Sie die Sarkokase auf eine neue 6-Well-Platte. Kultur die Sarkokasphäre mit 2,5 ml Alpha-MEM ergänzt mit 10% FBS, damit die Zellen an der Kulturplattenoberfläche befestigen.
- Nach einer Anhaftung für zwei Tage, schalten Sie das Kulturmedium von alpha-MEM ergänzt mit 10% FBS auf die 1:1 Mischung von Alpha-MEM ergänzt mit 10% FBS und humanmechymal Stammzell (hMSC) Wachstumsmedium.
- Wechseln Sie nach zwei Tagen zum abschlussdes hMSC-Wachstumsmedium.
- Wenn die Zellen 90% Koninfluenza erreichen, aspirieren Sie das hMSC-Medium und fügen Sie Differenzierungsmedium hinzu. Zur osteogenen Differenzierung fügen Sie ein osteogenes Differenzierungsmedium hinzu (hMSC-Wachstumsmedium, ergänzt durch 10 nM Dexamethason, 5 mM Glycerophosphat, 50 g/ml L-Ascorbinsäure und 10 mM Lithiumchlorid). Zur lipogenen Differenzierung fügen Sie das Adipozytendifferenzierungsmedium hinzu (hMSC-Wachstumsmedium, ergänzt durch 0,5 M Dexamethason, 0,5 M Isobutylmethylxanthin und 50 M Indomethacin).
- Ändern Sie das Differenzierungsmedium alle drei Tage.
- Nach drei bis vier Wochen die Differenzierung beenden und die Zellen mit PBS waschen. Dann aspirieren Sie die PBS und fügen Sie 2 ml von 10% Formalin zu den Zellen für die Fixierung. Lassen Sie die Zellen 45 min bei Raumtemperatur sitzen. Waschen Sie sie mit entionisiertem Wasser. Die Zellen sind nun bereit für Alizarin Red S Färbung (Schritt 3.3.6.1) oder Öl Rot O Färbung (Schritt 3.3.6.2).
- Um osteogene Differenzierung zu erkennen, führen Sie Alizarin Red S Färbung. Wasser ansaugen und 2 ml Alizarin Red S Arbeitslösung (2% Alizarin Red S, pH 6.0) zu den Zellen hinzufügen, und lassen Sie sie für 5 min für die Färbung sitzen. Waschen Sie die Zellen mit entionisiertem Wasser und beobachten Sie die Reaktion mikroskopisch.
- Um adipogene Differenzierung zu erkennen, führen Sie Öl rot O Färbung.
- Machen Sie eine Oil Red O Lösung. Bereiten Sie eine Stammlösung vor, indem Sie 300 mg Öl-Rot-O-Pulver zu 100 ml Isopropanol hinzufügen.
- Innerhalb von 2 h vor der Verwendung drei Teile (30 ml) der Öl-Rot-O-Lagerlösung mit zwei Teilen (20 ml) entionisiertem Wasser mischen. Lassen Sie die Mischung für 10 min bei Raumtemperatur sitzen.
- Filtern Sie die Arbeitslösung vor der Verwendung.
- Entfernen Sie das Wasser aus den zellengemäß nach Schritt 3.3.6 vorbereiteten Zellen. Fügen Sie 2 ml 60% Isopropanol hinzu, um die Zellmonoschicht abzudecken, und die Zellen sitzen 2 min lang.
- Entfernen Sie das Isopropanol und fügen Sie 2 ml Öl Red O Arbeitslösung. Lassen Sie die Zellen 5 min bei Raumtemperatur sitzen.
- Spülen Sie die Zellen mit entionisiertem Wasser und beobachten Sie die Reaktion unter einem Lichtmikroskop.
Ergebnisse
Ein menschliches Sarkom PDX wurde erzeugt und befleckt. Die intratumorale Heterogenität wurde durch Immunhistochemie mit HLA-1-Antikörpern nachgewiesen. Das Xenograft bestand aus zwei unterschiedlichen Subpopulationen, nämlich HLA-1 positiv und negativ (Abbildung 1A)12. Das Sarkom PDX zeigte histologische Ähnlichkeiten mit dem primären Tumor der Eltern (Abbildung 1A). Sarkom PDX TICs wurden von FACS isoliert. Mit einer Doppelsortierungsmethode wurden die HLA-1-negativen Zellen stark aus der elterlichen Zellpopulation angereichert (Abbildung 1B)12.
Gene, die in Stammzellen exprimiert wurden (z. B. Oct4, Nanog und Myc), wurden im Vergleich zu ihrem HLA-1-positiven Gegenstück (Abbildung1C)in isolierten HLA-1-negativen Zellen hochexprimiert . Sox-9, ein Entwicklungsgen, das in anderen Krebsstammzellen, wie z. B. beim Brustkarzinom, eine wichtige Rolle spielen soll, wurde speziell in HLA-1-negativen Zellen exprimiert (Abbildung 1D).
Zur Validierung der isolierten HLA-1-negativen Subpopulation wurde ein Sarkosphären-Formationstest durchgeführt, um die Selbsterneuerungsfähigkeit der Zellen zu untersuchen. HLA-1-negative Zellen waren in der Lage, Kugeln mit einer anfänglichen Eingabe von nur 10 Zellen zu bilden (Abbildung 1E)12. Um die tumorbildende Fähigkeit zu untersuchen, wurde ein Serial-Dilution-Tumorbildungstest durchgeführt. Die gleiche Anzahl von HLA-1-negativen und -positiven Zellen wurden subkutan in jede Flanke derselben Maus injiziert. HLA-1-negative Zellen zeigten eine signifikant höhere Tumorbildungsfähigkeit (Abbildung 1F)12, während Xenografts, die sowohl von HLA-1-negativen als auch von -positiven Subpopulationen gebildet wurden, zelluläre heterogene Tumoren waren (Abbildung 1H).
Wir führten eine Genexpressionsanalyse der isolierten HLA-1-negativen TICs12durch. Gene, die mit einer normalen mesenchymalen Zelldifferenzierung assoziiert sind, wurden in TICs12erhöht. So haben wir auch getestet, ob HLA-1-TICs zu einer terminalen Differenzierung induziert werden können und zu einer verminderten Tumorbildungsfähigkeit führen können. Die Ergebnisse zeigten, dass HLA-1-negative Zellen induziert werden können, um sowohl lipogene als auch osteogene Bahnen zu unterscheiden und starke Ölrot O und Alizarin Red S Färbung zeigen (Abbildung 1G). Im Gegensatz dazu differenzieren HLA-1-positive Zellen nicht unter den gleichen Bedingungen. Somit deuten diese Ergebnisse auf eine vielversprechende differenzierte Therapiestrategie hin, die verwendet werden kann, um Sarkom-TICs ins Visier zu nehmen.
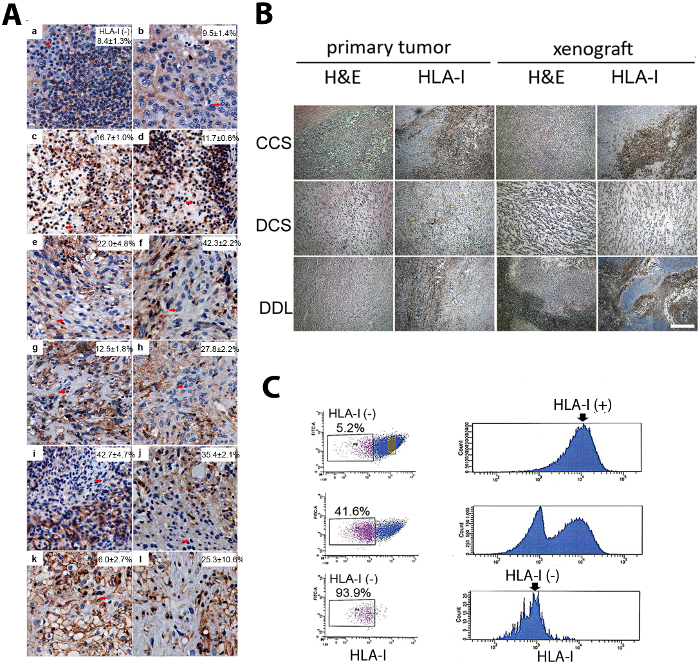
Abbildung 1: Isolierung von HLA-1-negativen Zellen aus intratumoralheterogenen Sarkom-PDXs. (A) HLA-1-negative Zellen (Pfeile) wurden in verschiedenen Subtypen menschlicher Sarkome durch Immunhistochemie (IHC) gefunden. (a und b) Zellsarkom klar. (c und d) Pleomorphes Liposarkom. (e und f) Leiomyosarkom. (g und h) Bösartiger peripherer Nervenscheidetumor. (i und j) Liposarkom, nicht anders angegeben. (k und l) Dedifferenziertes Liposarkom. Scale bar = 100 m. (B) Sarkom-PDXs ähnelten histologisch dem elterlichen Tumor (Hämatoxylin und Eosin [H&E] Fleck) und zeigten zelluläre Heterogenität in der HLA-1-Expression von IHC. Hier sind repräsentative Bilder von Sarkom-PDXs, darunter ein klares Zellsarkom (CCS), ein dedifferenziertes Chondrosarkom (DCS) und ein dedifferenziertes Liposarkom (DDL). Skala bar = 100 m. (C) Die Subpopulation von HLA-1-negativen Zellen wurde durch Durchflusszytometrie mit einer Doppelsortierungsmethode isoliert. Von oben nach unten: erste Sortierung, zweite Sortierung und Reinheitsprüfung. Isolierte HLA-1-negative und HLA-1-positive Zellen wurden einer anschließenden funktionellen Analyse unterzogen, einschließlich eines Tumorbildungsassays. Die Ergebnisse dieser Abbildung stammen aus einer früheren Veröffentlichung12. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
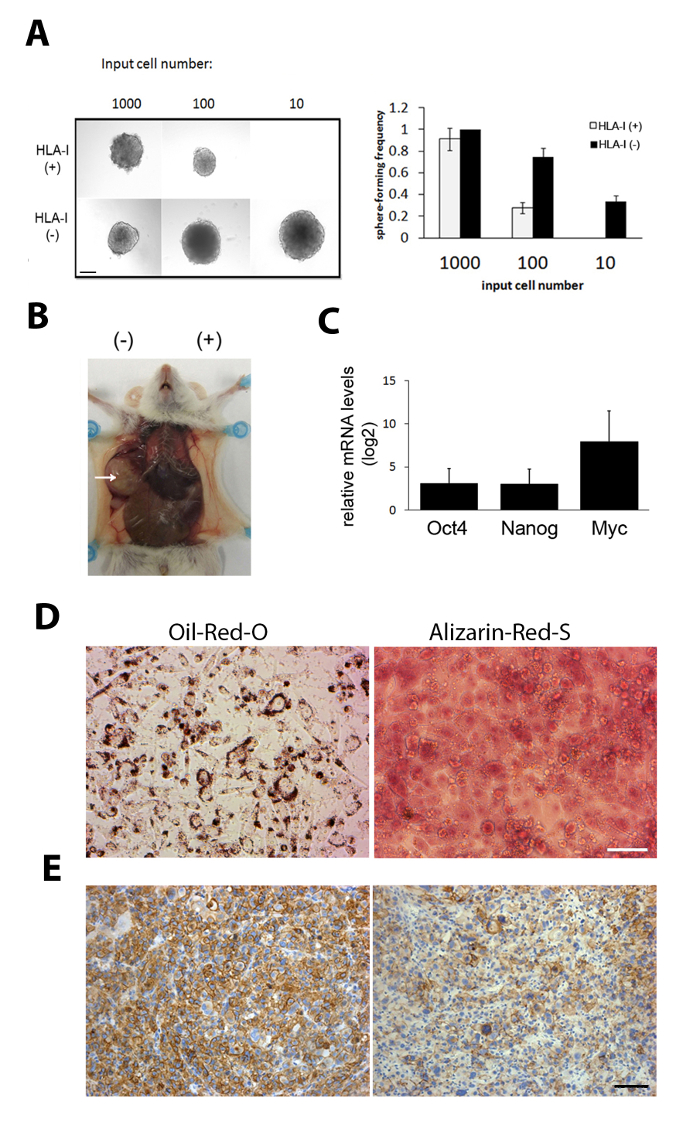
Abbildung 2: Charakterisierung von HLA-1-negativen TICs durch funktionelle Assays. (A) Ein Kugelbildungstest zeigte, dass nur 10 HLA-1-negative Zellen in der Lage waren, Sarkomkugeln zu bilden. Links: repräsentative Bilder von Sarkomkugeln. Rechts: kugelbildende Frequenz; Mittelwert s. SD. Scale bar = 100 m. (B) HLA-1-negative Zellen, die aus dem Sarkom PDX isoliert wurden, waren hochtumorogen. Hier sind repräsentative Bilder des Tumors, der durch HLA-1-negative und -positive Zellen aus DDL gebildet wird. Tausend Zellen von HLA-1-negativen und HLA-1-positiven DDL-Zellen wurden in separate Flanken derselben Maus injiziert. (C) Die mRNA-Spiegel der Stammzellgene Oct4, Nanogund Myc wurden in HLA-1-negativen Zellen im Vergleich zu HLA-1-positiven Zellen auf höheren Ebenen exprimiert. Die Daten stellen den Mittelwert sD (n = 5) dar. (D) Starke positive Färbung von Oil Red O und Alizarin Red S zeigt eine terminale Differenzierung entlang lipogener und osteogener Wege, die durch Sarkom-TICs induziert werden. (E) HLA-1-Immunostainierung von PDX, die durch HLA-1-positive (links) und -negative (rechte) Subpopulationen gebildet werden. Skalenbalken = 100 m. Die Ergebnisse dieser Abbildung stammen aus einer früheren Veröffentlichung12. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es gibt mehrere kritische Schritte, die den Erfolg dieses Protokolls zur Isolierung und Charakterisierung tumorinitiierender Zellen aus menschlichen Sarkom-PDXs begrenzen. Wir beobachteten, dass die PDX-Bildung in hohem Maße von Sarkom-Subtypen abhängt. Klinische aggressive Sarkome mit einem histologisch undifferenzierten Phänotyp (z.B. pleomorphe undifferenzierte Sarkome [Erfolgsrate 100%, n = 2], dedifferenzierte Liposarkome [Erfolgsrate 100%, n = 2] und synoviale Sarkome [ Erfolgsrate 100%, n = 3]) haben eine hohe Erfolgsrate der PDX-Bildung. Sarkome mit differenzierten Phänotypen (z. B. gut differenzierte Liposarkome [Erfolgsrate 0%, n = 3]) weisen niedrigere PDX-Bildungsraten auf. Es ist möglich, dass tumorinitiierende Zellen in bösartigeren Subtypen mit einem höheren Prozentsatz als in weniger bösartigen, differenzierten Subtypen vorhanden sind. Darüber hinaus empfehlen wir, das tumorinitiierende Zellisolationsverfahren innerhalb eines Tages ohne Stopp abzuschließen, um den Verlust der Zelllebensfähigkeit zu minimieren.
Wir haben festgestellt, dass HLA-1-negative Zellen weit verbreitet in menschlichen Sarkomen existieren. Aber der Prozentsatz der HLA-1-negativen Zellen kann zwischen Proben von verschiedenen Patienten variieren. Mit dieser Methode haben wir erfolgreich tumorinitiierende Zellen aus Proben isoliert, die HLA-1-negative Zellen haben, die von weniger als 0,5% bis zu mehr als 30%12reichen. Es ist wichtig, die HLA-1-negativen Zellen funktionell durch Kugelbildung und Tumorbildungstests zu charakterisieren, um die tumorinitiierende Zellidentität isolierter HLA-1-negativer Zellen zu bestätigen.
Das hier vorgestellte Protokoll hat jedoch auch Einschränkungen. Frühere Daten zeigten, dass die HLA-1-Expression epigenetisch reguliert ist, was mit der Beobachtung der zellulären Heterogenität der HLA-1-Expression innerhalb desselben Tumors übereinstimmt12. HLA-1 genomische Mutationen wurden bei Sarkomen und anderen Krebsarten nachgewiesen. Mutationen in HLA-1-Genen können zum vollständigen Verlust von HLA-1 auf der Zelloberfläche im gesamten Tumor oder zum Ausdruck nicht funktional mutierter HLA-1 führen. In beiden Fällen kann die HLA-1-Negativität nicht verwendet werden, um TICs innerhalb des Tumors zu identifizieren.
Mit HLA-1 als negativem Marker haben wir ERFOLGREICH TICs aus einer Vielzahl von menschlichen Sarkom-Subtypen isoliert und unsere Ergebnisse durch funktionelle Analysen validiert. So konnten wir molekulare Studien einschließlich Genexpressionsanalyse an den TICs durchführen, um eine spezifische Behandlung zu entwickeln, die auf diese TICs abzielt.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Forschung wurde von NCI-P01-CA087497 (nach C.C.-C. und D.H.) und NIH-U 54-0OD020353 (nach C.C.-C., D.H. und J.D.-D.), den Agilent Thought Leader Award (an C.C.-C.) und die Martel Foundation (nach C.C.-C. und J.D.-D.).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 μm cell culture filter | ThermoFisher | 450-0020 | |
| 100 mm Petri dish | Falcon | 353003 | |
| 15 mL conical tube | Falcon | 352196 | |
| 35 μm cell strainer | Falcon | 352340 | |
| 50 mL polystyrene tube | Falcon | 352070 | |
| 96-well ultra-low attachment cell culture plate | Corning | 7007 | |
| Alizarin Red S | Sigma-Aldrich | A5533 | |
| B-27 | Gibco | 08-0085SA | |
| bFGF | Invitrogen | PHG0021 | |
| dexamethasone | Sigma-Aldrich | D4902 | |
| EGF | Invitrogen | PHG0311 | |
| HLA-1-PE antibody | Abcam | ab43545 | |
| hMSC growth medium | ATCC | PCS-500-030 | |
| indomethacin | Sigma-Aldrich | I7378 | |
| isobutylmethylxanthine | Sigma-Aldrich | I5879 | |
| isopropanol | Sigma-Aldrich | W292907 | |
| Isotype Control Antibody | Abcam | ab103534 | |
| L-ascorbic acid | Sigma-Aldrich | A5960 | |
| lithium chloride | Sigma-Aldrich | 62476 | |
| Matrigel basement membrane matrix | Corning | 354230 | |
| MEM Alpha | Gibco | 12571-063 | |
| N2 | Gibco | 17502-048 | |
| NSG mice | The Jackson Lab | 005557 | |
| Oil Red O | Sigma-Aldrich | O0625 | |
| PBS | Corning | 21-040-CM | |
| penicillin/streptomycin | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Syringe with needle | BD | 309626 | |
| β-glycerophosphate | Sigma-Aldrich | G9422 |
Referenzen
- Medema, J. Cancer stem cells: the challenges ahead. Nature Cell Biology. 15 (4), 338-344 (2013).
- Jordan, C., Guzman, M., Noble, M. Cancer stem cells. The New England Journal of Medicine. 355 (12), 1253-1261 (2006).
- Jordan, C. Cancer stem cells: controversial or just misunderstood?. Cell Stem Cell. 4 (3), 203-205 (2009).
- Bapat, S., Mali, A., Koppikar, C., Kurrey, N. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer. Cancer Research. 65 (8), 3025-3029 (2005).
- Charafe-Jauffret, E. Breast cancer cell lines contain functional cancer stem cells with metastatic capacity and a distinct molecular signature. Cancer Research. 69 (4), 1302-1313 (2009).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22 (3), 373-388 (2012).
- Reya, T., Morrison, S., Clarke, M., Weissman, I. Stem cells, cancer, and cancer stem cells. Nature. 414 (6859), 105-111 (2001).
- Yi, J., et al. Abnormal DNA methylation of CD133 in colorectal and glioblastoma tumors. Cancer Research. 68 (19), 8094-8103 (2008).
- Ginestier, C., et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell. 1 (5), 555-567 (2007).
- Garrido, F., et al. Natural history of HLA expression during tumour development. Immunology Today. 14 (10), 491-499 (1993).
- Chang, C. C., Campoli, M., Ferrone, S. Classical and nonclassical HLA class I antigen and NK cell-activating ligand changes in malignant cells: current challenges and future directions. Advances in Cancer Research. 93, 189-234 (2005).
- Han, D., et al. Targeting sarcoma tumor-initiating cells through differentiation therapy. Stem Cell Research. 21, 117-123 (2017).
- Hu, Y., Smyth, G. K. ELDA: Extreme limiting dilution analysis for comparing depleted and enriched populations in stem cell and other assays. Journal of Immunology. 347, 70-78 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten