Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sipariş edilmiş, Pseudomonas aeruginosa baskı PA14 Transposon ekleme mutantlar Nonredundant Kütüphane çoğaltılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Pseudomonas aeruginosa enfeksiyon savunmasız konaklarda önemli morbidite neden olur. Nonredundant transposon ekleme mutant Kütüphane P. aeruginosa baskı PA14 PA14NR grubu olarak belirlenmiş, analiz çok sayıda süreçlerde gen işlevlerinin kolaylaştırır. Burada sunulan yüksek kaliteli PA14NR ayarla mutant kitaplığın kopyalarını oluşturmak üzere bir protokoldür.
Özet
Pseudomonas aeruginosa phenotypically ve genotypically farklı ve uyarlanabilir Ayagin Gram-negatif bakteri insan ortamlarda her yerde var. P. aeruginosa biyofilmler formu, antibiyotik direnci geliştirmek, virülans faktörleri üretmek ve hızla gelişmeye kronik bir enfeksiyon sırasında yapabiliyor. Böylece P. aeruginosa hem akut ve kronik, enfeksiyonları, tedavisi zor bazı hasta nüfus önemli morbidite sonuçlanan neden olabilir. P. aeruginosa yük PA14 çeşitli PA14 bu patojen çalışmak için çekici bir zorlanma yapma memeli ve nonvertebrate ana bilgisayarları bozar bir korunmuş genom yapısı ile bir insan klinik izole olduğunu. 2006 yılında 5,459 mutantlar 4,596 tahmin edilen PA14 genler için karşılık gelen içeren nonredundant transposon ekleme mutant bir kütüphane oluşturulmuştur. O zamandan beri PA14 Kütüphane dağılımı bireysel genlerin fonksiyonun ve P. aeruginosakarmaşık yollar daha iyi anlamak araştırma topluluğu izin verdi. Çoğaltma işlemi boyunca Kütüphane bütünlük bakımından uygun taşıma ve hassas teknikler gerektirir. Bu amaçla, bu el yazması ayrıntılı adımları Kütüphane çoğaltma, Kütüphane kalite kontrol ve bireysel mutant uygun depolama yer tarif iletişim kuralları sunar.
Giriş
Pseudomonas aeruginosa phenotypically ve genotypically farklı ve uyarlanabilir Ayagin Gram-negatif bakteri toprak, su ve en insani ortamlar, hem hem içinde cilt mikrofloranın mevcut olduğunu. Birçok bakteri türü için karşılaştırıldığında, P. aeruginosa 5,5-7 Mbp (65-%67) yüksek G + C içerik ile nispeten büyük bir genom vardır. Ayrıca, onun genleri önemli bir bölümünü metabolik adaptasyon katılmaktadırlar ve çevresel stres1yanıt olarak büyük esneklik için izin düzenleyici ağların bir parçasıdır. P. aeruginosa virülans faktörleri bir bolluk ifade eder, meyil formu biyofilmler için sergiler, birden çok çekirdek yolları algılama aracılığıyla yanıt koordine yeteneği sahip ve antibiyotik direnci geliştirmek için önemli bir kapasite görüntüler ve hoşgörü2,3,4,5,6,7,8. Bu öznitelikler P. aeruginosatarafından neden olduğu enfeksiyonların tedavisinde önemli sorunlar mevcut.
Kronik P. aeruginosa enfeksiyonlar çok sayıda hastalık durumlarında oluşabilir. Kistik fibroz (CF), Kistik fibrozis transmembran gürültülerinden regülatörü (CFTR) gen mutasyon genetik bir hastalığı inspissated, enfekte sekresyonun solunum yolu içinde sonuçları ilerici bronşiektazi ve sonuçta, ölüm solunum yetmezliği9. Yetişkinlik, CF ile hastaların çoğu kronik morbidite ve mortalite ile bu hastalık10ilişkili anahtar bir rol oynayan P. aeruginosa, bulaşmış. Ayrıca, hastalar şiddetli Yanık yaraları11, tracheostomies12, eklem replasmanları13ya da kalıcı kateter14 ile P. aeruginosa enfeksiyon bakteri yeteneği oluşturmak için ilgili etkilenir biyofilmler ve kaçış ana bilgisayar inflamatuar yanıt-e doğru15. Ayrıca, çoklu antibiyotik dirençli ya da hoşgörülü nüfus geniş spektrumlu, sıralı antimikrobiyal tedavi12,16,17 seçildikten sonra kolonizasyon rekabet olmadan oluşur , 18. P. aeruginosa patogenezinde daha iyi anlamak için çok sayıda hastalık durumlarında önemli etkileri olacak.
Suşların PAO1, PA103, PA14 ve PAK, dahil olmak üzere birkaç P. aeruginosa klinik yalıtır P. aeruginosa Patogenez farklı özelliklerini araştırmak için kapsamlı bir şekilde incelenmiştir. Soy PA14 en yaygın klonal gruplar dünya çapında19,20 birine ait olan ve yoğun laboratuvarda pasajlı değil bir klinik izole olduğunu. PA14is enfeksiyon, dikkate değer bir endotoksin ile omurgalı modellerinde son derece öldürücü profil21, pili yapısı22, patojen Adaları23, III salgı sistemi (TTSS) yazın, sitotoksisite doğru memeli hücreleri24 ve antibiyotik direnci ve sebat25profillerinde. Ayrıca, PA14 da çok sayıda ana bilgisayar-patojen modeli sistemlerinde son derece öldürücü, bitki yaprak da dahil olmak üzere26,27infiltrasyon modelleri,Caenorhabditis elegans enfeksiyon modeller28, 29, böcek modelleri30,31, hem de fare pnömoni modelleri32,33 ve cilt yanık modelleri34.
Genom çapında mutant kitaplıkları isogenic mutant gen işlevi analizini genomik bir ölçekte izin vererek bir organizma biyolojisi anlamak için çok güçlü araçlar teşkil önemli olmayan genlerdeki koleksiyonlarıdır. İki doygunluk yakınındaki transposon ekleme mutant kitaplıkları P. aeruginosa içinde inşa şu anda dağıtım için kullanılabilir. Transpozonlar ekleme siteleri her iki kütüphane için tespit edilmiştir. Bu sözde nonredundant kütüphaneler genom genelinde Çalışmalar bakteri suşlarının zamanı önemli ölçüde azaltarak kolaylaştırmak ve söz konusu olursa maliyet tarama uncharacterized rasgele transposon mutantlar. MPAO1 içinde inşa P. aeruginosa PAO1 transposon mutant Kütüphane, izole Transpozonlar IS kullanarak strain PAO1phoA/ hah velacZolduğunu / hah35, küratörlüğünü Manoil lab tarafından Washington Üniversitesi. Kütüphane koleksiyonunun geniş genom kapsama alanı sağlar ve çoğu genler36için iki mutantlar içeren bir sıra doğrulanmış 9,437 transposon mutant oluşur. P. aeruginosa PAO1 transposon mutant kitaplığı hakkında bilgi http://www.gs.washington.edu/labs/manoil/libraryindex.htm, kamu, internet erişimli Manoil lab Web sitesinde mevcuttur. P. aeruginosa zorlanma Transpozonlar MAR2xT7 ve TnphoAkullanarak strain PA1437 yılında inşa nonredundant transposon ekleme mutant kitaplığı (PA14NR Set) şu anda Pediatri bölümü tarafından dağıtılan PA14 Hastane Massachusetts General. PA14NR ayarla tek transposon eklemeleri önemli olmayan genler37' den fazla 5,800 mutantlarla topluluğu oluşur. PA14NR ayarla inşaatı ile ilgili ayrıntılar da içeren çeşitli PA14NR kullanımını kolaylaştırmak için online arama araçları kamu, internet erişimli site http://pa14.mgh.harvard.edu/cgi-bin/pa14/home.cgi?section=NR_LIB içinde açıklanan Ayarlayın.
Orijinal PA14NR ayarla 5,459 mutantlar, tüm tahmin edilen PA14 genler%3777 temsil eden 4,596 tahmin edilen PA14 genler için karşılık gelen yaklaşık 34.000 rasgele transposon ekleme mutantlar, kapsamlı kitaplığından seçilen oluşur. Kütüphane inşaatı 2006 yılında beri yeni mutantlar eklenmiş ve halen yaklaşık 4,600 PA14 genler temsil fazla 5,800 mutantlar38 PA14NR kümesi içerir. PA14 transposon mutantlar çoğunluğu vahşi türü arka plan37yılında üretildi. Detayları da dahil olmak üzere genetik arka plan, mutant kütüphanenin her üye ile ilgili çevrimiçi veritabanı arama yoluyla veya Nonredundant kütüphane elektronik tablo, her iki özellik (http:// PA14 Web sitesinde kullanılabilir indirme mevcuttur pa14.mgh.Harvard.edu/cgi-bin/pa14/Home.cgi). Mutantlar çoğunluğu MAR2xT7 kullanılarak oluşturulan TnPhoA (phoA) transposon37kullanılarak oluşturulan küçük bir set ile (MrT7) transposon. Her transposon gentamisin (MrT7) veya sefaloridin (phoA) kullanarak mutant seçim için izin verir bir antibiyotik direnci kaset var. Mutantlar PA14NR kümesi 63 96-şey levha depolanır ve kaplamalar, vahşi türü PA14 oluşur aşısını iki ek 96-şey denetimi içerir ve az wells bir hazır ayar deseni ara. Çevrimiçi arama araçları ile büyük ölçüde eşleştirilmiş 96-şey plaka biçimi kolayca mutant fenotipleri ile ilişkili genlerin tanımlamak, kullanıcıların deneyleri eleme özel geliştirme kolaylaştırır. Çevrimiçi arama araçları da arama ve seçim daha fazla çalışmalar için gerekli ek ilgili mutantların kolaylaştırmak.
PA14 ve PAO1 transposon mutant kitaplıklar bilimsel toplum için çok önemli küresel kaynaklar ve onlar birbirlerini tamamlayıcı bilinmeyen genlerin fonksiyonun ve yollar bu bakteriyel patojenin doğrulanıyor. Tesadüfen, PAO1 ve PA14 transposon mutasyon kitaplıklar inşaat beri PAO1 ve PA14 P. aeruginosa farklı büyük subclades için ait tam-genom DNA sıralama analizi birçok P. aeruginosa yalıtır göstermiştir phylogeny7,39,40,41. Klinik P. aeruginosa izole ediyor çünkü bulundu phylogeny PAO1 ve PA14 için farklı P. aeruginosa ait aslında boyunca dağıtılmış alt gruplar iki transposon mutasyon kitaplıkları için karşılaştırmalı değerini artırır çalışmalar.
İnşaat açıklayan ve P. aeruginosa kitaplıkları35,de dahil olmak üzere, bakteri mutasyona uğramış kütüphanelerin eleme yayınlar37,42, literatürde hazır. Ancak, bizim bilgi en iyi şekilde açıklayan ayrıntılı yordamlar ve çoğaltma için kullanılan teknikler hiçbir yayımlanmış bakım ve bakteri mutasyona uğramış kütüphanelerin doğrulama kullanılabilir iletişim kurallarıdır.
Bu yayında sıraladı metodoloji, kullanımı kolaylaştıran üç iletişim kuralları kümesi ve bakım PA14NR kümesi açıklar. İlk protokol çoğaltma Kütüphane PA14NR ayarla alıcıları için önerilen biçimde açıklamaktadır. İkinci Protokolü çizgiler, büyüyen ve bireysel mutant PA14NR ayarla kullanarak tanımlanan depolamak için yönergeler içerir. Kalite kontrol teknikleri, transposon mutantlar parçalardan amplifikasyon PCR ve mutant kimliğini onaylamak için sonraki sıralama dahil olmak üzere üçüncü protokolünü açıklar. Bu iletişim kuralları kümesi de çoğaltma ve diğer bakteri mutasyona uğramış kitaplıkları veya koleksiyonları bakım için adapte olabilir. Bakteri mutasyona uğramış kitaplıkları veya koleksiyonları çoğaltılması son derece "ana kopya" bütünlüğünü korumak için tavsiye edilir (orijinal kopya aldı). Çoğaltma kümesinin PA14NR rutin laboratuvar kullanım için birkaç kopya ana kopya interwell bulaşma olasılığını en aza indirir.
Protokol
Dikkat: Standart BSL-2 güvenlik önlemleri P. aeruginosa, insan bir patojen işlerken kullanır. İmmün bireysel veya bakteriyel enfeksiyona yatkınlık artar herhangi bir sağlık sorunu varsa, özel P. ile çalışırken dikkatli aeruginosa. Kurumunuzun Biyogüvenlik ofiste danışmak ve ile çalışmaya başlamadan önce doktorunuza onay almak PA14 NR ayarla veya bakteriyel patojenlerin mutant kitaplıkları.

Şekil 1: PA14NR iletişim kuralı ı: çoğaltma genel bakış ayarla. 1. gün: "ana kopyasını" PA14NR ayarla LB Agar medya içine donmuş mutant kültürler çoğaltmak ve mutantlar 37 ° C'de gecede büyümek 2. gün: mutant büyüme LB Agar medyadan derin de LB sıvı et suyu içeren blokları için Transfer, 37 ° C'de 950 rpm'de sallayarak ile bir gecede büyümek. 3. gün: gecede LB kültürler gliserol ile karıştırın, sonra 96-şey hedef Kaplamalar, uzun süreli depolama için transfer. -80 ° C dondurucu düz yer 96-şey levha. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Şekil 2: Kurulumu önerilen. Kısırlık ve düzgün iş akışı aracılığıyla uygun önlemler sağlanmalıdır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
1. iletişim kuralı ı: PA14NR, ayarlama
Not: Çoğaltma Kütüphane plakaların birbirini izleyen dört hafta içinde işlenen on altı her dört alt kümeleri PA14NR kümesinde bölerek elde edilebilir. 1-6 kopya nesil nesil 6'dan fazla kopya tablo 2'de özetlenen haftalık iş akışını takip ederken tablo 1'de özetlenen haftalık iş akışı bağlı kalır. PA14NR ayarla 12 kopyalarını oluşturmak üzere, aynı PA14NR alt içine sıvı LB medya gün 2 aşılamak ve yeniden 3. gün (gün 1'yinelenmiş agar plakaları aynı kümesinden) ve transfer mutant kültürler kopyalama plakaları gün 3 ve 4. gün içine sırasıyla gecede.
| Gün 0 | Gün 1 | 2. gün | 3. gün |
| Hazırlık günü | Büyüme PA14NR ayarla mutant LB agar medya | Büyüme PA14NR ayarla mutant sıvı LB medya | PA14NR ayarla mutant kültürlerin aktarmak hedef plakaları |
Tablo 1: 1-6 kopya PA14NR kümesinin çoğaltma zamanlamasını. Kopya az sayıda çoğaltma bir haftalık iş akışına uygun.
| Gün 0 | Gün 1 | 2. gün | 3. gün | 4. gün |
| Hazırlık günü | PA14NR ayarla mutant LB agar üzerinde büyüme | Sıvı LB medya PA14NR ayarla mutantların büyümek | Gün 3 mutant kültürler transferini 1 6 kopya PA14NR ayarla kümesini oluşturmak için | 4. gün mutant kültürler transferini 2 6 kopya PA14NR ayarla kümesini oluşturmak için |
| Büyüme PA14NR ayarla mutant sıvı LB medya |
Tablo 2: PA14NR kümesi'nin 12'ye kadar kopya çoğaltma zamanlamasını. Kopya daha çok sayıda çoğaltma katmanlama haftalık bir iş akışı içindeki gerektirir.
- 1. gün: Büyüme PA14NR ayarla ana kopyanın LB agar plakaları
- Eldiven, önlük ve PA14NR ayarla işlemek için maske tak.
- Tezgah temizleyin ve % 70 etanol ile yüzey silin.
- LB agar medya43 hazırlamak ve 25 dk. 55 ° C su serin ortama banyo ve MAR2xT7 transposon eklemeleri veya 200 µg/mL sefaloridin, Tniçeren mutantlar için içeren mutantlar ya 15 µg/mL gentamisin eklemek için otoklav içinde sterilize phoA ekleme.
- Medya plaka başına yaklaşık 60 mL kullanarak dikdörtgen tabaklar erimiş LB agar dökmek. Steril bir başlık için yaklaşık 1 saat önce kuru levha kullanın. İn agar yüzeyinde buğu yok su olduğundan emin olun. Tabaklar 4 ° C'de saklayabilirsiniz.
- Etanol sildi tezgah üstüne Bunsen burner ile steril bir alan oluşturun ve kapları Çoğalıcı PIN sterilizasyon için uygun çözümler ile ayarlayın (bkz. Adım 1.1.9). Aç plastik kaplar kullanın (5,25" L x 4.25" W x 1.75 "H yaklaşık boyutu) Çoğalıcı PIN sterilizasyon için. Otoklav kullanmadan önce plastik kaplar.
Not: Alev üstüne boşluk ısıtır ve çalışma alanının steril tutmak herhangi bir parçacık havada yukarı ve soğuk hava altında uzak asansörleri bir konveksiyon geçerli, Bunsen burner alev ısı oluşturur. - En fazla dört PA14NR ayarla ana Tabaklar (gereksiz çözdürme önlemek için)-80 ° C dondurucudan kaldırmak ve 4 L buz tavada kuru Buza koyun.
- Sadece zaman alacak kuru buz çoğaltılması ve kısa çözdürme, izin vermek için bankta yerleştirmek için 96-şey ana plaka (bkz. Adım 1.1.8) Çoğalıcı Pins (yaklaşık 3-4 dk) sterilizasyon için gerekli tedbirleri. Damgalama önce agar plaka üzerinde A1 koordinat konumunu işaretleyin. Ana plaka ve agar plaka sol üst köşede her iki tabak A1 koordinatı ile hizalayın.
- "Pin" Çoğalıcı aşağıda açıklanan adımları izleyerek sterilize. Çoğalıcı biraz aşırı sıvı kaldırmak için her adımdan sonra dokunun.
- 250 mL 0,3-0,5 iğne batırmak 30 saniye boyunca % sodyum hipoklorit (% 10 ev çamaşır suyu). Pins-in zarar yol açabilir gibi sodyum hipoklorit çözüm, ilgili kişiyle en aza indirmek. 250 mL steril GKD2O iğne batırmak ya da steril ultrasaf su 10 saniye sonra 250 mL % 70 etanol için 30 saniye sonra % 95 etanol 2 min için 250 mL.
- Alev Çoğalıcı dik Bunsen burner alev tutan, etanol tutuşturan kadar yavaş yavaş alev yaklaşıyor, o zaman hemen bu alev geri çekilmesi tarafından Çoğalıcı pimleri sterilize. Alev kapalı bir kez tüm etanol yanıklar söndürmek. Bir kapak veya benzer kapsayıcı gerekirse yanan etanol, boğmak için yakınlarda tutun.
Not: bir alev yakınındaki etanol ile çalışırken çok dikkatli olun. Çoğalıcı doğrudan ateşte tutmayın. - 30 saniye boyunca agar LB ortamı içeren bir kullanılmayan steril dikdörtgen plaka üzerine yoluyla serin pimleri.
- Kısa bir süre sıcak alüminyum mühür PA14NR ayarla ustadan plaka eliniz ile daha önce o soyulmuştu. Bunu Çoğalıcı pimleri soğutma. Dikkatlice mühür plaka rötuş önlemek için alüminyum mühür kaldırın. Alüminyum mühür herhangi bir kalıntıları soyma için cımbız kullanın.
- Çoğalıcı pimleri ana plaka, hafifçe iterek ve iğneler emin olmak için sallanan Çoğalıcı her dört yöne takın her 96-Wells donmuş bakteriyel kültürlerde ile temas. Plaka arasındaki sınırda yer alan Wells Çoğalıcı pimleri donmuş kültürleri karşı iterek plaka dış kenarında yer alan wells ekstra dikkat.
- Yavaşça Çoğalıcı pimleri agar plaka yüzeyine yerleştirin. Çoğalıcı hafif dairesel hareketlerle form mini-çimler her mutant suşu için yaklaşık 4-5 mm için hareket eder. Çapraz bulaşma kaçınmak için mini-çimenler çakışabilir olasılığını önlemek.
- PA14NR ayarla ana plaka ile yeni bir steril alüminyum mühür mühür. Alüminyum mühür kirlenmesini önlemek için herhangi bir noktada yapışkanlı tarafına dokunmayın. Her şey ve plaka kenarlarını tamamen bir plaka rulo kullanarak mühürlü olduğunu emin olun. Dönüş 96-şey plaka Buz Makinası.
- Her ana plaka için yordamı yineleyin.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı PA14NR ayarla işleme sonra silin.
- Çoğaltılmış Ağar kaplamalar için 37 ° C kuluçka aktarmak ve gecede kuluçkaya.
- 2. gün: Büyüme LB sıvı suyu PA14NR ayarla Master kopya
- MAR2xT7 transposon eklemeleri veya 200 µg/mL sefaloridin, TnphoA eklemeler içeren mutantlar için içeren mutantlar ya 15 µg/mL gentamisin içeren LB sıvı suyu43 hazırlayın.
- Laminar akış hood gereksiz ekipman temizleyin ve iş başlamadan önce en az 10 dk boyunca hood üfleyici açın. Hood yüzeyler ve % 70 etanol kullanarak mahallede yerleştirilen tüm öğeleri aşağı silin.
- 2 mL derin-iyi blok 525 µL laminar akış başlıklı bir 50-1200 µL 12 kanallı elektronik pipet kullanarak uygun antibiyotik içeren LB sıvı suyu ile doldurun. Ardından medya dolu derin-iyi blok etanol sildi tezgah üstüne aktarın. Steril koşullar tutulur sürece ipuçları yeniden.
- Eldiven, önlük ve PA14NR ayarla işlemek için maske tak.
- Tezgah temizleyin ve % 70 etanol ile yüzey silin.
- Ağar kaplamalar gecede yetişkin mutant suşları ile tezgah üstüne getirin.
- Etanol sildi tezgah üstüne Bunsen burner ile steril bir alan oluşturun ve kapları Çoğalıcı PIN sterilizasyon için uygun çözümler ile ayarlayın (sonraki adıma bakın).
- "Aşağıda açıklanan adımları izleyerek Çoğalıcı pins" sterilize. Çoğalıcı biraz aşırı sıvı kaldırmak için her daldırma sonra dokunun.
- 250 mL 0,3-0,5 iğne batırmak % sodyum hipoklorit 30 saniye için. Pins-in zarar yol açabilir gibi Çoğalıcı PIN temas sodyum hipoklorit çözüm, en aza indirmek. O zaman, 250 mL steril GKD2O iğne batırmak ya da 10 saniye, ultrasaf su 250 mL % 70 etanol için 30 saniye sonra 250 mL % 95 etanol için 2 dk sonra.
- Alev 30 saniyeliğine agar LB ortamı içeren kullanılmayan dikdörtgen plaka içine iğneleyerek Çoğalıcı pimleri, daha sonra serin pimleri sterilize.
Not: bir alev yakınındaki etanol ile çalışırken çok dikkatli olun (1.1.8 bakın).
- Yavaşça Çoğalıcı pimleri mutant büyüme ve iğne agar plaka üzerinde tüm 96 mutantlar ile temas halinde olan onay içeren agar plaka üzerine yerleştirin, sonra iğne LB sıvı et suyu içeren derin kuyu daldırın. İğne ile kuyu kenarlarında dokunmaktan kaçının.
- Derin kuyu blok steril solunabilir mühürleme membran ile kapatın. Her şey düzgün mühürlü emin olmak için bir plaka rulo kullanın.
- Her agar plaka için yordamı yineleyin.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı PA14NR ayarla işleme sonra silin.
- Aşısını sıvı kültürleri 950 varsa bir yüksek hızlı shaker kullanarak rpm'de 37 ° C'de 15-16 h için büyümek.
Not: bir yüksek hızlı shaker yoksa, kuluçka shaker 250-300 devirde derin kuyu blokların mümkün olabilir. Ancak, düşük oksijen koşullar altında ortaya çıkan küçük koloni türevleri (SCVs)25 daha büyük bir şansı var. Bu nedenle, son derece düşük shaker hızlarda derin kuyu blok kültürlerde büyüyen kuluçka altında 15-16 h kez saklamanız önerilir. İstenmeyen SCVs mutant Wells yayılması mutant fenotipleri genetik ekranlar gerçekleştirmek için kütüphane kullanarak değiştirebilirsiniz.
PA14NR ayarla belirli wells klonlar, eksik mutantlar, yavaş büyüyen/sigara-büyüyen içerebilir veya az ortamları içerir. Bu kuyu konumunu kayıt altına alınmış ve bu yayın ile bulunan ek PA14NR ayarla Wells bilgi dosyasında bulunabilir.
- 3. gün: Transfer hedef tabak içine bir gecede kültür PA14NR ayarla
- Laminar akış hood temizleyin ve iş başlamadan önce en az 10 dk boyunca hood üfleyici açın. Hood yüzeyler ve % 70 etanol kullanarak mahallede yerleştirilen tüm öğeleri aşağı silin.
- Yapışkanlı su geçirmez Etiketler yazdırmak (bakınız ek PA14NR etiketleri ayarla dosya şablonu için). Kaldır 96-şey plakalar plastik bir laminar akış başlık içinde sarın. Sıyırıcı plaka etiket ve plaka'nın kenarı boyunca H1 kuyu hedef plaka yapımı için A1 en yakın yerleştirin. Biraz hedef plaka kapağını kaldırın ve etiket plaka kapak ile örtülü etiket görüntülemek için alt kenarına yerleştirin.
- % 60 gliserol (v/v) 3.5 litre hazırlama ve otoklav içinde 20 dk sterilize.
- Eldiven, önlük ve PA14NR ayarla işlemek için maske tak. Derin kuyu bloklar yüksek hızlı shaker veya düzenli shaker kaldırma.
- Derin-iyi blok steril laminar akış Hood'a aktarmak ve solunabilir mühürleme membran dikkatli bir şekilde çıkarın. Alüminyum mühür ile değiştirin. Spin aşağı derin-iyi blok yoğunlaşma toplamak için çok düşük hızda (50-150 x g, 30 saniye sonra yavaşlatmak quicky santrifüj fren sahip).
- Derin-iyi blok geri steril hood bir 50-1200 µL 12 kanallı elektronik pipet kullanarak transfer ve steril süzülmüş ipuçları 525 µL gliserol/LB sıvı suyu karışımı (eşit parçaya LB sıvı suyu ve % 60 gliserol çözüm) her şey için ekleyin. Yavaşça 300 µL yukarı ve aşağı 3 kez ile elektronik pipet pipetting tarafından karıştırın. İpuçları iyi tarafına damlama önlemek için ipuçları çıkarma önce dokun. İpuçları dışarı atmak ve e kadar tüm derin kuyu bloğu ile bitmiş bir sonraki satıra devam edin.
- 12 kanallı elektronik tekrarlayan pipet ve filtre uygulanmış ipuçları, aliquoting sırasında interwell kontaminasyonu önlemek için kullanarak, mutasyona uğramış kültür 900 µL çekin ve 150 µL 6 Kütüphane plaka kopyalarını oluşturmak üzere her 96-şey hedef kalıplara dağıtmak. Damlar ipuçları ile kuyu duvarı hedef tabak içine kültür aktarımına başlamadan önce dokunarak önlemek. Tekrar yok pipet varsa, bir çok kanallı pipet 150 µL her damlayan engellemek için yukarıda açıklanan tekniği kullanarak altı 96-şey tabak içine dağıtmak için kullanın.
- Steril alüminyum contalar kuruyucu ve tamamen mühür plaka kenarları ve bütün wells bir plaka rulo kullanmak için kullanın. Etiket tanımlayıcı alüminyum mühür ile kapak değil emin olun. Kültür wells tarafına veya alüminyum mühür üzerinde sıçrama gibi kaplamalar, sallama.
- Mühürlü plakalar düz,-80 ° C dondurucuya bile yüzey hood ve yer Tabaklarda kaldırın.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı Kütüphane işleme sonra silin.
- Kalite kontrol denetimleri kitaplığı çoğaltması ve genetik ekranlar (bkz: protokol III) gerçekleştirmek için kütüphane kullandıktan sonra gerçekleştirmek.
2. protokol II: Kullanım ve depolama bireysel mutant PA14NR ayarlamak
-
1. gün: Çizgi mutant ilgi
- PA14NR ayarla bağlantısını http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS faiz mutant konumunu tanımlamak veya Nonredundant Library.xls dosyasını kullanarak bağlantı http:// indirilen pa14.mgh.Harvard.edu/cgi-bin/pa14/downloads.cgi). Belirli her mutantı (gentamisin veya sefaloridin) seçmek için gerekli antibiyotik not edin.
- LB agar ortam hazırlamak, 20-25 dk otoklav içinde sterilize ve 55 ° C su banyosu içinde serin. MAR2xT7 transposon eklemeler ve 200 µg/mL sefaloridin TnphoA transposon eklemeler içeren mutantlar için içeren mutantlar için 15 µg/mL gentamisin ekleyin. LB agar medya (yuvarlak veya dikdörtgen plakanın yeterli) Tabaklarda dökün. Yaklaşık 30 dakika önce 1 h için steril başlıklı kuru tabak kullanın.
- Otoklav tüm plasticware ve non-steril malzeme kullanmadan önce.
- Eldiven, önlük ve PA14NR ayarla işlemek için maske tak. Tezgah temizleyin ve % 70 etanol ile yüzey PA14NR Set ile çalışmaya başlamadan önce silin.
- Bunsen burner ile steril bir alan oluşturun.
- Mutant-80 ° C dondurucu dan ilgi ile PA14NR ayarla 96-şey plaka çıkarın ve kuru Buza koyun, tezgah için kuru buz kabı alın ve kısa bir süre 96-şey plaka (yaklaşık 1-2 dk) çözdürme hafif izin vermek için tezgah üstüne yerleştirin.
Not: daha fazla erişim Kütüphane plakaları interwell kirlenme için daha büyük bir risk ile ilişkili gibi çizgi için bireysel mutantlar, erişilen tüm PA14NR ayarla 96-şey plakaları kaydını tutmak. - Sıcak alüminyum mühür mühür plaka rötuş önlemek için dikkatli olmak, peeling önce el ile. Alüminyum mühür herhangi bir kalıntıları soyma için cımbız kullanın.
- Mutant ilgi 96-şey plaka üzerinde bulun. Steril ahşap çubuğu ya da steril pipet ucu de ilgi mutant içeren birey donmuş kültür küçük bir miktar almak için kullanın.
- Kültür agar plaka tek mutant colonies için aşağıdaki gibi donmuş çizgi: yavaşça yayıldı bakteri bir bölüm çizgi 1, bir taze, steril ahşap sopa veya pipet ucu, kullanarak oluşturmak için plaka üzerinde 1 çizgi sürükleyin ve bakteri ikinci bölümünün üzerine yayılmış plaka çizgi 2 oluşturmak için. Bir üçüncü steril ahşap sopa veya pipet ucu kullanarak, çizgi 2 sürükleyin ve bakteri çizgi 3 oluşturmak için plaka, son bölümünün üzerine yayıldı.
- Kaynak plaka ile yeni bir steril alüminyum mühür mühür. Yapışkan alüminyum mühür kirlenmesini önlemek için herhangi bir noktada tarafına dokunmayın. Her şey ve plaka kenarlarını tamamen bir plaka rulo kullanarak mühürlü olduğunu emin olun. Dönüş 96-şey plaka kuru buz ve-80 ° C dondurucu.
- Agar plaka 37 ° C kuluçka gecede kuluçkaya.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı Kütüphane işleme sonra silin.
-
2. gün: Büyüme mutant LB sıvı suyu ilgi
- 15 µg/mL gentamisin veya transposon ekleme göre 200 µg/mL sefaloridin içeren sıvı LB suyu hazırlayın.
- Eldiven, önlük ve P. aeruginosaişlemek için maske tak.
- Tezgah temizleyin ve % 70 etanol ile yüzey silin. Bunsen burner ile steril bir alan oluşturun.
- 3-5 mL LB suyu uygun antibiyotik ile kap ile steril kültür tüp içine aktarın.
- Steril bir aplikatör veya steril pipet ucu kullanarak, bir koloni mutant baskı almak ve LB medya içine aşılamak.
- Bir shaker 225-250 rpm'de 37 ° C'de LB sıvı kültürleri gecede kuluçkaya.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı P. aeruginosaişleme sonra silin.
-
3. gün: Mağaza mutant-80 ° C dondurucu ilgi
- Etiket cryovial mutant adı, antibiyotik ile LB suyu ve tarihi depolama ekledi.
- % 50'lik 500 mL hazırlamak gliserol (v/v) ve otoklav içinde sterilize.
- Eldiven, önlük ve P. aeruginosaişlemek için maske tak.
- Tezgah ve/veya laminar sel hood temizleyin ve % 70 etanol ile yüzey silin.
- Shaker mutant kültürü içeren tüpü çıkarması.
- Kuru buz ile küçük bir kap hazırlamak.
- Laminar Akış Başlığı kullan veya Bunsen burner ile etanol sildi tezgah üst steril bir alan oluşturun.
- Eşit miktarda bakteri kültürü ve % 50 gliserol steril koşullar kullanarak etiketli cryovial ekleyin ve karışımı yavaşça pipet ile (son hacim 1-2 mL/şişe kullanılan cryovials boyutuna bağlı olarak). Cryovial quick-freeze için Kuru Buza koyun.
- Cryovial-80 ° C dondurucu etiketli kutuya koyun.
- Tüm çalışma yüzeyleri % 70 etanol ile aşağı işleme sonra Sil P. aeruginosa.
3. protokol III: kalite kontrol PA14NR set
- Rasgele mutantların (30-40 / mutantlar tavsiye edilir test) mümkün interwell kirlenme algılamak için yeni çoğaltılmış plakalar seçeneğini belirleyin.
Not: belirli bir gen karakterizasyonu için kullanılan bir mutant kimliğini onaylamak için gerekli olduğu durumlarda, PCR Arttırımlar içeren gen olarak bilinen sırası için tasarlanmış gene özgü primerler kullanılarak gerçekleştirmek için önerilir transposon ekleme. Daha ne kadar zorlu, rasgele kullanmanın yararları gene özgü PCR astar transposon mutantlar amplyfing DNA parçaları yerine PCR astar kolaylığı büyük ölçekli mutant onay ve potansiyeli olup olmadığını belirlemek için yetenek eklemek kirletici. Mutantlar yeterli sayıda hata oranı değerlendirmek diplerinin sürece kalite kontrol amaçlı tüm rasgele slected mutantlar için yüksek kaliteli PCR sıralama verileri elde etmek gerekli değil. - "Protokolü çizgi ve mutant suşları büyümeye II" izleyin.
- Otoklav tüm plasticware ve non-steril malzeme kullanmadan önce.
- Genomik DNA tarafından tercih edilen yöntem yalıtmak. Bu çalışmada açıklanan analiz için üreticinin iletişim kuralları takip genomik DNA izolasyon kit kullanılmıştır. Aynı anda birden fazla mutant suşları analiz.
- Genomik DNA toplama microvolume Spektrofotometre kullanarak ölçmek. Genomik DNA konsantrasyonu yaklaşık 100 ng/µL için ayarlayın.
- Genomik DNA "PCR1 reaksiyonu" Adım 1, tablo Arb1 PCR parçaları (şekil 3) üreten 3'te, açıklandığı gibi çalıştırmak için şablon olarak kullanın. Bu adım için astar Tablo 4'te listelenir.
- 10 PCR1 tepki 5 µL arabelleğe yükleme x 0.5 µL eklemek, % 1,5-2 özel jel yüklemek ve jel 80-150 V adlı çalıştırmak.
Not: Belirli parça uzunluğu veya belirli parça aralığı değil beklenen ve rasgele astar birden çok konuma bağlamak gibi birden fazla grup mevcut olabilir. - Adım 2, tablo Arb2 PCR parçaları (şekil 3) üreten 3'te, açıklandığı gibi "PCR2 reaksiyonu" çalıştırmak için DNA PCR1 reaksiyon şablon olarak kullanın. Bu adım için astar Tablo 4'te listelenir.
- 10 PCR2 tepki 5 µL arabelleğe yükleme x 0.5 µL eklemek, % 1,5-2 özel jel yük ve jel 80-150 V adlı çalıştırın.
Not: Belirli parça uzunluğu veya belirli parça aralığı değil beklenen ve rasgele astar birden çok konuma bağlamak gibi birden fazla grup mevcut olabilir. - PCR2 reaksiyon sıralama için uygun transposon özgü astar ile birlikte gönderin.
- Onlara karşı patlama bağlantıyı kullanarak tam PA14 genom PA14NR Kütüphane Web sitesinde (http://pa14.mgh.harvard.edu/cgi-bin/pa14/blast.cgi) veya doğrudan onlara karşı belirli bir gen dizisini patlatma tarafından sağlanan sıralama sonuçları byBLASTing analizi faiz mutant.
Not: Seçilen mutantlar hakkında bilgi PA14NR ayarla veya Web sitesine (arama http://pa14.mgh.harvard.edu/cgi-bin/pa14/search.cgi?searchType=SEARCH_PLATE_POSITIONS download Nonredundant Library.xls dosya bağlantı http:/ arama yaparak bulunabilir / pa14.mgh.harvard.edu/cgi-bin/pa14/downloads.cgi).
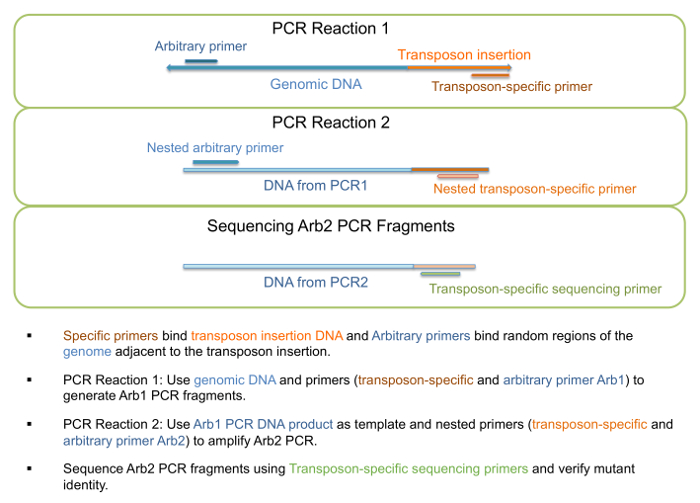
Şekil 3: PCR güçlendirme ve sıralamanın transposon ekleme mutantların. Şematik PCR güçlendirme dahil ve mutant kimlik doğrulaması için sıralama adımlar. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| PCR reaksiyon Set-up | |
| 1. adım | Adım 2 |
| PCR1 reaksiyon: | PCR2 reaksiyon: |
| 23,25 µL su (Moleküler Biyoloji sınıf) | 19.15 µL su (Moleküler Biyoloji Grade) |
| 3µL 10 x Taq polimeraz arabellek | 5 µL 10 x Taq polimeraz arabellek |
| 0.5µl Taq polimeraz | 0.6 µL Taq polimeraz |
| 0.625 µL 20 µM astar Arb1D (Tablo 4) | 0.625 µL 20 µM astar Arb2A (Tablo 4) |
| 0.625 µL 20 µM transposon özgü astar (PMFLGM. GB 3a veya Tn5Ext) (Tablo 4) | 0.625 mL 20 µM Transposon özgü astar (PMFLGM. GB 2a veya Tn5Int2) (Tablo 4) |
| 1 µL 10 mM dNTPs | 1 µL 10 mM dNTPs |
| 1 µL genomik DNA, 100 ng | 5 µL PCR1 tepki |
| 30 µL son tepki birim | 30 µL son tepki birim |
| PCR reaksiyon ayarları | |
| PCR1 Thermocycler şartlar: | PCR2 Thermocycler koşulları: |
| 95 ° C-2 dk | 95 ° C-2 dk |
| 5 döngüleri yineleyin: | 30 döngüleri yineleyin: |
| 95 ° C-30 s | 95 ° C-30 s |
| 30 ° C-1 dk | 54 ° C-30 s |
| 72 ° C-1 dk | 72 ° C – 1,5 dk |
| 30 döngüleri yineleyin: | 72 ° C-10 dk |
| 95 ° C-30 s | 4 ° C – tutun |
| 45 ° C-30 s | |
| 72 ° C-1 dk | |
| 72 ° C-10 dk | |
| 4° C – tutun |
Tablo 3: rasgele PCR için kullanılan PCR reaksiyon kurulum ve thermocycler koşulları. Rasgele PCR reaksiyonları sırasıyla gerçekleştirilir ve parçaları PCR1 reaksiyonu sırasında oluşturulan şablonu PCR2 tepki olarak kullanılır. Belirli thermocycler ayarları reaksiyonlar her kümesi için kullanılır.
| Astar adı | Astar sıra |
| MAR2xT7 Transposon özgü astar | |
| PMFLGM. GB-3a | TACAGTTTACGAACCGAACAGGC |
| PMFLGM. GB-2a | TGTCAACTGGGTTCGTGCCTTCATCCG |
| MAR2xT7 Transposon sıralama astar | |
| PMFLGM. GB-4a | GACCGAGATAGGGTTGAGTG |
| TNphoA Transposon özgü astar | |
| Tn5Ext | GAACGTTACCATGTTAGGAGGTC |
| Tn5Int2 | GGAGGTCACATGGAAGTCAGATCCTGG |
| TNphoA Transposon sıralama astar | |
| Tn5Int | CGGGAAAGGTTCCGTTCAGGACGC |
| Rasgele astar | |
| ARB1D | GGCCAGGCCTGCAGATGATGNNNNNNNNNNGTAT |
| ARB2A | GGCCAGGCCTGCAGATGATG |
Tablo 4: Kalite denetiminde kullanılan astar listesi Deneyler. Kullanılan astar PCR güçlendirme ve sıralamanın mutant kimliğini onaylamak için transposon ekleme mutantların için.
Sonuçlar
On iki yeni kopyalarını PA14NR ayarla ben ve üretilen yeni kopya bir kalite kontrol değerlendirme protokolü III kullanılarak gerçekleştirilmiştir protokolünü kullanarak çoğaltılmış.
PA14NR mutant plaka ile birlikte kontrol levha, vahşi türü PA14 oluşur aşılamaya ve hazır ayar deseni (şekil 4A) ara wells az, çoğaltılmış ayarla methology Protokolü ı. denetiminde açıkla...
Tartışmalar
P. aeruginosa PA14NR ayarla bilimsel topluluk için değerli bir kaynaktır. Göre Şubat 2017 dataset Clarivate Analytics'in temel bilim göstergeler veritabanından, Liberati vd. (2006) PA14NR ayarla inşaatı açıklayan, 37, Mikrobiyoloji yayınlar üst % 1 sınıflanır. Google Akademik Liberati vd. , 600'den fazla alıntıları raporları aynı derecede-in Ağustos 2017 orijinal el yazması (2006). Kütüphanede P. aeruginosa patogenezinde temel m...
Açıklamalar
Yazarlar hiçbir maddi çıkar çatışmaları rapor. Eliana Drenkard ve Frederick Ausubel oluşturulmasında PA14 nonredundant transposon mutant Kütüphane katıldı. Bryan Hurley ve Lael Yonker şu anda ev ve mutant Kütüphane Massachusetts General Hastanesi Pediatri bölümü bir parçası olarak dağıtın.
Teşekkürler
Veritabanı arama Lisa Philpotts MGH Treadwell sanal kütüphane onun rehberlik için teşekkür etmek istiyorum. Bu eser Kistik Fibrozis Vakfı (YONKER16G0 ve HURLEY16G0) ve NIH NIAID tarafından desteklenmiştir (BPH ve ADE: R01 A1095338).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials for Library Replication | |||
| Sterile 96-well Tissue-culture treated, case of 50 | Corning Life Sciences | 353072 | via Fisher Scientific |
| Sterile 96 Well Clear V-Bottom 2000μL Deep Well Plates, case of 25 | Corning Life Sciences | 3960 | via Fisher Scientific |
| Nunc OmniTray (rectangular plates), case of 60 | Thermo Scientific Rochester | 242811 | via Fisher Scientific |
| Rectangular Ice Pan, Midi (4L) | Corning Life Sciences | 432104 | via Fisher Scientific |
| Secure-Gard Cone Mask, case of 300 | Cardinal Health | AT7509 | via Fisher Scientific |
| AluminaSeal, pack of 100 | Diversified Biotech | ALUM-100 | via Fisher Scientific |
| Breathe-Easy membrane, pack of 100 | Diversified Biotech | BEM-1 | via Sigma-Aldrich |
| Sterile, individually wrapped, 50mL Solution Trough/Reagent Reservoir, case of 100 | Sorenson | S50100 | via Westnet Incorporated |
| Plate roller | VWR | 60941-118 | via VWR |
| Cryo Laser Labels - CRYOLAZRTAG 2.64" x 0.277", pack of 16 sheets | GA International | RCL-11T1-WH | via Labtag.com (template for printing also available from Labtag.com) |
| 96-well replicator | V & P Scientific, Inc. | Custom 407C, 3.18mm pin diameter, 57mm long | via V & P Scientific, Inc. |
| Multitron Pro, 3mm Shaking incubator | Infors HT | l10003P | via Infors HT |
| Picus 12 Channel 50-1200μL Electronic Pipette | Sartorius | 735491PR | via Sartorius |
| Filter Tips 50-1200μL, pack of 960 | Biohit | 14-559-512 | via Fisher Scientific; use electronic multichannel-compatible tips |
| Dry Ice | User-specific vendor | ||
| Materials for Individual Mutant Storage | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Materials for Quality Control PCR | |||
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| NanoDrop | Thermo Scientific | ND-2000 | via ThermoFisher |
| PCR Thermocycler | |||
| Omnistrips PCR Tubes with domed lids | Thermo Scientific | AB0404 | via Fisher Scientific |
| ART Barrier low-retention pipette tips (10 uL, 100 uL, 1000 uL) | Molecular BioProducts, Inc. | Z676543 (10 uL), Z676713 (100 uL), Z676802 (1000 uL) | via Sigma-Aldrich |
| Pipettes (P1000, P200, P20, P2) | Gilson | F167370 | via Gilson |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-130 | via Fisher Scientific |
| MasterPure DNA Purification Kit | Epicentre | MCD85201 | via Epicentre Technologies Corp |
| GeneRuler 1 kb Plus DNA Ladder, ready-to-use | Thermo Scientific | SM1333 | via ThermoFisher |
| RediLoad Loading Buffer | Invitrogen | 750026 | via ThermoFisher |
| Chemicals | |||
| Chemicals for Library and Individual Mutant Storage | |||
| Glycerol MB Grade, 1L | Sigma Aldrich | G5516 | via Sigma-Aldrich |
| LB Broth | Per 1L dH2O: 10g tryptone, 5g yeast extract, 5g NaCl, 1ml 1N NaOH (Current Protocols in Molecular Biology. Wiley, 1994.) | ||
| Tryptone | Sigma Aldrich | T7293 | via Sigma-Aldrich |
| Yeast Extract | Sigma Aldrich | Y1625 | via Sigma-Aldrich |
| Sodium Chloride | Sigma Aldrich | S7653 | via Sigma-Aldrich |
| Sodium Hydroxide | Sigma Aldrich | S8045 | via Sigma-Aldrich |
| LB agar | See preparation above, add 15g Bacto Agar | ||
| Bacto Agar | Sigma Aldrich | A5306 | via Sigma-Aldrich |
| Gentamicin sulfate, 10g | BioReagent | 1405-41-0 | via Sigma-Aldrich |
| Kanamycin sulfate | Gibco | 11815024 | via ThermoFisher |
| Ethanol, 190 proof | Decon | 04-355-221 | via Fisher Scientific |
| Chemicals for Quality Control PCR | |||
| Primers | User-preferred vendor | See primers listed in Table 3 | |
| Corning cellgro Molecular Biology Grade Water | Corning | 46000CV | via Fisher Scientific |
| Taq Polymerase Buffer | Invitrogen | 10342020 | via ThermoFisher |
| Taq DNA Polymerase, recombinant | Invitrogen | 10342020 | via ThermoFisher |
| dNTPs | Invitrogen | 10297018 | via ThermoFisher |
| Agarose | Sigma | A9539 | via Sigma-Aldrich |
Referanslar
- Moradali, M. F., Ghods, S., Rehm, B. H. Pseudomonas aeruginosa lifestyle: A paradigm for adaptation, survival, and persistence. Front Cell Infect Microbiol. 7, 39 (2017).
- Bleves, S., et al. Protein secretion systems in Pseudomonas aeruginosa: A wealth of pathogenic weapons. Int J Med Microbiol. 300 (8), 534-543 (2010).
- Breidenstein, E. B., de la Fuente-Nunez, C., Hancock, R. E. Pseudomonas aeruginosa: all roads lead to resistance. Trends Microbiol. 19 (8), 419-426 (2011).
- Flynn, K. M., et al. Evolution of ecological diversity in biofilms of Pseudomonas aeruginosa by altered cyclic diguanylate signaling. J Bacteriol. 198 (19), 2608-2618 (2016).
- Hazan, R., Maura, D., Que, Y. A., Rahme, L. G. Assessing Pseudomonas aeruginosa persister/antibiotic tolerant cells. Methods Mol Biol. 1149, 699-707 (2014).
- Klockgether, J., et al. Genome diversity of Pseudomonas aeruginosa PAO1 laboratory strains. J Bacteriol. 192 (4), 1113-1121 (2010).
- Mathee, K., et al. Dynamics of Pseudomonas aeruginosa genome evolution. Proc Natl Acad Sci U S A. 105 (8), 3100-3105 (2008).
- Taylor, P. K., Yeung, A. T., Hancock, R. E. Antibiotic resistance in Pseudomonas aeruginosa biofilms: towards the development of novel anti-biofilm therapies. J Biotechnol. 191, 121-130 (2014).
- Flume, P. A., Van Devanter, D. R. State of progress in treating cystic fibrosis respiratory disease. BMC Med. 10, 88 (2012).
- . Cystic Fibrosis Foundation Patient Registry 2015 Annual Data Report Available from: https://www.cff.org/Our-Research/CF-Patient-Registry/2015-Patient-Registry-Annual-Data-Report.pdf (2016)
- Church, D., Elsayed, S., Reid, O., Winston, B., Lindsay, R. Burn wound infections. Clin Microbiol Rev. 19 (2), 403-434 (2006).
- Sadikot, R. T., Blackwell, T. S., Christman, J., Prince, A. Pathogen-host interactions in Pseudomonas aeruginosa pneumonia. Am J Respir Crit Care Med. 171 (11), 1209-1223 (2005).
- Song, Z., et al. Prosthesis infections after orthopedic joint replacement: the possible role of bacterial biofilms. Orthop Rev (Pavia). 5 (2), 65-71 (2013).
- National Nosocomial Infections Surveillance, S. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 32 (8), 470-485 (2004).
- Cohen, T. S., Parker, D., Prince, A. . Pseudomonas aeruginosa Host Immune Evasion. 7, 3-23 (2014).
- Fernandes, A., Dias, M. The microbiological profiles of infected prosthetic implants with an emphasis on the organisms which form biofilms. J Clin Diagn Res. 7 (2), 219-223 (2013).
- Khosravi, A. D., Ahmadi, F., Salmanzadeh, S., Dashtbozorg, A., Montazeri, E. A. Study of Bacteria Isolated from Orthopedic Implant Infections and their Antimicrobial Susceptibility Pattern. Res J of Microbiol. 4 (4), 6 (2009).
- Roemhild, R., Barbosa, C., Beardmore, R. E., Jansen, G., Schulenburg, H. Temporal variation in antibiotic environments slows down resistance evolution in pathogenic Pseudomonas aeruginosa. Evol Appl. 8 (10), 945-955 (2015).
- Fischer, S., et al. Intraclonal genome diversity of the major Pseudomonas aeruginosa clones C and PA14. Environ Microbiol Rep. 8 (2), 227-234 (2016).
- Wiehlmann, L., et al. Population structure of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 104 (19), 8101-8106 (2007).
- Lam, J. S., Taylor, V. L., Islam, S. T., Hao, Y., Kocincova, D. Genetic and functional diversity of Pseudomonas aeruginosa lipopolysaccharide. Front Microbiol. 2, 118 (2011).
- Choi, J. Y., et al. Identification of virulence genes in a pathogenic strain of Pseudomonas aeruginosa by representational difference analysis. J Bacteriol. 184 (4), 952-961 (2002).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proc Natl Acad Sci U S A. 101 (8), 2530-2535 (2004).
- Mikkelsen, H., McMullan, R., Filloux, A. The Pseudomonas aeruginosa reference strain PA14 displays increased virulence due to a mutation in ladS. PLoS One. 6 (12), e29113 (2011).
- Drenkard, E., Ausubel, F. M. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 416 (6882), 740-743 (2002).
- Rahme, L. G., et al. Common virulence factors for bacterial pathogenicity in plants and animals. Science. 268 (5219), 1899-1902 (1995).
- Rahme, L. G., et al. Use of model plant hosts to identify Pseudomonas aeruginosa virulence factors. Proc Natl Acad Sci U S A. 94 (24), 13245-13250 (1997).
- Kirienko, N. V., Cezairliyan, B. O., Ausubel, F. M., Powell, J. R. Pseudomonas aeruginosa PA14 pathogenesis in Caenorhabditis elegans. Methods Mol Biol. 1149, 653-669 (2014).
- Mahajan-Miklos, S., Tan, M. W., Rahme, L. G., Ausubel, F. M. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model. Cell. 96 (1), 47-56 (1999).
- Limmer, S., et al. Pseudomonas aeruginosa RhlR is required to neutralize the cellular immune response in a Drosophila melanogaster oral infection model. Proc Natl Acad Sci U S A. 108 (42), 17378-17383 (2011).
- Miyata, S., Casey, M., Frank, D. W., Ausubel, F. M., Drenkard, E. Use of the Galleria mellonella caterpillar as a model host to study the role of the type III secretion system in Pseudomonas aeruginosa pathogenesis. Infect Immun. 71 (5), 2404-2413 (2003).
- Coleman, F. T., et al. Hypersusceptibility of cystic fibrosis mice to chronic Pseudomonas aeruginosa oropharyngeal colonization and lung infection. Proc Natl Acad Sci U S A. 100 (4), 1949-1954 (2003).
- Pazos, M. A., et al. Pseudomonas aeruginosa ExoU augments neutrophil transepithelial migration. PLoS Pathog. 13 (8), e1006548 (2017).
- Maura, D., Hazan, R., Kitao, T., Ballok, A. E., Rahme, L. G. Evidence for direct control of virulence and defense gene circuits by the Pseudomonas aeruginosa quorum sensing regulator, MvfR. Sci Rep. 6, 34083 (2016).
- Jacobs, M. A., et al. Comprehensive transposon mutant library of Pseudomonas aeruginosa. Proc Natl Acad Sci U S A. 100 (24), 14339-14344 (2003).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomonas aeruginosa PAO1. J Bacteriol. 194 (23), 6387-6389 (2012).
- Liberati, N. T., et al. An ordered, nonredundant library of Pseudomonas aeruginosa strain PA14 transposon insertion mutants. Proc Natl Acad Sci U S A. 103 (8), 2833-2838 (2006).
- Feinbaum, R. L., et al. Genome-wide identification of Pseudomonas aeruginosa virulence-related genes using a Caenorhabditis elegans infection model. PLoS Pathog. 8 (7), e1002813 (2012).
- Stewart, L., et al. Draft genomes of 12 host-adapted and environmental isolates of Pseudomonas aeruginosa and their positions in the core genome phylogeny. Pathog Dis. 71 (1), 20-25 (2014).
- Thrane, S. W., et al. The widespread multidrug-resistant serotype O12 Pseudomonas aeruginosa clone emerged through concomitant horizontal transfer of serotype antigen and antibiotic resistance gene clusters. MBio. 6 (5), e01396-e01315 (2015).
- van Belkum, A., et al. Phylogenetic Distribution of CRISPR-Cas Systems in Antibiotic-Resistant Pseudomonas aeruginosa. MBio. 6 (6), e01796-e01715 (2015).
- Lewenza, S., et al. Construction of a mini-Tn5-luxCDABE mutant library in Pseudomonas aeruginosa PAO1: a tool for identifying differentially regulated genes. Genome Res. 15 (4), 583-589 (2005).
- . . Current Protocols in Molecular Biology. , (1994).
- Breidenstein, E. B., Khaira, B. K., Wiegand, I., Overhage, J., Hancock, R. E. Complex ciprofloxacin resistome revealed by screening a Pseudomonas aeruginosa mutant library for altered susceptibility. Antimicrob Agents Chemother. 52 (12), 4486-4491 (2008).
- Musken, M., Di Fiore, S., Dotsch, A., Fischer, R., Haussler, S. Genetic determinants of Pseudomonas aeruginosa biofilm establishment. Microbiology. 156 (Pt 2), 431-441 (2010).
- Schurek, K. N., et al. Novel genetic determinants of low-level aminoglycoside resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 52 (12), 4213-4219 (2008).
- Oumeraci, T., et al. Comprehensive MALDI-TOF biotyping of the non-redundant Harvard Pseudomonas aeruginosa PA14 transposon insertion mutant library. PLoS One. 10 (2), e0117144 (2015).
- Yeung, A. T., et al. Swarming of Pseudomonas aeruginosa is controlled by a broad spectrum of transcriptional regulators, including MetR. J Bacteriol. 191 (18), 5592-5602 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır