Method Article
Fare Makrofaj Kemotaksisinin Hızlandırılmış Görüntülemesi
Bu Makalede
Özet
Burada, kemotaktik kompleman C5a gradientinde fare yerleşik periton makrofajlarını görüntülemek için zaman atlamalı, faz-kontrast mikroskobu kullanan yöntemleri açıklıyoruz. Protokoller diğer bağışıklık hücrelerine genişletilebilir.
Özet
Kemotaksis bir kimyasal gradyan boyunca hücrelerin reseptör aracılı rehberlik, kemokizi ise bir kimyasal tarafından rasgele hücre hareketliliği uyarılmasıdır. Kemokinez ve kemotaksi, bağışıklık hücrelerinin mobilizasyonu ve dağıtımı için temel dir. Örneğin, chemokines (kemotaktik sitokinler) hızla inflamasyon ekstravasküler sitelere dolaşan nötrofiller ve monositler işe olabilir. Kemoattractant reseptörleri G protein-çiftli reseptörleri büyük bir aileye aittir. G proteini ile birleşen reseptör sinyali ile kemoattractant (yani, ligand) gradyanlarının hücre göçünü nasıl doğrudan olduğu henüz tam olarak anlaşılamamıştır. İmmünoloji alanında, nötrofiller in vitro kemotaksis eğitimi için popüler model hücrelerdir. Burada, geleneksel olarak incelenmesi daha zor olan fare yerleşik makrofajlar için uyarlanmış gerçek zamanlı iki boyutlu (2D) kemotaksis bir dosdoğru tarif ediyoruz. Makrofajlar 2B yüzeyde ~1 μm/dk yavaş bir hızda hareket eder ve daha az iyi bir şekilde nokta kaynaklı göç tahlilleri için uygundur (örneğin, kemoattractant dolu bir mikropipetucu ucuna doğru göç) nötrofiller veya Dictyostelium discoideumdaha , hangi daha hızlı bir büyüklük sırası hareket. Yaygın olarak kullanılan Transwell tahlilleri farklı maddelerin kemotaktik aktivitesini incelemek için yararlıdır, ancak hücre morfolojisi, hız veya kemotaktik navigasyon hakkında bilgi sağlamaz. Burada, hücre hızı nın ve kemotaktik verimliliğin ölçülmesine olanak tanıyan ve kemotaksisin transdüserlerini, sinyal yollarını ve etkilerini tanımlayan bir zaman atlamalı mikroskopesi bazlı makrofaj kemotaksis testini tanımlıyoruz.
Giriş
Bağışıklık hücreleri genellikle bir amipoid moda 2D yüzeyüzerinde tek başına göç1,2, ön çıkıntı tekrarlanan döngüleri içerir, integrin aracılı hücre adezyonu, ve arka geri çekilme. Ön koşul adımı hücre polarizasyonudur, hangi hücrelerin ön ve arka3biter oluşturur. Kemotaksis G protein-coupled reseptörleri ve membran demirlemiş heterotrimerik G proteinleri ve küçük monomerik G proteinleri aracılık karmaşık bir sinyal ağı tarafından kemoattractants tespiti ile başlar, yanı sıra fosfolipid bağlı guanin nükleotid değişim faktörleri (GEFs)4,5. Cdc42 ve Rac alt ailelerin Rho GTPases aktivasyonu ön çıkıntılar neden6 ve Rho alt familyası üyeleri, özellikle RhoA, arka daralma etkinleştirmek5,7. Üç boyutlu (3D) bir ortamda, integrinler lökosit göçü için büyük ölçüde gereksiz dir ve RhoA dargeçitler8 ile hücreleri sıkma için daha önemli hale gelir , cdc42 ise- veya Rac indüklenen Arp2/3 aktivasyon kemotaktik direksiyon için önemli olmaya devam ediyor9,10.
Bağışıklık hücreleri doku yaralanması, patojen invazyonu ve inflamasyon ortamlarında, özellikle farklı kemoattractants karşı karşıya olabilir. Fagositler kompleman C3a ve C5a ifade endojen kemoattractants, hızla kompleman kaskad aktivasyonu tarafından oluşturulur, ve kompleman C3a ve C5a reseptörleri tarafından tanınan. Benzer şekilde, nekrotik hücreler formyl peptid reseptörleri aracılığıyla fagositler işe, hangi mitokondri türetilmiş yanı sıra bakteri kaynaklı formyl peptidler tanımak11. Bağışıklık hücreleri de keokinler için G protein-çift reseptörleri ifade, kemoattractant peptidler büyük bir aile hem homeostaz isi hem de inflamasyon sırasında bağışıklık hücre ticaretinin düzenlenmesinde yer. Kemokinler ilk iki sistein (C) kalıntısının aralığına bağlı olarak dört gruba ayrılır: C, CC, CXC ve CX3C sitokinler, X'in bir amino asit olduğu yer. Bu nedenle, in vivo bağışıklık hücreleri uygun son derece karmaşık mekansal ve zamansal sinyallere yanıt gerekir, kemotaksis çalışma yıldırıcı bir görev yapma. Aşağıda intravital görüntüleme yaklaşımları ile başlayan kemotaksinin kısa bir öyküsü üb.a.r.'dır.
Lökosit kemotaksis çalışma geri uzanır 188812, oftalmolog Theodor Karl Gustav Leber açıkça lökositlerin yönlendirilmiş göç açıklanan zaman, ve birikimi, mikotik bir model inflamasyon siteleri (mantar) keratit. Leber patojen kaynaklı maddeler tarafından aşırı lökosit cazibe fagositoz yoluyla zararlı mikroorganizmaların ortadan kaldırılması için önemli olduğunu vurguladı, hangi Metchnikoff tarafından tarif edilmişti (ayrıca Metschnikoff olarak da bilinir) aynı on yıl içinde13. In vivo deneyler de 1920'lerde Clark ve Clark tarafından yapıldı14 ,15, kim kurbağa yavrularının şeffaflık yararlandı ve croton yağı tarafından indüklenen steril inflamasyon gösterdi1414 veya diğer tahriş edici15 lökositler kan damarlarına uymak için lökositler neden, diyapedezis takip (transendothelial göç) ve tahriş doğru doku boşlukları ile hızlı göç. Jean Comandon16 tarafından geliştirilen mikrosinematografi yöntemini kullanarak yapılan in vitro deneyler, lökositlerin bakteri17gibi partikül selakaralı kemoattractant kaynağına doğru göç ettiğini göstermiştir. O zamanlar kemotaktik faktörlerin moleküler kimlikleri bilinmiyordu. 1960'larda Stephen Boyden18 çözünür maddelerin kemotaktik aktivitesini inceleme tekniklerinin eksik olduğunu fark etti. Daha sonra Boyden odası olarak bilinen ve filtre kağıdı zarı ile ayrılmış iki bölmeli bir oda tasarladı. Üst bölmeye bir hücre süspansiyonu eklenir ve test maddesi her iki bölmeye veya sadece alt bölmeye eklenir. Kuluçka döneminden sonra filtre zarı çıkarılır ve hücreler sabitlenir ve lekelenir. Filtre zarına, her iki bölmedeki test maddesi ile alt kuyuya doğru kaç hücrenin göç ettiği karşılaştırılarak, ne bölmede, ne de sadece alt bölmede kemotaktik aktivite belirlenebilir. Transwell tahlilleri bugün hala popüler ve tanımlanmış gözenek boyutları ve yoğunlukları19,,20ile farklı polikarbonat membranlar kullanımı da dahil olmak üzere çeşitli şekillerde modifiye edilmiştir. Transwell tahlillerinin önemli bir dezavantajı, göç eden hücreleri doğrudan görselleştirmenin pratik olmadığı ve zardaki göç yolunun genellikle bir bağışıklık hücresinin çapını aşmamasıdır.
Sally H. Zigmond floresan boyalar kullanarak hem gradyan oluşumu ve hücre morfolojisi görselleştirme sağlayan bir chemotaxis odası21 geliştirdi. Oda, her biri ~100 μL hacimli, kaydıraktan üst düzlemin 3-10 m altında 1 mm genişliğinde köprü ile ayrılmış iki paralel doğrusal kuyuya sahip pleksiglas (akrilik) bir slayttan oluşur. Hücrelerle tohumlanmış bir kapak kayması ters çevrilmiş ve iki kuyuya yayılacak şekilde slaytüzerine yerleştirilir. Kuyulardan birine bir kemoattractant ilave edildikten sonra, genellikle 30-90 dakika içinde köprü boyunca dik bir kemoattractant gradyan formları, zigmond odasında insan polimorfonükleer lökositler (granülositler) kemoattractant doğru kendilerini yönlendirme gözlenir. Dunn22 ve Insall23 odaları da dahil olmak üzere Zigmond odasının varyasyonları bildirilmiştir ve bunların her ikisi de 1 mm genişliğindebir köprü ile ayrılmış iki kuyuya yerleştirilen hücrelerle tohumlanmış bir kapak kayması kullanmıştır. Dunn odası dairesel bir köprü ile ayrılmış konsantrik kuyulardan oluşur, Insall odası ise Zigmond odası ile daha yakından ilişkilidir, ancak 0,5 mm ve 1 mm olmak üzere iki farklı genişlikte köprüler sağlar. Yeni bir kemotaksis odası, μ-Slayt chemotaxis olarak adlandırılır ve plastik enjeksiyon kalıplama tarafından üretilen, Zemgel ve ark.24tarafından tanımlanmıştır. Kemotaksis haznesi, 2 mm uzunluğunda ve 70 μm yüksekliğinde 1 mm genişliğinde bir kanalla ayrılmış iki adet 40 μL rezervuardan oluşur. Haznenin alt kısmı, 1,5 no'lu cam kapaklı24'ünaynı kalınlıkta ve optik özelliklerine sahip, geçirilmeen, ince plastik bir levhadan oluşur. Burada bir kemotakis tetkikini, fare yerleşik periton makrofajlarının bir kemotaktik (kompleman C5a) gradyanda 14 saate kadar geçişini görselleştirmek için μ-Slide Chemotaxis odasını kullanarak tanımlıyoruz.
Protokol
Protokoller, yerel araştırma etik komitemizin ve hayvan bakım yönergelerinin yönergelerine uygundur.
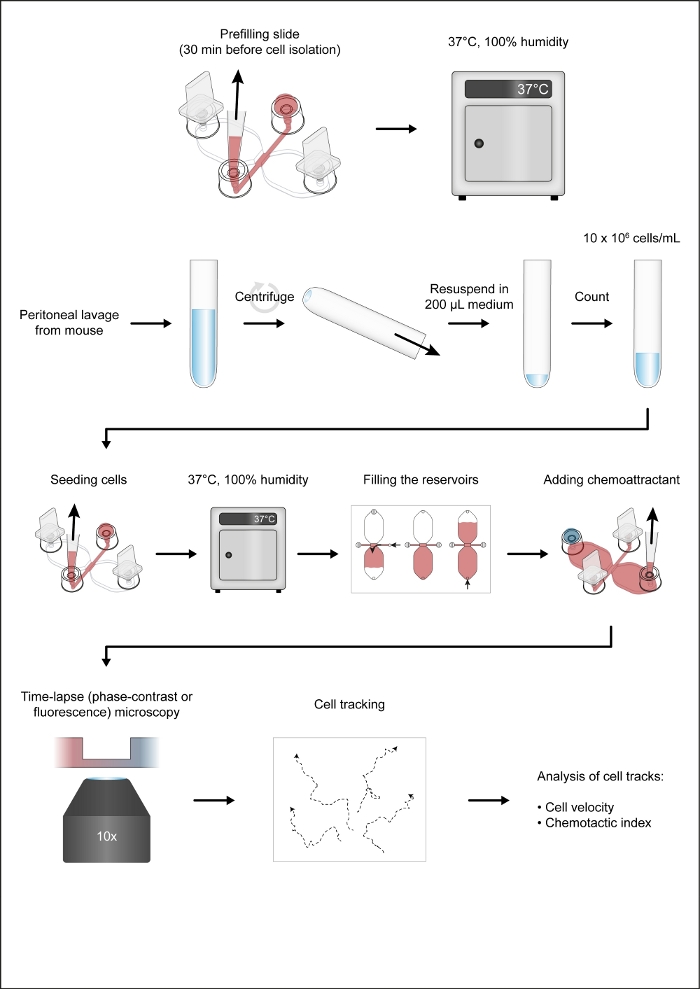
NOT: Şekil 1 kemotaksis tamtisi iş akışını gösterir.
1. Prefilling Chemotaxis Slaytlar
-
Modifiye RPMI 1640 HEPES ortamı kullanılarak bir veya iki kemotaksis kaydıraktan oluşan 1 mm genişliğinde ve 2 mm uzunluğundaki bağlantı kanallarını önceden doldurun, 20 mM 4-(2-hidroksitil)-1-piperazineeesulfon içeren bikarbonatsız RPMI 1640 orta 100x penisilin/streptomisin seyreltilmesiyle hazırlanan penisilin (100 U/mL) ve streptomisin (100 g/mL) gibi antibiyotikler %10 ısı yalıtımlı fetal sığır serumu (FBS) ve antibiyotikler, ve 1 μg/mL lipopolisakkarit (E. coli'den),ve Toll benzeri reseptör 4 ligand hücreleri etkinleştirmek için.
- Her ikisi de önceden 37 °C'ye ısıtılmış yuvarlak (10 cm çapında) bir hücre kültür kabına bir kemotaksis slaytı(Şekil 2A)yerleştirin ve kabı ısıtmalı (37 °C) alüminyum bir blok üzerine yerleştirin. 1 ve 4 bağlantı noktalarına fişleri takın(Şekil 2B).
NOT: 37 °C'de muhafaza edilen ve laminar akış kaputunun içine yerleştirilen alüminyum blok, kemotaksis odalarının hazırlanmasında yararlıdır. İdeal olarak, ısıtmalı blok 50 mL tüpler ve 2 mL mikrosantrifüj tüpler gibi çeşitli tüpler için düz bir çalışma alanı ve kuyu sağlamalıdır. - 10-200 μL'lik bir pipet ucu ile beveled uçlu bir pipet ucu kullanarak, 15 μL'lik modifiye RPMI 1640 HEPES ortamını dolum portu 3'e(Şekil 2B)yatırın. Daha sonra, hacim hala 15 μL olarak ayarlanmış ve (2-20°L hacim) pipetin kontrol düğmesi depresif, pipet ucunu port 2'ye takın ve 15°L'yi orta derecede hızlı bir hızda aspire edin(Şekil 2B). Bu, 1 mm x 2 mm bağlantı kanalının (gözlem alanı) yanı sıra iki yan besleme kanalının (sırasıyla merkezi gözlem alanı ile 2 ve 3 bağlantı noktaları arasında) önceden doldurulacaktır. Kapak lı 2 ve 3 bağlantı noktalarını kapaklarla kaplayın.
- Ön doldurduktan sonra, chemotaksis slaytlarını 37 °C'de kuru ve CO2-serbest kuluçka makinesi içinde kapalı nem odasında tutulan bir rafın üzerine yerleştirin.
NOT: Kemotaksis slaytını doldurmak için doğru pipet ucunu kullanmak önemlidir. Bir yontma pipet ucu dolum portunun üst içine sıkıştırır, yaygın olarak kullanılan sivri pipet uçları dolum portuna daha derinden yerleştirilmesi ve sıvı akışına karşı direnci büyük ölçüde artırabilir.
- Her ikisi de önceden 37 °C'ye ısıtılmış yuvarlak (10 cm çapında) bir hücre kültür kabına bir kemotaksis slaytı(Şekil 2A)yerleştirin ve kabı ısıtmalı (37 °C) alüminyum bir blok üzerine yerleştirin. 1 ve 4 bağlantı noktalarına fişleri takın(Şekil 2B).
2. Fare Yerleşik Periton Makrofajlarının İzolasyon
- Uçucu anestezik isofluran (>5% hava) veya karbondioksit25yüksek konsantrasyonkullanarak 3-4 aylık bir fare kurban , servikal çıkığı takip. Kemirgenlerde sağ refleks kaybı insanlarda bilinç kaybı ile ilişkilidir26. Farenin karnını suda %80 etanol ile temizleyin ve daha sonra künt uçlu cerrahi makas kullanarak 1-2 cm orta hat deri kesisini yapın. Altta yatan karın duvarını ortaya çıkarmak için deri geri peel.
- Periton boşluğuna 24 G plastik kateter yerleştirin. 5 mL plastik şırınga kullanarak, Ka2+ ve Mg2+olmadan 2 x 4,5 mL buz gibi Hank'in tamponlu tuz çözeltisini (HBSS) kullanarak boşluğu lavajlayın. Şırıngada yaklaşık 0,5 mL kalan HBSS bırakın, böylece kateterin ucuna yanlışlıkla emilen doku dışarı atılabilir.
- Lavaged orta transfer, genellikle 8-8.5 mL toplam, bir 14 mL polipropilen yuvarlak alt tüp içine. Oda sıcaklığında 6,5 dakika boyunca 300 x g'de tüpü santrifüj edin.
NOT: Yuvarlak alt tüp supernatant tamamen decanted sağlar ve hücre kümelenme azaltır. - Modifiye RPMI 1640 HEPES orta 200 μL içinde supernatant atın ve periton hücreleri (genellikle ~ 4 x 106 hücre fare başına) askıya alın. Hücre süspansiyonu 1:20'nin bir örneğini seyreltin ve hücreleri saymak için Neubauer'in geliştirilmiş sayma odası gibi bir sayma cihazı kullanın. Daha sonra, hücre süspansiyonunu 10 x 106 hücre/mL'lik son konsantrasyona seyreltin ve hücreleri 37 °C'de 2 mL polipropilen mikrosantrifüj tüpünde ısıtmalı alüminyum blok kullanarak koruyun (bkz. adım 1.1.1'deki NOT).
3. Periton Hücrelerinin Kemotaksiz Slaytlarına Tohumlanması
- Hücre süspansiyonu, kümelenmeyi azaltmak için 100 μL (veya süspansiyon hacminin yarısı) olarak ayarlanmış pipet hacmiyle 5 kat yukarı ve aşağı boruhaline geldikten sonra, hücre süspansiyonunun 10 μL'sini bir chemotaxis odasının3. Pipet ucunu bağlantı noktası 2'ye yerleştirin ve hücre süspansiyonuna yavaşça bağlantı kanalına çekin(Şekil 2C). Hücre süspansiyonu kullanıma sunulduğu anda, hücre süspansiyonunun akışını niçin durduracağınız 1 ve 4 portlarında fişleri çıkarın. Dört dolum portuna da kapak yerleştirin.
- Tüm kemotaksis odaları için adım 3.1'i tekrarlayın. Küçük bir ters mikroskop ve 10x faz kontrastlı objektif lens kullanarak, istenmeyen hava kabarcıkları için chemotaxis slaytlar inceleyin.
- Periton hücreleri ile tohumlanmış kemotaksis slaytlarını 37 °C'de bir nem odasına 2-3 saat süreyle yerleştirin.
4. Rezervuarların Doldurulması ve Kemoattractant Eklenmesi
- Ters bir mikroskop kullanarak gözlem alanını (iki 40°L rezervuarı birbirine bağlayan kanal) inceleyin.
NOT: Bu aşamada hücre yoğunluğu rezervuarları doldurduktan sonra daha yüksek olacaktır, çünkü ağırlıklı olarak CD19+ hücreler (B1 hücreleri) ağırlıklı olarak yapışık hücreler, dolum işlemi sırasında gözlem alanından yıkanacaktır(Şekil 2C–E). - Fişleri dolum portları 1 ve 2'ye yerleştirin(Şekil 2D). Dolum portu 3'ün orta ve hava kabarcıkları ile üst lere doldurulduğundan emin olun. Gerekirse istenmeyen hava kabarcıklarını çıkarmak için steril 27 G şırınga iğnesi kullanın.
- 10-100°L hacimli mekanik pipet kullanarak, modifiye RPMI 1640 HEPES ortamının ~60 μL'sini aspire edin ve pipet ucunu dolum portu 3'e yerleştirin. Pipetin hacim ayar halkasını kullanarak haznenin hacim ayar halkasını kullanarak rezervuara orta yı yavaşça ve sürekli olarak enjekte edinki ortam, 1-2 dakika dan sonra dolum portu 4'ün tepesine ulaşır(Şekil 2D).
- İkinci rezervuarı doldurun. Fişi bağlantı noktası 1'den hareket ettirin ve yavaşça bağlantı noktasına takın 3(Şekil 2D). Daha sonra, modifiye RPMI 1640 HEPES orta ~50 μL aspire ve dolum portu 4 içine pipet ucu yerleştirin. 10-100°L hacimli pipetin hacim ayar halkasını kullanarak orta nın ikinci haznesine yavaş ve istikrarlı bir şekilde enjekte etmesini n 1-2 dakika sonra dolum portu 1'in en üstüne ulaşır(Şekil 2D).
- 495 μL modifiye RPMI 1640 HEPES ortamını 2 mL mikrosantrifüj tüpe yerleştirin ve konsantrasyon gradyanı oluşumunun görsel bir göstergesi olarak kullanılan mavi boya olan 5 μL Patent Blue V (stok çözeltisi: fosfat tamponlu salinde [PBS], mavi bir boya 5 μL ekleyin. Kısa girdap ile karıştırın. 5.4 μL rekombinant fare kompleman C5a ekleyin (stok çözeltisi: PBS'de %0,1 büyükbaş serum albumini ile 50 μg/mL) ve kısa girdap ile karıştırın.
- 15 μL mavi, kompleman C5a içeren orta dolum portu içine 1(Şekil 3A),liman üst sığ depresyon orta ücretsiz olduğundan emin olduktan sonra (aksi takdirde damla dökülme olabilir).
- Dolum portu 4'e 10-200°L l lik bir pipet ucu yerleştirin ve mavinin damlasını çekmek için 10-100°L hacimli pipetin hacim ayar halkasını yavaşça ve sürekli olarak döndürün, c5a içeren ortamı ters rezervuara tamamlayın(Şekil 3B). Hava dolum portu 1 kısa dikey sütun girmeye başlayacaktır. Sıvı-hava arabirimi dikey sütunun ortasında olana kadar hava çekin ve ardından yavaşça bağlantı noktasına bir fiş takın.
- Slaydın yerinde sabit kalmasını sağlamak için diğer elinizi kullanarak pipeti bağlantı noktası 4'ten yavaşça kaldırın. Son olarak, yavaşça bağlantı noktası 4(Şekil 3B)takın.
- Ters bir mikroskopüzerinde kemotaksis slaytı inceleyin.
NOT: Gözlem alanında kalan yapışık hücreler ağırlıklı olarak makrofajolmalıdır. Bu floresan etiketli anti-F4/80 antikorları kullanılarak teyit edilebilir (F4/80 fare makrofajlar için özel bir belirteçtir). B hücreleri floresan etiketli anti-CD19 antikorları ve F4/80-/CD19- hücreler mavi floresan nükleik asit lekesi kullanılarak tespit edilebilir(Şekil 4).
5. Zaman atlamalı Görüntüleme Makrofaj Göçü, Faz-kontrast Mikroskobu
- Bir sahne kuluçka makinesi ile donatılmış bir ters mikroskop sahnesine bir kemotaksis slayt yerleştirin. Sıcaklığı 37 °C'de koruyun.
- 1mm x 2 mm gözlem alanını 10x faz kontrastlı objektif lens kullanarak görüntüleyin ve makrofaj lamellipodia'ya odaklanın: ince, levha benzeri membran çıkıntıları. Her 2 dakikada 1 kare hızında 14 saat boyunca görüntü yakalayın.
6. Hızlandırılmış Görüntülerin Analizi
- ImageJ için Fabrice P. Cordelières tarafından üretilen otomatik görüntü analiz yazılımı veya Manuel İzleme eklentisini kullanarak hızlandırılmış, faz kontrastlı görüntüleri analiz edin.
NOT: Otomatik izleme programları zaman atlamalı, faz kontrastı veya floresan mikroskopisi ile görüntülenmiş hücreleri analiz etmek için kullanılabilir. Örneğin, Cordelières ve ark.27 tarafından üretilen Java tabanlı yazılım iTrack4U, otomatik hücre izleme ve analiz için zaman atlamalı, faz kontrastı veya floresan görüntüleri girdi olarak kullanarak kullanılabilir. Manuel izleme daha fazla zaman alıcı, ancak ImageJ eklentimanuel izleme tarafından oluşturulan parça doğrudan içe aktarılabilir ve otomatik olarak ImageJ eklentisi Chemotaxis ve Geçiş Aracı28,29tarafından analiz edilebilir.
Sonuçlar
Kemotaktik gradyanda göç eden fare periton makrofajlarının hızlandırılmış video mikroskobu için kullanılan kemotaksis slaytının şematik diyagramı Şekil 2A'dagösterilmiştir. Slayt, her biri dört dolum noktası bulunan üç kemotaksi odası içerir. Bağlantı noktaları, slaydın üzerinde gösterilen fişler kullanılarak tek tek kapatılabilir. Alternatif olarak, steriliteyi korumak için fişsiz bir bağlantı noktasının üzerine sızdırmazlık kapağı yerleştirilebilir. 1 ve 4 bağlantı noktalarını taktıktan sonra, 2 ve 3 arasındaki gözlem alanı (iki rezervuarı birbirine bağlayan 1 mm genişlik x 2 mm uzunluğunda x 70 μm yüksek kanal) port 3'e 15°L'lik bir damla yerleştirilerek ve bağlantı noktası 2'de 2-20°L hacimli pipetle asılarak ortamla doldurulabilir(Şekil 2B). Fare yerleşik periton hücrelerinin (10 x 106 hücre/mL) süspansiyonu, bağlantı noktası 3'e 10°L'lik bir süspansiyon damlası yerleştirilerek ve bağlantı noktası 2'de yavaşça aspire edilerek gözlem alanına serililmiştir(Şekil 2C). Faz kontrastlı mikroskopi ile 10x objektif lens kullanılarak alınan gözlem alanında tohumlanmış hücrelerin tipik bir görüntüsü Şekil 2C'degösterilmiştir. 2-3 saat kuluçkadan sonra, kemotaksis slayt yavaş yavaş orta ile dolduruldu (Şekil 2D). 1 ve 2 bağlantı noktalarını taktıktan sonra, orta bağlantı noktası 4'ten çıkana kadar 3. Daha sonra, fiş port 1'den port 3'e değiştirildi ve ikinci rezervuar bağlantı noktası 1'de ortaya çıkana kadar yavaşça port 4 üzerinden orta enjekte edilerek dolduruldu. Bu aşamada, gözlem alanındaki hücreler ters mikroskop(Şekil 2E)kullanılarak yeniden incelenmiştir. Rezervuarların doldurulmasından kısa bir süre önce(Şekil 2C)ve sonrası(Şekil 2C)görüntüleri karşılaştırılarak, hücrelerin üçte ikisi gözlem alanından yıkanmıştır. Genellikle, zayıf yapışık CD19+ hücreleri (B1 hücreleri) yıkanmış ve kalan hücreler ağırlıklı olarak F4/80+ hücreler (makrofajlar) idi. Bu durum floresan mikroskopi ile her hücre tipini floresan olarak etiketlenmiş spesifik antikorlarla etiketledikten sonra gösterilmiştir(Şekil 4). Şekil 4A'da,taze izole edilmiş fare yerleşik periton hücreleri yeşil floresan floresan floresan floresan floresan konjuge anti-F4/80 antikorları ve kırmızı floresan floresan floresan floresan anti-CD19 antikorları ile etiketlenmiş ve hücre çekirdekleri mavi floresan nükleik asit lekesi ile etiketlenmiştir. F4/80 fare makrofajları için özel bir işaretçidir30,CD19 ise Bir B hücre belirtecidir. Şekil 4B, kemotaksis odasının gözlem alanında dönen disk konfokal mikroskopisi ile görüntülenmiş F4/80+ hücreleri göstermektedir. Hücreler zaman atlamalı, faz-kontrast mikroskobu ile kaydedilen bir gecede kemotaksis doytisi sonra etiketlenmiştir.
Kompleman C5a (kemoattractant) bağlantı noktaları 2 ve3'ütaktıktan sonra 0.54 μg/mL (rekombinant fare) içeren 15 μL'lik bir ortam damlası yerleştirilerek iki rezervuardan birine, C5a ve 10 μg/mL Patent Blue V'yi doldurarak tutarak tanıtıldı. Kemoattractant orta yavaş yavaş port 4 üzerinden bir pipet ile yavaş aspirasyon tarafından rezervuar içine çekildi. Şekil 3B, 15 μL'lik damlayı bir rezervuara çektikten sonra mavi boyanın difüzyonunu gösterir. Patent Blue V kemoattractant difüzyon dolaylı bir görsel göstergesi olarak kullanılmıştır. Kompleman C5a molekülleri Patent Mavi V (9.0 kDa karşı 0.57 kDa) ve daha yavaş yayılır olanlara göre oldukça büyüktür. Rezervuardaki kompleman C5a difüzyonundan sonra konsantrasyonu ~0.2 μg/mL (15 μL/40 μL [rezervuar hacmi] x 0.54 g/mL = 0.2 g/mL idi ve bu konsantrasyon ~22.5 nM'ye eşdeğerdi. Bir mütevazı dik gradyan gözlem alanı boyunca oluşan 3 saat sonra ve artmaya devam etti, yaklaşık 12 saat31maksimum ulaşan . Şekil 3C, kemoattractant ekledikten sonra 6-12 saat arasında kompleman C5a gradientinde göç eden makrofajların geçiş izlerini gösterir. Hücre hızı ve kemotaktik verimlilik, y-FMI (y-forward göç indeksi; aralık: -1 -1 için +1) ve x-FMI, tek tek makrofajlar olarak indekslenmiş göç çizimlerinden(Şekil 3D)hesaplanmıştır. Şekil 3B, her geçiş parçasının başlangıç noktasını kutu çizimlerinin altında X = 0 ve Y = 0'a normalleştirdikten sonra üretilen bir geçiş çizimini de gösterir. Geçiş çizimindeki inset, her geçiş parçası için y-FMI'nin nasıl hesaplandığını gösterir.
Şekil 1: Kemotaksis titrecinin iş akışı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Kemotaksis slaytlarının işlenmesi. (A) Dört fiş ve dört kapaklı bir kemotaksis slaytının 3Boyutlu görünümü. Slayt, her biri gözlem alanı olarak adlandırılan 1 mm x 2 mm'lik bir kanalla birbirine bağlanmış iki adet 40 μL rezervuardan oluşan üç kemotaksi odası içerir. (B) Bağlantı kanalı her iki uçta da 2 ve 3 dolum bağlantı noktalarına kadar uzanır. 1 ve 4 dolum portlarına fişleri taktıktan sonra, gözlem alanı orta (kırmızı) ile önceden doldurulmuş, 3. Daha sonra, 37 °C'de kaydırağı kuluçkaya yatırmadan ve hücre süspansiyonu hazırlamadan önce 2 ve 3 numaralı limanlara kapaklar uygulandı. (C) Kemoattractant gradyanının oluştuğu gözlem alanı, port 3'te 10 μL'lik fare yerleşik periton hücresi uygulanarak ve bağlantı noktası 2'de yavaşça aspire edilerek makrofajlarla donanmış. Slayt daha sonra 37 °C'de 2-3 saat boyunca nem odasında kuluçkaya yatırıldı. Sağda gösterilen faz kontrastlı görüntü, 10x nesnel lens ile elde edilen, 2 h. Ölçek çubuğu = 500 μm. (D) Chemotaxis odaları için 37 °C'de tohumlama ve kuluçka sonrası periton hücrelerini gösterir. 20-100 μL hacimli pipetin hacim ayar halkası çevirilerek yavaş ve sabit dolum elde edilebilir. İlk rezervuar dolduruldıktan sonra, ikinci rezervuar port 2 ve 3 takılarak doldurulabilir ve daha sonra port 4'te yavaşça orta enjekte edilerek bağlantı noktası 1'de ortaya çıkana kadar. (E) Yukarıda gösterilen aynı gözlem alanının faz-kontrast görüntüsü(C)iki rezervuarı doldurduktan sonra. Ölçek çubuğu = 500 μm. Elias Horn tarafından sağlanan grafik elemanları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Kemotaksis titreci. (A)Kemotaksist, bir kemotaksis odasının iki rezervuarından birine, 0,54 μg/mL kompleman C5a ve 10 μg/mL Patent Mavi V içeren 15 μL'lik bir ortam damlası uygulanarak port 1'i doldurmak ve ardından port 4'te yavaş aspirasyon uygulanarak tanıtıldı. (B) Başlangıçta rezervuar içine çekildikten sonra mavi, kemoattractant içeren orta kabaca ters bir damla şekli vardı, ve daha sonra yavaş yavaş rezervuar boyunca yayılmış. (C) Rezervuarlardan birine kemoattractant sokulduktan sonra 6-12 saat arasında bir kemoattractant (kompleman C5a) gradyan göç makrofajların göç izleri. Degradenin yönü sağda gösterilir. Her geçiş parçasının sonu dolu bir daire ile gösterilir. (D) Blox hız, x-FMI (x-forward göç indeksi) ve y-FMI (y-ileri göç indeksi), -1 ile +1 arasında değişen bir kemotaktik verimlilik indeksi çizer. Veriler 25 makrofaj geçiş parçasının analizi ile elde edilerek elde edilebildi. Gözlem alanının alt yarısında ki ve en az bir hücre genişliğinin 6 saat in üzerinde yer değiştirmesini gösteren makrofajlar analiz için rastgele seçilmiştir. Aşağıda x = 0 ve Y = 0 başlangıç noktası normalleştirdikten sonra geçiş parçaları bir arsa. Kemotaksis indeksi (y-FMI), y ekseni (d) boyunca net yer değiştirmesinin, şematik olarak gösterildiği gibi, göç yolunun birikmiş uzunluğuna (l) bölünmesiyle hesaplanmıştır. Elias Horn tarafından sağlanan A ve B panellerinde grafik elemanları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
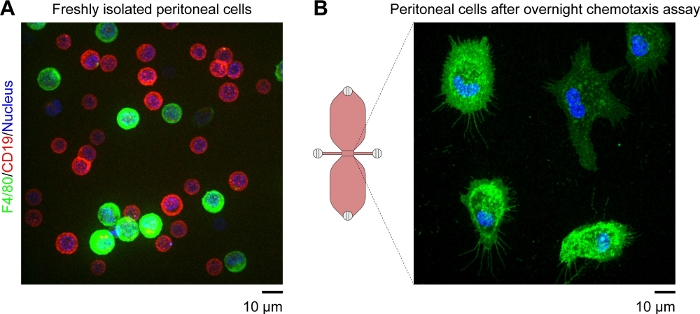
Şekil 4: Dönen disk konfokal mikroskopi ile elde edilen canlı fare yerleşik periton hücrelerinin floresan görüntüleri. (A)Genişletilmiş odak görüntüsü (tüm Z-düzlemlerinin en parlak nokta birleştirme) taze izole fare periton hücreleri yeşil floresan anti-F4/80 (makrofaj marker) antikorlar, kırmızı floresan anti-CD19 (B hücre marker) antikorlar ve mavi floresan nükleik asit lekesi ile etiketlenmiş. Ölçek çubuğu = 10 μm. (B) Bir gecede kemotaksis tetkikinden sonra alınan bir kemotaksiz odasının gözlem alanında F4/80+ hücrelerin (makrofajlar) snapshot (tek Z-düzlem). Hücreler yeşil floresan anti-F4/80 antikorları ve mavi floresan nükleik asit lekesi ile etiketlendi. Kompleman C5a ve Patent Mavi V gradyanları hücre etiketleme prosedürü ile yıkandı, bu da kemotaksis odasının şematik diyagramındaki üst haznenin neden mavi olmadığını açıklıyor. Ölçek çubuğu = 10 μm. Elias Horn tarafından sağlanan grafik elemanı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
İntravital görüntüleme 19. Ancak, günümüzün gelişmiş mikroskopi ve genetik teknikler bile in vivo belirli kemoattractants hücrelerin in tepki çalışma zordur. Bu sorunu aşmak için, Boyden18 1960'larda Transwell tahlilleri geliştirdi, ancak bu son nokta tahlilleri hücrelerin aslında kemoattractants doğru göç nasıl görselleştirme vermedi, zor kemoinez ayırt etmek için yapım, kimyasal bir işaret ile rasgele göç uyarılmış32, ve kemotaksis, birbirinden kimyasal uyaranların yüksek konsantrasyonlarına doğru göç33. Bu sorun bir köprü ile çeşitli açık odaları tasarlayarak çözüldü, genellikle 1 mm genişliğinde, iki rezervuar arasında yer alan ve objektif bir lens tarafından erişilebilir21,22,23. Yapışık hücrelerle tohumlanmış ters kapak fişi uygulamak, odaları kapatır ve rezervuarlardan birine eklenen kemoattractant köprü boyunca karşı rezervuara yayılır ve bir konsantrasyon gradyanı oluşturur. Burada aynı prensibi kullanarak bir kemotaksis tamtisi ama dört dolum portu içeren kapalı bir oda kullanarak açıklar. Bu sistemi ve zaman atlamalı, faz-kontrast mikroskobu kullanarak, biz bir kemotaktik kompleman C5a gradyangöçgörüntü fare yerleşik periton makrofajlar için bir tetkik geliştirdi31 ,34,35,36. Bu tetki, nakavt fare modelleri ile birlikte, makrofaj morfolojisi çeşitli Rho GTPases ve motor proteinlerin rollerinin araştırılmasında etkili oldu, hareketlilik, ve kemotaksis31,34,35,36,37. Biz de görüntü insan periferik kan monositler bir 2D yüzey veya 3D kollajen tip I matris38göç bu yaklaşımı kullandık. Ayrıca, titrefare kemik iliği türetilmiş makrofajlar veya makrofajlar koşullu ölümsüzleştirilmiş miyeloid öncül hücrelerden elde edilenuygundur 39,40. Daha önce kültür kemik iliği hücrelerine luer adaptörleri ile politetrafloroetilen (PTFE) torbalar kullandık ve makrofajlar elde34. PTFE torbalarının avantajı, torbayı 20-30 dakika buza yerleştirdikten sonra hücrelerin kolayca askıya alınıp kullanıma hazır olmasıdır. Bu yaklaşım, istenmeyen hava kabarcıklarının daha sonra (değişken başarı ile) dışarı atılabilir avantajı vardır ve önceden ıslatılmış gözlem alanı pipetleme tarafından bir hücre süspansiyon yavaş giriş sağlar. Ancak ön dolgu, ortamın kısmen kanat rezervuarlarından birine veya her ikisine akma olasılığını arttırır, bu da hücrelerin gözlem alanının ötesinde tohumlamayı teşvik eder. Alternatif olarak, hücre süspansiyondoğrudan kuru bir gözlem alanına pipetli olabilir, ancak istenmeyen hava kabarcıkları daha sonra dışarı atılamaz.
Farenin periton boşluğu iki ana hücre popülasyonu içerir: F4/80+ makrofajlar ve (daha küçük) CD19+ B hücreleri, yaklaşık 1:2 oranında(Şekil 4A). Bu iki hücre popülasyonu periton kavite hücrelerinin %95'inden fazlasını oluştururken, kalan F4/80-/CD19- hücreler genellikle CD11c+ hücreler (dendritik hücreler) veya CD3+ hücreler (T hücreleri) olarak tanımlanabilir. Zayıf yapışık B hücreleri, rezervuarların orta ile doldurulması sırasında gözlem alanından yıkanır (Şekil 2). İki rezervuardan birine kemoattractant ekledikten sonra, zaman atlamalı, faz-kontrast mikroskobu, gelişen bir kemoattractant gradyan içinde göç eden kalan hücreleri (makrofajlar) görüntülemek için kullanılabilir. Gözlem alanında kompleman C5a gradyanının oluşumu, bir rezervuardan diğerine difüzyon yoluyla, benzer molekül ağırlığına sahip floresan boya kullanılarak simüle edilebilir. Rekombinant fare kompleman C5a için iyi bir yedek (öngörülen molekül ağırlığı, 9.0 kDa) floresan dextran (10 kDa)31etiketli . Konfokal mikroskopi kullanılarak, kemotaksis slaytIki rezervuar bağlayan dar kanal (gözlem alanı) floresan gradyanı sabit aralıklarla ölçülebilir ve farklı zaman noktalarında konsantrasyon profilleri çizilebilir24,31. Biz rutin bir nonfloresan eklemek, mavi boya (Patent Mavi V) kemoattractant orta difüzyon ve degrade oluşumu uygun bir görsel göstergesi sağlamak için. 15 μL mavi, kemoattractant içeren ortamı bir rezervuara soktuktan sonra, rezervuar düzgün bir şekilde mavi görünür ve Fick'in difüzyon yasalarına göre rezervuarları birbirine bağlayan dar gözlem alanı boyunca bir degrade oluşacaktır(Şekil 3B). Birkaç gün solute için gereklidir (mavi boya veya kemoattractant) düzgün dağıtılacak.
Floresan mikroskopisi, otomatik hücre takibi için avantajlar sunan faz kontrastlı mikroskopi ile değiştirilebilir, çünkü floresan etiketli hücreler arka plandan kolayca ayırt edilebilir. Bir diğer avantajı da, yüzey belirteçlerini floresan antikorlarla etiketledikten sonra belirli bağışıklık hücrelerinin popülasyonlarının seçici olarak izlenebiliyor olmasıdır. Biz görüntü insan periferik kan CD14+ hücreleri (monositler) bir kemotaktik fMLP göç için bu yaklaşımı kullandı (N-formylmethionine-lökil-fenililin) gradyan38. Benzer şekilde, floresan anti-F4/80 antikorları kemotaktik kompleman C5a gradient göç fare makrofajlar görüntü için kullanılabilir. Fototoksisite floresan görüntüleme kullanarak potansiyel bir dezavantajdır41. Bu çeşitli yollarla azaltılabilir42, uzun dalga boylarında heyecanlı floroforlar kullanarak ve orta antioksidanlar ekleyerek de dahil olmak üzere. Alternatif olarak, etiketli hücreler başlangıçta floresan mikroskobu ile tespit edilebilir ve daha sonra zaman atlamalı, faz-kontrast mikroskobu ile görüntülenebilir. Ancak, uygulamada, ~1 μm/dk (makrofajlar) veya ~4 μm/dk (monositler) gibi orta derecede düşük hızlarda hareket eden hücreler, floresan mikroskopi ile aralıklı olarak dakikalar aralıklarla görüntülenebilir ve bu da38. Biz daha önce floresan mikroskobu ve 3D kemotaksis tahlilleri için burada açıklanan kemotaksis slayt kullanılır38,43. Bu durumda, her iki rezervuar orta ile önceden doldurulmuş ve 15 μL kemoattractant içeren ortam gözlem alanına kollajen tip I içeren ortamda asılı floresan etiketli hücreleri yavaş yavaş pipetleme önce rezervuarlardan birine çizildi. Bu işlemin zor kısmı asidik çözelti de yoğunlaşmıştır kollajen tip I, işleme. Kollajen çözeltisinin pH hücre süspansiyonu ile buz gibi kollajen çözeltisi karıştırmadan önce alkali çözeltisi ilave edilerek nötralize edilmesi gerekir. Kollajen hücreli karışımın 37 °C'de bir kuvöze aktarılması kollajen polimerizasyonunu başlatacaktır. Kuluçka sırasında, kollajen bir jel içine polimerize ise hücreler X-, Y- ve Z-ekseni yönde eşit olarak dağıtılan kalır, böylece slayt yavaş yavaş uzun ekseni etrafında döndürülmelidir. 3D chemotaxis tahlilleri için uygun ilgili kapalı kemotaksis slayt, dört fişler yerine altı fişler ile, son zamanlarda29tarif edilmiştir . Bu sistem, her rezervuarın tek bir bağlantı noktası yerine iki dolum portu olduğundan, kollajen hücre karışımının bağımsız olarak yan rezervuarların her birini doldurmadan önce gözlem alanına girmesini sağlar.
Özetle, 6 veya daha fazla saatlik bir süre içinde kemotaktik gradyanda gezinen hücrelerin görselleştirilmesine olanak tanıyan gerçek zamanlı kemotaksis tamını açıklarız. Burada inflamatuar hastalıklarda önemli rol oynayan ancak nötrofiller ve Dictyostelium amipler gibi daha hızlı hareket eden hücrelere kıyasla gerçek zamanlı kemotaksis tahlillerinde yeterince temsil edilmeyen makrofajlara odaklanıyoruz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma DFG(Deutsche Forschungsgemeinschaft) tarafından hibe (HA 3271/3-2) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Slide (anodized aluminium) rack | Ibidi, Martinsried, Germany | 80003 | Autoclavable stackable rack for channel slides |
| µ-Slide Chemotaxis 2D (chemotaxis slide) | Ibidi, Martinsried, Germany | 80306 | Slide containing chemotaxis chambers (tissue culture treated) |
| 100x penicillin/streptomycin | Thermo Fisher Scientific | 15140122 | Used as supplement for RPMI 1640 media |
| 10-100 µL pipette with volume control ring | Eppendorf | 3123000047 | Eppendorf Research plus pipette |
| 10-200 µL pipette tips | Greiner Bio-One International | 739261 | Pipette tips with beveled tips (96 pieces per rack: sterile) |
| 14 mL polypropylene round bottom tubes | BD Falcon | 352059 | Used to collect peritoneal cells |
| 14-bit Hamamatsu C9100-50 Electron Multiplying-Charged Couple Device (EM-CCD) peltier-cooled camera | Hamamatsu Photonics Inc., Japan | EM-CCD camera of the spinning disk confocal microscope system | |
| 2-20 µL pipette with volume control ring | Eppendorf | 3123000039 | Eppendorf Research plus pipette |
| 24 G plastic catheter | B Braun Mesungen AG, Germany | 4254503-01 | Used for peritoneal lavage |
| 405 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (405 nm) source of spinning disk confocal microscope system | |
| 488 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (488 nm) source of spinning disk confocal microscope system | |
| 561 nm solid state laser, 50 mW | Perkin Elmer, Rodgau, Germany | Laser (561 nm) source of spinning disk confocal microscope system | |
| Alexa Fluor 488-conjugated rat (IgG2a) monoclonal (clone BM8) anti-mouse F4/80 antibody | Thermo Fisher Scientific | MF48020 | Mouse macrophage marker and plasma membrane label |
| Alexa Fluor 594-conjugated rat (IgG2a) monoclonal (clone 6D5) anti-mouse CD19 antibody | BioLegend | 115552 | Mouse B cell marker |
| C-Chip disposable (improved Neubauer) hemocytometer | NanoEnTek (distributed by VWR International) | 631-1098 | Used to count cells |
| CSU-X1 spinning disk scanner | Yokogawa Electric Corporation, Japan | Nipkow spinning disk unit | |
| Hank’s buffered salt solution without Ca2+ and Mg2+ | Thermo Fisher Scientific | 14170120 | Used for peritoneal lavage |
| Heat-inactivated fetal bovine serum | Thermo Fisher Scientific | 10082139 | Used as supplement for RPMI 1640 media |
| Hoechst 34580 | Thermo Fisher Scientific | H21486 | Cell permeable, blue fluorescent nucleic acid stain |
| ImageJ (image processing and analysis in Java) | National Institutes of Health (NIH) | Image analysis software | |
| Lipopolysaccharides from Escherichia coliO111:B4 | Sigma-Aldrich | L4391-1MG | Toll-like receptor 4 ligand |
| Nikon Eclipse Ti inverse microscope | Nikon, Japan | Inverted microscope | |
| Patent Blue V, sodium salt | Sigma-Aldrich | 21605-10G | Blue-colored dye used as visual indicator of gradient formation |
| Recombinant mouse complement C5a protein | R&D Systems | 2150-C5-025 | Chemoattractant for mouse macrophages |
| RPMI 1640 medium containing 20 mM Hepes | Sigma-Aldrich | R7388 | Basis medium for assays |
| UltraVIEW Vox 3D live cell imaging system + Volocity software | Perkin Elmer, Rodgau, Germany | Spinning disk confocal microscope system | |
| Zeiss LSM 510 + Axiovision software | Carl Zeiss Microscopy, Oberkochen, Germany | Confocal laser scanning microscope (LSM) adapted for phase-contrast microscopy |
Referanslar
- Lammermann, T., Germain, R. N. The multiple faces of leukocyte interstitial migration. Seminars in Immunopathology. 36, 227-251 (2014).
- Lammermann, T., Sixt, M. Mechanical modes of 'amoeboid' cell migration. Current Opinion in Cell Biology. 21, 636-644 (2009).
- Woodham, E. F., Machesky, L. M. Polarised cell migration: intrinsic and extrinsic drivers. Current Opinion in Cell Biology. 30, 25-32 (2014).
- Devreotes, P. N., et al. Excitable Signal Transduction Networks in Directed Cell Migration. Annual Review of Cell and Developmental Biology. 33, 103-125 (2017).
- Kamp, M. E., Liu, Y., Kortholt, A. Function and Regulation of Heterotrimeric G Proteins during Chemotaxis. International Journal of Molecular Sciences. 17 (1), 90 (2016).
- Miao, Y., et al. Wave patterns organize cellular protrusions and control cortical dynamics. Molecular Systems Biology. 15, 8585 (2019).
- Ridley, A. J., et al. Cell migration: integrating signals from front to back. Science. 302, 1704-1709 (2003).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453, 51-55 (2008).
- Mullins, R. D., Heuser, J. A., Pollard, T. D. The interaction of Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of filaments. Proceedings of the National Academy of Sciences of the United States of America. 95, 6181-6186 (1998).
- Leithner, A., et al. Diversified actin protrusions promote environmental exploration but are dispensable for locomotion of leukocytes. Nature Cell Biology. 18, 1253-1259 (2016).
- McDonald, B., et al. Intravascular danger signals guide neutrophils to sites of sterile inflammation. Science. 330, 362-366 (2010).
- Leber, T. Ueber die Entstehung der Entzündung und die Wirkung der entzündungserregenden Schädlichkeiten. Fortschritte der Medizin. 6, 460-464 (1888).
- Tauber, A. I. Metchnikoff and the phagocytosis theory. Nature Reviews Molecular Cell Biology. 4, 897-901 (2003).
- Clark, E. R., Linton Clark, E. Reactions of cells in the tail of amphibian larvae to injected croton oil (aseptic inflammation). American Journal of Anatomy. 27, 221-254 (1920).
- Clark, E. R., Linton Clark, E. The reaction of living cells in the tadpole's tail toward starch, agar-agar, gelatin, and gum arabic. The Anatomical Record. 24, (1922).
- Comandon, J. Phagocytose in vitro des Hématozoaires du Calfat (enregistrement cinématographique). Comptes Rendus Hebdomadaires des Séances et Mémoires de la Société de Biologie. 69, 314-316 (1917).
- McCutcheon, M. Chemotaxis in leukocytes. Physiological Reviews. 26, 319-336 (1946).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Horwitz, D. A., Garrett, M. A. Use of leukocyte chemotaxis in vitro to assay mediators generated by immune reactions. I. Quantitation of mononuclear and polymorphonuclear leukocyte chemotaxis with polycarbonate (nuclepore) filters. Journal of Immunology. 106, 649-655 (1971).
- Bignold, L. P. A novel polycarbonate (Nuclepore) membrane demonstrates chemotaxis, unaffected by chemokinesis, of polymorphonuclear leukocytes in the Boyden chamber. Journal of Immunological Methods. 105, 275-280 (1987).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of Cell Biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of Cell Science. 99, 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PLoS One. 5, 15309 (2010).
- Zengel, P., et al. mu-Slide Chemotaxis: a new chamber for long-term chemotaxis studies. BMC Cell Biology. 12, 21 (2011).
- Valentim, A. M., Guedes, S. R., Pereira, A. M., Antunes, L. M. Euthanasia using gaseous agents in laboratory rodents. Lab Animal. 50, 241-253 (2016).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nature Reviews. Neuroscience. 9, 370-386 (2008).
- Cordelieres, F. P., et al. Automated cell tracking and analysis in phase-contrast videos (iTrack4U): development of Java software based on combined mean-shift processes. PLoS One. 8, 81266 (2013).
- Zantl, R., Horn, E. Chemotaxis of slow migrating mammalian cells analysed by video microscopy. Methods in Molecular Biology. 769, 191-203 (2011).
- Biswenger, V., et al. Characterization of EGF-guided MDA-MB-231 cell chemotaxis in vitro using a physiological and highly sensitive assay system. PLoS One. 13, 0203040 (2018).
- Austyn, J. M., Gordon, S. F4/80, a monoclonal antibody directed specifically against the mouse macrophage. European Journal of Immunology. 11, 805-815 (1981).
- Hanley, P. J., et al. Motorized RhoGAP myosin IXb (Myo9b) controls cell shape and motility. Proceedings of the National Academy of Sciences of the United States of America. 107, 12145-12150 (2010).
- Wilkinson, P. C. Cell Locomotion and Chemotaxis: Basic Concepts and Methodological Approaches. Methods. 10, 74-81 (1996).
- Pfeffer, W. Locomotorische Richtungsbewegungen durch chemische Reize. Untersuchungen aus dem Botanischen Institut zu Tübingen. 1, 363 (1884).
- Konigs, V., et al. Mouse macrophages completely lacking Rho subfamily GTPases (RhoA, RhoB, and RhoC) have severe lamellipodial retraction defects, but robust chemotactic navigation and altered motility. The Journal of Biological Chemistry. 289, 30772-30784 (2014).
- Horsthemke, M., et al. Multiple roles of filopodial dynamics in particle capture and phagocytosis and phenotypes of Cdc42 and Myo10 deletion. The Journal of Biological Chemistry. 292, 7258-7273 (2017).
- Bachg, A. C., et al. Phenotypic analysis of Myo10 knockout (Myo10(tm2/tm2)) mice lacking full-length (motorized) but not brain-specific headless myosin X. Scientific Reports. 9, 597 (2019).
- Horsthemke, M., et al. A novel isoform of myosin 18A (Myo18Agamma) is an essential sarcomeric protein in mouse heart. The Journal of Biological Chemistry. 294, 7202-7218 (2019).
- Bzymek, R., et al. Real-time two- and three-dimensional imaging of monocyte motility and navigation on planar surfaces and in collagen matrices: roles of Rho. Scientific Reports. 6, 25016 (2016).
- Wang, G. G., et al. Quantitative production of macrophages or neutrophils ex vivo using conditional Hoxb8. Nature Methods. 3, 287-293 (2006).
- Gran, S., et al. Imaging, myeloid precursor immortalization, and genome editing for defining mechanisms of leukocyte recruitment in vivo. Theranostics. 8, 2407-2423 (2018).
- Magidson, V., Khodjakov, A. Circumventing photodamage in live-cell microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. BioEssays : News and Reviews in Molecular, Cellular and Developmental Biology. 39 (8), 1700003 (2017).
- Isfort, K., et al. Real-time imaging reveals that P2Y2 and P2Y12 receptor agonists are not chemoattractants and macrophage chemotaxis to complement C5a is phosphatidylinositol 3-kinase (PI3K)- and p38 mitogen-activated protein kinase (MAPK)-independent. The Journal of Biological Chemistry. 286, 44776-44787 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır