Method Article
HiPSC Türetilmiş Kardiyomiyosit Kullanarak İskemik Kalp Hastalığı Modeli ve Kardiyomiyosit Kontraksiyonunun Video Tabanlı Karşılaştırılması
Bu Makalede
Özet
İskemiye neden olan doku hasarının kantitatif değerlendirilmesi için bir yöntem le birlikte, insan kaynaklı pluripotent kök hücrelerden elde edilen kardiyomiyositler kullanılarak iskemik kalp hastalığı nın bir modelini saklı atıyoruz. Bu model ilaç tarama ve iskemik kalp hastalığı üzerinde daha fazla araştırma için yararlı bir platform sağlayabilir.
Özet
İskemik kalp hastalığı dünya çapında önemli bir ölüm nedenidir. Bu nedenle, genellikle kemirgenler gibi küçük hayvan modelleri ile, araştırma muazzam miktarda konu olmuştur. Ancak, insan kalbinin fizyolojisi önemli ölçüde kemirgen kalp farklıdır, kalp hastalığı çalışma için klinik olarak ilgili modeller için ihtiyaç altını çizerek. Burada, insan kaynaklı pluripotent kök hücrelerden (hiPS-CM) farklı kardiyomiyositler kullanarak iskemik kalp hastalığını modellemek ve iskemik kardiyomiyositlerin hasar ını ve fonksiyonel bozukluğunu ölçmek için bir protokol saklıyız. Glikoz ve serum olmadan %2 oksijene maruz kalmak, çekirdeğin propidium iyodürile boyanması ile endike olan yaralı hücrelerin yüzdesini artırır ve hücresel canlılığı azaltır. Bu koşullar aynı zamanda mikroskobik video görüntülerinin yer değiştirme vektör alan analizi ile doğrulanan hiPS-CM'lerin kontryağışlılığını azaltır. Bu protokol ayrıca bireysel hastalardan hiPS hücrelerinin kullanımını kolaylaştırarak kişiselleştirilmiş ilaç taraması için uygun bir yöntem sağlayabilir. Bu nedenle, iskemik kalp hastalığı bu model, insan kökenli iPS-CMs dayalı, ilaç tarama ve iskemik kalp hastalığı üzerinde daha fazla araştırma için yararlı bir platform sağlayabilir.
Giriş
İskemik kalp hastalığı (İhD) dünya çapında önde gelen ölüm nedeni olarak kabul edilmektedir ve 2016 yılında dokuz milyondan fazla ölümden sorumlu olduğu tahmin edilmektedir1. Kardiyovasküler hastalık prevalansı artmaya devam etmektedir ve küreselleşme gelişmekte olan ülkelerde kalp hastalığı risk faktörlerinin yaygınlığına katkıda bulunmuş gibi görünmektedir. Bu nedenle, İhD çalışma giderek daha acil hale geliyor2.
Kardiyovasküler hastalıkların deneysel modelleri, hastalığın mekanizmaları, tanının doğruluğu ve yeni tedavilerin geliştirilmesi açısından kritik öneme yöneliktir. Birçok deneysel model birçok laboratuvar tarafından önerilmiştir. Önemli avantajlara sahip bir model seçmek son derece önemlidir; fizibilite, tekrarlanabilirlik ve insan hastalığına benzerlik kardiyovasküler hastalık modellerinin seçiminde önemli faktörlerdir3. Spesifik kardiyomiyopati ile ilişkili mutasyonlar taşıyan insan kaynaklı pluripotent kök hücreler (hiPSCs) hayvan modelleri için umut verici bir alternatiftir4. Birçok strateji iPSCs kullanarak kardiyomiyosit indükleme için tarif edilmiş olmasına rağmen5,6,7,8,9, Burada biz hiPSCs farklı kardiyomiyositler kullanarak bir İhD modeli üretmek için basit bir yöntem sağlamak, hangi kardiyomiyosit kullanarak kardiyomiyosit zahmetli seçimi uygulanmaz. Bu yöntemde kardiyomiyositler fonksiyonel olarak spontan kontraksiyon analiz edilerek seçilir.
HiPSC kullanan kardiyomiyositin indüksiyonu hayvan kurban ını ve teknik olarak zor ameliyatları önler. İhD hayvan modelleri kurulması zorlu cerrahi teknikler10gerektirir. Kalp hızı ve kemirgenlerin fizyolojisinden etki potansiyelleri gibi insan kalp hastalığının çeşitli patofizyolojik yönlerini mükemmel bir şekilde simüle etmek neredeyse imkansızdır. Hayvan modellerinin kullanılmasının ahlakı ve etiği ile birleştiğinde, hayvan modelleri dışında yeni deneysel modellerin geliştirilmesi zorunludur. İnsan iPS hücrelerinden farklı kardiyomiyositler insan kalbinin fizyolojik durumunu daha iyi taklit eder. Bu protokolde hiPS hücrelerinden (hiPS-CM) elde edilen kardiyomiyositler kullanılarak Bir İhD modeli oluşturduk. Bizim modelimizde, oksijen ve glikoz yoksunluğu kontraktil kuvvet ve hiPS-CM'lerin canlılık azalmaya yol açar. Yöntemimiz Modeli İhD için yeni bir yaklaşım sağlar ve bu hastalığın çalışması için yeni bir platform göstermektedir.
Protokol
1. hiPSC bakım kültürü
- Coat laminin ile altı iyi bir kültür plakası(Malzeme Tablosu).
- Fosfat tamponlu salinde (PBS) 0,5 μg/mL'ye seyreltin laminin.
- 2,0 mL/kuyu hacminde altı kuyulu bir tabağa seyreltilmiş laminin ekleyin.
- Plakayı 37 °C'de 30 dk kuluçkaya yatırın.
- Laminin çözeltisini kuyulardan çıkarın.
- 2 mL iPSC bakım ortamındaki tohum hiPSC'leri(Malzeme Tablosu)yüzeyi kurutmadan 3 × 104 hücre/kuyu yoğunluğunda kaplanmış kuyuların üzerine.
- HiPSC'lerin alt kültürü.
- 0,5× hücre dissosiyasyonu enzimleri(Malzeme Tablosu) çözeltisihazırlayın.
- 0,5 mM EDTA/PBS yapmak için 10 μL 0,5 M Ethylenediamminetetraacetic (EDTA) ve 10 mL PBS'yi karıştırın.
- 10 mL 1× hücre dissosilasyon enzimlerini 0,5 × 10 mL 0,5 mM EDTA/PBS ekleyerek seyreltin.
- Kuyulardan harcanan ortamı aspire edin.
- Hücreleri yıkamak için 2 mL/kuyu PBS ekleyin ve PBS'yi atın.
- 0,5× hücre ayrışma enzimlerinin 800 μL'sini ekleyin ve hücreleri %5 CO2içeren nemlendirilmiş bir kuluçka makinesinde 37 °C'de 7 dakika kuluçkaya yatırın.
NOT: Hücreleri ayırmak için %0.05 tripsin-EDTA kullanılabilir. - 0,5× hücre ayrışma enzimçözeltisini nazikçe çıkarın.
- Hücreleri 2 mL PBS ile yıkayın, ardından PBS'yi atın.
NOT: Hücreler hücre dissosyasyon enzimleri çözeltisi ekledikten sonra kolayca kopunca nazik olun. - 10 μM Y-27632 içeren 1 mL iPS bakım ortamı(Malzeme Tablosu)ekleyin.
NOT: Y-27632 eklemek hiPSC'lerin sağkalım oranını artırır. - Hücreleri bir hücre kazıyıcı kullanarak yerinden ve 15 mL santrifüj tüpünde toplayın.
- Hücre sayısını say. 10 μM Y-27632 içeren iPS bakım ortamı ekleyerek hücre yoğunluğunu 1,5 × 104 hücre/mL olarak ayarlayın.
NOT: Hücre hasarlarını önlemek için santrifüj kullanmayın. - Lamina kaplı altı kuyulu plaka (son yoğunluk: 3 × 104 hücre/kuyu) üzerinde hücre karışımı tohum 2 mL.
- Hücreleri %5 CO2içeren nemlendirilmiş bir kuluçka makinesinde 37 °C'de kuluçkaya yatırın.
- 1, 4, 5 ve 6 günlerinde Y-27632 olmadan iPS bakım ortamı ile kültür ortamı değiştirin.
- 0,5× hücre dissosiyasyonu enzimleri(Malzeme Tablosu) çözeltisihazırlayın.
- 7. günde hücreleri alt kültüre sat.
NOT: HiPSC'lerin rastgele farklılaşmasını engellemek için hücreleri 7.
2. HiPSC'lerin kardiyak farklılaşmasıinin indüksiyonu
- Coat laminin ile 96-iyi kültür plakası (Malzeme Tablosu).
- PBS ile 1,675 μg/mL'ye seyreltin laminin.
- Seyreltilmiş laminin çözeltisini 0,1 mL/kuyu hacminde 96 kuyuluk bir tabağa ekleyin.
- Plakayı 37 °C'de 30 dk kuluçkaya yatırın.
- Tohum hiPSCs 3 × 104 hücre / iyi bir yoğunlukta 96-iyi plaka üzerine.
- %5 CO2içeren nemlendirilmiş bir kuluçka makinesinde 37 °C'de çoğalma hiPSC'leri .
- Bir gün sonra, 200 μL/well iPS büyüme ortamı(Malzeme Tablosu)ile orta değiştirin.
- Hücreler %70-80 biraraya gelene kadar her gün 2-3 gün daha orta yı değiştirin.
- Farklılaştırma ortamı uygulayın.
- Harcanan ortamı aspire edin ve önceden ısıtılmış diferansiyasyon ortamı A(Malzeme Tablosu)200 μL/well ile yavaşça değiştirin.
- Plakayı %5 CO2içeren nemli bir kuluçka makinesine 37 °C'ye yerleştirin.
- 48 saat sonra, orta aspire ve yavaş yavaş 200 μL / iyi önceden ısıtılmış diferansiyasyon orta B(Malzeme Tablosu) ile değiştirin.
- Plakayı %5 CO2içeren nemli bir kuluçka makinesine 37 °C'ye yerleştirin.
NOT: Farklılaşma ortamının taze tutulması son derece önemlidir. Genellikle iki hafta içinde, yavaş yavaş farklılaşma etkilerini kaybederler. Gerekirse taze orta ve depolamak −20 °C.
- Kardiyomiyosit bakım ortamı uygulayın.
- 48 saat sonra, orta aspire ve yavaş yavaş 200 μL / iyi önceden ısıtılmış kardiyomiyosit bakım ortamı(Malzeme Tablosu)ile değiştirin.
- Plakayı %5 CO2içeren nemli bir kuluçka makinesine 37 °C'ye yerleştirin.
- Kardiyomiyosit farklılaşma ortamını 30.
NOT: Farklılaşma için gerekli genlerin kesin ifade sırasını sağlamak için a ve b ayırım ortamının uygulama süresinin doğru bir şekilde 48 saat olarak ayarlanması önemlidir.
3. İskemiye maruz kalma
- Besin ve oksijen kültür ortamı mahrum.
- Dulbecco'nun modifiye Eagle ortamını (DMEM) glikoz ve serumsuz hazırlayın.
- HiPS-CM'ler içeren 96 kuyulu plakanın kuyularından aspire kültür ortamı.
- 200 μL/well hacminde kuyulara besin yoksun orta ekleyin.
- Bir hipoksik kuluçka(Malzeme Tablosu)kültür plakası yerleştirin.
- Azot gazı aşıla ve iç oksijen konsantrasyonunu %2 ve CO2 konsantrasyonu %5 ile 24 saat boyunca koruyun.
- İstenilen analizlere devam edin: örneğin,uygulanabilirlik analizi, sözleşmenin değerlendirilmesi veya hücresel hasarın değerlendirilmesi.
4. MTT tsası kullanılarak hücresel canlılığın değerlendirilmesi
- Hücrelerin canlılığını nicel olarak değerlendirmek için MTT araştırma kitini(Malzeme Tablosu)kullanın.
NOT: DMEM'de 1 mM hidrojen peroksite 1 saat süreyle maruz kalmak hücrelere zarar vermek için kullanılabilir (pozitif kontrol). Negatif kontrol için DMEM'de 0 mM hidrojen peroksit maruziyeti kullanılabilir.- Tekrareden pipettor kullanarak hücrelere 10 μL MTT reaktifi ekleyin.
- Bir orbital shaker üzerinde bir dakika hafifçe karıştırın.
- Hücreleri %5 CO2 kuluçka makinesinde 37 °C'de 3-4 saat kuluçkaya yatırın. Kuluçkadan sonra hücrelerde üretilen formazan kuyuların dibinde koyu kristaller olarak görünür.
- Supernatant çıkardıktan sonra, 100 μL dimetil sülfoksit çözeltisi (DMSO) çözünmez formazan kristalleri eritin. Bu çözelti formazan kristallerini eriterek mor bir çözelti üretecektir.
DİkKAT: DMSO gözleri, solunum sistemini ve cildi tahriş edebilir. Uygun eldiven ve göz/yüz koruması giyin. - Her numunenin emiciliğini 570 nm dalga boyunda bir mikroplaka okuyucuile ölçün.
5. iPS-CM'lerin sözleşmeselliğinin değerlendirilmesi
- Yüklü değilse, https://sites.google.com/site/qingzongtseng/piv'da Parçacık Görüntü Velocimetry ImageJ eklentisi11'i edinin ve yükleyin.
- Faz kontrastmikroskobu kullanarak, ~10 s için saniyede ~20 kare 4× objektif lens kullanarak hiPS-CM'lerin video görüntülerini kaydedin ve "analyze.avi" olarak kaydedin. Iskemi öncesi ve sonrası arasındaki sözleşmenin karşılaştırılması için, ilgi alanının kaydedildiğini doğrulayın.
NOT: Otomatik bir aşamalı bir mikroskop ilgi yerini hedeflemek için yararlıdır. Film dosyası daha sonraki analiziçin .avi formatında olmalıdır. Değilse, filmi .avi'ye dönüştürün. - Şekil 1'debelirtildiği gibi klasör yapısı oluşturun. Ek dosyada "joblist.txt" örneği belirtilir.
- Hücresel yer değiştirmenin ayrık iki boyutlu vektör alanlarını analiz edin.
- Başlat Fiji (ImageJ) yazılımı12, Eklentiler > Makrolar > Düzenleyin ve "vector_analysis.ijm" (Ek Kodlama Dosyası) açın gidin.
- Çalıştır'ıtıklatın. Analiz otomatik olarak yapılacaktır.
NOT: Deplasman vektörleri D(x,y) referans çerçevesi (ilk kare) ile sonraki tüm kareler (kare 1' e karşı 2, 1 vs. 3, 1 vs. 4, vb.) arasında her 16 × 16 piksel için hesaplanır. Sonuç her kare için hesaplanır ve "vec_x.txt" olarak kaydedilir(x kare numarasıdır). Maksimum yer değiştirme vektörü, M(x, y), her (x, y) çifti için aşağıdaki gibi tanımlanır: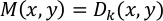
k'nin kare numarasını temsil ettiği yer | Dk (x,y)| = max [| D2 (x,y)|, | D3 (x,y)|, ..., | Dn (x,y)|] ve n son kareyi gösterir. Sonuç "Max_vector.txt" olarak kaydedilir. | M(x, y)| analiz noktasında (x, y) kardiyomiyosit daralması sonucu oluşan maksimum yer değiştirmeyi temsil eder. Rasgele birimlerde Sözleşme değeri C aşağıdaki gibi hesaplanır: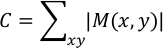
Bu değer sütun 7'ye, satır 1'e "Max_vector.txt" olarak kaydedilir. C, tüm (x, y) için yer değiştirme toplamını temsil eder. Miyokardiyal daralma nedeniyle yer değiştirmenin büyük olduğu kısım ne kadar büyükse, C değeri de o kadar büyüktür. Maksimum yer değiştirmenin vektör alanı, M(x, y), ilk karenin faz kontrast görüntüsü ("Phase_contrast.png") ile kaplanır ve "Overlaid.png" olarak kaydedilir. Yer değiştirme vektörünün büyüklüğü videonun ilk karesine göre hesaplandığı için hiPS-CM'lerin ilk kare için diyastolik dönemde dinlenmesi tercih edilir.
6. Akış sitometrisi kullanarak hücresel hasarın değerlendirilmesi
- PBS'de 1 mg/mL propidium iyodür çözeltisini 1:1.000'e seyreltin.
- Propidium iyodür ile ayrılmış hücreleri leke.
- Orta aspire ve uygun büyüklükte bir santrifüj tüp yerleştirin.
- Tüpü 1.000 × g'de 5 dakika boyunca santrifüj edin ve tortulanmış hücreleri kaybetmemek için süpernatantı dikkatlice çıkarın.
- Karanlıkta 15 dakika oda sıcaklığında seyreltilmiş propidium iyodür çözeltisi ile hücreleri kuluçkaya yatırın.
- Tüpü 1.000 × g'de 5 dakika boyunca santrifüj edin ve tortulanmış hücreleri kaybetmemek için süpernatantı dikkatlice çıkarın.
- PBS~1 mL'deki hücreleri yeniden oluştur.
NOT: Hücresel hasarı doğru bir şekilde ölçmek için orta ortamdan müstakil yüzen hücreleri toplamak önemlidir.
- Propidium iyodür ile leke bağlı hücreler.
- Ekli hücreleri PBS ile iki kez hafifçe yıkayın ve PBS'yi atın.
- Karanlıkta 15 dakika seyreltilmiş propidium iyodür çözeltisi ile hücreleri kuluçkaya yatırın.
- Propidium iyodür çözeltisini aspire edin.
- Hücreleri %0.25 tripsin kullanarak ayırın. Hücre çözeltisini bir santrifüj tüpüne taşıyın.
- Tüpü 1.000 × g'de 5 dakika boyunca santrifüj edin ve tortulanmış hücreleri kaybetmemek için süpernatantı dikkatlice çıkarın.
- PBS~1 mL'deki hücreleri yeniden oluştur.
- Floresan aktif hücre sıralama (FACS) analizi için yüzen ve bağlı hücreleri karıştırın.
- Hücre çözeltisini 30 μm'lik bir filtreden geçirin.
NOT: Hücreleri bir filtreye geçirmek, doğru bir FACS ölçümü için çok önemlidir. - Örnekleri bir FACS sistemi kullanarak analiz edin.
7. İmmünoboyama
- Hücre örneğini düzeltin.
- Kültür ortamını aspire edin.
- Oda sıcaklığında 10 dakika pbs% 4 paraformaldehit ekleyin.
- Hücreleri PBS ile üç kez yıkayın.
NOT: Optimal fiksasyon için taze paraformaldehit çözeltisi önerilir.
- Hücreleri %0.2 Triton X-100 ile 15 dakika geçirin, sonra reaktifi atın.
- 30 dakika hücreleri engellemek için% 3 sığır serum albumin ekleyin.
- Birincil antikor uygulayın.
- Büyükbaş hayvan serum albumin çözeltisini kültür plakasından atın.
- Hücreleri bir gecede 4 °C'de primer antikorlarla kuluçkaya yatırın.
- Antikor solüsyonunu çıkarın.
- Hücreleri PBS ile üç kez yıkayın.
- İkincil antikor uygulayın.
- PBS çözeltisini kültür plakasından atın.
- Karanlıkta oda sıcaklığında 30 dakika boyunca ikincil antikorlar ile hücreleri kuluçkaya yatırın.
NOT: Primer antikardiyak troponin T (TNNT2) fare monoklonal antikor% 3 BSA 1:750 bir seyreltme kullanılır. Alexa Fluor 488 konjuge ikincil keçi anti-fare antikor 1:1.000 için seyreltilmiş 3% BSA.
- Çekirdek ve aktin liflerinin ek boyanma.
- Antikor solüsyonunu çıkarın.
- PBS'deki çekirdek boyama reaktifindeki(Malzeme Tablosu)ve actin boyama reaktifinde(Malzeme Tablosu)hücreleri 30 dakika boyunca oda sıcaklığında karanlıkta kuluçkaya yatırın.
NOT: 4', 6-diamidino-2-fenilindole (DAPI) veya Hoechst 33342 nükleer boyama için kullanılabilir. - Hücreleri PBS ile üç kez yıkayın.
- Floresan mikroskobu kullanarak floresan görüntülerini yakalayın.
Sonuçlar
Başarıyla farklılaşmış hücreler mikroskop altında spontan kasılma gösterir (Video 1). Tipik olarak, kuyuların %50'si <20 gün içinde spontan kasılma gösterir(Ek Şekil 1). Kardiyak marker protein (örneğin, cTnT) başarılı farklılaşmayı doğrulamak için kullanılabilir(Şekil 2).
Tipik olarak, iskemik gruptaki hücreler, MTT tahlillerinde(Şekil 3A)ve kontraktürde normoksik kontrol grubundan daha düşük canlılık(Şekil 3E,F, Ek Şekil 2) gösterirler. Ayrıca, propidium iyodür pozitif hücrelerin oranı iskemik grupta kontrol grubuna göre daha yüksektir(Şekil 3B-D), hangi yüksek hücresel hasar gösterir.

Şekil 1: imageJ kullanarak yer değiştirme vektör analizi için klasör yapısı.
"joblist.txt" her satırda film dosyalarına giden yolu açıklar. Çözümlenecek üç dosya varsa, "analyze.avi" (ilgi çekici film) yerleştirilmeleri gereken üç klasör (movie1, movie2 ve movie3) olacaktır. Analiz "vector_analysis.ijm" kodu ile yapıldıktan sonra, her film klasöründe dosyalar (mavi renkle gösterilir) oluşturulur. Her dosyada depolanan bilgiler ana metinde ayrıntılı olarak açıklanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
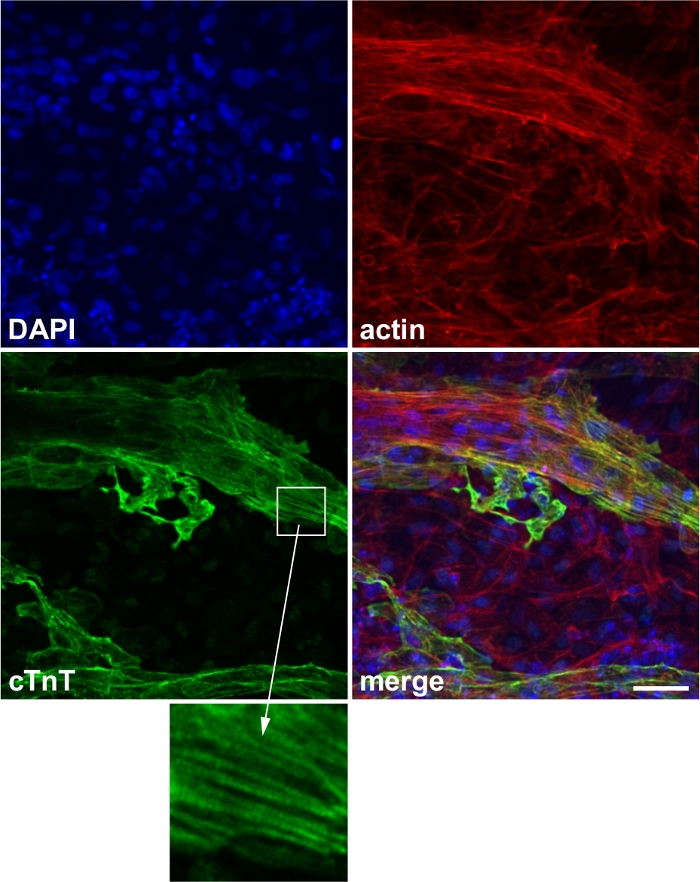
Şekil 2: Kardiyak marker boyama temsili görüntü.
Kardiyak marker protein kardiyak troponin T (cTnT) ifadesi. Mavi: 4',6-diamidino-2-fenilindole (DAPI), kırmızı: aktin, yeşil: cTnT. Inset: sarcomere yapısına karşılık gelen cTnT,. Ölçek çubuğu, 50 μm. Bu rakam Wei ve ark.13'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
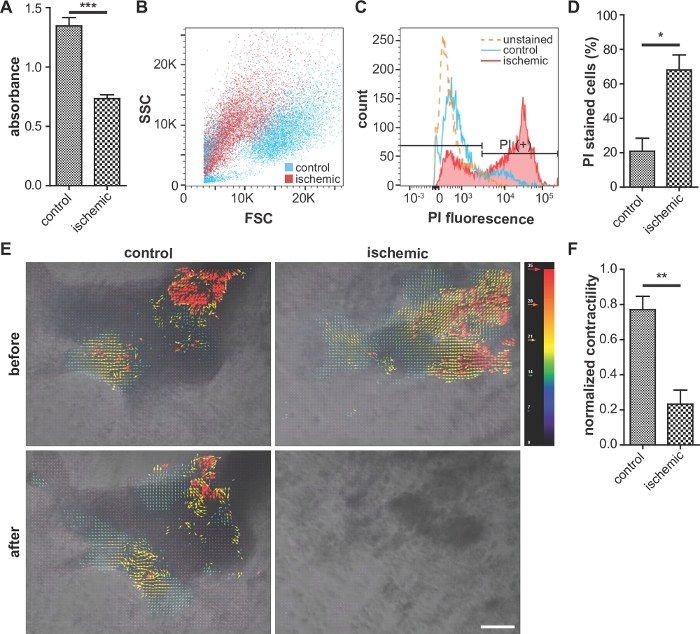
Şekil 3: Hücresel canlılık titreci, hücresel hasarın değerlendirilmesi ve kontraktilliğin temsili görüntüleri.
(A) Hücresel canlılığın karşılaştırılması (MTT tsası). Daha yüksek absorbans daha yüksek canlılık gösterir. n = 5 her koşul için. (B, C ve D) Propidium iyodür (PI) lekeli hücrelerin akış sitometri analizi. İskemik hücreler kontrolile karşılaştırıldığında, daha az ileri dağılım yoğunluğu ve artmış PI floresansı sergilerler. (D) Akış sitometri analizinde PI lekeli hücrelerin yüzdesi. n = 3 her koşul için. (E) ImageJ yazılımı kullanılarak iPS-CM'lerin sözleşmeanalizi. Kırmızı ve mavi vektörler sırasıyla en büyük ve en küçük kasılmaları gösterir. Ölçek çubuğu, 100 μm. (F) kod kullanarak iPS-CM sözleşmesinin nicel analizi. kontrol için n = 3 ve iskemik durum için n = 8. Hata çubukları ortalamanın standart hatasını temsil ediyor. İstatistiksel analiz için, eşleşmemiş iki kuyruklu öğrencinin t-testi yapıldı. *: p < 0.05, **: p < 0.01. : p < 0.0001. Bu rakam Wei ve ark.13bu rakamın daha büyük bir sürümünü görmek için lütfen buraya tıklayın alıntıdır.
Video 1: Diferansiye hücreler mikroskop altında spontan kasılma gösterir. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Şekil 1: Kaplan-Meier spontan kasılma olmadan örneklerin yüzdesinin analizi. iPS-CM örneklerinin %50'si 20. 30. günde, örneklerin %64.4'ü kasılma gösterdi. n = 83 olarak Bu rakamı indirmek için lütfen tıklayınız.
Ek Şekil 2: Kardiyak kontrformitenin değerlendirilmesi. 24 saat hipoksiye maruz kalmadan önce ve sonra kontrol ve iskemik gruplar için analiz noktaları (x, y) sayısına göre sözleşme C bölünmesi ile elde edilen ölçekli sözleşme. kontrol için n = 3 ve iskemik durum için n = 8. Bu rakamı indirmek için lütfen tıklayınız.
Ek Şekil 3: Kardiyomiyosit içeriğinin değerlendirilmesi. 96 kuyu plakası üzerinde kardiyak marker proteinin immünboylemi. Yeşil: cTnT, Mavi: DAPI. CTnT lekeli bölgenin alanı DAPI lekeli bölgeye bölünerek diferansiye hücrelerin oranı %20,7 ± %9,6 olarak hesaplandı. Ölçek çubuğu = 1 mm. n = 4 kontrol koşulu için. Bu rakamı indirmek için lütfen tıklayınız.
Ek Kodlama Dosyası. Bu dosyayı indirmek için lütfen buraya tıklayınız.
Tartışmalar
Araştırmacılar genellikle İhD deneyleri yapmak için laboratuvar küçük hayvan modelleri kullanın. Burada, bu tür deneylericra etmek için insan İhD'nin bir hücre kültürü modelini geliştirdik.
Bu protokolün bir kullanıcı karşılaşabileceği temel sorun farklılaştırılmış kardiyomiyosit lerin düşük oranda karşılaşAbileceği. Başarılı farklılaşma oranını artırmak için büyük bir özenle birkaç adım atılmalıdır: (a) hücre bölünmesi enzimleri reaktifi ilave edildikten sonra hücreler kolayca ayırmak, çünkü pipetleme nazik olmak, (b) Y-27632'yi eklemek, ayrışırken iPS hücrelerinin hayatta kalma oranını arttırır ve (c) farklılaşmanın başlangıcındaki orta değişikliklerin zamanlaması, farklılaşmada yer alan genlerin kontrollü bir şekilde ifade edilmesini sağlamak için tam olarak 48 saat arayla olmalıdır.
Kültür plakasının yüzeyinin kaplanmasında kullanılan hücre dışı matriks proteinleri ile ilgili olarak, bu protokolde kullandığımız laminin dışındaki diğer malzemeler de kullanılabilir. Örneğin, Matrigel14,15, ve jelatin16,17 hiPSCs besleyici ücretsiz bakım kültürü için kullanılır. Haraguchi ve ark göre, Matrigel üzerinde tohumlu hiPSCs başarıyla kardiyak hücre levha18olarak ayırt edildi.
HiPSC'lerden elde edilen kardiyomiyositler kullanılarak hastalık modellemesi için kültür modelleri ile ilgili daha önceki çalışmalar vardır. İskemi-reperfüzyon hasarının modelleştirilmesi ile ilgili olarak, hiperkalemi, asidoz ve laktat birikimi gibi hücresel çevrenin manipülasyonları19. Diğer yöntemler arasında oksijen difüzyonu engellemek için hücre peletleme20 ve siyanür kullanarak metabolik inhibisyonu21. Mevcut protokolde, hücre hasarı nispeten basit bir yöntem, yani oksijen ve besin 24 saat yoksunluk ile elde edildi. Ancak, iskemik kalp hastalığının doğru patofizyolojik süreçlerini göz önünde bulundurmaya özen gerekir, çünkü in vivo hastalığı ile mevcut protokolün hastalık modeli arasında üç boyutlu hücresel çevre ve kan varlığı veya yokluğu gibi gerçekten farklılıklar vardır.
Kardiyomiyosit fonksiyonunun değerlendirilmesinin teknolojik yönü ile ilgili olarak, Toepfer ve ark. hiPS-CMs22sarcomere daralma ve gevşeme belirlemek için bir MatLab tabanlı algoritma bildirdi. Smith ve ark. gelişmiş nanotopografik desenli çok elektrot dizileri 23 kullanarak, hiPS-CMs türetilen heyecanlı hücrelerin yüksek iş lenme elektrofizyolojik analizi gelişmiş bir yöntem bildirdi23,24. Protokolümüzün avantajı, imageJ yazılımı ve 96 kuyulu plakalar gibi sadece geleneksel yazılım ve sarf malzemeleri gerektirmesidir.
Kalpteki oksijen seviyesine göre kalbe ulaşan damarlarda oksijen basıncının 40 mmHg25olduğu düşünülmektedir. McDougal ve ark.'ya göre hipoksi altındaki ekstrasellüler oksijen basıncının <12.8 mmHg26olduğu tahmin edilmektedir. 27.Rounds yöntemi uygulanarak, mevcut protokolle tedavi edilen 37 °C'de hipoksik durum altında (tuzluluk: 35)) kültür ortamındaki oksijen basıncı yukarıdaki tahminden daha yüksek olan 14,9 mmHg olarak hesaplanır. İlginçtir, Al-Ani ve ark kültür orta oksijen basıncı bir gradyan olduğunu bildirdi, ve oksijen basıncı hücre tipi etkilenir, tohumlama yoğunluğu, ve orta hacim28. Tipik olarak, hücrelerin yaşadığı kültür plakasının altındaki oksijen konsantrasyonu en düşüktür. Bu nedenle, kültür ortamı derinlik etkisi daha da hiPS-CMs yakın etkili oksijen basıncı azaltacaktır. HiPS-CM'lere hipoksik durum la yeterli hasar vermek için ortamın derinliğine ve hücre yoğunluğuna dikkat edilmelidir.
İnsan kardiyak miyositlerinin fizyolojik koşullarına çok yakın olan hiPS-CM modelimiz insan İhD'sini avantajlı bir şekilde taklit etmektedir. Hayvan modeline dayalı yaklaşımlar etik, teknik ve akademik konuları içerir. Özellikle, in vivo modelleri tekrarlanabilir veri elde etmek için mikrocerrahi gelişmiş bir teknik gerektirir: örneğin, kemirgenler sol koroner arterin anterior inen dalı oklüzyon3. Burada açıklanan hiPS-CM modeli bu kritik engelleri aşar ve kardiyovasküler hastalıklar için yararlı, alakalı ve tekrarlanabilir bir platform sağlar.
Ancak, bazı sınırlamalar belirtilmelidir. iPS'ye bağlı kardiyomiyositler ile normal kardiyomiyositler arasındaki bariz fark T-tübüllerinyokluğu29'durve çalışmamızda lökositlerin neden olduğu doku hasarı ve kompleman sisteminin aktivasyonu gibi mizahi faktörleri içermedik. Ayrıca bu modelde diferansiye kardiyomiyosit oranı (20.7 ± %9.6, Ek Şekil 3)artırılmalıdır. Halloin ve ark. tarafından son yayın belirteçleri30tarafından herhangi bir seçim gerek kalmadan kimyasal WNT yol modülatörleri tarafından hiPS-CM saflık >95% hiPS-CM saflık neden ölçeklenebilir, kimyasal olarak tanımlanmış bir yöntem açıklar. Bununla birlikte, insan İhD modelimiz nispeten basit ve klinik olarak uygulanabilirdir (örn. hasta kaynaklı iPS hücreleri kullanılarak ilaç taraması). Modelimiz aynı zamanda IHD'lerin altında yatan mekanizmaları daha da açıklamak için benzersiz bir platformdur.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma JSPS KAKENHI, Ortak Uluslararası AraştırmaYı Destekleme Fonu (Ortak Uluslararası Araştırmayı Teşvik Etmek), 17KK0168 tarafından desteklenmiştir. Yazarlar minnetle Merkezi Araştırma Laboratuvarı, Okayama Üniversitesi Tıp Fakültesi FACS yardımı için kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Actin staining reagent (ActinRed 555 ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37112 | |
| Anti cardiac troponin T antibody | Thermo Fisher Scientific, Waltham, MA, USA | MA5-12960 | |
| Cardiomyocyte maintenance medium (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Cell dissociation enzymes (TrypLE Select) | Thermo Fisher Scientific, Waltham, MA, USA | 12563011 | |
| Differentiation medium A (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Differentiation medium B (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| FACS Aria III system | BD Biosciences, San Jose, CA, USA | ||
| Fluorescenct microscope | KEYENCE, Osaka, Japan | BZ-X710 | |
| Goat anti-mouse Alexa Fluor 488 secondary antibody | Thermo Fisher Scientific, Waltham, MA, USA | A28175 | |
| Human iPS cells | RIKEN, Tsukuba, Japan | 201B7 | |
| Hypoxic incubator | SANYO, Osaka, Japan | MCO-175M | |
| iPSC growth medium (Essential 8 Medium) | Thermo Fisher Scientific, Waltham, MA, USA | A1517001 | |
| iPSC maintenance medium (StemFit AK02N) | Ajinomoto, Tokyo, Japan | RCAK02N | |
| Laminin (iMatrix-511) | Nippi, Tokyo, Japan | iMatrix-511 | |
| MTT assay kit (MTT Cell Proliferation Assay Kit) | Cayman Chemical Company, Ann Arbor, MI, USA | 10009365 | |
| Nucleus staining reagent (NucBlue Fixed Cell ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37606 | |
| Triton X-100 | Nacalai Tesque, Kyoto, Japan | 35501-02 |
Referanslar
- Naghavi, M. Global Burden of Disease Self-Harm, C. Global, regional, and national burden of suicide mortality 1990 to 2016: systematic analysis for the Global Burden of Disease Study 2016. BMJ. 364, 94 (2019).
- Nowbar, A. N., Gitto, M., Howard, J. P., Francis, D. P., Al-Lamee, R. Mortality From Ischemic Heart Disease. Circulation: Cardiovascular Quality and Outcomes. 12 (6), 005375 (2019).
- Oh, J. G., Ishikawa, K. Experimental Models of Cardiovascular Diseases: Overview. Methods in Molecular Biology. 1816, 3-14 (2018).
- Brodehl, A., et al. Human Induced Pluripotent Stem-Cell-Derived Cardiomyocytes as Models for Genetic Cardiomyopathies. International Journal of Molecular Sciences. 20 (18), (2019).
- Garbern, J. C., et al. Inhibition of mTOR Signaling Enhances Maturation of Cardiomyocytes Derived from Human Induced Pluripotent Stem Cells via p53-Induced Quiescence. Circulation. , (2019).
- Horikoshi, Y., et al. Fatty Acid-Treated Induced Pluripotent Stem Cell-Derived Human Cardiomyocytes Exhibit Adult Cardiomyocyte-Like Energy Metabolism Phenotypes. Cells. 8 (9), (2019).
- Hu, D., et al. Metabolic Maturation of Human Pluripotent Stem Cell-Derived Cardiomyocytes by Inhibition of HIF1alpha and LDHA. Circulation Research. 123 (9), 1066-1079 (2018).
- Correia, C., et al. Distinct carbon sources affect structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Scientific Reports. 7 (1), 8590 (2017).
- Yang, X., et al. Tri-iodo-l-thyronine promotes the maturation of human cardiomyocytes-derived from induced pluripotent stem cells. Journal of Molecular and Cellular Cardiology. 72, 296-304 (2014).
- Tamargo, J., et al. Genetically engineered mice as a model for studying cardiac arrhythmias. Frontiers in Bioscience. 12, 22-38 (2007).
- Tseng, Q., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Wei, H., Wang, C., Guo, R., Takahashi, K., Naruse, K. Development of a model of ischemic heart disease using cardiomyocytes differentiated from human induced pluripotent stem cells. Biochemical and Biophysical Research Communications. 520 (3), 600-605 (2019).
- Ghaedi, M., Niklason, L. E. Human Pluripotent Stem Cells (iPSC) Generation, Culture, and Differentiation to Lung Progenitor Cells. Methods in Molecular Biology. 1576, 55-92 (2019).
- Hou, J., et al. Retaining mTeSR1 Medium during Hepatic Differentiation Facilitates Hepatocyte-Like Cell Survival by Decreasing Apoptosis. Cellular Physiology and Biochemistry. 51 (4), 1533-1543 (2018).
- Yoshida, K., et al. Differentiation of mouse iPS cells into ameloblast-like cells in cultures using medium conditioned by epithelial cell rests of Malassez and gelatin-coated dishes. Medical Molecular Morphology. 48 (3), 138-145 (2015).
- Guzzo, R. M., Drissi, H. Differentiation of Human Induced Pluripotent Stem Cells to Chondrocytes. Methods in Molecular Biology. 1340, 79-95 (2015).
- Haraguchi, Y., Matsuura, K., Shimizu, T., Yamato, M., Okano, T. Simple suspension culture system of human iPS cells maintaining their pluripotency for cardiac cell sheet engineering. Journal of Tissue Engineering and Regenerative. 9 (12), 1363-1375 (2015).
- Chen, T., Vunjak-Novakovic, G. In vitro Models of Ischemia-Reperfusion Injury. Regenerative Engineering and Translational Medicine. 4 (3), 142-153 (2018).
- Strijdom, H., Genade, S., Lochner, A. Nitric Oxide synthase (NOS) does not contribute to simulated ischaemic preconditioning in an isolated rat cardiomyocyte model. Cardiovascular Drugs and Therapy. 18 (2), 99-112 (2004).
- Cavalheiro, R. A., et al. Potent cardioprotective effect of the 4-anilinoquinazoline derivative PD153035: involvement of mitochondrial K(ATP) channel activation. PLoS One. 5 (5), 10666 (2010).
- Toepfer, C. N., et al. SarcTrack. Circulation Research. 124 (8), 1172-1183 (2019).
- Smith, A. S. T., et al. NanoMEA: A Tool for High-Throughput, Electrophysiological Phenotyping of Patterned Excitable Cells. Nano Letters. , (2019).
- Smith, A. S., Macadangdang, J., Leung, W., Laflamme, M. A., Kim, D. H. Human iPSC-derived cardiomyocytes and tissue engineering strategies for disease modeling and drug screening. Biotechnology Advances. 35 (1), 77-94 (2017).
- Sitkovsky, M., Lukashev, D. Regulation of immune cells by local-tissue oxygen tension: HIF1 alpha and adenosine receptors. Nature Reviews Immunology. 5 (9), 712-721 (2005).
- McDougal, A. D., Dewey, C. F. Modeling oxygen requirements in ischemic cardiomyocytes. Journal of Biological Chemistry. 292 (28), 11760-11776 (2017).
- Rounds, S. A., Wilde, F. D., Ritz, G. F. Chapter A6. Section 6.2. Dissolved oxygen. Report No. 09-A6.2. , (2006).
- Al-Ani, A., et al. Oxygenation in cell culture: Critical parameters for reproducibility are routinely not reported. PLoS One. 13 (10), 0204269 (2018).
- Cadet, J. S., Kamp, T. J. A Recipe for T-Tubules in Human iPS Cell-Derived Cardiomyocytes. Circulation Research. 121 (12), 1294-1295 (2017).
- Halloin, C., et al. Continuous WNT Control Enables Advanced hPSC Cardiac Processing and Prognostic Surface Marker Identification in Chemically Defined Suspension Culture. Stem Cell Reports. 13 (2), 366-379 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır