Method Article
Модель ишемической болезни сердца и видео-сравнение кардиомиоцитов схватки с использованием hiPSC-производных кардиомиоцитов
В этой статье
Резюме
Мы представляем модель ишемической болезни сердца с использованием кардиомиоцитов, полученных из индуцированных человеком плюрипотентных стволовых клеток, вместе с методом количественной оценки повреждения тканей, вызванного ишемией. Эта модель может обеспечить полезную платформу для скрининга лекарств и дальнейших исследований ишемической болезни сердца.
Аннотация
Ишемическая болезнь сердца является основной причиной смерти во всем мире. Поэтому он был предметом огромного количества исследований, часто с мелкими животными моделями, такими как грызуны. Тем не менее, физиология человеческого сердца значительно отличается от сердца грызунов, подчеркивая необходимость клинически значимых моделей для изучения сердечных заболеваний. Здесь мы представляем протокол для моделирования ишемической болезни сердца с использованием кардиомиоцитов, дифференцированных от индуцированных человеком плюрипотентных стволовых клеток (hiPS-CMs) и количественной оценки ущерба и функциональных нарушений ишемических кардиомиоцитов. Воздействие 2% кислорода без глюкозы и сыворотки увеличивает процент травмированных клеток, что указывается на окрашивание ядра йодидом пропидия, и снижает клеточную жизнеспособность. Эти условия также снижают контрактность hiPS-CMs, что подтверждается анализом векторных векторов смещения микроскопических видеосъемок. Этот протокол может также обеспечить удобный метод для персонализированного скрининга снадобья путем облегчать пользу клеток hiPS от индивидуальных пациентов. Таким образом, эта модель ишемической болезни сердца, основанная на iPS-CMs человеческого происхождения, может обеспечить полезную платформу для скрининга наркотиков и дальнейших исследований ишемической болезни сердца.
Введение
Ишемическая болезнь сердца (ИБС) признана во всем мире в качестве основной причины смерти, и, по оценкам, она несет ответственность за более чем девять миллионов смертельных исходов в 2016году 1. Распространенность сердечно-сосудистых заболеваний продолжает расти, и глобализация, как представляется, способствовала распространенности факторов риска сердечных заболеваний в развивающихся странах. Таким образом, изучение ИБС становится все более актуальным2.
Экспериментальные модели сердечно-сосудистых заболеваний имеют решающее значение для изучения механизмов заболевания, точности диагностики и разработки новых методов лечения. Многие лаборатории предложили несколько экспериментальных моделей. Крайне важно выбрать модель со значительными преимуществами; осуществимость, повторяемость и сходство с болезнью человека являются ключевыми факторами при выборе моделей сердечно-сосудистыхзаболеваний 3. Человеческие индуцированные плюрипотентные стволовые клетки (гипСК), несущие специфические кардиомиопатия связанных мутаций являются перспективной альтернативой животныхмоделей 4. Хотя многие стратегии были описаны для индуцирования кардиомиоцитовс использованиемiPSCs 5,6,7,8,9, здесь мы предоставляем простой метод для производства модели IHD с использованием кардиомиоцитов отличается от hiPSCs, в котором трудоемкий выбор кардиомиоцитов с использованием маркеров не применяется. В этом методе, кардиомиоциты выбираются функционально путем анализа спонтанного сокращения.
Индукция кардиомиоцитов с использованием hiPSCs позволяет избежать жертвоприношений животных и технически сложной хирургии. Создание животных моделей IHD требует сложных хирургическихметодов 10. Идеально имитировать различные патофизиологические аспекты сердечных заболеваний человека, такие как пульс и потенциал действия от физиологии грызунов практически невозможно. В сочетании с моралью и этикой использования моделей животных, разработка новых экспериментальных моделей, помимо моделей животных, является настоятельной необходимостью. Кардиомиоциты, дифференцированные от клеток iPS человека, лучше имитируют физиологическое состояние сердца человека. В этом протоколе мы устанавливаем модель ИБС с использованием кардиомиоцитов, полученных из клеток hiPS (hiPS-CMs). В нашей модели лишение кислорода и глюкозы приводит к снижению контрактной силы и жизнеспособности hiPS-CMs. Наш метод обеспечивает новый подход к модели IHD и демонстрирует новую платформу для изучения этого заболевания.
протокол
1. культура обслуживания hiPSC
- Пальто шесть хорошо культуры пластины с ламинином( Таблица материалов).
- Разбавить ламинин до 0,5 мкг/мл в фосфатном буферном солевом растворе (PBS).
- Добавьте разбавленный ламинин в шестиясную пластину объемом 2,0 мл/колодец.
- Инкубировать тарелку при 37 градусов по Цельсию в течение 30 мин.
- Удалите раствор ламинина из колодцев.
- Семена hiPSCs в 2 мл iPSC обслуживания среды(Таблица материалов) на покрытие скважин при плотности 3 × 104 клеток / хорошо без высыхания поверхности.
- Субкультура hiPSCs.
- Подготовка 0,5× ферментов диссоциации клеток(Таблица материалов)раствор.
- Смешайте 10 МЛ 0,5 М этилендиаминтетраатетик (ЭДТА) и 10 мл PBS, чтобы сделать 0,5 мМ EDTA/PBS.
- Разбавить 10 мл 1× ферментов диссоциации клеток до 0,5×, добавив 10 мл 0,5 мМ EDTA/PBS.
- Аспирировать потраченную среду из скважин.
- Добавить 2 мл / хорошо PBS для мытья клеток, а затем отказаться от PBS.
- Добавьте 800 МКЛ из ферментов диссоциации клеток 0,5× и инкубировать клетки в течение 7 мин при 37 градусов по Цельсию во влажном инкубаторе, содержащем 5% CO2.
ПРИМЕЧАНИЕ: 0,05% трипсина-ЭДТА могут быть использованы для разобщения клеток. - Аккуратно удалите раствор ферментов диссоциации × 0,5%.
- Вымойте клетки с 2 мл PBS, а затем отбросить PBS.
ПРИМЕЧАНИЕ: Будьте нежны, потому что клетки легко отсоединяются после добавления раствора ферментов диссоциации клеток. - Добавьте 1 мл среды обслуживания iPS(Таблица материалов),содержащую 10 МК Y-27632.
ПРИМЕЧАНИЕ: Добавление Y-27632 увеличивает выживаемость hiPSCs. - Выбить клетки с помощью клеточного скребка, и собирать их в 15 мл центрифуги трубки.
- Подсчитайте количество ячеек. Отрегулируйте плотность ячейки до 1,5 × 104 ячейки/мл, добавив среду обслуживания iPS, содержащую 10 МК Y-27632.
ПРИМЕЧАНИЕ: Не используйте центрифугу для предотвращения повреждения клеток. - Семя 2 мл клеточной смеси на пластине с ламинином покрытием из шести колодец (окончательная плотность: 3 × 104 клеток/хорошо).
- Инкубировать клетки при 37 градусов по Цельсию во влажном инкубаторе, содержащем 5% CO2.
- Замените культурную среду средой обслуживания iPS без Y-27632 в дни 1, 4, 5 и 6.
- Подготовка 0,5× ферментов диссоциации клеток(Таблица материалов)раствор.
- Субкультура клеток на 7-й день.
ПРИМЕЧАНИЕ: Субкультура клеток на день 7 для того, чтобы ингибировать случайную дифференциацию hiPSCs.
2. Индукция сердечной дифференциации hiPSCs
- Пальто 96-ну культуры пластины с ламинином(Таблица материалов).
- Разбавить ламинин до 1,675 мкг/мл с помощью PBS.
- Добавьте разбавленный раствор ламинина в пластину 96-колодец объемом 0,1 мл/колодец.
- Инкубировать тарелку при 37 градусов по Цельсию в течение 30 мин.
- Семена hiPSCs на 96-хорошо пластины при плотности 3 × 104 клеток / хорошо.
- Пролиферировать hiPSCs при 37 градусов по Цельсию во влажном инкубаторе, содержащем 5% CO2.
- Один день спустя, заменить средний с 200 йл / хорошо iPS среднего роста(Таблица материалов).
- Изменение среды каждый день в течение дополнительных 2-3 дней, пока клетки не достигнут 70%-80% слияния.
- Применить средства дифференциации.
- Аспирировать оттягченную среду и медленно заменить ее 200 йл/колодец предварительно разогретой дифференциации среды А( Таблица материалов).
- Поместите пластину при 37 градусов по Цельсию во влажный инкубатор, содержащий 5% CO2.
- После 48 ч, аспирировать средний и медленно заменить его на 200 йл / хорошо предварительно разогретой дифференциации среды B (Таблица материалов).
- Поместите пластину при 37 градусов по Цельсию во влажный инкубатор, содержащий 5% CO2.
ПРИМЕЧАНИЕ: Чрезвычайно важно, чтобы средства дифференциации были свежими. Они будут постепенно терять свой эффект дифференциации, как правило, в течение двух недель. При необходимости, aliquot свежей среде и хранить при 20 градусов по Цельсию.
- Применить кардиомиоцитов поддержания среды.
- После 48 ч, аспирировать средний и медленно заменить его на 200 йл / хорошо предварительно разогретой кардиомиоцитов поддержания среды (Таблица материалов).
- Поместите пластину при 37 градусов по Цельсию во влажный инкубатор, содержащий 5% CO2.
- Замените кардиомиоцитов дифференциации среды через день до дня 30.
ПРИМЕЧАНИЕ: Важно, чтобы продолжительность применения средств дифференциации A и B точно устанавливали до 48 ч для обеспечения точной последовательности экспрессии генов, необходимых для дифференциации.
3. Воздействие ишемии
- Лишить культурную среду питательных веществ и кислорода.
- Приготовьте модифицированную среду Eagle (DMEM) Dulbecco без глюкозы и сыворотки.
- Аспират культуры среды из колодцев 96-хорошо пластины, содержащей hiPS-CMs.
- Добавьте к скважинам среду, лишенную питательных веществ, объемом 200 мкл/колодец.
- Поместите культурную пластину в гипоксический инкубатор(Таблица материалов).
- Настоять азотный газ, и поддерживать внутреннюю концентрацию кислорода на 2% и CO2 концентрации на 5% в течение 24 ч.
- Приступайте к желаемому анализу: например,анализ жизнеспособности, оценка контрактности или оценка повреждения клеток.
4. Оценка клеточной жизнеспособности с помощью анализа МТТ
- Используйте набор анализа MTT(Таблица материалов)для количественной оценки жизнеспособности клеток.
ПРИМЕЧАНИЕ: Воздействие перекиси водорода 1 мМ в DMEM в течение 1 ч может быть использовано для повреждения клеток (положительный контроль). Воздействие перекиси водорода 0 мМ в DMEM может быть использовано для отрицательного контроля.- Добавьте 10 МКЛ реагента МТТ в клетки с помощью повторяющегося пипетора.
- Смешайте осторожно в течение одной минуты на орбитальном шейкере.
- Инкубировать клетки в течение 3-4 ч при 37 градусов по Цельсию в 5% CO2 инкубатора. После инкубации, formazan производится в клетках появится как темные кристаллы в нижней части колодцев.
- После удаления супернатанта растворите нерастворимые кристаллы formazan в 100 йл раствора диметилового сульфоксида (DMSO). Этот раствор растворит кристаллы formazan, производя фиолетовый раствор.
ВНИМАНИЕ: DMSO может раздражать глаза, дыхательную систему и кожу. Носите подходящие перчатки и защиту глаз/лица. - Измерьте абсорбтность каждого образца с помощью микропластиного считыватель на длине волны 570 нм.
5. Оценка контрактности iPS-CMs
- Если не установлен, получить Particle Image Velocimetry ImageJ плагин11 на https://sites.google.com/site/qingzongtseng/piv и установить.
- Используя фазовый контрастный микроскоп, записыв видео изображения hiPS-CMs с помощью объектива 4× объектива со 20 кадров в секунду за 10 с, и сохраните как "analyze.avi". Для сравнения договорности между до и после ишемии, подтвердить, что место интереса регистрируется.
ПРИМЕЧАНИЕ: Микроскоп с автоматизированной стадией полезен для таргетинга на место, которое представляет интерес. Файл фильма должен быть в формате .avi для более позднего анализа. Если нет, конвертировать фильм в .avi. - Создание структуры папок, как указано на рисунке 1. Пример "joblist.txt" указан в дополнительном файле.
- Проанализируйте дискретные двумерные векторные поля клеточного смещения.
- Запуск Фиджи (ImageJ)программное обеспечение 12, перейдите на vector_analysis Плагины
- Нажмите Вы запустите. Анализ будет проводиться автоматически.
ПРИМЕЧАНИЕ: Векторы перемещения D (x,y) рассчитываются на каждые 16 × 16 пикселей между эталонным кадром (первый кадр) и всеми последующими кадрами (кадры 1 против 2, 1 против 3, 1 против 4 и т.д.). Результат рассчитывается для каждого кадра и сохраняется как "vec_x.txt"(x - это номер кадра). Вектор максимального смещения, M (x, y), определяется для каждой пары (x, y) следующим образом: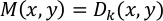
где k представляет номер кадра, на котором Dk (x,y) D2 (x,y) D3 (x,y) , ..., Dn (x,y) и n обозначает последний кадр. Результат сохраняется как "Max_vector.txt". | М(x, у) представляет собой максимальное смещение, вызванное сокращением кардиомиоцитов в точке анализа (x, y). Стоимость контракта C в произвольных единицах рассчитывается следующим образом: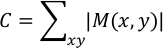
Это значение сохраняется в столбце 7, строка 1 в "Max_vector.txt". C представляет сумму смещения для всех (x, y). Чем больше часть, где смещение из-за сокращения миокарда является большим, тем больше значение C. Векторное поле максимального смещения, M (x, y), накладывается фазово-контрастным изображением первого кадра ("Phase_contrast.png") и сохраняется как "Overlaid.png". Поскольку величина вектора смещения рассчитывается на основе первого кадра видео, предпочтительнее, чтобы hiPS-CMs были в диастолическом периоде для первого кадра.
6. Оценка повреждения клеток с использованием цитометрии потока
- Разбавить 1 мг/мл раствора йодида пропидия до 1:1,000 в PBS.
- Окрашивайте отдельные клетки йодидом пропидия.
- Аспирировать средний и поместить его в соответствующим размером центрифуги трубки.
- Центрифуга трубки при 1000 × в g течение 5 минут, и тщательно удалить супернатант, чтобы не потерять осадочные клетки.
- Инкубировать клетки с разбавленным раствором йодида пропидия при комнатной температуре в течение 15 минут в темноте.
- Центрифуга трубки при 1000 × в g течение 5 минут, и тщательно удалить супернатант, чтобы не потерять осадочные клетки.
- Восстановить клетки в 1 мл PBS.
ПРИМЕЧАНИЕ: Важно собирать отдельные плавающие клетки из среды для точной количественной оценки повреждения клеток.
- Пятно прикрепленных клеток с йодидом пропидия.
- Вымойте прикрепленные клетки дважды с PBS мягко, а затем отбросить PBS.
- Инкубировать клетки с разбавленным раствором йодида пропидия в течение 15 минут в темноте.
- Аспирировать раствор йодида пропидия.
- Отсоедините клетки с помощью 0,25% трипсина. Перемести клеточный раствор в центрифугу.
- Центрифуга трубки при 1000 × в g течение 5 минут, и тщательно удалить супернатант, чтобы не потерять осадочные клетки.
- Восстановить клетки в 1 мл PBS.
- Смешайте плавающие и прикрепленные клетки для анализа флуоресценции активированной сортировки клеток (FACS).
- Перейдите решение ячейки через фильтр 30 мкм.
ПРИМЕЧАНИЕ: Передача ячеек фильтру очень важна для точного измерения FACS. - Проанализируйте образцы с помощью системы FACS.
7. Иммуностимулятор
- Исправьте образец клетки.
- Аспирировать культурную среду.
- Добавить 4% параформальдегид в PBS в течение 10 мин при комнатной температуре.
- Вымойте клетки три раза с PBS.
ПРИМЕЧАНИЕ: Для оптимальной фиксации рекомендуется свежее решение параформальдегида.
- Permeabilize клетки с 0,2% Тритон X-100 в течение 15 минут, а затем отказаться от реагента.
- Добавьте 3% альбумин сыворотки крупного рогатого скота, чтобы блокировать клетки в течение 30 минут.
- Применяют первичные антитела.
- Откажитесь от раствора альбумин сыворотки крупного рогатого скота из пластины культуры.
- Инкубировать клетки с первичными антителами на ночь при 4 градусов по Цельсию.
- Удалите раствор антитела.
- Вымойте клетки три раза с PBS.
- Применяем вторичные антитела.
- Откажитесь от решения PBS из пластины культуры.
- Инкубировать клетки вторичными антителами в течение 30 мин при комнатной температуре в темноте.
ПРИМЕЧАНИЕ: Первичный анти-сердечный тропонин T (TNNT2) моноклональные антитела мыши используется при разбавлении 1:750 в 3% BSA. Alexa Fluor 488-конъюгированных вторичных коз анти-мышь антитела разбавляется до 1:1,000 в 3% BSA.
- Дополнительное окрашивание ядер и актиновых волокон.
- Удалите раствор антитела.
- Инкубировать клетки в ядре окрашивания реагента (Таблица материалов) и актин окрашивания реагента (Таблица материалов) в PBS в течение 30 мин при комнатной температуре в темноте.
ПРИМЕЧАНИЕ: 4', 6-diamidino-2-фенилиндол (DAPI) или Hoechst 33342 могут быть использованы для ядерного окрашивания. - Вымойте клетки три раза с PBS.
- Захват флуоресценции изображения с помощью флуоресценции микроскопа.
Результаты
Успешно дифференцированные клетки показывают спонтанное сжатие под микроскопом(Видео 1). Как правило, 50% скважин показывают спонтанное сокращение в lt;20 дней(Дополнительный рисунок 1). Сердечный маркер белка (например, cTnT) может быть использован для подтверждения успешной дифференциации (Рисунок 2).
Как правило, клетки из ишемической группы показывают более низкую жизнеспособность в анализахMTT (рисунок 3A)и контрактность(рисунок 3E,F, Дополнительный рисунок 2), чем у нормоксической контрольной группы. Кроме того, соотношение пропидий йодид-положительных клеток выше в ишемической группе, чем в контрольной группе(рисунок 3B-D), что указывает на более высокий уровень повреждения клеток.

Рисунок 1: Структура folder для анализа вектора перемещения с помощью imageJ.
"joblist.txt" описывает путь к файлам фильмов каждой строки. Если есть три файла для анализа, будет три папки (movie1, movie2 и movie3), в которых "analyze.avi" (фильм, представляющий интерес) должны быть размещены. После того, как анализ выполняется кодом "vector_analysis.ijm", файлы будут генерироваться (указанные синим цветом) в каждой папке фильма. Информация, хранящаяся в каждом файле, подробно описана в основном тексте. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
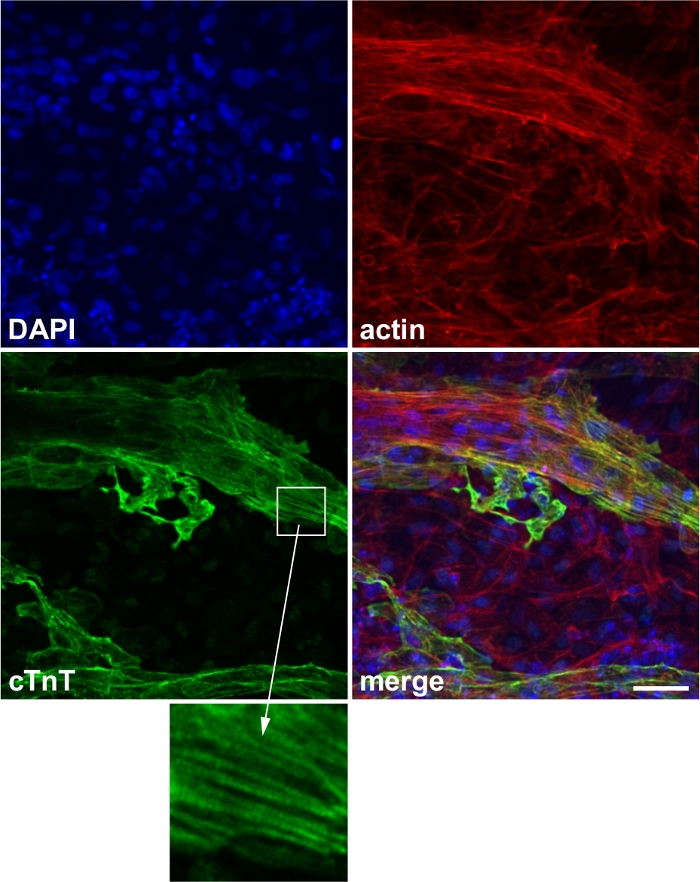
Рисунок 2: Репрезентативное изображение окрашивания сердечного маркера.
Выражение сердечного маркера белка сердечный тропонин Т (cTnT). Синий: 4',6-диамидино-2-фенилиндол (DAPI), красный: актин, зеленый: cTnT. Вставка: полосатый экспрессия cTnT, которая соответствует структуре саркомера. Шкала бар, 50 мкм. Эта цифра была изменена с Вэй и др.13. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
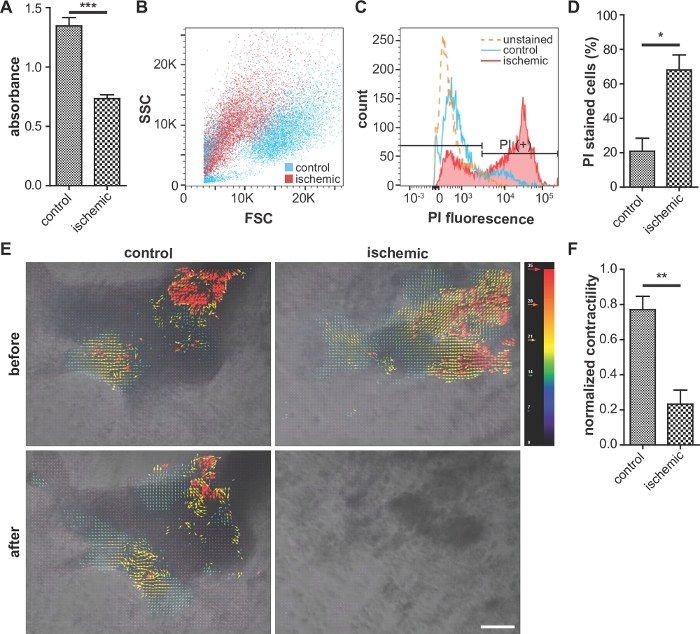
Рисунок 3: Репрезентативные изображения клеточной жизнеспособности анализа, оценки повреждения клеток, и контрактность.
(A) Сравнение жизнеспособности клеток (анализ МТТ). Более высокая абсорбтность указывает на более высокую жизнеспособность. n No 5 для каждого условия. (B, C и D) Анализ цитометрии пропидия йодида (PI)-окрашенных клеток. Ишемические клетки обладают уменьшенной интенсивностью рассеяния вперед и повышенной флуоресценцией PI, по сравнению с контролем. (D) Процент PI-окрашенных клеток в анализе цитометрии потока. n No 3 для каждого условия. (E) Анализ контрактности iPS-CMs с использованием программного обеспечения ImageJ. Красный и синий векторы указывают на самые большие и маленькие сокращения, соответственно. Шкала бар, 100 мкм. (F) Количественный анализ контрактности iPS-CM с использованием кода. n No 3 для контроля и n No 8 для ишемического состояния. Бары ошибок представляют собой стандартную ошибку среднего. Для статистического анализа был проведен неспареный двуххвостый тест студента. Вопрос: р хт; 0,05, й: р йт; 0,01. : p Lt; 0.0001. Эта цифра приводится из Вэй и др.13 Пожалуйста, нажмитездесь, чтобы просмотреть более широкую версию этой цифры.
Видео 1: Дифференцированные клетки показывают спонтанное сокращение под микроскопом. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительная цифра 1: Каплан-Мейер анализ процент образцов без спонтанного сокращения. 50% образцов iPS-CM показали сокращение на 20-й день. На 30-й день 64,4% образцов показали сокращение. n No 83. Пожалуйста, нажмите здесь, чтобы загрузить эту цифру.
Дополнительная цифра 2: Оценка сердечной контрактности. Масштабируемая контрактность, полученная путем деления контрактности С на количество точек анализа (x, y), была рассчитана на контрольные и ишемические группы до и после воздействия гипоксии 24 ч. n No 3 для контроля и n No 8 для ишемического состояния. Пожалуйста, нажмите здесь, чтобы загрузить эту цифру.
Дополнительная цифра 3: Оценка содержания кардиомиоцитов. Иммуностимулятор сердечного маркера белка на пластине 96 хорошо. Зеленый: cTnT, синий: DAPI. Скорость дифференцированных клеток была рассчитана на 20,7 ± 9,6%, разделив площадь окрашенных цТН на область, окрашенную DAPI. Масштабная планка 1 мм. n No 4 для управления состоянием. Пожалуйста, нажмите здесь, чтобы загрузить эту цифру.
Дополнительный файл кодирования. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Исследователи часто используют лабораторные модели малых животных для проведения экспериментов с ИБС. Здесь мы разработали модель клеточной культуры человеческого ИБС для проведения таких экспериментов.
Основная проблема, с которой может столкнуться пользователь этого протокола, это низкий уровень дифференцированных кардиомиоцитов. Несколько шагов следует предпринять с большой осторожностью, чтобы улучшить скорость успешной дифференциации: а) быть нежным, когда пипетки, потому что клетки легко отделить после добавления реагента ферментов диссоциации клеток, (б) добавление Y-27632 увеличивает выживаемость клеток iPS при отсоединения, и (с) сроки средних изменений в начале дифференциации должны быть точно 48 ч друг от друга, чтобы обеспечить контролируемое выражение генов, участвующих в дифференциации.
Что касается внеклеточных белков матрицы, используемых для покрытия поверхности пластины культуры, другие материалы, чем ламинин мы использовали в этом протоколе могут быть использованы. Например, Matrigel14,15, ижелатин 16,17 используются для подачи свободной культуры обслуживания hiPSCs. Согласно Haraguchi et al., hiPSCs посеянные на Matrigel успешно были продифференцированы в лист сердечной клетки18.
Есть ряд предыдущих исследований, касающихся моделей культуры для моделирования заболеваний с использованием кардиомиоцитов, полученных из hiPSCs. Что касается моделирования ишемии-реперфузии травмы, манипуляции клеточной среды, такие как гиперкалиемия, ацидоз, и накоплениелактата, были введены 19. Другие методы включают гранулирование клеток, чтобы препятствовать распространению кислорода20 и метаболические ингибирования с использованиемцианида 21. В текущем протоколе, повреждение клеток было достигнуто относительно простым методом, а именно 24 ч лишения кислорода и питательных веществ. Однако следует позаботиться о точных патофизиологических процессах ишемической болезни сердца, так как действительно существуют различия между болезнью in vivo и моделью заболевания текущего протокола, такие как наличие или отсутствие трехмерной клеточной среды и крови.
Что касается технологического аспекта оценки функции кардиомиоцитов, Toepfer et al. сообщили о алгоритме на основе MatLab для определения саркомерного сокращения и релаксации в hiPS-CMs22. Smith et al. сообщили о передовом методе высокопрофильного электрофизиологического анализа возбудимых клеток, полученных из hiPS-CMs, используя сложные нанотопографически узорчатые многоэлектрозныемассивы 23,24. Преимущество нашего протокола в том, что он требует только обычного программного обеспечения и расходных материалов, таких как программное обеспечение ImageJ и 96-колодец пластин.
Что касается уровня кислорода в сердце, давление кислорода в венах, которые достигают сердца, как полагают, 40 мм рт.ст. 25. По данным McDougal et al., внеклеточное давление кислорода при гипоксии оценивается в 12,8 мм рт.ст. Применяя метод Раундов и др.27, давление кислорода в среде культуры (соленость: 35‰) при гипоксической состоянии (2% кислорода) при 37 градусах Цельсия, обработанных текущим протоколом, рассчитывается на уровне 14,9 мм рт. ст., что выше выше выше оценки выше. Интересно, что Аль-Ани и др. сообщили, что существует градиент кислородного давления в среде культуры, и давление кислорода зависит от типа клеток, плотности посева, исредний объем 28. Как правило, концентрация кислорода в нижней части пластины культуры, где находятся клетки, является самой низкой. Таким образом, эффект глубины в среде культуры будет еще больше снизить эффективное давление кислорода вблизи hiPS-CMs. Для того, чтобы вызвать достаточный ущерб hiPS-CMs с использованием гипоксического состояния, пристальное внимание должно быть уделено глубине среды и плотности клеток.
Наша модель hiPS-CM, которая очень близка к физиологическим условиям сердечных миоцитов человека, выгодно имитирует ИБС человека. Подходы, основанные на модели животных, включают этические, технические и академические вопросы. В частности, в моделях in vivo требуется передовая методика микрохирургии для достижения воспроизводимых данных: например, окклюзия передней нисходящей ветви левой коронарной артерии угрызунов 3. Описанная в настоящем случае модель hiPS-CM преодолевает эти критические барьеры и обеспечивает полезную, релевантную и повторяемую платформу для сердечно-сосудистых заболеваний.
Однако следует отметить некоторые ограничения. Очевидная разница между iPS-индуцированных кардиомиоцитов и нормальных кардиомиоцитов является отсутствиеТ-труб 29, и мы не включают гуморальные факторы, такие как повреждение тканей, вызванных лейкоцитов и активации системы дополнения в нашем исследовании. Кроме того, следует улучшить скорость дифференцированных кардиомиоцитов в этой модели (20,7 ± 9,6%, дополнительный рисунок 3). Недавняя публикация Halloin et al. описывает масштабируемый, химически определенный метод, чтобы вызвать чистоту hiPS-CM в размере 95% от химических модуляторов пути WNT без требования какого-либо выбора маркерами30. Тем не менее, наша модель ИБС человека относительно проста и клинически применима (например, скрининг на наркотики с использованием клеток iPS, полученных пациентом). Наша модель также является уникальной платформой для дальнейшего выяснения механизмов, лежащих в основе IHD.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Это исследование было поддержано JSPS KAKENHI, Фондом содействия совместным международным исследованиям (Fostering Joint International Research), 17KK0168. Авторы с благодарностью признают Центральную исследовательскую лабораторию, Медицинскую школу Университета Окаяма за помощь FACS.
Материалы
| Name | Company | Catalog Number | Comments |
| Actin staining reagent (ActinRed 555 ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37112 | |
| Anti cardiac troponin T antibody | Thermo Fisher Scientific, Waltham, MA, USA | MA5-12960 | |
| Cardiomyocyte maintenance medium (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Cell dissociation enzymes (TrypLE Select) | Thermo Fisher Scientific, Waltham, MA, USA | 12563011 | |
| Differentiation medium A (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| Differentiation medium B (PSC Cardiomyocyte Differentiation Kit) | Thermo Fisher Scientific, Waltham, MA, USA | A2921201 | |
| FACS Aria III system | BD Biosciences, San Jose, CA, USA | ||
| Fluorescenct microscope | KEYENCE, Osaka, Japan | BZ-X710 | |
| Goat anti-mouse Alexa Fluor 488 secondary antibody | Thermo Fisher Scientific, Waltham, MA, USA | A28175 | |
| Human iPS cells | RIKEN, Tsukuba, Japan | 201B7 | |
| Hypoxic incubator | SANYO, Osaka, Japan | MCO-175M | |
| iPSC growth medium (Essential 8 Medium) | Thermo Fisher Scientific, Waltham, MA, USA | A1517001 | |
| iPSC maintenance medium (StemFit AK02N) | Ajinomoto, Tokyo, Japan | RCAK02N | |
| Laminin (iMatrix-511) | Nippi, Tokyo, Japan | iMatrix-511 | |
| MTT assay kit (MTT Cell Proliferation Assay Kit) | Cayman Chemical Company, Ann Arbor, MI, USA | 10009365 | |
| Nucleus staining reagent (NucBlue Fixed Cell ReadyProbes Reagent) | Thermo Fisher Scientific, Waltham, MA, USA | R37606 | |
| Triton X-100 | Nacalai Tesque, Kyoto, Japan | 35501-02 |
Ссылки
- Naghavi, M. Global Burden of Disease Self-Harm, C. Global, regional, and national burden of suicide mortality 1990 to 2016: systematic analysis for the Global Burden of Disease Study 2016. BMJ. 364, 94 (2019).
- Nowbar, A. N., Gitto, M., Howard, J. P., Francis, D. P., Al-Lamee, R. Mortality From Ischemic Heart Disease. Circulation: Cardiovascular Quality and Outcomes. 12 (6), 005375 (2019).
- Oh, J. G., Ishikawa, K. Experimental Models of Cardiovascular Diseases: Overview. Methods in Molecular Biology. 1816, 3-14 (2018).
- Brodehl, A., et al. Human Induced Pluripotent Stem-Cell-Derived Cardiomyocytes as Models for Genetic Cardiomyopathies. International Journal of Molecular Sciences. 20 (18), (2019).
- Garbern, J. C., et al. Inhibition of mTOR Signaling Enhances Maturation of Cardiomyocytes Derived from Human Induced Pluripotent Stem Cells via p53-Induced Quiescence. Circulation. , (2019).
- Horikoshi, Y., et al. Fatty Acid-Treated Induced Pluripotent Stem Cell-Derived Human Cardiomyocytes Exhibit Adult Cardiomyocyte-Like Energy Metabolism Phenotypes. Cells. 8 (9), (2019).
- Hu, D., et al. Metabolic Maturation of Human Pluripotent Stem Cell-Derived Cardiomyocytes by Inhibition of HIF1alpha and LDHA. Circulation Research. 123 (9), 1066-1079 (2018).
- Correia, C., et al. Distinct carbon sources affect structural and functional maturation of cardiomyocytes derived from human pluripotent stem cells. Scientific Reports. 7 (1), 8590 (2017).
- Yang, X., et al. Tri-iodo-l-thyronine promotes the maturation of human cardiomyocytes-derived from induced pluripotent stem cells. Journal of Molecular and Cellular Cardiology. 72, 296-304 (2014).
- Tamargo, J., et al. Genetically engineered mice as a model for studying cardiac arrhythmias. Frontiers in Bioscience. 12, 22-38 (2007).
- Tseng, Q., et al. Spatial organization of the extracellular matrix regulates cell-cell junction positioning. Proceedings of the National Academy of Sciences of the United States of America. 109 (5), 1506-1511 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Wei, H., Wang, C., Guo, R., Takahashi, K., Naruse, K. Development of a model of ischemic heart disease using cardiomyocytes differentiated from human induced pluripotent stem cells. Biochemical and Biophysical Research Communications. 520 (3), 600-605 (2019).
- Ghaedi, M., Niklason, L. E. Human Pluripotent Stem Cells (iPSC) Generation, Culture, and Differentiation to Lung Progenitor Cells. Methods in Molecular Biology. 1576, 55-92 (2019).
- Hou, J., et al. Retaining mTeSR1 Medium during Hepatic Differentiation Facilitates Hepatocyte-Like Cell Survival by Decreasing Apoptosis. Cellular Physiology and Biochemistry. 51 (4), 1533-1543 (2018).
- Yoshida, K., et al. Differentiation of mouse iPS cells into ameloblast-like cells in cultures using medium conditioned by epithelial cell rests of Malassez and gelatin-coated dishes. Medical Molecular Morphology. 48 (3), 138-145 (2015).
- Guzzo, R. M., Drissi, H. Differentiation of Human Induced Pluripotent Stem Cells to Chondrocytes. Methods in Molecular Biology. 1340, 79-95 (2015).
- Haraguchi, Y., Matsuura, K., Shimizu, T., Yamato, M., Okano, T. Simple suspension culture system of human iPS cells maintaining their pluripotency for cardiac cell sheet engineering. Journal of Tissue Engineering and Regenerative. 9 (12), 1363-1375 (2015).
- Chen, T., Vunjak-Novakovic, G. In vitro Models of Ischemia-Reperfusion Injury. Regenerative Engineering and Translational Medicine. 4 (3), 142-153 (2018).
- Strijdom, H., Genade, S., Lochner, A. Nitric Oxide synthase (NOS) does not contribute to simulated ischaemic preconditioning in an isolated rat cardiomyocyte model. Cardiovascular Drugs and Therapy. 18 (2), 99-112 (2004).
- Cavalheiro, R. A., et al. Potent cardioprotective effect of the 4-anilinoquinazoline derivative PD153035: involvement of mitochondrial K(ATP) channel activation. PLoS One. 5 (5), 10666 (2010).
- Toepfer, C. N., et al. SarcTrack. Circulation Research. 124 (8), 1172-1183 (2019).
- Smith, A. S. T., et al. NanoMEA: A Tool for High-Throughput, Electrophysiological Phenotyping of Patterned Excitable Cells. Nano Letters. , (2019).
- Smith, A. S., Macadangdang, J., Leung, W., Laflamme, M. A., Kim, D. H. Human iPSC-derived cardiomyocytes and tissue engineering strategies for disease modeling and drug screening. Biotechnology Advances. 35 (1), 77-94 (2017).
- Sitkovsky, M., Lukashev, D. Regulation of immune cells by local-tissue oxygen tension: HIF1 alpha and adenosine receptors. Nature Reviews Immunology. 5 (9), 712-721 (2005).
- McDougal, A. D., Dewey, C. F. Modeling oxygen requirements in ischemic cardiomyocytes. Journal of Biological Chemistry. 292 (28), 11760-11776 (2017).
- Rounds, S. A., Wilde, F. D., Ritz, G. F. Chapter A6. Section 6.2. Dissolved oxygen. Report No. 09-A6.2. , (2006).
- Al-Ani, A., et al. Oxygenation in cell culture: Critical parameters for reproducibility are routinely not reported. PLoS One. 13 (10), 0204269 (2018).
- Cadet, J. S., Kamp, T. J. A Recipe for T-Tubules in Human iPS Cell-Derived Cardiomyocytes. Circulation Research. 121 (12), 1294-1295 (2017).
- Halloin, C., et al. Continuous WNT Control Enables Advanced hPSC Cardiac Processing and Prognostic Surface Marker Identification in Chemically Defined Suspension Culture. Stem Cell Reports. 13 (2), 366-379 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены