Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vivo'da Genişlemiş Kardiyomiyopatinin Doxorubicin Kaynaklı Murine Modeli
Bu Makalede
Erratum Notice
Özet
Tarif edilen, doxorubicin'in uzun süreli intraperitoneal enjeksiyonu yoluyla farelerde Doxorubicin kaynaklı genişlemiş kardiyomiyopati (DCM) modeli oluşturmak için bir protokoldür.
Özet
Genişlemiş kardiyomiyopati (DCM), hipertansiyon, valvüler, konjenital veya iskemik kalp hastalıklarının yokluğunda ventrikül genişlemesi ve depresif kardiyak performans ile karakterize ve enfeksiyon, otoimmün veya metabolik anormallikler veya aile kalıtımı ile ilgili olabilecek heterojen miyokard bozuklukları spektrumunu ifade eder. Kötü bir prognoz ile konjestif kalp yetmezliğine doğru ilerleyebilir. Doxorubicin (Dox) yaygın olarak kemoterapötik bir ilaç olarak kullanılır, ancak miyokardda DCM benzeri değişikliklere neden olduğu için kullanımı sınırlıdır. Miyokard toksisitesi oksidatif stres, kronik inflamasyon ve kardiyomiyosit apoptoza atfedilir. Bu Dox kaynaklı DCM semptomlarından yararlanan bir DCM modeli oluşturulmamıştır.
Giriş
Kalp yetmezliğinin en yaygın nedenlerinden biri olan DCM, ventrikül dilatasyonu ve kalp fonksiyonunun azalması ile karakterizedir ve dünya çapında kalp naklinin en yaygın nedenidir1. Patogenezini daha fazla araştırmak ve etkili tedaviler bulmak için olgun hayvan modellerine erişim özellikle önemlidir. Açıklanan deneylerin amacı, insan DCM'sine benzeyen kararlı bir DCM fare modeli oluşturmaktır.
DCM'nin karmaşık patogenezleri nedeniyle, karşılık gelen hayvan modelleri yapmak için birçok farklı yöntem vardır. Spontan DCM modelleri2 nispeten kararlıdır, ancak pahalıdır ve kolayca mevcut değildir. Genetiği değiştirilmiş hayvan modelleri3 köklü değildir ve daha deneysel kullanım gerektirir. Viral enfeksiyon4 veya otoimmün defektler5 tarafından indüklenen DCM hayvan modellerinin elde etmesi kolaydır, ancak tamamen DCM'yi temsil etmezler. Miyokard toksisitesi ile ilişkili modeller arasında alkol kaynaklı DCM modelleri ve Dox kaynaklı DCM hayvan modelleri bulunur.
Dox kaynaklı kardiyomiyopati modeli Dox6'nınintraperitoneal enjeksiyonu ile elde edilir. Model Dox'un en şiddetli kronik yan etkisinden yararlanır: Dox maruziyeti sonrasında hastalar klinik homojenlik ile geç başlangıçlı DCM semptomları geliştirir7. Doksadatif stres8 ve mitokondriyal hasar9Kardiyomiyosit apoptoza yol açan DCM patogenezinde belirtilerdir. Akut ve kronik Dox tedavi modelleri vardır: tek bir yüksek doz Dox (15 mg / kg) kardiyomiyopati için kısa vadeli bir modele neden olur10, tekrarlayan düşük doz Dox enjeksiyonları (altı haftalık, 3 mg / kg) kardiyomiyopati için uzun vadeli bir modele nedenolur 11. Sunulan çalışmaya dayanarak, vahşi tip fareler intraperitoneally bir ay boyunca haftada bir kez 5 mg / kg ekran morfolojisi ve tedavinin sonuna kadar DCM özellikleri ile tutarlı kalbin histolojisi bir dozda enjekte edildi ve bir DCM modeli kurmak için ideal bir yol sağladı.
Protokol
Hayvan deneyleri Nanjing Drum Tower Hastanesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylandı.
1. Reaktiflerin ve hayvanların hazırlanması
- Doxorubicin hidroklorür (Pfizer, ABD) sterilize su içinde çözün. 1 mg/mL'lik bir Dox çözeltisi elde etmek ve 4 °C'de tutmak için girdap.
- C57BL/6 fare kullanın (8-10 haftalık; 25-30 g ağırlık). Bu çalışma için Nanjing Üniversitesi Model Hayvan Araştırma Merkezi'nden fareler satın alınmış ve Nanjing Davul Kulesi Hastanesi'nin hayvan odasında tutulmuştur.
- Patojen içermeyen fare kafesleri 23 °C sabit sıcaklıkta 12 saat açık/karanlık bir döngü altında muhafaza edildi. Tüm hayvanlar normal bir yemek diyeti ile beslendi ve yiyecek ve su reklam libitum aldı.
2. DCM hayvan modelinin kurulması
- Fareleri normal (n = 5) bir gruba ve Dox (n = 5) grubuna randomize edin.
- Dox grubu için haftada 1x mL sterilize şırıng kullanarak Dox çözeltisini intraperitoneal olarak 5 mg/ kg dozda uygulayın. Kontrol farelerini aynı miktarda tuzlu su çözeltisi ile aynı şekilde tedavi edin.
- Haftalık olarak iki grubun vücut ağırlığını ölçün. Buna göre, enjeksiyon dozunu haftalık olarak vücut ağırlığına göre toplam 4 hafta boyunca, kümülatif doz 20 mg/ kg ile ayarlayın (Şekil 1).
NOT: 4 haftalık ekokardiyografide iki grup arasında kardiyak fonksiyonda anlamlı bir fark olduğu için 4 haftalık bir zaman dilimi seçilmiştir.
3. Ekokardiyografik inceleme
- Dördüncü haftanın sonunda, farelerin ekokardiyografik incelemesini gerçekleştirin.
- Fareleri intranazal olarak% 2 izofluran ile uyuşturun. Fareler cildin bir tutamına dişli bir cımbızla yanıt vermezse veya parmakları ve kuyrukları uyarmazsa, protokole devam edin.
- Fareyi supine konumunda bir hayvan işleme platformuna yerleştirin. Anesteziyi korumak için, hayvanın burnunu ve ağzını bir burun konisi ile kapatın ve% 2 izoflurane teslim edin.
NOT: IP anestezisi için% 4 kloral hidrat 0.2 mL / 20 g dozda enjekte edin. - Göğüs kürkünü elektrikli tıraş makinesiyle dikkatlice çıkarın. Transtorasik ekokardiyografi kullanarak in vivo kardiyak fonksiyonu değerlendirin.
- LV ekokardiyogramını hem parasternal uzun eksenli hem de kısa eksenli görünümlerde 233 Hz kare hızında gerçekleştirin.
- M modundaki izlemelerde, ortalama LV uç-sistolik çapı (LVIDd), LV uç diyastolik çapı (LVID'ler), müdahale septal kalınlığını (IVS) ve LV arka duvar kalınlığını (LVPW) 3-5 kalp atışından ölçün. Ayrıca ekokardiyografiye dayanarak çıkarma fraksiyonunu (EF) ve kesir kısaltmasını (FS) hesaplayın.
4. Histolojik lekeleme
- Ekokardiyografik analizden sonra, % 10 potasyum klorürün intraventriküler enjeksiyonu ile fareleri kurban edin.
- Karaciğer ve akciğer soluklaşana kadar diseksiyondan sonra kalbi yaklaşık 30 mL salin ile perfuse edin.
- Kalbi dışarı dökün ve kanı ekstrüze etmek için fosfat tampon çözeltisinde iyice yıkayın.
- Kalbi oda sıcaklığında 24 saat boyunca% 4 formalin olarak sabitleyin ve dokuyu bir parafin kutusunda tedavi edin, böylece parafin balmumu soğur ve katır.
- Patolojik lekeleme için kalpleri 5 μm kalınlığında dilimler halinde kesin.
- Papiller kas içeren dewax ve rehidrat bölümleri.
- 30 dakika boyunca 55 °C'de kuluçkaya yaslanın. Daha sonra, her biri 2 dakika boyunca ksilen 2x'te kuluçkaya yatırın; Her biri 2 dakika için% 100 etanol 2x; Her biri 2 dakika için% 95 etanol 2x; 2 dakika boyunca% 80 etanol; 2 dakika boyunca% 75 etanol; ve 2 dakika boyunca% 50 etanol.
- Hematoksilin ve eozin (H&E) ve Masson lekesi kullanarak leke.
Sonuçlar
Kardiyak fonksiyon
Genişlemiş kardiyomiyopati progresif ventriküler dilatasyon ve kontrtil disfonksiyon ile karakterizedir. Şekil 2'de iki grubun temsili ekokardiyografik görüntüleri gösterdir. Dox ile tedavi edilen fareler belirgin şekilde azalmış sol ventrikül çıkarma fraksiyonu ve sol ventrikül fraksiyonel kısaltması gösterdi (Şekil 3A,B). LV çapı ayrıca hem diyastolik hem de sistolik fazlarda artmı?...
Tartışmalar
Dox, klinik uygulamada yaygın olarak kullanılan spesifik olmayan periyodik bir antitümör kemoterapi ilacıdır12. Ana yan etkisi kardiyomiyopatidir, kardiyomiyopati ve sonraki kalp yetmezliği ile karakterizedir13. Alttaki mekanizma miyokard lipid peroksidasyonunun hasarını, miyokard sarkoplazmik retikülum Ca2+-ATPase aktivitesinin inhibisyonunu ve miyokard lokal renin-anjiyotensin sisteminin aktivasyonunu içerir, bu da AT II üretiminin artmasına ve hü...
Açıklamalar
Çıkar çatışması bildirilmedi.
Teşekkürler
Bu çalışma Anahtar Proje Tıp Bilimi ve Teknoloji Geliştirme Vakfı, Nanjing Sağlık Bakanlığı (No.YKK16098) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
Referanslar
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
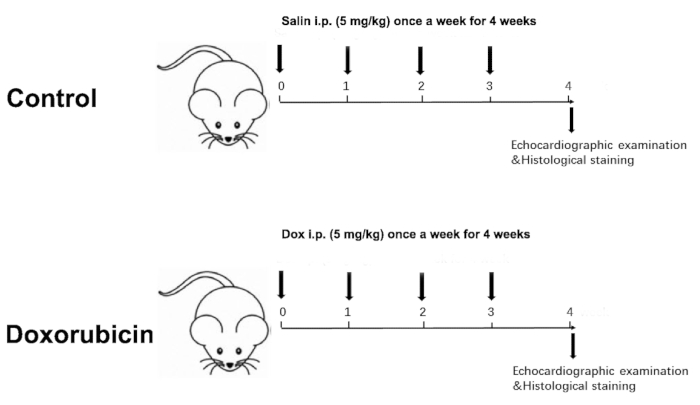
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
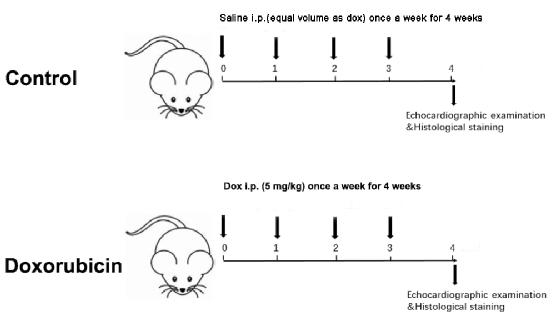
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır