Method Article
Ayarlanabilir Biyo-Fiziksel Özelliklere Sahip 3D Ortamda Tümör-Stroma Etkileşimlerini İncelemek İçin Karaciğer Kanseri için Biyomimetik Model
Bu Makalede
Özet
Bu protokol, eşlik eden fibrotik stromal bölmeli 3D biyomimetik bir model sunar. Hücresel etkileşimlerin, tümör büyümesinin ve metastazın aktif bir arabulucu olan stromal hücre dışı matrisin biyo-fiziksel özelliklerini taklit eden oranlarda fizyolojik olarak ilgili hidrojellerle hazırlanmıştır.
Özet
Hepatosellüler karsinom (HCC), kronik karaciğer hastalığı sonrasında gelişen primer karaciğer tümörüdür. Kronik karaciğer hastalığı ve iltihabı, hepatokarsinogenezin aktif olarak desteklenmesine ve yönlendirlmesine neden olan fibrotik bir ortama yol açar. Tümör stroma mikro çevresi ve tümör hücreleri arasındaki etkileşim açısından hepatokarsinogenez hakkında içgörü bu nedenle önemli bir öneme sahiptir. Üç boyutlu (3D) hücre kültürü modelleri, mevcut in vitro 2D hücre kültürü modelleri ile in vivo hayvan modelleri arasındaki eksik bağlantı olarak önerilmektedir. Amacımız fibrotik stromal bölme ve vaskülat eşliğinde yeni bir 3D biyomimetik HCC modeli tasarlamaktı. Tümör ECM'nin biyo-fiziksel özelliklerini taklit etmek için kollajen ve fibrinojen gibi fizyolojik olarak ilgili hidrojeller dahil edildi. Bu modelde bir hidrojel matrisine gömülü LX2 ve HepG2 hücreleri ters transmembran kesici ucun üzerine tohumlanmıştır. HUVEC hücreleri daha sonra zarın karşı tarafına tohumlandı. Hücrelerle gömülü ECM-hidrojellerden oluşan üç formülasyon hazırlandı ve reoloji ile biyo-fiziksel özellikleri belirlendi. Hücre canlılığı 21 gün boyunca hücre canlılığı test edilerek belirlendi. Kemoterapötik ilaç doksorubisin etkisi hem 2D ortak kültürde hem de 3D modelimizde 72h'lik bir süre için değerlendirildi. Reoloji sonuçları fibrotik, siroz ve HCC karaciğerinin biyo-fiziksel özelliklerinin başarıyla taklit edilebileceğini göstermektedir. Genel olarak, sonuçlar bu 3D modelin geleneksel 2D kültürlere kıyasla in vivo durumu daha fazla temsil ettiğini göstermektedir. 3D tümör modelimiz, tipik olarak HCC hastalarında görülen ilaç direncini taklit ederek kemoterapötiklere yanıtta azalma gösterdi.
Giriş
Hepatosellüler karsinom (HCC) tüm primer karaciğer kanserlerinin % 90'ını oluşturur1,2. Yılda bildirilen 810.000 ölüm ve 854.000 yeni vaka ile şu anda en yüksek ölüm insidanslarından biriyle dünya çapında en sık görülen beşinci kanser olarak sıralanmıştır1. HCC gelişimi ağırlıklı olarak kronik karaciğer hastalıkları ile ilişkili inflamasyona atfedilir, yani viral hepatit, kronik aşırı alkol alımı, metabolik sendrom, obezite ve diyabet1,3,4. Bu patolojik durumlarla ilişkili inflamasyon, hepatik yıldız hücrelerini ve enflamatuar hücreleri fibrozis başlatmak için aktive eden ve işe alan çeşitli sitokinlerin hepatosit yaralanması ve salgılanması ile sonuçlanır5. Hepatik yıldız hücreleri hepatik fibrozisin başlatılmasında, ilerlemesinde ve gerilemesinde kilit rolleri ile bilinir. Aktivasyondan sonra, kontrtil, pro-enflamatuar ve pro-fibrinojen özelliklere sahip hücreler gibi miyofibroblast'a ayırırlar6,7,8. Ortaya çıkan fibrozis, hücre dışı matris remodeling enzim aktivitesinin düzensizliğine neden olur ve büyüme faktörlerinin salgılanması ile birlikte genel olarak artan sertlik ile karakterize bir ortam yaratır, bu da HCC patogenez9,10'a daha fazla katkıda bulunur. Hepatositler ve stromal ortam arasındaki bu sürekli patojenik geri bildirim döngüsüdür, bu da kanserin başlatılmasını, mezenkimal geçişlere epitel (EMT), anjiogenez, metastatik potansiyel ve değiştirilmiş ilaç yanıtı11 , 12,13'übesler. Tümör ve tümör mikro çevresi arasındaki etkileşim açısından hepatokarsinogenez hakkındaki içgörü, bu nedenle, sadece mekanistik değil, aynı zamanda tedavi açısından da önemli bir öneme sahiptir.
İki boyutlu (2D) in vitro hücre kültürü modelleri ağırlıklı olarak kanser hücresi biyologlarının% 80'i tarafından kullanılmaktadır14. Bununla birlikte, bu modeller kemoterapötik yanıtları etkileyen gerçek tümör mikro çevresini temsil etmez14,15,16. Şu anda kemoterapötik ilaçların% 96'sı klinik çalışmalar sırasında başarısız14. İlaç yıpratma oranlarındaki bu yüksek insidans, mevcut in vitro ön eleme modellerinin HCC karmaşıklığı ve mikroçevrim16hakkındaki mevcut içgörümüzü ve anlayışımızı tam olarak temsil etmemesine bağlanabilir. Tersine in vivo hayvan modelleri, insanlara kıyasla tümör ve mikroçevre arasındaki etkileşimlerde aşılmış bağışıklık sistemleri ve tutarsızlıklar ile ortaya16,17. Hayvan çalışmalarından elde edilen sonuçların ortalama% 8'i klinik öncesi klinik ortamdan klinik ayara güvenilir bir şekilde çevrilebilir16,17. Bu nedenle, HCC'nin değerlendirilmesinin, sadece tümörün değil, aynı zamanda mikroçevrinin karmaşıklığını etkili bir şekilde yeniden sağlayan bir in vitro platformun geliştirilmesini gerektirdiği açıktır. Platformlar, şu anda mevcut olan in vitro klinik öncesi tarama modellerini tamamlayacak ve gelecekte hayvan çalışmaları miktarınıazaltacaktır 7,14.
Bu platformlardan biri gelişmiş üç boyutlu (3D) hücre kültürü modelleridir. HCC'yi incelemek için bu gelişmiş 3D modellerin çok sayıda son on yılda ortaya çıktı ve çeşitli incelemeler yayınlandı. HCC'yi incelemek için mevcut 3D modeller arasında çok hücreli sferoidler, organoidler, iskele bazlı modeller, hidrojeller, mikroakışkanlar ve biyo-baskı bulunur. Bunlardan çok hücreli sferoidler tümör gelişimi çalışmasında kullanılan en iyi bilinen modellerden biridir. Küreseller, düşük teknik zorluğa sahip ucuz bir modeldir ve aynı zamanda in vivo tümör mimarisini etkili bir şekilde taklit eder18,19,20. Çok hücreli küreseller HCC17 , 21,22hakkında çok sayıda bilgiye katkıdabulunmuştur. Bununla birlikte, çok hücreli sferoidler kültürde 7 ila 48 gün arasında tutulduğu için standartlaştırılmış kültür zamanı eksiktir. Artan kültür zamanı önemli bir öneme sahiptir. Eilenberger, küresel yaştaki farklılıkların Sorafenib'i (karaciğer kanserlerinin tedavisinde kullanılan bir kinaz inhibitörü) difüzyusite ve toksisiteyi derinden etkilediğini buldu23. Wrzesinski ve Fey, 3D hepatosit sferoidlerin trypsinizasyondan sonra anahtar fizyolojik karaciğer fonksiyonlarını yeniden oluşturmak için 18 gün gerektirdiğini ve bu iyileşmeden sonra 24 güne kadar istikrarlı işlevselliği sergilemeye devam ettiğini tespit ederken24,25.
Daha gelişmiş 3D HCC modellerinden bazıları, insan desellülerize karaciğer iskelelerinin ve biyo-baskılı iskelelerin kullanımını içerir. Mazza ve meslektaşları, transplantasyon için uygun olmayan hücrelerden arındırılmış insan karaciğerlerini kullanarak HCC modellemesi için doğal bir 3D iskeleoluşturdular 26. Bu doğal iskeleler, hepatik yıldız ve hepatoblastom hücrelerinin ortak kültürü ile 21 gün boyunca başarıyla yeniden doldurulabilirken, kollajen tip I, III, IV ve fibronektin gibi temel hücre dışı matris bileşenlerinin ekspresyonunun sürdürülmesi sağlanabilir. Hastalık modellemesi dışında, bu model aynı zamanda fonksiyonel organ nakli ve klinik öncesi ilaç ve toksisite taraması avantajı sunar26. 3D biyo-baskıdaki gelişmelerle, 3D hücre dışı matrisli iskeleler artık biyo-baskı da yapılabilir. Ma ve meslektaşları, değişken mekanik özelliklere sahip biyo-baskılı hücre dışı matris iskeleleri ve hücre dışı matris27'denhidrojel mühendisi kullanarak biyomimetik mikro mimarisi. Şüphesiz bunların hepsi mükemmel 3D HCC modelleridir. Bununla birlikte, insan karaciğerlerinin kullanılamazlığı ve gerekli ekipman ve malzemelerin eldesında yer alan maliyet, bu modelleri dezavantajlı duruma yerleştirir. Ayrıca, bu yöntemlerin tümü teknik olarak gelişmiştir ve tüm araştırmacılar tarafından kolayca kullanılamayan kapsamlı eğitim gerektirir.
HCC'nin karmaşıklığına ve şu anda mevcut olan 3D modellere dayanarak, her şeyi kapsayan bir 3D HCC modeli geliştirmeye gayret ettik. Ayarlanabilir hidrojel sertlik değerlerini birleştirerek hem premalign hem de tümör mikroçevrimini yeniden üretebilen bir model hedefledik. Ayrıca, HCC patogenezinde kilit rol oynayan hepatosellüler ve stroma ilişkili hücre hatlarını da dahil ettik. Bunlar arasında endotel hücreleri, hepatik yıldız hücreleri ve fizyolojik olarak ilgili hidrojellerden oluşan bir mikroçevrimde yetişen kötü huylu hepatositler bulunur. Seçilen hidrojeller, kollajen tip I ve fibrinojen ile HCC'nin başlatılması ve ilerlemesi sırasında karaciğer sertliğinde görülen biyo-fiziksel değişikliklerle karşılaştırılabilir oranlarda dahil edilir. Ayrıca, uzun bir süre kültürde tutulabilecek bir model hedefledik. Temel ekipman, minimum eğitim ve deneyim ve hazır malzemelerle kurulabilen modüler, uygun maliyetli bir model öngördük.
Protokol
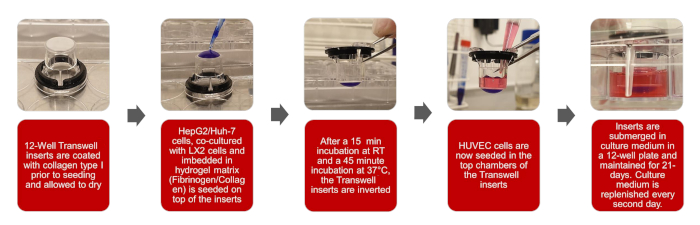
Şekil 1: 3D biyomimetik HCC modelinin oluşturulmasının grafiksel tasvirleri Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NOT: Bu protokolün genel iş akışı Şekil 1'in çizimlerinde belirlenmiştir
1. Fibrinojen stok çözeltisinin hazırlanması
- 2,21g CaCl 2 ağırlığında ve 20 mL damıtılmış suya (dH 2 O) ekleyerek1 M kalsiyum klorür (CaCl2)stok çözeltisi hazırlayın. Stok çözeltisi oda sıcaklığında (RT) saklanabilir.
- 5 mg aprotinin tartarak ve 20 mL dH 2 O. Aliquot stok çözeltisine ekleyerek 20 mL aprotinin stok çözeltisi(1218,75KIU/mL) hazırlayın ve -20 °C'de saklayın.
- 10 mL 80 mg/mL fibrinojen stok çözeltisi hazırlayın.
- 50 mL tüpte 7.849 mL fosfat tamponlu salin (PBS), 2.051 mL aprotinin stoğu (1218.75 KIU) ekleyin /mL) 250 KIU/mL ve 100 μL CaCl2 (1M) nihai aprotinin konsantrasyonu için 10 mM'lik son bir CaCl2 konsantrasyonu için.
- 800 mg fibrinojen ağırlığında.
- Stok çözeltisinin% 2 w / v NaCl içermesi için 200 mg sodyum klorür (NaCl) ağırlığındadır.
- PBS, aprotinin ve CaCl2içeren 50 mL tüpe fibrinojen ve NaCl'yi artışlarla ekleyin. Çözeltide fibrinojen jelleşme ve topakların oluşmasına neden olacağından kuvvetlice karıştırmayın veya sallamayın.
- Fibrinojen stok çözeltisinin 50 mL'lik tüpünü yatay olarak bir çalkalayıcıya yerleştirin ve 300 rpm'lik düşük bir ayarda çalkalayın.
- Çözelti çözüldükten sonra, hacme bağlı olarak 0,22 μm şırınna filtresi veya şişe üst filtresi kullanarak filtreleyin. Daha da önemlisi, fibrinojen çözeltisini otoklavlamayın, çünkü bu fibrinojeni yok edecektir.
NOT: Protokolün bu kısmı stok çözeltisi miktarına bağlı olarak 2 ila 5 saat arasında sürebilir, bu süre deneysel kurulum sırasında dikkate alınmalıdır.
2. Hidrojelleri kesici uçlara tohumlamadan önce kollajen ile kaplama uçları
- Laminer akış davlumbazında veya doku kültürü davlumbazında, sterilize edilmiş cımbız kullanarak, plakadan kesici uçları çıkarın ve plakanın kapağına ters yerleştirin.
- 25 mL dH 2 O'ya 115 μL buzul asetik asit ekleyerek 100 mL'lik20mM'lik bir buzul asetik asit stok çözeltisi hazırlayın ve dH2O ile 100 mL'lik son hacme ayarlayın. Stok çözümü RT'de saklanabilir.
- 2.2'de hazırlanan 20 mM'lik buzul asetik asit stok çözeltisinin 1.960 mL'sine 5 mg/mL kollajen çözeltisinin 40 μL'lik kısmını ekleyerek 5 mg/mL kollajen çözeltisinden 2 mL'lik bir kollajen çözeltisi hazırlayın.
- Kesici uçları, çözeltinin 100 μL'lik kısmını her kesici ucun üzerine pipetleyarak 2,3'te hazırlanan 100 μg/mL kollajen çözeltisi ile kaplayın. Laminar akış davlumbaz veya doku kültürü davlumbaz içinde 2 ila 3 saat boyunca havanın kurumasını bekleyin.
- Kesici uçlar kuruduktan sonra her kesici ucu PBS ile 3x yıkayın. 12 kuyu plakasının her kuyusuna 1 mL PBS ekleyin, kollajen kaplamalı kesici uçları kuyulara yerleştirin, PBS'yi kuyudan çıkarın ve prosedürü tekrarlayın. Laminar akış davlumbazı içinde 1 ila 2 saat arasında havanın kurumasını bekleyin.
DİkKAT: Asetik asit hücreler için toksiktir ve kesici uçlar PBS ile iyice yıkanmalıdır. - Kesici uçların üzerine özel bir 3D baskılı aralayıcı ekleyin, jeller plakanın alt kısmına dokunmalarını önlemek için kesici uçtan sarktıktan sonra bu gerekli olacaktır (Şekil 2).

Şekil 2: Özel 3D baskılı aralayıcı Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Ters uçları plakanın alt kısmıyla örtün ve hücreler hidrojellere gömülüp tohuma hazır olana kadar inkübatöre yerleştirin.
3. Hidrojellere gömülü tohumlama hücreleri kesici uçlara
NOT: Tablo 1, hazırlanacak çeşitli konsantrasyonlarda fibrinojen içeren 3 formülasyonun açıklamasını sağlar. Formülasyon bir fibrozis başlangıcında karaciğere karşılık gelir, iki siroz ve üç HCC, protokol optimizasyonu sırasında bu formülasyonların her biri için sertlik değerleri reoloji ile belirlenmiştir.
| Formülasyon | Son Fibrinojen konsantrasyonu (mg/mL) | Son Kollajen konsantrasyonu (mg/mL) | Hücreler (LX2 + HepG2 Ortak Kültür 1:1) | Karaciğer aşaması | Literatür karaciğer sertlik değerleri (kPa) | Reolojiden Model Sertliği değeri (kPa) | Formülasyon | Eklenecek fibrinojen (mL) | Eklenecek kolajen (mL) | %10 DMEM (mL) | Trombin (μL) | Başvurus |
| 1 | 10 | 2 | 2 x 106 hücre/mL | Fibrozis | ≥2 | 3 | 1 | 1 | 0.8 | 0.2 | 4 | 28; 29; 30 |
| 2 | 30 | 2 | 2 x 106 hücre/mL | Siroz | 6 | 2 | 0.75 | 0.8 | 0.45 | 3 | ||
| 3 | 40 | 2 | 2 x 106 hücre/mL | Hcc | ≥10 | 10 | 3 | 0.25 | 0.8 | 0.95 | 1 | 28; 31; 32 |
Tablo 1: Hidrojellere kesici uçlara gömülü tohumlama hücreleri için formülasyonların açıklaması
- 100 mL dH2O'ya 3,99 g NaOH ekleyerek 1 M sodyum hidroksit stok çözeltisi hazırlayın. Çözelti daha sonra 0,22 μm şırınna filtresi kullanılarak filtrelenebilir. Stok çözümünü RT'de saklayın.
- 5 mg/mL kollajen ve 10 mL 1 M NaOH'u buza yerleştirin.
- Bölüm 1'de hazırlanan 50 mL PBS, 15 mL tripsin, 70 mL%10 DMEM ve fibrinojen stok çözeltisini bir su banyosunda 20 dakika boyunca 37 °C'ye ısıtın.
- Hücre süspansiyonlarını hazırlayın.
- Hepatik yıldız hücrelerini (LX2) ve karaciğer karsinom (HepG2) hücrelerini 10 mL PBS ile T175 kültür şişelerinde iki kez yıkayın.
- 37 °C'de 4 dakika boyunca 6 mL tripsin ile tripsin hücreleri.
- Trypsin'i %10 DMEM'in 6 mL'si ile inaktive edin.
- Hücre süspansiyonu 15 mL tüp ve santrifüjde 300 x g'da3 dakika boyunca toplayın.
- Santrifüjlemeden sonra, süpernatantı aspire edin ve her hücre hattını% 10 DMEM'in 5 mL'sinde yeniden diri.
- Otomatik hücre sayacı kullanarak hücreleri sayma: Sayım odası slaydına her hücre süspansiyonunun 10 μL'sini ekleyin ve slaydı hücre sayacına yerleştirin. Hücre sayısı hücre/mL olarak görüntülenir.
- Adım 3.4.6'daki hücre sayısını kullanarak hücreleri her hücre hattından mL başına1 x 10 6 hücreye seyreltin ve açıkça işaretlenmiş 15 mL tüplere dönüştürün. Seyreltmeleri 300 x g'da 3 dakika santrifüj edin.
- Santrifüjlemeden sonra, süpernatantı aspire edin ve Tablo 1'e göre her 15 mL tüpe% 10DMEM ekleyin, Tabloda sağlanan değerler her formülasyonun 2 mL'si içindir.
- Kollajen miktarını 10 μL / mL NaOH (1 M) ile nötralize edin ve nötralize edilmiş kollajeni hücre süspansiyonu ekleyin, mevcut% 10 DMEM sarıya dönecektir, süspansiyon kesilmiş bir uçla pipetle iyice karıştırıldığında parlak bir pembeye dönüşecektir.
- Tablo 1'e göre kollajen hücre süspansiyonu içine fibrinojen ekleyin, kesilmiş bir pipet ucu kullanarak süspansiyonu iyice karıştırın.
- Son olarak kollajen-fibrinojen hücre süspansiyonu için trombin ekleyin, her 10 mg fibrinojen için 0.1 KIU trombin.
- Bölüm 2'de hazırlanan önceden kaplanmış ters uçları inkübatörden çıkarın ve belirlenen kesici uçlara 200 μL pipet ucu, pipet 200 μL kesilmiş süspansiyon kullanarak çıkarın. Jellerin laminer akış başlığı içinde 15 dakika çapraz bağlantı yapmasına izin verin.
- 15 dakika sonra, plakanın alt bölümünü jellerin üzerine hafifçe yerleştirin ve jellerin 45 dakika boyunca 37 ° C'de çapraz bağlantı yapmasına izin vermek için inkübatöre taşıyın.
- Jeller çapraz bağlandıktan sonra, kesici uçları tekrar ters çevirin ve plakanın alt kuyularının her birine 2 mL% 10 DMEM ekleyin.
4. Endotel hücrelerinin tohumlama
- Önceden ısıtın 25 mL hanks dengeli tuz çözeltisi (HBSS), 10 mL tripsin, 10 mL tripsin inhibitörü ve 50 mL endotel büyüme ortamı, bir su banyosunda 20 dakika boyunca 37 ° C'ye.
- Endotel (HUVEC) hücre süspansiyonunu hazırlayın.
- HUVEC hücrelerini T175 kültür şişelerinde 10 mL HBSS ile iki kez yıkayın.
- 37 °C'de 4 dakika boyunca 6 mL tripsin ile tripsin hücreleri. 6 mL tripsin inhibitörü ile tripini inaktive edin. Hücre süspansiyonu 15 mL tüp ve santrifüjde 200 x g'da3 dakika boyunca toplayın.
- Santrifüjlemeden sonra süpernatantı aspire edin ve hücreleri 5 mL endotel büyüme ortamında askıya alın.
- Otomatik bir hücre sayacı kullanarak hücreleri daha önce 3.4.6'da açıklandığı gibi sayın.
- Hücre sayacından hücre sayısını kullanarak, endotel büyüme ortamında 1,0 x10 4 hücre/mL tohumlama yoğunluğu hazırlayın.
- Kesici uç başına 5,0 x 103 hücrelik son hacme sahip olmak için kesici ucun üst kısmının her bir kuyusuna HUVEC hücre süspansiyonunun 500 μL tohum.
5. Bakım
- Büyüme ortamını her iki günde bir değiştirin, harcanan büyüme ortamını hem kuyudan hem de kesici uçtan epire edin. Jeli içeren kuyulara 2 mL%10 DMEM ve HUVEC hücrelerini içeren kesici uçlara 0,5 mL endotel büyüme ortamı ekleyin.
- Denemeden önce modeli 21 gün boyunca koruyun.
6. Reoloji
- 8 mm çapında paralel plaka paslanmaz çelik geometrisi kullanarak 0,1-20 Hz'den %0,267 ve 37°C'de frekans süpürmeleri gerçekleştirerek, bir reometre kullanarak sertlik değerlerini belirtmek için jel formülasyonlarının depolama modülünü ölçün.
7. Canlılık ve ilaç tepkisi
- 2D ortak kültürlerde ve 3D modelde ilaç yanıtını ve canlılığını belirleyin.
- Tohum HepG2 (5.0 x 103 hücre/mL) ve LX2 (5.0 x10 3 hücre/mL) hücreleri 1:1 oranında 2D ortak kültür için 1.0 x 104 hücre/mL tohumlama yoğunluğunda siyah şeffaf alt 96 kuyu plakalarına. Hücrelerin gece boyunca bağlanmasına izin verin.
- 3B modeli, sertlik değeri 6 kPa olan siroz ortamına karşılık gelecek şekilde ayarla. Doxorubicin tedavisinden önce modeli 21 gün boyunca koruyun.
- Doxorubicin tedavisinden iki saat önce, kültür ortamını hem 2D hem de 3D modelden aspire edin. Her iki modeli de PBS ile iki kez yıkayın. Açlık ortamını (%1 v/v antimycotic antibiyotik çözeltisi ile desteklenmiş DMEM) 2D ortak kültürüne (kuyu başına 200 μL) ve 3D modele (hidrojel içeren kuyulara 2 mL ve kesici uça 500 μL) ekleyin.
- Doxorubicin'i hem 2D hem de 3D modele yönetin. Dozajlar aşağıdaki gibidir: sırasıyla IC25, 50 ve 75 değerlerine karşılık gelen 0,5, 1 ve 1,5 mM. Her iki modeli de 72 saat boyunca tedavi edin.
NOT: Bir topoisomeraz II inhibitörü olan doxorubicin, HCC için kullanılan ilk kemoterapötik ilaçlardan biridir ve aynı zamanda HCC33,34tedavisinde en aktif kemoterapötik ajanlardan biridir. - 72 saat sonra, hem 2D hem de 3D modelden aspire kültür ortamı. Her iki modeli de PBS ile iki kez yıkayarak kalan kültür ortamlarının çıkarıldığına emin olun.
- Üretici önerilerine göre AlamarBlue hazırlayın ve 2D ve 3D modelin kuyularına ekleyin. 2D kültürü için kuyu başına 150 μL ve kuyu başına 2 mL ve 3D kültür için kesici uç başına 500 μL ekleyin. 37°C'de gece boyunca kuluçkaya yatırıldı.
- 3D kurulumun her kuyusundan 150 μL AlamarBlue'nun inkübasyon transferini takiben siyah şeffaf bir alt 96 kuyu plakasına aktarın. AlamarBlue, 2B modeli için doğrudan plakadan okunabilir.
- Floresan'ı, ekscitasyon dalga boyunda ve emisyon dalga boyunda sırasıyla 485 ve 550 nm'lik bir mikro plaka okuyucu ile okuyun.
- Aşağıdaki formülü kullanarak her iki modelde de yüzde hücre canlılığını hesaplayın:
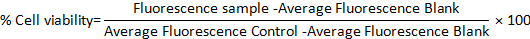
Sonuçlar
Konsantrasyon aralıkları ve tohumlama hacmi
Şekil 3'tesunulan şematik diyagrama göre son işleyen protokolü elde etmek için protokol optimizasyonu meydana geldi. Fizyolojik olarak ilgili iki hidrojel, Kollajen tip I ve Fibrinojen, literatür taraması ile tanımlanmıştır35,36. Sıçan kuyruğu kollajen tipi I'den başlayarak, kesici uçlara başarılı bir şekilde yapışma yeteneklerini belirlemek için ters uçlara bir dizi konsantrasyon (4, 3, 2 ve 1 mg/mL) tohumlandı. Bu aralıktaki tüm konsantrasyonlar jeller oluşturabildi, ancak kollajen jelleri düzleştirilmiş olarak ortaya çıktı ve elleçleme ve pipetleme nedeniyle içlerine sıkışmış çeşitli hava kabarcıkları vardı, bkz. Kollajen jelin kalitesini artırmak için en uygun tohumlama hacmini belirlemek için, bir dizi tohumlama hacmi (100, 150 ve 200 μL), ters kesici uçlara tohumlanmıştır, bkz. Tohumlama hacminin jelin görünümü veya jel içindeki kabarcıkların varlığı üzerinde hiçbir etkisi yoktu. Buna göre, 200 μL'nin en dolu jelleri üreten en uygun tohumlama hacmi olduğuna karar verildi. Fibrinojen ayrıca uzun bir süre bir kesici uça yapışabilecek bir jel üretme yeteneği açısından da değerlendirildi. Bir konsantrasyon aralığı (70, 50, 40, 30, 20, 10, 5, 1 mg/mL) hazırlandı ve 12 kuyulu bir plakanın kapağına 200 μL hacimde tohumlandı, bkz. Şekil 6. Tohumlamadan sonraki 20 dakika içinde tüm konsantrasyonlar başarılı bir şekilde bir jel oluşturabildi. Ancak oluşan jeller kıvam gibi bir sıvıya sahip olduğu ve gece boyunca 37 °C'de tutulduktan sonra kapaktan kopmaya başladığı için 5 ve 1 mg/mL konsantrasyonları hariç tutulmuştur.
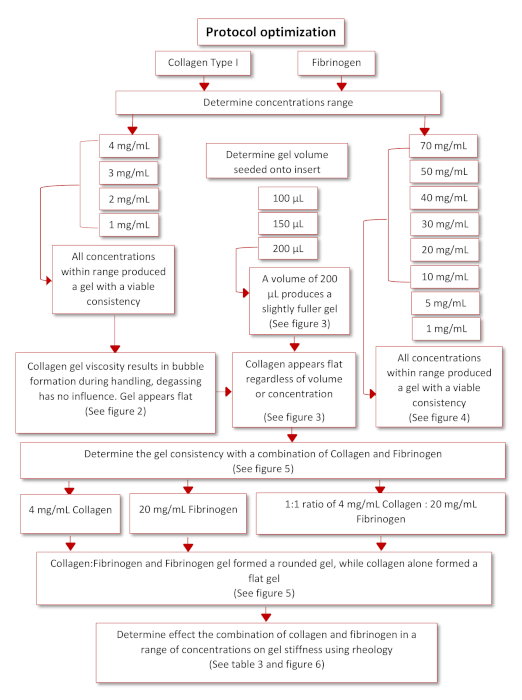
Şekil 3: Protokol optimizasyonunun şematik diyagramı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Kollajen jeller 4 mg/mL içeren 1.0 x10 5 hücre/mL jelde bulunan kabarcıkları gösteren kesici uçlar üzerine tohumlanmıştır. Soldaki kesici uç 15 dakika boyunca buz üzerinde gazdan arındırılırken, sağdaki kesici uç gazdan arındırılmış değildir. Gaz gidermenin jellerde bulunan kabarcıklar üzerinde herhangi bir etkisi olmadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Kollajen jelleri 4 mg/mL içeren 1.0 x 105 hücre/mL farklı hacimlerdeki kesici uçlara tohumlanmıştır. (A) Tohumlamadan hemen sonra sol 100 μL, orta 150 μL ve sağ 200 μL'ye yerleştirin. Jellerdeki kabarcıklar hala mevcuttu. (B) 60 dakikalık çapraz bağlamadan sonra sola 200 μL, orta 150 μL ve sağ 100 μL'ye yerleştirin. Hacimden bağımsız olarak tüm jeller hala düz görünür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: 12 kuyu plakasının kapağına tohumlanmış 70 ila 1 mg/mL konsantrasyon aralığında fibrinojen (200 μL). (A) Jeller doğrudan tohumlamadan sonra. (B) Jeller tohumlamadan 20 dk sonra. (C) Jeller gece boyunca tutulur. Tüm jeller iyi yuvarlanmış görünür, 5 mg / mL ve 1 mg / mL jelleri tohumlamadan 20 dakika sonra daha akışkan bir kıvama sahip göründükleri ve gece tutulduktan sonra kapaktan ayırmaya başladıkları için hariç tutuldu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kombinasyon kolajen ve fibrinojen
Kollajen ve fibrinojen konsantrasyon aralıklarından elde edilen sonuçlara göre kollajen ve fibrinojenin birleştirilmesinin etkisi değerlendirildi. Aşağıdakilerle üç kesici uç kuruldu, 4 mg/ mL kollajen, 20 mg / mL fibrinojen ve kollajen (4 mg / mL) ve fibrinojen (20 mg / mL) 1:1 rasyon, bkz. Hidrojelleri tohumladıktan hemen sonra, tek başına kollajen içeren kesici ucun jel içindeki kabarcıkların oluşumuyla birlikte düz bir görünüme sahip olduğunu gözlemledik. Fibrinojenli kesici uçlar tam ve yuvarlak bir jel üretti, kollajen ve fibrinojen kombinasyonu ile kesici uç da yaptı. 37 °C'de 60 dakika çapraz bağlantı yaptıktan sonra, tüm jeller kesici uçlara tutturulmuş ve 37 °C'de gece inkübasyonunu takiben bağlı kalmıştır.

Şekil 7: Kollajen ve fibrinojen kombinasyonunun etkisi. (A) Kollajen 4 mg/mL soldaki kesici uç üzerine tohumlanmış, fibrinojen 20 mg/mL ortadaki kesici uç üzerine tohumlanmış ve kollajen 4 mg/mL, fibrinojen 20 mg/mL (1:1 rasyon) sağdaki kesici uç üzerine tohumlanmıştır. 1.0 x 105 hücre/mL içeren 200 μL hacimde tohumlanan tüm jeller, tüm jeller 37 °C'de 60 dakika çapraz bağlanır. (C) Sol fibrinojene yerleştirin 20 mg/mL, jel yuvarlak görünür, kabarcık yoktur, sağ kolajene 4 mg/mL, fibrinojen 20 mg/mL jel, jel kabarcıksız olarak iyi yuvarlanır. (D) Kollajen 4 mg / mL jel 37 ° C'de bir gece tutulduktan sonra, jel hala çok miktarda kabarcık içeriyordu, jelin bir miktar şişmesi meydana geldi. (E) Fibrinojen 20 mg/mL gece boyunca 37 °C'de tutulur. (F) Kollajen 4 mg/mL, fibrinojen 20 mg/mL jel gece boyunca 37 °C'de tutulur.
Hücre tohumlama yoğunluğunu belirleme
Hidrojellerle çalışmanın önceki deneyimine dayanarak, en uygun hücre tohumlama yoğunluğunu belirlemek için bir deney kuruldu (veriler gösterilmedi)37. Hücreler aşağıdaki konsantrasyon aralığında kollajen ve fibrinojen kombinasyonuna gömülmüştü (7.5 x 105, 8.5 x 105, 9.5 x 105, 1.0 x 106, 1.5 x 106 ve 2.0 x 106 hücre/mL), 2.0 x10 6 hücre/mL en uygun tohumlama yoğunluğu bulundu.
Reoloji
Fibrinojen ve kollajen hidrojel kombinasyonlarının on formülasyonu reoloji ile değerlendirildi, bkz. Amaç, bu formülasyonlardan hangisinin HCC gelişimi sırasında görülen karaciğer sertliğini taklit edebileceğini belirlemekti. Literatür fibrozis, siroz ve HCC sırasında sıçanlar, fareler ve insanlar için bilinen karaciğer sertliği değerlerini sağlamış ve amaç bu değerlere mümkün olduğunca yaklaşmaktı28,29,30,31,32. Tablo 2'de belirtilen on formülasyon üç taraflı olarak hazırlanmış ve her birinin depolama modülü bir reometre kullanılarak belirlenmiştir, sonuçlar Şekil 8'degösterilmiştir.
| Formülasyon | Fibrinojen (mg/ml) | Kollajen (mg/ml) |
| 1 | 60 | 2 |
| 2 | 50 | 2 |
| 3 | 40 | 2 |
| 4 | 30 | 2 |
| 5 | 20 | 2 |
| 6 | 10 | 2 |
| 7 | 20 | 5 |
| 8 | 20 | 4 |
| 9 | 20 | 3 |
| 10 | 20 | 1 |
Tablo 2: Sertlik değerlerini belirlemek için Reoloji ile değerlendirilen çeşitli konsantrasyonlarda kollajen ve fibrinojen kombinasyonları
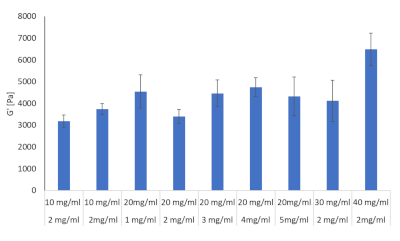
Şekil 8: Reoloji ile değerlendirilen çeşitli konsantrasyonlarda Kollajen ve fibrinojen kombinasyonları için hidrojel sertlik değerleri. Depolama modülü ve kayıp modülleri Discovery HR-2 Hybrid Reometre (n = 3, Hata çubukları = SD) ile 37 °C ve 1Hz olarak belirlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu on formülden üç tane seçildi. Bunlar arasında fibrozisin başlangıcında karaciğer sertlik değerlerine karşılık gelen 2 mg/mL kollajen tipi I ve 10 mg/mL fibrinojen, siroza karşılık gelen 2 mg/mL kollajen tipi I ve 30 mg/mL fibrinojen ve HCC'ye karşılık gelen 2 mg/mL kollajen tip I ve 40 mg/mL fibrinojen yeraldı, bkz.
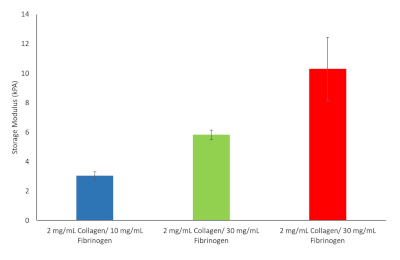
Şekil 9: Devam etmek için seçilen çeşitli Fibrinojen/Kollajen hidrojel formülasyonları için hidrojel sertlik değerleri. Depolama modülü ve kayıp modülü 37 °C ve 1 Hz (n = 3, Hata çubukları = SD) olarak belirlenmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Canlılık, ilaç yanıtı ve metastatik potansiyel
AlamarBlue tahlili sonuçları, 2Blue eş kültürü içinde genel olarak azaltılmış bir hücre canlılığı gösterdi, bilinen bildirilen IC 25, 50 ve 75 değerlerine dayanarak beklenenden daha düşük, tedavi edilmemiş kontrolle karşılaştırıldığında, bkz. Bu, ortak kültürümüzde Doxorubicin tedavisine daha duyarlı olan LX2 hücrelerine bağlanabilir. Bununla birlikte, 3D modelimizde, genellikle 3D model sistemlerinde görülen kemoterapötik potansiyeldeki azalmayı doğrulayan doksrubicin direncinde fark ettik ve arttık. Kontrollere göre istatistiksel anlamlılık, P<0.05 anlamlı olarak kabul edilen Öğrenci T testi (iki kuyruklu) kullanılarak değerlendirildi.
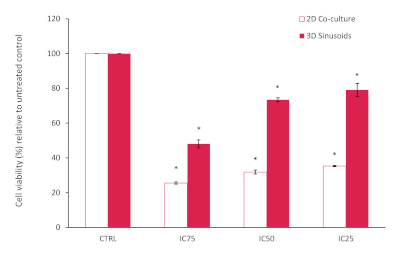
Şekil 10: 72 saat boyunca çeşitli konsantrasyonlarda Doxorubicin ile tedaviden sonra 3D modele kıyasla 2D ortak kültür modelinin yüzde hücre canlılığı. Sonuçlar tedavi edilmeyen denetime göre normalleştirildi (n=3, hata çubukları = SD) (* = p<0.0001). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Jel yapıları, hidrojellerin farklı konsantrasyonlarında hücre büyümesini takip etmek için hafif bir mikroskop kullanılarak her gün görsel olarak incelendi. Hücreler hidrojelleri homojen ve kompakt bir şekilde doldurdular, 7 günden itibaren sferoidler matris içinde toplanmaya başladı.
Tartışmalar
Bu protokol, HCC için biyomimetik bir model oluşturmak için bir yöntemin geliştirilmesini açıklar. Net bir iş akışı oluşturuldu ve ilgili kritik adımlar belirlendi. Bu kritik adımlar arasında fibrinojen stok çözeltisinin hazırlanması, kesici uçların kollajen ile kaplanması ve hidrojel içine yerleştirilen hücrelerin tohumlaması yer almaktadır. Fibrinojen stok çözeltisinin hazırlanması sırasında, fibrinojenin daha yüksek konsantrasyonlarda daha küçük artışlarla eklenmesi önemlidir. Bu sadece fibrinojenin çözünmesi için gereken süreyi azaltmakla kalmayacak, aynı zamanda fibrinojenin Şekil 11'degörüldüğü gibi tutarsız ve erken jelleşmesini önleyecektir. Fibrinojen jelin hazırlanması önemli miktarda zaman alır ve bu genel deneysel başarıyı etkileyebilir. Sonuçlar, fibrinojen jel tutarsız bir şekilde jelleşmeye başladığında, onu at etmenin en iyisi olduğunu gösterir. Kesici uçlar kollajen ile kaplanmalı, PBS ile yıkanmalı ve hidrojellere gömülü hücrelerin tohumlanmadan önce laminer akış davlumbazında kurutulmalıdır. Kesici uçların kuru olduğundan emin olunmaması, hidrojellerin kesici ucun kenarlarına dökülmesine neden olur ve düzensiz bir jel ile sonuçlanır. Jelin düzensizliği sonuçta difüzyonun bir faktör olduğu sonuçları etkileyecektir.
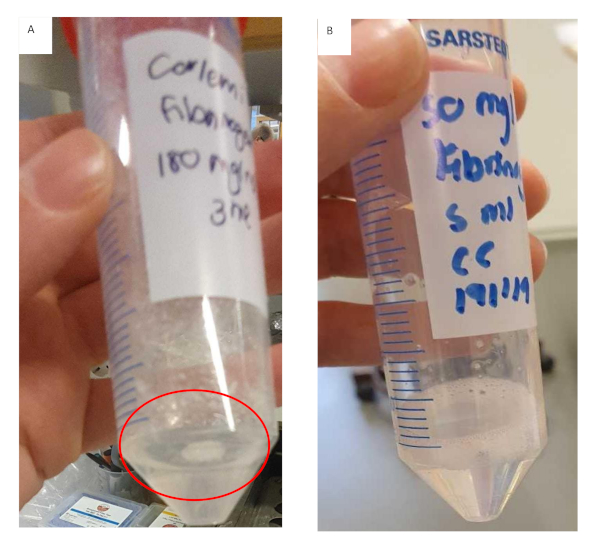
Şekil 11: Fibrinojen/kollajen hidrojel formülasyonları için fibrinojen jel hazırlanması. (A) Kümeler oluşturan ve tüpe yapışan çözülmemiş fibrinojen ile zamanından önce jelleşmeye başlayan fibrinojen jel çözeltisi. (B) Tamamen çözünen fibrinojen jel çözeltisi, çözelti açık ve biraz daha viskozdur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hidrojel hücre süspansiyonunun kesici uçlara tohumlanırken mümkün olduğunca hızlı çalışması önerilir, çünkü fibrinojen bileşen trombin ilavesiyle çapraz bağlantıya başlayacaktır. Tohumlama yaparken jelin çapraz bağlanmasını önlemek için daha yüksek konsantrasyonlarda jel süspansiyonlarla çalışırken daha küçük çalışma hacimleri hazırlayın. İkincisi, dağılım ve her kuyuya tohumlanan jel miktarı üzerinde bir etkiye sahip olacaktır. Bileşenleri ekleme sırası kritiktir, bu protokolde jellerin zamanından önce çapraz bağlantı yapmasını önlemek için kolaylaştırılmış bir iş akışı sağladık. Hidrojel jel süspansiyonun viskozitesi nedeniyle, karıştırma ve ölçüm sırasında kesilmiş bir pipet ucu ile çalışması önerilir. Süspansiyonu karıştırırken, homojen bir süspansiyon oluşturmak için bunun hızlı ve eşit bir şekilde yapıldığından emin olun. Düzensiz karıştırma, sonuçları olumsuz yönde etkileyecek heterojen bir jel ile sonuçlanacaktır, bkz.
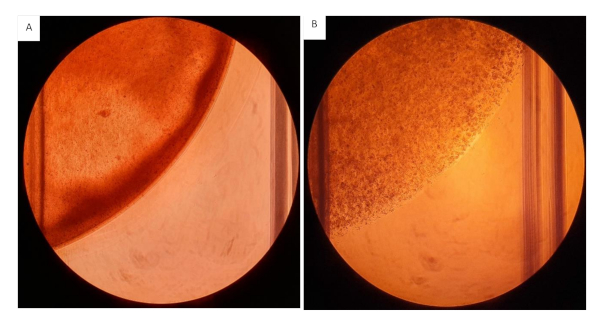
Şekil 12: Kollajen/fibrinojen jeller 12 kuyu plakası üzerine tohumlanmıştır. Tüm jeller 2mg / mL Kollajen ve 2.0 x 106 hücre / mL ile 20 mg / mL Fibrinojen içeren 200 μL hacminde tohumlanmıştır. (A) Heterojen kıvamda hidrojel jel, hidrojellerin görünür düzensiz dağılımı. (B) Hidrojeller homojen bir şekilde karıştırılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol optimizasyonunun ardından model biyo-fiziksel özellikleri belirlemek üzere değerlendirildi. Reoloji verileri, fizyolojik olarak ilgili hücre dışı matris bileşenlerinden yani kollajen tip I ve fibrinojenden oluşan modelimizin fibrotik, siroz ve HCC karaciğer28 , 29, 30,31,32'nin biyo-fiziksel özelliklerini taklit edebildiğini göstermiştir. HCC için 3D modellerde karaciğer sertliğinin yeniden kesilmesi önemli bir öneme sahiptir ve model geliştirme sırasında sıklıkla göz ardı edilir. Artan karaciğer sertliği, HCC38'dekemoterapötik direnç, çoğalma, göç ve uyuşukluk ile ilgilidir. HCC'deki hepatik yıldız hücrelerinin aktivasyonu artan hücre dışı matris sertliği ile ilişkiliyken, bu hepatik yıldız hücreleri ile ilişkili birkaç sinyal yolu mekanosensitivitygösterir 39.
HCC için 3D modellerin geliştirilmesinde hepatik yıldız hücreleri ve endotel hücresi gibi stroma ilişkili hücrelerin dahil edilmesi giderek daha alakalı hale gelmiştir. Çalışmalar, hepatik yıldız ve HCC hücrelerinden oluşan çok hücreli sferoidlerin, bir PXT fare modeli ve insan HCC doku örnekleri ile karşılaştırıldığında, vivo HCC tümör görünümünü taklit ederken, kemoterapötik direncin artmasına ve invaziv göçe neden olduğunu göstermektedir17. Jung ve ark., 2017 tarafından yapılan benzer bir çalışmada hepatosellüler karsinom (Huh-7) ve endotel (HUVEC) hücrelerinden oluşan çok hücreli sferoidin damarlanmayı ve agresifliği teşvik ettiği bulunmuştur22. Bu sferoidler, Huh-7 monokültür sferoidleri22ile karşılaştırıldığında önemli ölçüde daha yüksek doksrubisin ve sorafenib konsantrasyonlarında canlılık gösterdi. Modelimizin doxorubicin'e uygulanabilirliğinin ve yanıtının değerlendirilmesi, HCC'ninkine karşılık gelen sertlik değerleri ve stroma ilişkili hücrelerin (LX2 ve HUVEC) dahil edilmesi, 2D ortak kültür modeline kıyasla kemoterapötiklere yanıtta benzer bir azalma göstermiştir. Bu nedenle, tipik olarak hastalarda ve diğer 3D HCC modellerinde görülen ilaç direncini etkili bir şekilde taklit etmek.
Bu modüler bir sistem olduğu için model, diğer hücre dışı matris bileşenlerinin yani laminin ve hyaluronik asidin eklenmesiyle güçlendirilebilir. Alternatif olarak, bu modelde kullanılan mevcut hidrojeller sodyum aljinat veya chitosan gibi sentetik hidrojellerle değiştirilebilir. Mevcut modelde yapılacak diğer değişiklikler, hücre çizgilerinin birincil hücre kültürleriyle ikame edilerek fizyolojik olarak daha da alakalı bir model üretilmesi veya diğer tümör ve stromal hücre hatlarının kombinasyonlarının kullanılması olabilir.
Böylece HCC'deki tümör-stroma etkileşimlerini incelemek için ayarlanabilir biyo-fiziksel özelliklere sahip bir 3D modeli başarıyla geliştirdik. Modelimizi, doxorubicin'e yanıt olarak geleneksel 2D kültürlere kıyasla in vivo durumu daha fazla temsil ettiğini gördük. Bununla birlikte, hala yapılması gereken çok şey var, bu modeli kapsamlı bir şekilde karakterize etmeyi ve çalışma HCC'sinde kalan daha karmaşık ve acil soruları yanıtlamak için modeli olası bir metastatik platform olarak keşfetmeyi umuyoruz.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma İsveç Kanser Vakfı (Cancerfonden, CAN2017/518), İsveç tıbbi araştırma derneği (SSMF, S17-0092), O.E. och Edla Johanssons vakfı ve Olga Jönssons vakfından alınan hibelerle finanse edildi. Bu finansman kaynakları çalışma tasarımında yer almamaktadır; verilerin toplanması, analizi ve yorumlanması; raporun yazılması; ve makalenin yayımlanmak üzere sunulması kararında. Bu protokolde kullanılan özel tasarlanmış ara uzaycıların 3D baskısı U-PRINT: Uppsala Üniversitesi'nin Tıp ve Eczacılık Disiplin Alanı'ndaki 3D baskı tesisinde U-PRINT@mcb.uu.se gerçekleştirildi. Paul O'Callaghan'a projemizdeki değerli katkıları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AlamarBlue (Resazurin sodium salt) | Sigma | 211-500 | Prepare according to manufacturesr recommendations |
| Antibiotic Antimycotic Solution (100×), Stabilized | Sigma | A5955-100ML | |
| Aprotinin Protease Inhibitor | Thermo Fisher Scientific | 78432 | |
| Calcium chloride (CaCl2) | Sigma | C1016-2.5KG | Anhydrous, granular, ≤7.0 mm, ≥93.0% |
| CO2 Incubator | Kebo Biomed Sweden | ||
| Corning Black, clear flat bottom 96-well plate | Sigma | CLS3904-100EA | |
| Corning HTS Transwell-24 well permeable supports | Sigma | CLS3396-2EA | HTS Transwell-24 units w/ 0.4 μm pore polycarbonate membrane and 6.5 mm inserts, TC-treated, sterile, 2/cs |
| Discovery Hybrid Rheometer 2 | TA instruments, Sollentuna, Sweden | ||
| DMEM, high glucose, GlutaMAX supplement (LX2 and HepG2 cells) | Thermo Fisher Scientific | 61965059 | Supplemented with 10% v/v FBS and 1% v/v antibiotic antimycotic solution |
| Endothelial Cell Growth Medium (500 ml) (HUVEC) | Cell Applications, Inc | 211-500 | |
| Fetal Bovine Serum, qualified, One Shot format, New Zealand | Thermo Fisher Scientific | A3160902 | |
| Fibrinogen type I-S from bovine plasma | Sigma | F8630-10G | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| Hanks' balanced salt solution | Sigma | H9394-500ML | Modified, with sodium bicarbonate, without calcium chloride and magnesium sulfate |
| Labogene scanspeed 416 centrifuge | Labogene, Sweden | ||
| Laminar flow hood | Kebo Biomed Sweden | ||
| Mettler Toledo AG245 Analytical Balance | Mettler Toledo | ||
| Nikon TMS Light microscope | Nikon, Japan | ||
| Phosphate buffered saline tablet | Sigma | P4417-100TAB | Prepare according to manufacturers recommendation |
| Rat tail Collagen Type I 5 mg/mL | Ibidi | 50201 | |
| Sodium chloride (NaCl) | Sigma | S7653-1KG | |
| Sodium Hydroxide (NaOH) | Merck | B619298 | |
| TC20 Automated cell counter | BioRad | ||
| TC20 cell counter counting slides | BioRad | ||
| Thrombin from bovine plasma | Sigma | T9549 | Powder, suitable for cell culture, ≥1,500 NIH units/mg protein (E1%/280 = 19.5) |
| Trypsin (2.5%) 10x | Thermo Fisher Scientific | Dilute to 1x in PBS | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T6414-100ML | Solution, sterile-filtered |
Referanslar
- Galle, P. R., et al. EASL Clinical practice guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 69, 182-236 (2018).
- Marquardt, J. U., Andersen, J. B., Thorgeirsson, S. S. Functional and genetic deconstruction of the cellular origin in liver cancer. Nature Reviews Cancer. 15, 653-667 (2015).
- Balogh, J., et al. Hepatocellular Carcinoma: A review. Journal of Hepatocellular Carcinoma. 3, 41-53 (2016).
- Perumpail, R. B., Womg, R. J., Ahmed, A., Harrison, S. A. Hepatocellular carcinoma in the setting of non-cirrhotic non-alcoholic fatty liver disease and the metabolic syndrome: US experience. Digestive Diseases and Science. 60, 3142-3148 (2016).
- Baglieri, J., Brenner, D. A., Kisseleva, T. The role of fibrosis and liver associated fibroblasts in the pathogenesis of hepatocellular carcinoma. International Journal of Molecular Sciences. 20, 1723 (2019).
- Arriazu, E., et al. Extracellular matrix and liver disease. Antioxidants & Redox Signaling. 21 (7), 1078-1097 (2014).
- Malarkey, D. E., Johnson, K., Ryan, L., Boorman, G., Maronpot, R. R. New insight into functional aspects of liver morphology. Toxicologic Pathology. 33, 27-34 (2005).
- Moreira, R. K. Hepatic stellate cells and liver fibrosis. Archive of Pathology and Lab Medicine. 131, 1728-1734 (2007).
- Hernandez-Gea, V., Toffanin, S., Friedman, S. L., Llovet, J. M. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenteroloy. 144, 512-527 (2013).
- Amicone, L., Marchetti, A. Microenvironment and tumor cells: two targets for new molecular therapies of hepatocellular carcinoma. Translational Gastroenterology and Hepatology. 3, 24 (2018).
- Rawal, P., et al. Endothelial cell-derived TGF-B promotes epithelial-mesenchymal transition via CD133 in Hbx-Infected Hepatoma cells. Frontiers in Oncology. 9 (308), 1-9 (2019).
- Yoo, J. E., et al. Progressive enrichment of stemness features and tumour stromal alterations in multistep hepatocarcinogenesis. PLoS One. 12 (3), 0170465 (2017).
- Landry, B. D., et al. Tumor-stroma interactions differentially alter drug sensitivity based on the origin of stromal cells. Molecular Systems Biology. 14, 8332 (2018).
- Le, B. D., et al. Three-dimensional hepatocellular carcinoma/fibroblast model on a nanofibrous membrane mimics tumor cell phenotypic changes and anticancer drug resistance. Nanomaterials. 8 (64), 1-11 (2018).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14, 6999-7010 (2017).
- Hoarau-Véchot, J., Rafii, A., Touboul, C., Pasquier, J. Halfway between 2D and animal models: Are 3D cultures the ideal tool to study cancer-microenvironment interactions. International Journal of Molecular Sciences. 19 (181), 1-24 (2018).
- Khawar, I. A., et al. Three Dimensional Mixed-Cell Spheroids Mimic Stroma-Mediated Chemoresistance and Invasive Migration in hepatocellular carcinoma. Neoplasia. 20, 800-812 (2018).
- Elliott, N. T., Yuan, F. A review of three-dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2010).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model. Pharmacology Therapy. 163, 94-108 (2016).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Jung, H. R., et al. Cell spheroids with enhanced aggressiveness to mimic human liver cancer in vitro and in vivo. Scientific Reports. 7, 10499 (2017).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. -. K., Ertl, P., Küpcü, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D hepg2 spheroid model. Scientific Reports. 9, 4863 (2019).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2 (2), 123-135 (2013).
- Wrzesinski, K., et al. Human liver spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Mazza, G., et al. Decellularized human liver as a natural 3D-scaffold of liver bioengineering and transplantation. Scientific Reports. 5, 13079 (2015).
- Ma, X., et al. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials. 185, 310-321 (2018).
- Mueller, S., Sandrin, L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepatic Medicine: Evidence and Research. 2, 49-67 (2010).
- Wang, M. H., et al. In vivo quantification of liver stiffness in a rat model of hepatic fibrosis with acoustic radiation force. Ultrasound in Medicine & Biology. 35 (10), 1709-1721 (2009).
- Georges, P. C., et al. Increased liver stiffness of the rat liver precedes matrix deposition: implications for fibrosis. American Journal of Physiology - Gastrointestinal and Liver Physiology. 293, 1147-1154 (2007).
- Massironi, S., et al. et al. Liver stiffness and hepatocellular carcinoma: is it really useful. Journal of Hepatology. 58, 293 (2013).
- Singh, S., et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review. Clinical Gastroenterology and Hepatology. 11, 1573-1584 (2013).
- Yang, T. S., Wang, C. H., Hsieh, R. K., Chen, J. S., Fung, M. C. Gemcitabine and doxorubicin for the treatment of patients with advanced hepatocellular carcinoma: a phase I-II trail. Annals of Oncology. 13, 1771-1778 (2002).
- Le Grazie, M., Biagini, M. R., Tarocchi, M., Polvani, S., Galli, A. Chemotherapy for hepatocellular carcinoma: the present and the future. World Journal of Hepatology. 9 (21), 907-920 (2017).
- Saneyasu, T., Akhtar, R., Sakai, T. Molecular cues guiding matrix stiffness in liver fibrosis. BioMed Research International. 2016, 1-11 (2016).
- Zuliani-Alvarez, L., Midwood, K. S. Fibrinogen-related proteins in tissue repair: how a unique domain with common structure controls diverse aspects of wound healing. Advances in Wound Care. 4 (5), 273-285 (2015).
- Smit, T., et al. Characterization of an alginated encapsulated LS180 spheroid model for anti-colorectal cancer compound screening. ACS Medicinal Chemistry Letters. 11 (5), 1014-1021 (2020).
- Schrader, J., et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 53 (4), 1192-1205 (2011).
- Lachowski, D., et al. Matrix stiffness modulates the activity of MMP-9 and TIMP-1 in hepatic stellate cells to perpetuate fibrosis. Scientific Reports. 9, 7299 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır