Method Article
튜닝 가능한 바이오 물속성과 3D 환경에서 종양-스트로마 상호 작용을 연구하는 간암을 위한 생체 모방 모형
요약
이 프로토콜은 섬유성 기질 구획을 동반한 3D 생체 모방 모델을 제공합니다. 생리학적으로 관련된 하이드로겔을 사용하여 기질 세포 외 매트릭스의 생체 물성 특성, 세포 상호 작용, 종양 성장 및 전이의 활성 중재자를 모방합니다.
초록
간 세포 암 (HCC) 만성 간 질환의 여파로 개발 하는 기본 간 종양. 만성 간 질환과 염증은 간장암 발생을 적극적으로 지원하고 운전하는 섬유성 환경으로 이어집니다. 종양 기질 미세 환경과 종양 세포 사이의 상호 작용의 관점에서 간장 암분 발생에 대한 통찰력은 따라서 상당한 중요성이다. 3차원(3D) 세포 배양 모델은 현재 시험관 내 2D 세포 배양 모델과 생체 내 동물 모델 사이의 누락된 링크로서 제안된다. 우리의 목표는 섬유질 기질 구획과 혈관과 함께 새로운 3D 생체 모방 HCC 모델을 설계하는 것이었습니다. 콜라겐 및 피브리노겐과 같은 생리학적으로 관련된 하이드로겔은 종양 ECM의 생체 물성을 모방하기 위해 통합되었다. 이 모델에서 LX2 및 HepG2 세포는 하이드로겔 매트릭스에 내장되어 반전된 대막 인서트에 시드하였다. HUVEC 세포는 그 때 막의 반대쪽에 시드되었다. 세포에 내장된 ECM-하이드로겔로 구성된 3개의 제형이 제조되었고, 바이오-물체성질은 유경학에 의해 결정되었다. 세포 생존가능성은 21일 동안 세포 생존성 분석에 의해 결정되었다. 화학요법 약물 독소루비신의 효과는 72시간 동안 2D 공동 배양및 3D 모델 모두에서 평가되었다. 유변학 결과는 섬유증, cirrhotic 및 HCC 간의 생체 물리적 특성이 성공적으로 모방될 수 있다는 것을 보여줍니다. 전반적으로, 결과는 이 3D 모델이 전통적인 2D 배양에 비해 생체 내 상황을 더 대표한다는 것을 나타낸다. 우리의 3D 종양 모형은 HCC 환자에서 전형적으로 보인 약 저항을 모방하는 화학요법에 감소된 반응을 보여주었습니다.
서문
간세포 암 (HCC)은 모든 1 차성 간암1,2의90 %를 포함한다. 매년 810,000명의 사망자와 854,000건의 새로운 사례가 보고되면서 현재 사망률1의가장 높은 발병률 중 하나인 전 세계적으로 다섯 번째로 흔한 암으로 평가받고 있습니다. HCC의 발달은 주로 만성 간 질환, 바이러스 성 간염, 만성 과다 알코올 섭취, 대사 증후군, 비만 및 당뇨병1,3,4와관련된 염증에 기인한다. 이러한 병리학적 조건과 관련된 염증은 섬유증5를개시하기 위해 간세포 와 염증 세포를 활성화하고 모집하는 다양한 사이토카인의 간세포 손상 및 분비를 초래한다. 간 질세포는 간 섬유증의 개시, 진행 및 회귀에 있는 그들의 중요한 역할에 대 한 알려져 있습니다. 활성화시 수축, 프로 염증 및 프로 피브리노겐 성질6,7,8을가진 세포와 같은 근섬유세포로 분화한다. 결과 섬유증은 차례로 세포외 매트릭스 리모델링 효소 활성의 난독증을 일으켜, 성장 인자의 분비를 동반한 전반적인 강성을 특징으로 하는 환경을 조성하여 HCC 병인9,10에더 기여한다. 암 개시, 중간엽 전이(EMT), 혈관신생, 전이성 전위 및 변경된 약물 반응11,12,13에연료를 공급하는 간세포와 기질 환경 사이의 이러한 지속적인 병원성 피드백 루프이다. 종양과 종양 미세 환경 사이의 상호 작용의 관점에서 간근증 발생에 대한 통찰력은, 따라서, 기계론뿐만 아니라 치료 관점에서뿐만 아니라 상당한 중요성이다.
체외 세포 배양 모델의 2차원(2D)은 주로 암세포 생물학자14의80%에 의해 사용된다. 그러나, 이들 모델은 화학요법반응(14,15,16)에영향을 미치는 진정한 종양 미세 환경을 대표하지 않는다. 현재 화학요법 약물의 96%는 임상 시험14시동안 실패한다. 약물 감소율에 있는 이 높은 부각은 시험관 외 사전 검열 모형이 HCC 복잡성 및 마이크로 환경의 우리의 현재 통찰력 그리고 이해를 완전히 나타내지 않는다는 사실에 기인할 수 있습니다16. 반대로 인간에 비해 종양과 미세 환경 간의 상호 작용에 있는 손상된 면역 계통 및 불일치로 존재하는 생체 내 동물모형은 16,17에비하여. 동물 연구에서 얻은 결과의 평균 8%만이 임상 전에서 임상설정(16,17)으로안정적으로 번역될 수 있다. 따라서, HCC의 평가는 종양뿐만 아니라 미세 환경의 복잡성을 효과적으로 재구성하는 체외 플랫폼의 개발이 필요하다는 것이 분명합니다. 이 플랫폼은 현재 사용 가능한 시험관장 전 임상 선별 모델을 보완하고 향후7,14에서동물 연구의 양을 줄일 것입니다.
이러한 플랫폼 중 하나는 고급 3차원(3D) 세포 배양 모델이다. HCC를 연구하는 이러한 고급 3D 모델의 무리가 지난 10 년 동안 등장하고 다양한 리뷰가 출판되었습니다. HCC를 연구하는 사용 가능한 3D 모델에는 다세포 스페로이드, 오르가노이드, 스캐폴드 기반 모델, 하이드로겔, 미세 유체 및 바이오 프린팅이 포함됩니다. 이들 중, 다세포 구체는 종양 발달의 연구에 사용되는 가장 잘 알려진 모델 중 하나입니다. 스페로이드는 낮은 기술적 난이도를 가진 저렴한 모델이며 동시에 생체종양아키텍처(18,19,20)에서효과적으로 모방된다. 다세포 구형은 HCC17,21,22에대한 풍부한 정보에 기여했다. 그러나, 표준화된 배양 시간은 다세포 스페로이드가 7 48일 사이에 배양에 유지되기 때문에 부족합니다. 문화 시간이 증가하는 것은 상당히 중요합니다. Eilenberger는 스페로이드 시대의 차이가 소라페닙 (간암 치료에 사용되는 키나아제 억제제)에 심오하게 영향을 미친다는 것을 발견했습니다(23) 확산성 및독성(23). Wrzesinski와 Fey는 3D 간세포 구체가 트립시화 후 주요 생리적 간 기능을 다시 확립하는 데 18 일이 필요하다는 것을 발견했지만 이 회복 후 최대 24 일 동안 안정적인 기능을 계속 전시하고있으며 24,25.
좀 더 진보된 3D HCC 모델 중 일부는 인간 탈세포화된 간 비계 및 생체 인쇄 비계의 사용을 포함한다. Mazza와 동료는 이식에 적합하지 않은 탈세포 인간 간을 사용하여 HCC 모델링을위한 천연 3D 비계를만들었습니다(26). 이러한 천연 스캐폴드는 콜라겐 타입 I, III, IV 및 섬유넥틴과 같은 주요 세포외 매트릭스 성분의 발현을 유지하면서 간 질및 간 세포종 세포의 공동 배양으로 21 일 동안 성공적으로 다시 채워질 수 있었습니다. 질병 모델링 이외에, 이 모형은 또한 기능성 기관 이식 및 전임상 약물 및 독성스크리닝(26)의이점을 제공한다. 3D 바이오 프린팅의 발전으로 3D 세포 외 매트릭스 스캐폴드는 이제 바이오 인쇄될 수 있습니다. Ma 및 동료, 세포외 외 세포 매트릭스(27)에서하이드로겔 엔지니어를 사용하여 가변 기계적 특성 및 생물 모방 마이크로 아키텍처를 가진 바이오 인쇄 외세포 매트릭스 스캐폴드. 의심 할 여지없이 이들은 모두 우수한 3D HCC 모델입니다. 그러나, 인간의 간 가용성및 필요한 장비 및 재료 취득에 관련 된 비용 불리 한이러한 모델을 배치. 또한, 이러한 방법은 모든 기술적으로 고급 모든 연구원에 게 쉽게 사용할 수 없습니다 광범위 한 훈련을 필요로.
HCC와 현재 사용 가능한 3D 모델의 복잡성을 바탕으로 모든 것을 포괄하는 3D HCC 모델을 개발하기 위해 노력했습니다. 우리는 조정 가능한 하이드로겔 강성 값을 통합하여 전문체 및 종양 미세 환경을 모두 회수할 수 있는 모델을 목표로 했습니다. 더욱이, 우리는 또한 HCC의 병기에서 중요한 역할을 하는 간세포 세포주 및 기질 관련 세포주를 포함했습니다. 이들은 생리적으로 관련 하이드로겔로 구성된 미세 환경에서 자란 내피 세포, 간질 세포 및 악성 간구세포를 포함합니다. 선택된 하이드로겔, 콜라겐 타입 I 및 피브리노겐을 사용하여 HCC의 개시 및 진행 중에 간 경직에서 볼 수 있는 바이오 물리적 변화에 필적하는 비율로 통합되었습니다. 또한, 우리는 장기간 문화에 보관 할 수있는 모델을 목표로했다. 우리는 기본 장비, 최소한의 교육 및 경험, 쉽게 사용할 수있는 재료로 설정할 수있는 모듈식, 비용 효율적인 모델을 구상했다.
프로토콜
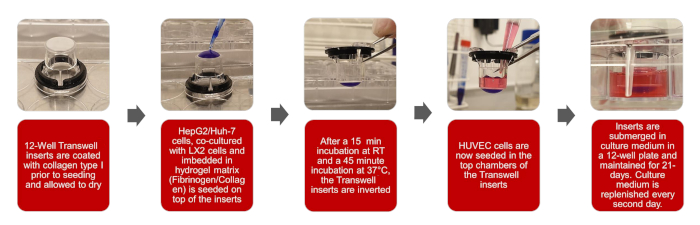
그림 1: 3D 생체 모방 HCC 모델의 생성에 대한 그래픽 묘사는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: 이 프로토콜의 전체 워크플로우는 그림 1의 그림에 명시되어 있습니다.
1. 피브리노겐 재고 솔루션 준비
- 1M 칼슘 염화물(CaCl2)스톡 용액을 2.21g의무게로 20mL 증류수(dH2O)에 첨가하여 준비한다. 재고 용액은 실온(RT)에 보관할 수 있습니다.
- 20mL 아프로틴 스톡 솔루션(1218.75 KIU/mL)을 5 mg의 아프로틴계량하여 20mL dH2O. Aliquot 스톡 용액을 1mL 알리쿼트스톡용액에 넣고 -20°C에 보관한다.
- 80 mg / mL 피브리노겐 재고 솔루션의 10 mL을 준비합니다.
- 50mL 튜브에서 7.849 mL 인산완충식셀린(PBS), 2.051mL 아프로틴 재고(1218.75 KIU/mL)를 추가하여 최종 아프로틴 농도 250KIU/mL, 100 μL CaCl 2(1M)의 최종2ClM 농도를 기록했다.
- 무게 800 피브리노겐의 mg.
- 무게 200 mg 염화 나트륨 (NaCl) 재고 용액에 대 한 포함 하는 2% w/v NaCl.
- PBS, 아프로틴 및 CaCl2를포함하는 50 mL 튜브에 피브리노겐과 NaCl을 증분에 추가한다. 이 용액에 형성 되는 fibrinogen 겔화 및 덩어리 귀착 될 것 이다 적극적으로 저어 또는 흔들어 하지 마십시오.
- 피브리노겐 스톡 용액의 50mL 튜브를 셰이커에 수평으로 놓고 300 rpm의 낮은 설정에서 흔들어 줍니다.
- 용액이 용해되면 볼륨에 따라 0.22 μm 주사기 필터 또는 병 상단 필터를 사용하여 필터링합니다. 중요한 것은, 이것이 피브리노겐을 파괴할 것이기 때문에 피브리노겐 용액을 자동화하지 마십시오.
참고: 프로토콜의 이 부분은 재고 솔루션의 양에 따라 2~5시간 정도 걸릴 수 있으며, 이번에는 실험 설정 중에 고려해야 합니다.
2. 하이드로겔을 인서츠에 파종하기 전에 콜라겐으로 인서트를 코팅합니다.
- 라미나르 플로우 후드 또는 조직 배양 후드에서 멸균 핀셋을 사용하여 플레이트에서 인서트를 제거하고 플레이트 뚜껑에 반전배치합니다.
- 20mM 빙하 아세트산 스톡 용액 100mL를 dH2O의25mL에 115 μL을 추가하고 dH2O.로 100mL의 최종 부피에 적응하여 0.22 μm 주사기 필터를 사용하여 용액을 필터링합니다. 재고 용액은 RT에 저장할 수 있습니다.
- 20mM 빙하 아세트산 스톡 용액의 1.960mL에 5 mg/mL 콜라겐 용액의 40 μL을 추가하여 5 mg/mL 콜라겐 용액으로부터 100 μg/mL 콜라겐 용액의 2mL를 준비한다.
- 각 인서트에 용액의 100 μL을 파이프팅하여 2.3으로 제조된 100 μg/mL 콜라겐 용액으로 인서트를 코팅합니다. 2 ~3 시간 동안 라미나르 플로우 후드 또는 조직 배양 후드 내에서 공기를 건조하게하십시오.
- 일단 인서트가 건조되면 PBS로 각 삽입 3배. 12 웰 플레이트의 각 웰에 PBS 1 mL을 추가하고, 우물에 아래로 향한 콜라겐 코팅삽입을 배치하고, 우물에서 PBS를 제거하고 절차를 반복합니다. 라미나르 플로우 후드 1~2시간 내에 공기를 건조시키십시오.
주의: 아세트산은 세포에 독성이 있으며 삽입은 PBS로 철저히 세척되어야 합니다. - 인서츠 위에 사용자 정의 3D 인쇄 스페이서를 추가하면 젤이 삽입에서 매달려 있으면 플레이트의 바닥 우물을 만지지 않도록해야합니다(그림 2).

그림 2: 사용자 정의 3D 인쇄 스페이서이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 반전된 인서트를 플레이트의 바닥 부분으로 덮고 셀이 하이드로겔에 내장되어 종자 될 때까지 인큐베이터에 넣습니다.
3. 하이드로겔에 내장된 파종 셀을 삽입에 넣습니다.
참고: 표 1은 준비될 다양한 농도의 피브리노겐을 가진 3개의 제제에 대한 설명을 제공한다. 제형 1개는 섬유증, 2개의 간경변 및 3개의 HCC의 개시 도중 간, 2개의 간경변 및 3개의 HCC에 대응하는, 이들 제제각각에 대한 강성 값은 프로토콜 최적화 동안 유경학으로 결정되었다.
| 정립 | 최종 피브리노겐 농도 (mg/mL) | 최종 콜라겐 농도 (mg/mL) | 셀(LX2 + HepG2 공동 배양 1:1) | 간 단계 | 문학 간 강성 값 (kPa) | 유경학(kPa)의 모델 강성 값 | 정립 | 추가하는 피브리노겐 (mL) | 추가할 콜라겐(mL) | 10% DMEM(mL) | 트롬빈 (μL) | 참조s |
| 1 | 10 | 2 | 2 x 106 셀/mL | 섬유 증 | ≥2 | 3 | 1 | 1 | 0.8 | 0.2 | 4 | 28; 29; 30 |
| 2 | 30 | 2 | 2 x 106 셀/mL | 경 변 증 | 6 | 2 | 0.75 | 0.8 | 0.45 | 3 | ||
| 3 | 40 | 2 | 2 x 106 셀/mL | Hcc | ≥10 | 10 | 3 | 0.25 | 0.8 | 0.95 | 1 | 28; 31; 32 |
표 1: 하이드로겔에 내장된 파종 세포에 대한 제형에 대한 설명
- dH2O의 100mL에 NaOH 3.99 g를 추가하여 수산화 나트륨 스톡 용액 1M을 준비하십시오. 그런 다음 0.22 μm 주사기 필터를 사용하여 용액을 필터링할 수 있습니다. 재고 솔루션을 RT에 저장합니다.
- 5 mg / mL 콜라겐과 얼음에 1 M NaOH의 10 mL을 놓습니다.
- 50mL PBS, 15mL 트립신, 70mL 10% DMEM 및 피브리노겐 스톡 용액을 예열하여 1부에서 37°C~ 37°C로 수조에서 20분 동안 준비하였다.
- 셀 서스펜션을 준비합니다.
- T175 배양물에서 간 염기 세포(LX2) 및 간 암종(HepG2) 세포를 PBS 10mL로 두 번 세척한다.
- 37°C에서 4분 동안 6mL 트립신으로 세포를 트립시니즈합니다.
- 10% DMEM의 6mL로 트립신을 비활성화합니다.
- 세포 현탁액을 15mL 튜브와 원심분리기에서 300 x g로 3분 동안 수집합니다.
- 원심 분리 후, 10% DMEM의 5mL에서 상류체를 흡인하고 각 세포줄을 재연한다.
- 자동 셀 카운터를 사용하여 셀 계산: 각 셀 서스펜션의 10 μL을 카운팅 챔버 슬라이드에 추가하고 슬라이드를 셀 카운터에 삽입합니다. 셀 카운트는 셀/mL로 표시됩니다.
- 명확하게 표시된 15 mL 튜브로 3.4.6 단계의 세포 수를 사용하여 각 세포주에서 1 x 106 세포로 세포를 희석시. 300 x g에서 3 분 동안 희석을 원심 분리합니다.
- 원심분리 후, 표 1에 따라 각 15mL 튜브에 10% DMEM을 흡인시키고, 표에제공된 값은 각 제형의 2mL에 대한 것이다.
- 콜라겐의 양을 10μL/mL NaOH(1M)로 중화시키고, 중화 콜라겐을 세포 현탁액에 첨가하고, 10% DMEM선물은 노란색으로 변하고, 서스펜션이 컷 팁으로 파이펫팅하여 철저히 혼합되면 밝은 분홍색으로 변하게 된다.
- 표 1에 따른 콜라겐 세포 현탁액에 피브리노겐을 추가하고, 컷 파이펫 팁을 사용하여 서스펜션을 철저히 섞는다.
- 마지막으로 콜라겐-피브리노겐 세포 현탁액에 혈전을 추가, 0.1 KIU 혈소암각 10 mg의 피브리노겐에 대 한.
- 인큐베이터에서 2절에 제조된 미리 코팅된 반전 인서트를 제거하고, 지정된 인서트에 준비된 서스펜션의 200 μL 파이펫 팁, 파이펫 200 μL을 사용하여 한다. 젤이 라미나르 플로우 후드 내에서 15분 동안 크로스링크를 연결하도록 허용합니다.
- 15분 후, 접시의 바닥 부분을 젤 위에 부드럽게 놓고 인큐베이터로 이동하여 젤이 45분 동안 37°C에서 교차연결할 수 있도록 합니다.
- 젤이 교차 연결되면 인서트를 다시 반전시키고 플레이트의 각 하단 우물에 10% DMEM의 2mL을 추가합니다.
4. 내피 세포를 파종
- 25mL 행크 균형 소금 용액 (HBSS), 10 mL 트립신, 10 mL 트립신 억제제 및 50 mL 내피 성장 매체, 수조에서 20 분 동안 37 °C로 예열하십시오.
- 내피 (HUVEC) 세포 현탁액을 준비한다.
- T175 배양물에서 HUVEC 세포를 10mL HBSS로 두 번 세척합니다.
- 37°C에서 4분 동안 6mL 트립신으로 세포를 트립시니즈합니다. 6 mL 트립신 억제제와 트립신을 비활성화. 200 x g에서3 분 동안 튜브와 원심 분리기의 15 mL에서 세포 현탁액을 수집합니다.
- 원심분리 후 상류체를 흡인시키고 5mL 내피 성장 배지에서 세포를 중단한다.
- 자동화된 셀 카운터를 사용하여 3.4.6에서 이전에 설명한 대로 셀을 계산합니다.
- 세포 카운터에서 세포 수를 사용하여 내피 성장 배지에서 1.0 x 104 세포/mL의 파종 밀도를 준비합니다.
- 후브C 셀 서스펜션의 종자 500 μL은 인서트가 삽입당 5.0 x 103 세포의 최종 부피를 갖는 인서드의 상단 부분의 각 우물에 들어갑니다.
5. 유지 보수
- 양일마다 성장 배지를 교체하고, 우물과 인서트가 모두 소비한 성장 배지를 흡인한다. 2mL 10% DMEM을 후브C 세포를 함유하는 인서츠에 겔 및 0.5mL 내피 성장 배지를 함유하는 웰에 첨가한다.
- 실험 전에 21일 동안 모델을 유지관리합니다.
6. 리솔로지
- 겔 제형의 저장 계수를 측정하여 rheometer를 사용하여 강성 값을 나타내고, 0.1-20 Hz에서 0.267% 및 37°C의 주파수 스윕을 수행하여 8mm 직경의 병렬 플레이트 스테인리스 스틸 기하학을 사용하여 0.1N의 일정한 축력을 발휘합니다.
7. 생존력 및 약물 반응
- 2D 공동 배양 및 3D 모델에서 약물 반응 및 생존 가능성을 결정합니다.
- 종자 HepG2 (5.0 x 103 세포 /mL) 및 LX2 (5.0 x 103 세포 /mL) 세포는 1.0 x 104 셀 /mL의 종자 밀도에서 검은 선명한 하단 96 웰 플레이트로 2D 공동 배양을위한 1:1 비율로 세포. 세포가 하룻밤 사이에 부착되도록 허용합니다.
- 3D 모델을 설정하여 6kPa의 강성 값을 가진 cirrhotic 환경에 대응한다. 독소루비신 치료 21일 전에 모델을 유지한다.
- 독소루비신 치료 2시간 전에, 2D 및 3D 모델 모두에서 배양 배지를 흡인한다. PBS로 두 모델을 두 번 세척합니다. 기아 배지(1% v/v 항진항항생제 용액으로 보충)를 2D 공동배양(웰당 200 μL)과 3D 모델(하이드로겔을 함유한 웰에 2mL 및 삽입에 500 μL)을 추가한다.
- 2D 및 3D 모델 모두에 독소루비신을 투여한다. 투여량은 다음과 같습니다: IC25, 50 및 75 값에 대응하는 0.5, 1 및 1.5 mMM, 각각. 두 모델을 72h로 처리합니다.
참고: 독소루비신, 토포이소라제 II 억제제는 HCC에 사용되는 최초의 화학요법 약물 중 하나이며 HCC33,34의치료에 가장 활발한 화학요법 제제 중 하나이기도 하다. - 72h 이후, 2D 및 3D 모델 모두에서 흡인 배양 배지. 나머지 배양 매체는 PBS로 두 모델을 두 번 세척하여 제거되었는지 확인합니다.
- 제조업체의 권장 사항에 따라 AlamarBlue를 준비하고 2D 및 3D 모델의 우물에 추가하십시오. 2D 배양에 대해 우물당 150 μL, 3D 배양을 위해 인서드당 2mL, 인서드당 500 μL을 추가합니다. 37°C에서 하룻밤 동안 배양.
- 3D 설정의 각 웰에서 AlamarBlue의 150 μL을 블랙 클리어 하부 96 웰 플레이트로 배양 전송합니다. AlamarBlue는 2D 모델의 플레이트에서 직접 읽을 수 있습니다.
- 각각 485 및 550 nm의 난초 파장 및 방출 파장에서 마이크로 플레이트 판독기와 형광을 읽어보십시오.
- 다음 수식을 사용하여 두 모델모두에서 셀 실행 가능성을 계산합니다.
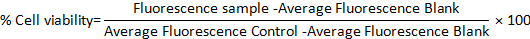
결과
농도 범위 및 시드 볼륨
최종 기능 프로토콜을 얻기 위한 프로토콜 최적화는 도 3에제시된 회로도도에 따라 일어났다. 2개의 생리학적 관련 하이드로겔, 콜라겐 타입 I 및 피브리노겐은 문헌검색(35,36)을통해 확인되었다. 쥐 꼬리 콜라겐 유형 I로 시작하여, 농도의 범위 (4, 3, 2 및 1 mg/mL)는 다시 한 번 반전 된 삽입에 성공적으로 부착 할 수있는 능력을 결정하기 위해 반전 인서트에 시드되었다. 이 범위 내의 모든 농도는 젤을 형성할 수 있었지만, 콜라겐 젤은 평평해 보였고 처리 및 파이펫팅으로 인해 다양한 기포가 그 안에 갇혀 있었으며, 도 4 및 도 5를참조하십시오. 콜라겐 겔의 품질을 향상시키기 위한 최적의 파종 부피를 결정하기 위해, 다양한 파종부(100, 150 및 200 μL)를 반전 된 인서트에 시드하였고, 도 5를참조하십시오. 시드 볼륨은 젤의 출현이나 젤 내의 거품의 존재에 영향을 미치지 않았다. 이에 따라, 200 μL이 가장 완전한 젤을 생산하는 최적의 종자 부피라고 결정되었다. 피브리노겐은 또한 장기간 인서트를 부착할 수 있는 젤을 생산하는 능력에 대해 평가되었다. 농도 범위(70, 50, 40, 30, 20, 10, 5, 1 mg/mL)를 12웰 플레이트의 뚜껑에 200 μL의 부피로 제조 및 시드하였다, 도 6을참조한다. 모든 농도를 시드 후 20 분 이내에 성공적으로 젤을 형성 할 수 있었다. 그러나, 농도 5 및 1 mg/mL은 형성된 겔이 일관성과 같은 유체를 가지고 있고 37°C에서 하룻밤 동안 보관된 후 뚜껑에서 분리되기 시작했기 때문에 배제되었다.
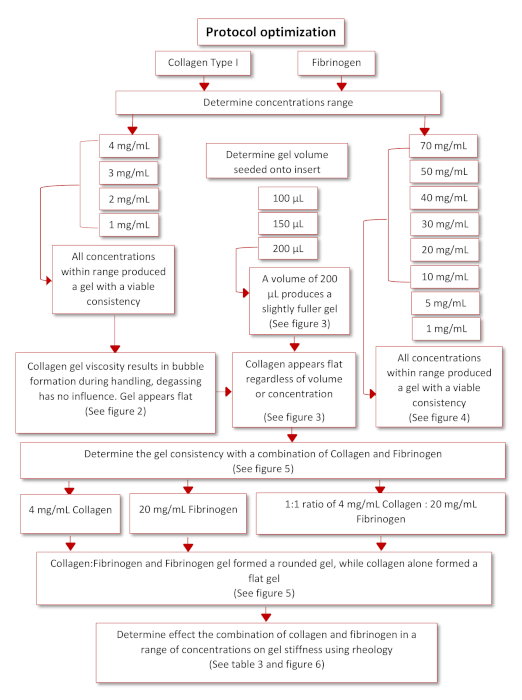
그림 3: 프로토콜 최적화의 회로도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 콜라겐 젤 4 mg/mL 포함 1.0 x 105 세포/mL 에 시드 된 삽입에 젤에 존재하는 거품을 보여주는. 왼쪽에 삽입된 것은 15분 동안 얼음 위에 탈가스가 있었고, 오른쪽에 삽입된 것은 탈가스가 없습니다. 탈기는 젤에 존재하는 기포에 어떤 영향도 미치지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
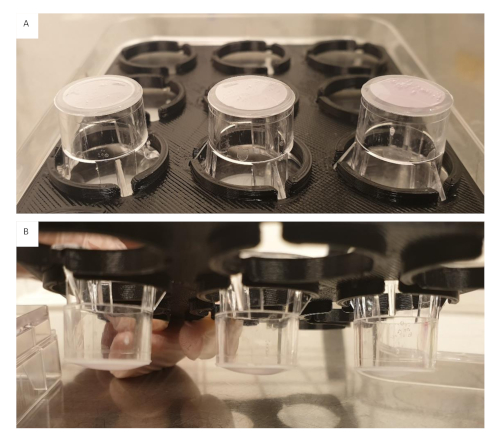
그림 5: 콜라겐 젤 4 mg/mL 포함 1.0 x 105 셀/mL 다양한 볼륨의 인서츠에 시드. (A)시드 직후 왼쪽 100 μL, 중간 150 μL 및 오른쪽 200 μL에 삽입합니다. 젤의 거품은 여전히 존재했다. (B)60분 크로스링크 후 왼쪽 200 μL, 중간 150 μL 및 오른쪽 100 μL에 삽입한다. 볼륨에 관계없이 모든 젤은 여전히 평평하게 나타납니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 12웰 플레이트의 뚜껑에 시드된 70~1mg/mL의 농도 범위에서 피브리노겐(200 μL). (A)시드 직후에 젤. (B)시드 후 20분 젤. (C)젤은 하룻밤 동안 보관. 모든 젤은 잘 둥근 나타납니다, 5 mg/mL 및 1 mg/mL 젤 그들은 더 유동적인 농도를 가지고 등장으로 제외 되었다 20 시드 후 분 하룻밤 유지 되 고 뚜껑에서 분리 하기 시작 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
조합 콜라겐과 피브리노겐
콜라겐 및 피브리노겐 농도 범위의 결과에 기초하여 콜라겐과 피브리노겐을 결합하는 효과를 평가하였다. 3개의 삽입은 다음, 4 mg/mL 콜라겐, 20 mg/mL 피브리노겐 및 콜라겐 (4 mg/mL) 및 피브리노겐 (20 mg/mL)의 1:1 배급을, 도 7을참조하십시오. 하이드로겔을 파종한 직후, 콜라겐을 직접 삽입한 것은 겔 내의 거품 발생과 결합된 평평한 외관을 가지고 있음을 관찰했습니다. 피브리노겐을 가진 인서트가 풀고 둥근 젤을 생산했기 때문에 콜라겐과 피브리노겐의 조합으로 인서트를 했습니다. 60분 동안 37°C에서 교차 연결한 후, 모든 젤은 인서트에 부착되어 있었고, 37°C에서 하룻밤 동안 인큐베이션에 부착되어 있었다.

그림 7: 콜라겐과 피브리노겐의 조합의 효과. (A)콜라겐 4 mg/mL 시드는 왼쪽에 인서트를 삽입하고, 피브리노겐 20 mg/mL은 중앙및 콜라겐 4 mg/mL, 피브리노겐 20 mg/mL(1:1 ration)에 삽입하여 오른쪽에 삽입하였다. 1.0 x 105 세포/mL을 함유한 200 μL의 부피로 시드된 모든 젤은 37°C에서 60분 동안 교차연결되었다(B) 콜라겐 4 mg/mL 60분 교차 후 겔이 평평하게 나타났고 거품이 있었다. (C)왼쪽 피브리노겐 20 mg/mL에 삽입하고, 겔이 둥글게 나타나고, 거품이 없고, 오른쪽 콜라겐 4 mg/mL, 피브리노겐 20 mg/mL 젤에 삽입하고, 겔은 거품없이 잘 둥글게 된다. (D)콜라겐 4 mg/mL 젤은 37°C에서 하룻밤 동안 보관된 후, 겔은 여전히 많은 양의 거품을 포함하고 있으며, 겔의 일부 부종이 발생하였다. (E)피브리노겐 20 mg/mL은 37°C에서 하룻밤 동안 보관되어 있습니다.(F)콜라겐 4 mg/mL, 피브리노겐 20 mg/mL 젤은 37°C에서 하룻밤 동안 보관되어 있습니다.
세포 종자 밀도 결정
하이드로겔과 함께 작업한 이전의 경험을 바탕으로 최적의 세포 시싱 밀도(도시되지 않은 데이터)를 결정하기 위한 실험이설정되었다(37). 세포는 콜라겐과 피브리노겐의 조합으로 다음과 같은 농도 범위(7.5 x 105,8.5 x 105,9.5 x 105,1.0 x 106,1.5 x 106 및 2.0 x 106 세포/mL), 2.0 x 10 6 세포/mL, 2.0 x 106 세포/mL의 조합으로 포함되었다.
경채학
피브리노겐 및 콜라겐 하이드로겔 조합의 10가지 제형은 유경학을 통해 평가하였고, 표 2를참조하였다. 목표는 이러한 제제 중 HCC 의 발달 중에 볼 수있는 간 강성을 모방 할 수있는 결정이었습니다. 문헌은 섬유증, 간경변 및 HCC 동안 쥐, 마우스 및 인간에게 알려진 간 강성 값을 제공했으며, 목표는 이러한값(28,29,30,31,32)에최대한 가까워지는 것이었다. 표 2에 명시된 10개의 제형은 각각의 트리플리케이트및 저장계를 사용하여 제조되었고, 결과는 도 8에도시되었다.
| 정립 | 피브리노겐 (mg/ml) | 콜라겐 (mg/ml) |
| 1 | 60 | 2 |
| 2 | 50 | 2 |
| 3 | 40 | 2 |
| 4 | 30 | 2 |
| 5 | 20 | 2 |
| 6 | 10 | 2 |
| 7 | 20 | 5 |
| 8 | 20 | 4 |
| 9 | 20 | 3 |
| 10 | 20 | 1 |
표 2: 경직성 값을 결정하기 위해 유경학과 평가된 다양한 농도의 콜라겐 및 피브리노겐 조합
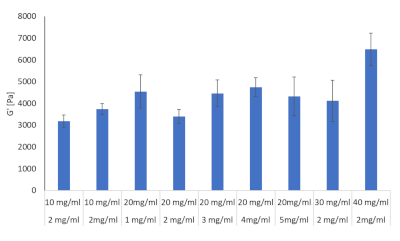
그림 8: 유경학으로 평가된 다양한 농도에서 콜라겐 및 피브리노겐 조합에 대한 하이드로겔 강성 값. 스토리지 계수 및 손실 계둘루는 디스커버리 HR-2 하이브리드 Rheometer(n= 3, 오류 막대 = SD)를 통해 37°C 및 1Hz에서 결정되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 10개의 수식에서 3개가 선택되어 진행했습니다. 여기에는 섬유증 발병 시 간 강성 값에 해당하는 2 mg/mL 콜라겐 타입 I 및 10 mg/mL 피브리노겐, 2 mg/mL 콜라겐 타입 I 및 2 mg/mL 콜라겐 타입 I 및 40 mg/mL 피브리노겐이 포함되었다.
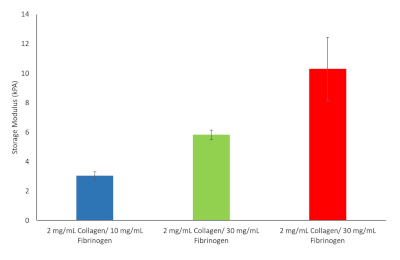
도 9: 다양한 피브리노젠/콜라겐 하이드로겔 제형에 대한 하이드로겔 강성 값을 계속 선택하였다. 스토리지 계둘루 및 손실 계둘루는 37°C 및 1Hz(n= 3, 오류 막대 = SD)로 결정되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
생존가능성, 약물 반응 및 전이성 전위
AlamarBlue 분석의 결과는 2D 공동 배양 내에서 전체적인 감소된 세포 생존가능성을 보였으며, 알려진 보고된 IC 25, 50 및 75값에 기초하여 예상보다 낮으며, 처리되지 않은 대조군과 비교했을 때 도 10을참조하십시오. 이것은 Doxorubicin 처리에 더 민감한 우리의 공동 배양에 있는 LX2 세포에 기인할 지도 모릅니다. 그러나, 우리의 3D 모형에서 우리는 3D 모형 시스템에서 수시로 보인 화학요법 잠재력에 있는 감소를 확인하는 독소루비신 저항에 있는 그리고 증가했습니다. 대조군과 비교한 통계적 유의성은 학생 T 시험(두 꼬리)을 사용하여 평가되었으며, P&05는 유의하다고 판단되었습니다.
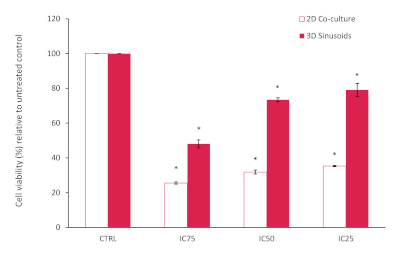
도 10: 72h의 기간 동안 다양한 농도에서 Doxorubicin을 치료한 후 3D 모델에 비해 2D 공동 배양 모델의 백분율 세포 생존가능성. 처리되지 않은 컨트롤(n=3, 오류 막대 = SD)에 비해 정규화된 결과(* = p&0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
겔 구조는 하이드로겔의 상이한 농도 내에서 세포 성장을 따르기 위해 가벼운 현미경을 사용하여 매일 육안으로 검사되었다. 세포는 균일하고 컴팩트한 방식으로 하이드로겔을 채웠으며, 7일째부터 스페로이드가 매트릭스 내에서 조립되기 시작했습니다.
토론
이 프로토콜은 HCC에 대한 생체 모방 모델을 만드는 방법의 개발을 설명합니다. 명확한 워크플로우가 설정되었으며 관련 중요한 단계를 식별했습니다. 이러한 중요한 단계에는 피브리노겐 스톡 용액의 제조, 콜라겐으로 인서트를 코팅하고 하이드로겔에 침지된 세포를 파종하는 것이 포함됩니다. 피브리노겐 스톡 솔루션을 준비하는 동안 더 높은 농도에서 더 작은 증분에 피브리노겐을 추가하는 것이 중요합니다. 이것은 피브리노겐이 용해되는 데 걸리는 시간을 줄일 뿐만 아니라 도 11에서볼 수 있듯이 피브리노겐이 일관되고 조기에 겔화되는 것을 방지할 수 있습니다. 피브리노겐 젤의 제조는 상당한 시간이 걸리며 이것은 전반적인 실험 성공에 영향을 미칠 수 있습니다. 결과는 피브리노겐 젤이 일관되게 젤을 시작하면 그것을 버리는 것이 가장 좋습니다. 인서츠는 콜라겐으로 코팅하고, PBS로 세척하고 하이드로겔에 내장된 세포를 파종하기 전에 라미나르 플로우 후드 내에서 건조되어야 합니다. 인서트가 건조하도록 하지 않으면 하이드로겔이 인서츠 의 가장자리 위로 흘러들어와 균일한 젤이 생성됩니다. 젤의 불균일성은 궁극적으로 확산이 요인인 결과에 영향을 미칩니다.
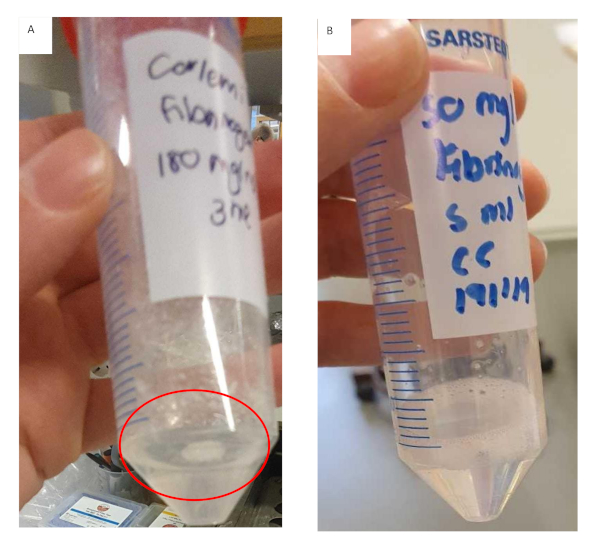
도 11: 피브리노겐/콜라겐 하이드로겔 제형용 피브리노겐 젤의 제조. (A)덩어리를 형성하고 튜브에 용해되지 않은 피브리노겐을 고수하여 조기에 젤을 형성한 피브리노겐 젤 용액. (B)완전히 용해된 피브리노겐 젤 용액은 용액이 명확하고 약간 점성이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
피브리노겐 성분이 혈소판을 추가하여 교차 연결을 시작하기 때문에 하이드로겔 세포 현탁액을 삽입물에 시드하는 동안 가능한 한 빨리 작업하는 것이 좋습니다. 젤이 시딩하는 동안 교차하는 것을 방지하기 위해 더 높은 농도에서 젤 서스펜션으로 작업할 때 한 번에 더 작은 작업량을 준비합니다. 후자는 각 우물에 시드 된 젤의 분포 와 양에 영향을 미칠 것입니다. 이 프로토콜에서는 구성 요소를 추가하는 순서가 매우 중요하며, 이 프로토콜에서는 젤이 조기에 교차하는 것을 방지하기 위해 간소화된 워크플로우를 제공했습니다. 하이드로겔 젤 서스펜션의 점도로 인해 절단 파이펫 팁으로 작업하는 것은 혼합 및 측정 중에 권장됩니다. 현탁액을 혼합할 때 균일한 서스펜션을 만들기 위해 신속하고 균등하게 수행되도록 합니다. 고르지 않은 혼합은 결과에 부정적인 영향을 미칠 이질성 젤을 초래할 것이며, 그림 12를참조하십시오.
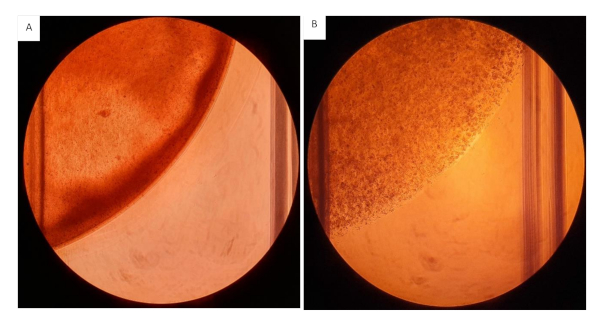
그림 12: 콜라겐/피브리노겐 젤을 12개의 웰 플레이트에 시드했습니다. 모든 젤은 2mg/mL 콜라겐을 함유하는 200 μL의 부피와 2.0 x 106 세포/mL을 함유한 20 mg/mL 피브리노겐으로 시드되었습니다. (A)하이드로겔의 이질적인 일관성, 가시적인 비균일한 하이드로겔을 결합한 하이드로겔겔. (B)하이드로겔이 균질하게 혼합된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜 최적화에 따라, 모델은 모델바이오-물속성을 결정하기 위해 평가되었다. 유변학 데이터는 생리학적으로 관련된 세포외 매트릭스 성분, 즉 콜라겐 타입 I 및 피브리노겐으로 구성된 당사의 모델이 섬유성, cirrhotic 및 HCC 간28,29,30,31,32의생체 물리적 특성을 모방할 수 있었다는 것을 보여주었다. HCC에 대 한 3D 모델에서 간 강성을 다시 항복 하는 것은 상당한 중요성이며 종종 모델 개발 하는 동안 간과. 증가 된 간 강성은 HCC38내화학 요법 저항, 증식, 이주 및 휴면과 관련이 있습니다. HCC에서 간 stellate 세포의 활성화는 증가 세포 외 매트릭스 강성과 연관되는 동안, 메카노민증을 보여주는 이러한 간 stellate 세포와 관련된 여러 신호경로와 39.
HCC를 위한 3D 모델의 발달에 있는 간 stellate 세포 및 내피 세포와 같은 기질 관련 세포의 포함은 점점 더 관련성이 되고 있습니다. 연구 결과에 따르면 간 stellate 및 HCC 세포로 구성된 다세포 구체는 PXT 마우스 모델 및 인간 HCC 조직 샘플17과비교했을 때 생체 내에서 HCC 종양 모양을 모방하면서 화학 요법 저항및 침습적 이동을 증가시켰다. 정외에 의한 유사한 연구 결과는, 2017년 간세포 암종(Huh-7) 및 내피(HUVEC) 세포로 구성된 다세포 구엽이 혈관화 및공격성(22)을승진시켰다는 것을 것을을 발견했습니다. 이러한 스페로이드는 Huh-7 단양스페로이드(22)와비교했을 때 독소루비신과 소라페네이브의 상당히 높은 농도에서 생존력을 보였다. HCC의 강성 값과 스트로마 관련 세포(LX2 및 HUVEC)의 포함에 상응하는 강성 값을 가진 독소루비신에 대한 모델의 생존가능성 과 반응에 대한 평가는 2D 공동 배양 모델에 비해 화학요법에 대한 반응에서 유사한 감소를 보였다. 따라서, 일반적으로 환자 및 기타 3D HCC 모델에서 볼 수 있는 약물 내성을 효과적으로 모방한다.
이는 모듈식 시스템이므로 다른 세포외 매트릭스 성분, 라미닌 및 히알루론산의 첨가에 의해 모델을 강화할 수 있다. 대안적으로, 이 모델 내에서 사용되는 현재 하이드로겔은 알기네이트 나트륨 또는 키토산과 같은 합성 하이드로겔로 대체될 수 있다. 현재 모델에 대한 추가 변형은 1차 세포 배양과 세포주를 대체하여 더욱 생리적으로 관련된 모델을 생성하거나 다른 종양 및 기질 세포주 조합을 사용할 수 있다.
우리는 이렇게 성공적으로 HCC에 있는 종양-stroma 상호 작용을 공부하기 위한 조정 가능한 bio-물리적 속성을 가진 3D 모형을 개발했습니다. 우리는 독소루비신에 대한 응답으로 기존의 2D 문화와 비교할 때 생체 내 상황을 보다 대표적인 것으로 나타났습니다. 그러나 아직 해야 할 일이 많으며, 이 모델을 광범위하게 특성화하고 HCC 연구에 남아 있는 더 복잡하고 시급한 질문에 답할 수 있는 가능한 전이성 플랫폼으로 모델을 탐구하기를 희망합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 스웨덴 암 재단 (Cancerfonden, CAN2017/518), 의학 연구를위한 스웨덴 사회 (SSMF, S17-0092), O.E. och Edla 요한슨 재단 및 올가 욘슨 재단에서 얻은 보조금을 통해 투자되었습니다. 이러한 자금 출처는 연구 설계에 관여하지 않았습니다. 데이터의 수집, 분석 및 해석; 보고서 작성; 그리고 출판을 위해 기사를 제출하기로 결정. 이 프로토콜에 사용되는 사용자 정의 설계 스페이서의 3D 프린팅은 U-PRINT에서 수행되었다: 웁살라 대학의 3D 인쇄 시설은 의학 및 약국의 징계 도메인에서, U-PRINT@mcb.uu.se. 우리는 우리의 프로젝트에 대한 그의 귀중한 입력 폴 오칼라한 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| AlamarBlue (Resazurin sodium salt) | Sigma | 211-500 | Prepare according to manufacturesr recommendations |
| Antibiotic Antimycotic Solution (100×), Stabilized | Sigma | A5955-100ML | |
| Aprotinin Protease Inhibitor | Thermo Fisher Scientific | 78432 | |
| Calcium chloride (CaCl2) | Sigma | C1016-2.5KG | Anhydrous, granular, ≤7.0 mm, ≥93.0% |
| CO2 Incubator | Kebo Biomed Sweden | ||
| Corning Black, clear flat bottom 96-well plate | Sigma | CLS3904-100EA | |
| Corning HTS Transwell-24 well permeable supports | Sigma | CLS3396-2EA | HTS Transwell-24 units w/ 0.4 μm pore polycarbonate membrane and 6.5 mm inserts, TC-treated, sterile, 2/cs |
| Discovery Hybrid Rheometer 2 | TA instruments, Sollentuna, Sweden | ||
| DMEM, high glucose, GlutaMAX supplement (LX2 and HepG2 cells) | Thermo Fisher Scientific | 61965059 | Supplemented with 10% v/v FBS and 1% v/v antibiotic antimycotic solution |
| Endothelial Cell Growth Medium (500 ml) (HUVEC) | Cell Applications, Inc | 211-500 | |
| Fetal Bovine Serum, qualified, One Shot format, New Zealand | Thermo Fisher Scientific | A3160902 | |
| Fibrinogen type I-S from bovine plasma | Sigma | F8630-10G | |
| FLUOstar Omega plate reader | BMG Labtech | ||
| Hanks' balanced salt solution | Sigma | H9394-500ML | Modified, with sodium bicarbonate, without calcium chloride and magnesium sulfate |
| Labogene scanspeed 416 centrifuge | Labogene, Sweden | ||
| Laminar flow hood | Kebo Biomed Sweden | ||
| Mettler Toledo AG245 Analytical Balance | Mettler Toledo | ||
| Nikon TMS Light microscope | Nikon, Japan | ||
| Phosphate buffered saline tablet | Sigma | P4417-100TAB | Prepare according to manufacturers recommendation |
| Rat tail Collagen Type I 5 mg/mL | Ibidi | 50201 | |
| Sodium chloride (NaCl) | Sigma | S7653-1KG | |
| Sodium Hydroxide (NaOH) | Merck | B619298 | |
| TC20 Automated cell counter | BioRad | ||
| TC20 cell counter counting slides | BioRad | ||
| Thrombin from bovine plasma | Sigma | T9549 | Powder, suitable for cell culture, ≥1,500 NIH units/mg protein (E1%/280 = 19.5) |
| Trypsin (2.5%) 10x | Thermo Fisher Scientific | Dilute to 1x in PBS | |
| Trypsin inhibitor from Glycine max (soybean) | Sigma | T6414-100ML | Solution, sterile-filtered |
참고문헌
- Galle, P. R., et al. EASL Clinical practice guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 69, 182-236 (2018).
- Marquardt, J. U., Andersen, J. B., Thorgeirsson, S. S. Functional and genetic deconstruction of the cellular origin in liver cancer. Nature Reviews Cancer. 15, 653-667 (2015).
- Balogh, J., et al. Hepatocellular Carcinoma: A review. Journal of Hepatocellular Carcinoma. 3, 41-53 (2016).
- Perumpail, R. B., Womg, R. J., Ahmed, A., Harrison, S. A. Hepatocellular carcinoma in the setting of non-cirrhotic non-alcoholic fatty liver disease and the metabolic syndrome: US experience. Digestive Diseases and Science. 60, 3142-3148 (2016).
- Baglieri, J., Brenner, D. A., Kisseleva, T. The role of fibrosis and liver associated fibroblasts in the pathogenesis of hepatocellular carcinoma. International Journal of Molecular Sciences. 20, 1723 (2019).
- Arriazu, E., et al. Extracellular matrix and liver disease. Antioxidants & Redox Signaling. 21 (7), 1078-1097 (2014).
- Malarkey, D. E., Johnson, K., Ryan, L., Boorman, G., Maronpot, R. R. New insight into functional aspects of liver morphology. Toxicologic Pathology. 33, 27-34 (2005).
- Moreira, R. K. Hepatic stellate cells and liver fibrosis. Archive of Pathology and Lab Medicine. 131, 1728-1734 (2007).
- Hernandez-Gea, V., Toffanin, S., Friedman, S. L., Llovet, J. M. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenteroloy. 144, 512-527 (2013).
- Amicone, L., Marchetti, A. Microenvironment and tumor cells: two targets for new molecular therapies of hepatocellular carcinoma. Translational Gastroenterology and Hepatology. 3, 24 (2018).
- Rawal, P., et al. Endothelial cell-derived TGF-B promotes epithelial-mesenchymal transition via CD133 in Hbx-Infected Hepatoma cells. Frontiers in Oncology. 9 (308), 1-9 (2019).
- Yoo, J. E., et al. Progressive enrichment of stemness features and tumour stromal alterations in multistep hepatocarcinogenesis. PLoS One. 12 (3), 0170465 (2017).
- Landry, B. D., et al. Tumor-stroma interactions differentially alter drug sensitivity based on the origin of stromal cells. Molecular Systems Biology. 14, 8332 (2018).
- Le, B. D., et al. Three-dimensional hepatocellular carcinoma/fibroblast model on a nanofibrous membrane mimics tumor cell phenotypic changes and anticancer drug resistance. Nanomaterials. 8 (64), 1-11 (2018).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review). Oncology Letters. 14, 6999-7010 (2017).
- Hoarau-Véchot, J., Rafii, A., Touboul, C., Pasquier, J. Halfway between 2D and animal models: Are 3D cultures the ideal tool to study cancer-microenvironment interactions. International Journal of Molecular Sciences. 19 (181), 1-24 (2018).
- Khawar, I. A., et al. Three Dimensional Mixed-Cell Spheroids Mimic Stroma-Mediated Chemoresistance and Invasive Migration in hepatocellular carcinoma. Neoplasia. 20, 800-812 (2018).
- Elliott, N. T., Yuan, F. A review of three-dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2010).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: focus on tumor spheroid model. Pharmacology Therapy. 163, 94-108 (2016).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Jung, H. R., et al. Cell spheroids with enhanced aggressiveness to mimic human liver cancer in vitro and in vivo. Scientific Reports. 7, 10499 (2017).
- Eilenberger, C., Rothbauer, M., Ehmoser, E. -. K., Ertl, P., Küpcü, S. Effect of spheroidal age on sorafenib diffusivity and toxicity in a 3D hepg2 spheroid model. Scientific Reports. 9, 4863 (2019).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2 (2), 123-135 (2013).
- Wrzesinski, K., et al. Human liver spheroids exhibit stable physiological functionality for at least 24 days after recovering from trypsinisation. Toxicology Research. 2 (3), 163-172 (2013).
- Mazza, G., et al. Decellularized human liver as a natural 3D-scaffold of liver bioengineering and transplantation. Scientific Reports. 5, 13079 (2015).
- Ma, X., et al. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials. 185, 310-321 (2018).
- Mueller, S., Sandrin, L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepatic Medicine: Evidence and Research. 2, 49-67 (2010).
- Wang, M. H., et al. In vivo quantification of liver stiffness in a rat model of hepatic fibrosis with acoustic radiation force. Ultrasound in Medicine & Biology. 35 (10), 1709-1721 (2009).
- Georges, P. C., et al. Increased liver stiffness of the rat liver precedes matrix deposition: implications for fibrosis. American Journal of Physiology - Gastrointestinal and Liver Physiology. 293, 1147-1154 (2007).
- Massironi, S., et al. et al. Liver stiffness and hepatocellular carcinoma: is it really useful. Journal of Hepatology. 58, 293 (2013).
- Singh, S., et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: A systematic review. Clinical Gastroenterology and Hepatology. 11, 1573-1584 (2013).
- Yang, T. S., Wang, C. H., Hsieh, R. K., Chen, J. S., Fung, M. C. Gemcitabine and doxorubicin for the treatment of patients with advanced hepatocellular carcinoma: a phase I-II trail. Annals of Oncology. 13, 1771-1778 (2002).
- Le Grazie, M., Biagini, M. R., Tarocchi, M., Polvani, S., Galli, A. Chemotherapy for hepatocellular carcinoma: the present and the future. World Journal of Hepatology. 9 (21), 907-920 (2017).
- Saneyasu, T., Akhtar, R., Sakai, T. Molecular cues guiding matrix stiffness in liver fibrosis. BioMed Research International. 2016, 1-11 (2016).
- Zuliani-Alvarez, L., Midwood, K. S. Fibrinogen-related proteins in tissue repair: how a unique domain with common structure controls diverse aspects of wound healing. Advances in Wound Care. 4 (5), 273-285 (2015).
- Smit, T., et al. Characterization of an alginated encapsulated LS180 spheroid model for anti-colorectal cancer compound screening. ACS Medicinal Chemistry Letters. 11 (5), 1014-1021 (2020).
- Schrader, J., et al. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 53 (4), 1192-1205 (2011).
- Lachowski, D., et al. Matrix stiffness modulates the activity of MMP-9 and TIMP-1 in hepatic stellate cells to perpetuate fibrosis. Scientific Reports. 9, 7299 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유