Method Article
Yüksek Çözünürlüklü Kriyo-Elektron Tomografisi için 3D Korbağıntılı Odaklanmış İyon Işını Frezeleme ile Numune Hazırlama
Bu Makalede
Özet
Burada, kriyo-elektron tomografisi için hücresel numunelerin hazırlanmasına rehberlik etmek için 3D bağıntılı odaklanmış iyon ışını frezeleme için bir boru hattı sunuyoruz. İlgilenilen floresan etiketli proteinlerin 3 boyutlu konumu önce kriyo-floresan mikroskobu ile belirlenir ve daha sonra öğütme için hedeflenir. Protokol memeli, maya ve bakteri hücreleri için uygundur.
Özet
Kriyo-elektron tomografisi (kriyo-ET), hücresel ultrastrüktür ve moleküler kompleksleri doğal, dondurulmuş-hidratlı hallerinde araştırmak için tercih edilen yöntem haline gelmiştir. Bununla birlikte, cryo-ET, numunelerin gelen elektron ışınını dağıtmayacak veya engellemeyecek kadar ince olmasını gerektirir. Kalın hücresel numuneler için bu, kriyo odaklı iyon ışını (FIB) öğütme ile elde edilebilir. Bu protokol, üç boyutlu floresan mikroskobu verilerini FIB taramalı elektron mikroskobundan gelen bilgilerle birleştiren 3D bağıntılı bir yaklaşım kullanarak FIB frezeleme sırasında belirli hücresel bölgelerin nasıl hedefleneceğini açıklar. Bu teknik kullanılarak, nadir hücresel olaylar ve yapılar yüksek doğrulukla hedeflenebilir ve kriyo-transmisyon elektron mikroskobu (kriyo-TEM) kullanılarak moleküler çözünürlükte görselleştirilebilir.
Giriş
Odaklanmış iyon ışını frezeleme, bıçak izleri ve sıkıştırma artefaktları gibi mekanik kesitlerle yaygın olarak ilişkilendirilen problemler olmadan kriyo ile sabitlenmiş numunelerden ince biyolojik numunelerin hazırlanmasına olanak tanır1. Kriyo-elektron tomografisi ile eşleştirildiğinde, FIB frezeleme, hücresel morfolojinin yüksek çözünürlüklü biyolojik çalışmalarını ve makromoleküler komplekslerin yapısının doğrudan hücrelerin içinden nanometre altı çözünürlükte 2,3,4 belirlenmesini sağlar. Ribozomlar gibi bol miktarda bulunan türler rastgele kesilmiş FIB lamellerinde kolayca bulunurken, birçok hücresel süreç birkaç kompleksin kolokalizasyonuna dayanır veya hücre içindeki belirli bölgelere lokalize edilir. Sonuç olarak, öğütme işlemi sırasında ilgilenilen biyolojik özelliği kaybetmemek ve rastgele vuruşlarla sınırlı kalmak için verimli hedefleme gereklidir. Bu nedenle, taramalı elektron mikroskobu (SEM)-FIB ve bir kriyo-floresan ışık mikroskobundan (FLM) gelen verileri birleştiren bağıntılı bir yaklaşım gereklidir. İlk korelasyonu atlamak ve FLM ve cryo-ET verilerini ancak TEM 5,6 ediniminden sonra birleştirmek mümkün olsa da, floresan kılavuzlu odaklanmış iyon ışını frezeleme, frezeleme alanının önceden doğru bir şekilde seçilmesini sağlayarak daha verimli veri toplama sağlar. Anlayışından bu yana, biyolojik çalışmalarda 3D ile ilişkili FIB öğütme uygulaması, yakın zamanda bu tekniği kullanarak mayada yeni bir sıvı-sıvı fazla ayrılmış (LLPS) bölme tanımladığımızı bildirene kadar sınırlıydı8.
Burada açıklanan, bakterilerden mayalara ve memeli hücrelerine kadar çok çeşitli örnekleri incelemek için kullanılabilen genelleştirilmiş bir 3D kriyo ile ilişkili ışık ve elektron mikroskobu (CLEM) protokolüdür. Deneyler belirli bir dizi cihaz kullanılarak gerçekleştirilirken, bireysel adımlar belirli bir donanıma bağlı değildir ve mevcut protokollerinbir uzantısı olarak diğer sistemlere kolayca aktarılabilir 3,5. Test edilen ekipmanın ve önerilen ayarların bir listesi Malzeme Tablosu ve Tablo 1'de verilmiştir. Boru hattının dört temel adımı, (1) numune hazırlama, (2) kriyo-floresan mikroskobu ile ilgilenilen özelliklerin lokalizasyonu, (3) 3D ile ilişkili odaklanmış iyon ışını öğütme ve (4) kriyo-transmisyon elektron mikroskobunda lameller üzerinde kriyo-ET veri toplama için hedeflenen yapıların lokalizasyonudur (Şekil 1).
Protokol
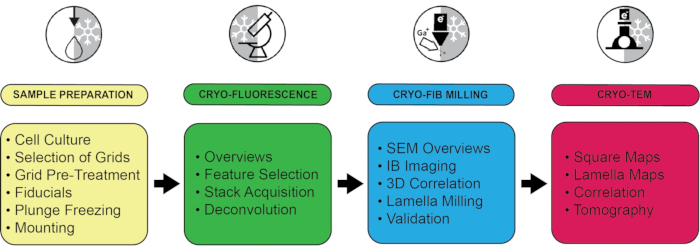
Şekil 1: Kritik adımların seçimiyle iş akışının özeti. Tüm protokol, kullanılan ekipmana göre dört aşamaya ayrılmıştır: Daldırmalı dondurma, kriyo-floresan mikroskobu, kriyo-odaklı iyon ışını öğütme ve kriyo-elektron mikroskobu dahil olmak üzere numune hazırlama. Her adım için birkaç önemli nokta vurgulanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Hücre kültürü ve ızgaraların daldırılarak dondurulması
- Kriyo deneylerine geçmeden önce tercih edilen hücreleri kültürleyin ve oda sıcaklığında etiketleme ve işleme stratejilerini optimize edin. İlgilenilen hedefler ya floresan protein füzyonları ya da canlı boyama (örneğin, Halo-Tag, LysoTracker, BODIPY, canlı antikor boyama, vb.) kullanılarak etiketlenir. İlgilenilen biyolojik süreci araştırmak için kimyasal veya biyolojik ajanlarla (küçük moleküller, özel ortamlar, siRNA, vb.) işlem gerekiyorsa, canlı hücre FLM görüntülemeyi kullanarak koşulları (örn. zaman, konsantrasyon) optimize edin.
- İlgilenilen bölgelerin, daha sonraki kriyo koşullarıyla mümkün olduğunca yakından eşleşen görüntüleme ayarları kullanılarak yeterli sayıda hücrede arka planın üzerinde başarılı bir şekilde lokalize edilebildiğinden emin olun (yani, NA, maruz kalma süresi, vb.).
- Izgaraların seçimi ve hazırlanması
- Kullanılan hücreler ve referans işaretleri için uygun delik boyutuna ve aralığına sahip ızgaraları seçin (bkz. adım 1.3.1). Deliksiz sürekli film kullanmayın, çünkü bu, lekelemeden sonra çok fazla kalıntı tampona neden olabilir ve böylece vitrifikasyon verimliliğini azaltabilir ve referans boncuklarının algılanmasını engelleyebilir. Hücrelerin ızgaralarla uzun süreli teması için, ızgara desteğinin ve film malzemesinin biyouyumlu olduğundan emin olun.
- Cryo-EM ızgaralarını daha hidrofilik hale getirmek için plazma ile temizleyin. Yapışık hücre kültüründe kullanım için, plazma temizliğinden sonra UV radyasyonu ile ızgaraları laminer akış başlığında 20 dakika sterilize edin. İsteğe bağlı olarak, ızgaralar, aşağıda açıklandığı gibi poli-L-lizin veya konkanavalin A gibi hücre yapışmasına yardımcı olan bileşiklerle ön işleme tabi tutulabilir.
NOT: Genel olarak, bağıntılı kriyo-FIB iş akışında aşağıdaki ızgara/numune kombinasyonları başarıyla kullanılmıştır: Maya: Cu veya Au, 200 ağ, R1/4 karbon veyaSiO2 film, isteğe bağlı olarak concanavalin A ile kaplanmış; Escherichia coli: Cu veya Au, 200 ağ, R1/4 karbon veyaSiO2 filmi; Chlamydomonas reinhardtii: Cu veya Au, 200 ağ, R1/2 veya R1/4 karbon veyaSiO2 filmi; HeLa: Au, 200 ağ, R1 / 4 SiO2 filmi, poli-L-lizin ile kaplanmış; HEK293: Au, 200 gözlü, R1/4SiO2 film, poli-L-lizin ile kaplanmış. - Maya hücrelerinin bağlanmasını iyileştirmek için Concanavalin A kaplaması:
- 100 μM CaCl2, pH 8.5 ile 10 mM HEPES tamponunda 1 mg / mL concanavalin A kaplama çözeltisi hazırlayın. Bir damla (50 μL) kaplama solüsyonu ve iki damla damıtılmış suyu bir parça parafin film üzerine ayrı ayrı yerleştirin.
- Plazma ile temizlenmiş ızgarayı ters kuvvet cımbızıyla alın ve filmin zarar görmesini önlemek için ızgaraya dik hareketlerden kaçınarak kaplama solüsyonunun damlasına dikkatlice yerleştirin.
- ~5 s inkübasyondan sonra, ızgarayı benzer şekilde su damlalarına sokarak iki kez yıkayın. Son olarak, ızgaranın arkasına bir filtre kağıdı uygulayarak fazla sıvıyı kurulayın ve ızgarayı cımbızdan çıkarmadan önce tamamen kurumasını bekleyin. Daldırma-dondurma için kurutulmuş ızgaraları kullanın.
- Süspansiyon kültürü ve yapışkan hücreler için poli-L-lizin kaplama:
- 0.1 M sodyum borat tamponu, pH 8.5 içinde 1 mg / mL poli-L-lizin kaplama çözeltisi hazırlayın.
- Plazma ile temizlenmiş ızgaraları hücre kültürü için uygun bir kaba yerleştirin ve UV radyasyonu ile 20 dakika sterilize edin.
- Yavaşça tüm ızgaraları kaplayacak kadar kaplama solüsyonu ekleyin ve 37 °C'de en az 2 saat inkübe edin. Sıvıyı aspire edin ve hücreleri istenen konsantrasyona getirmeden önce ızgaraları PBS ile iki kez nazikçe yıkayın.
- Hücrelerin ve referans boncukların hazırlanması
NOT: 3D bağıntılı FIB frezelemesine izin vermek için FIB/SEM mikroskobunda alınan görüntülerle floresan verilerinin 3D kaydı için referans boncukları gereklidir.- FLM, SEM ve IB (önerilen çap 0,5-1 μm) gibi tüm görüntüleme yöntemlerinde tanınabilir boncukları seçin, ancak boncukları ve ilgilenilen biyolojik özelliği ayırt etmeyi kolaylaştırmak için bunların floresan görüntüleme sırasında hücresel hedef yapıyı gölgede bırakmadığından emin olun. Referans boncuklarındaki sitotoksik koruyucuları (örn., NaN3) üretici tarafından talimat verildiği şekilde çıkarın.
NOT: İlgilenilen biyolojik özellikler ile referanslar arasında daha kolay bir ayrım yapmak için, sinyallerin FLM kanallarındaki yoğunluk farklılıklarına göre ayırt edilebilmesi için floresan emisyon spektrumlarının yalnızca kısmen örtüşmesi yararlıdır. - Süspansiyon kültürü kullanılıyorsa, hücreleri uygun bir yoğunluğa kadar büyütün (örneğin, maya OD 600 = 0.8, E. coli OD 600 = 0.8-1.0, C. reinhardtii 1500 hücre / μL) ve ortam değişimi, kimyasalların eklenmesi, açlık vb. gibi deney için gerekli tedavileri gerçekleştirin. Plazma ile temizlenmiş ızgaraları, daldırma yöntemi (manuel/otomatik) için gerektiği gibi cımbızlara takın ve ızgaraların film tarafına ~1 x 105 boncuk/μL referans boncuk süspansiyonu ile karıştırılmış 4 μL hücre süspansiyonu uygulayın.
NOT: Titrasyon deneylerinde hücrelerin ve referansların optimum seyreltmesini belirleyin (örneğin, kriyo-FLM veya FIB/SEM'i kontrol ederek, aşağıya bakın). Bununla birlikte, süspansiyon halinde büyütülen çoğu hücre için, 1 μm referans boncuklarının ~ 1 x 105 boncuk / μL'lik nihai konsantrasyonu (stoktan 1:20 seyreltme; ayrıntılar için Malzeme Tablosuna bakın) iyi bir başlangıç noktası olduğunu kanıtlamıştır. - Yapışık kültür kullanılıyorsa, aseptik kültür için UV radyasyonu kullanarak ızgaraları plazma ile temizleyin ve sterilize edin. Gerekirse, ızgaraları hücre yapışmasına yardımcı olan bileşiklerle önceden kaplayın (örneğin, poli-l-lizin, fibronektin, laminin; bkz. adım 1.2.2). Normal kültür kaplarında veya ızgaralar için alt bölümlere sahip tabaklarda ızgaralar üzerinde tohum ve büyüyen hücreler.
- Numuneleri deney için gerektiği gibi işlemden geçirin ve hücreleri donma noktasına kadar en uygun koşullarda tutun (örneğin, HEK/HeLa için 37 °C/%5CO2 ). Izgaraları kültür kabından dikkatlice çıkarın ve dalma cımbızına takın. Hücre taşıyan tarafa 4 μL referans maddesi (1 μm referans için 1 x10 5 boncuk/μL) uygulayın.
- FLM, SEM ve IB (önerilen çap 0,5-1 μm) gibi tüm görüntüleme yöntemlerinde tanınabilir boncukları seçin, ancak boncukları ve ilgilenilen biyolojik özelliği ayırt etmeyi kolaylaştırmak için bunların floresan görüntüleme sırasında hücresel hedef yapıyı gölgede bırakmadığından emin olun. Referans boncuklarındaki sitotoksik koruyucuları (örn., NaN3) üretici tarafından talimat verildiği şekilde çıkarın.
- Manuel veya otomatik dondurma prosedürü kullanarak hücreleri daldırarak dondurun. Mümkünse, hücrelere mekanik olarak zarar vermemek için ızgarayı yalnızca hücrelerin karşısındaki taraftan kurulayın (Şekil 2A). İki kollu otomatik daldırma sistemlerinde, hücrelere bakan pedin üzerine kağıt kurutmak yerine bir Politetrafloroetilen (örneğin Teflon) tabakası yerleştirerek bunu başarın. Izgaraları saklama kutularına aktarın ve kullanana kadar sıvı nitrojen (lN2) içinde tutun.
DİKKAT:lN2 ve diğer kriyojenler gözlerde ve ciltte ciddi hasara neden olabilir. Kişisel koruyucu ekipman (KKD) kullanın ve tehlikeliN2 konsantrasyonlarının birikmesini önlemek için yalnızca iyi havalandırılan bir alanda çalışın.
NOT: Hücre ve lamel yüzeylerinin kirlenmesini önlemek için sonraki tüm adımlar en iyi şekildelN2'nin sıvı fazında gerçekleştirilmelidir, çünkü bu, aşağı akış işlemeyi zorlaştırabilir. Her zaman temiz sıvı nitrojen (örneğin, yüzen buzu çıkarmak için filtre) kullanarak, gereksiz transfer adımlarını ortadan kaldırarak ve mümkünse nem kontrollü bir ortamda çalışarak yüzen buz kristalleriyle teması azaltın. - Sonraki kriyo-floresan görüntüleme ve FIB frezeleme için daldırma-donmuş ızgaraları kesme ve hücreler yukarı bakacak şekilde AutoGrids'e monte edin ve kırpın (Şekil 2A). TEM'deki numunelerin uygun şekilde hizalanmasını sağlamak için, öğütme yönünün cryo-ET eğim eksenine dik olması gerekir. Buna göre, bu hizalamaya yardımcı olması için kırpmadan önce yönlendirme işaretlerini (örn. LAZER kazıma veya çıkarılabilir işaret noktaları) AutoGrid'lere yerleştirin (Şekil 2A).
- Cryo-FLM ve FIB/SEM'de ızgara kalitesini (Şekil 2B) tarayın. Hücrelerin ve boncukların eşit dağılımını elde etmek için hücre yoğunluğunu, lekeleme süresini ve kuvvetini optimize edin. Bir kriyo-floresan mikroskobunda yansıyan ışık görüntülemeyi kullanın veya hem hücrelerin hem de referans boncuklarının açıkça görülebildiğinden emin olmak için kriyo-FIB-SEM'i kullanın (Şekil 2B, beyaz oklar).
- Gerekirse, daha iyi koşullarla, örneğin değişen hücre konsantrasyonu ve / veya lekelenme süresiyle daldırmayı tekrarlayın. Uygun daldırma parametreleri bulunduğunda, her yeni deney turu için ızgara taramasını tekrarlamayın.

Şekil 2: SEM ve IB kullanılarak uygun ızgaraların taranması . (A) TEM'e doğru yüklemeyi kolaylaştırmak için AutoGrid'lere frezeleme yönüne dik olarak yönlendirme işaretleri yerleştirilmelidir. Hücreler, monte edilmiş AutoGrid'e yukarı bakacak şekilde monte edilir. (B) Daldırmalı dondurmadan sonra, dalma koşullarını değerlendirmek ve optimize etmek için ızgaralar SEM'de incelenir: a) Izgara başına çok fazla hücre olmamalıdır. Örneğin HeLa hücreleri için 1-4 hücre/kareden fazla kullanmayın. Saccharomyces cerevisiae (burada gösterilmiştir) gibi daha küçük hücreler için 4-6 hücrelik kümeler yararlı bulunmuştur. b) Referans boncukları (beyaz oklar) açıkça görülmeli ve hücreleri çevreleyen çok fazla tampon olmamalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Kriyo-floresan ışık mikroskobu
- Her ızgara için, (geniş alan) floresan ve diferansiyel girişim kontrastı (DIC) veya yansıyan modda bir genel bakış elde edin ve floresan sinyalli uygun ızgara karelerini seçin. Hem ilgilenilen hücreleri hem de yeterli sayıda referans işaretleyiciyi içeren görünüm alanlarını seçin (6-12).
- Hücrelerin ve boncukların eşit olarak dağıldığından, çok yoğun olmadığından ve her karenin ortasına doğru olduğundan emin olun. Yalnızca hem FIB-SEM hem de TEM cihazı tarafından erişilebilen kareleri seçin, dolayısıyla 200 gözenekli ızgarada ızgara kenarından en az üç kare uzakta olanları seçin (Şekil 3A, kırmızı dairenin içinde).
- Seçilen ızgara karelerinin her birinde, daha sonraki evrişim için uygun bir odak adımına sahip bir floresan yığını elde edin, yani eksenel çözünürlük sınırının <1/2'si. Mümkünse, foton sayısını ve lokalizasyon doğruluğunu artırmak için yüksek sayısal açıklık (NA) hedefleri kullanın.
- NA 0.9 objektifli bir konfokal mikroskopta, Nyquist değerini yüksek örnekleyerek 300 nm adım boyutuna sahip yığınlar elde edin. Gerekirse birden fazla renk yığını kaydedin (Şekil 2B). Izgaraları daha fazla kullanıma kadar lN2 altında saklayın.
NOT: En uygun adım boyutunu belirlemek için, mikroskop kontrol yazılımı tarafından hesaplanan değerleri seçin veya çevrimiçi araçlarıkullanın 9. Kanallar arasındaki sinyal sızıntısını kontrol edin, çünkü aşırı sızıntı kolokalizasyon deneyleri için zararlıdır. Bununla birlikte, bazıları çok renkli yığınlardaki renk sapmalarını düzeltmek için avantajlı olabilir.
- NA 0.9 objektifli bir konfokal mikroskopta, Nyquist değerini yüksek örnekleyerek 300 nm adım boyutuna sahip yığınlar elde edin. Gerekirse birden fazla renk yığını kaydedin (Şekil 2B). Izgaraları daha fazla kullanıma kadar lN2 altında saklayın.
- Uygun yazılım10,11 kullanarak yığınları çözün ve izotropik piksel boyutu gerekiyorsa7'yi yeniden dilimleyin. Dekonvolüsyon — tıpkı oda sıcaklığında olduğu gibi — FLM sinyalini temizler ve lokalizasyon doğruluğunu artırabilir (Şekil 3C).

Şekil 3: FLM yığını alımı için karelerin seçilmesi ve evrişim yoluyla verilerin iyileştirilmesi . (A) eGFP-Ede1 (yeşil) ve mCherry-Atg8 (macenta) eksprese eden maya hücreleriyle daldırılmış bir ızgaraya genel bakış. İyi bir boncuk ve hücre dağılımına sahip konumları seçin, ancak ızgaranın kenarlarından kaçının (gölgeli kırmızı). Kutular, floresan yığınlarının alındığı iyi hücre dağılımlarına sahip konumları gösterir. (B) Evrişimden sonra sarı kutulu kare (A'dan) üzerinde alınan çok renkli yığının maksimum yoğunluk projeksiyonu (MIP). FLM yığınlarının evrişiminin bozulması, istenmeyen arka plan sinyallerini önemli ölçüde temizler ve dekonvolüsyondan (C) önce ve sonra (D) gauss uyumlarından da anlaşılacağı gibi, z'deki boncukların daha doğru bir şekilde lokalize edilmesine yardımcı olur (uyumlar 3DCT'de gerçekleştirilmiştir ve 1 ile işaretlenmiş boncuk için gösterilmiştir). Görüntüler, kırmızı kanalın yakınlaştırılmış MIP görünümlerini gösterir (uyarma: 552 nm, emisyon: 585-650 nm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Odaklanmış iyon ışını frezeleme
- Izgaraları kriyo-FIB-SEM cihazına yükleyin ve daha sonra TEM'e yerleştirmek üzere doğru yönlendirmeyi sağlamak için kesme ve/veya yönlendirme işaretlerini kullanın (Şekil 2A). Frezeleme yönünün TEM'in eğim eksenine dik olduğundan emin olun.
- Bir gaz enjeksiyon sistemi (GIS; CpMePtMe3) ızgaraları koruyucu bir organometalik tabaka ile kaplamak için FIB-SEM kurulumu tarafından önceden tanımlanmış aşama konumlarında. Çok fazla uygulamayın, çünkü bu daha sonra TEM'de referans boncuk lokalizasyonunu engelleyebilir. Numune şarjını azaltmak için metalik platin uygulamak için bir plazma kaplayıcı kullanın.
NOT: GIS kaplama için herhangi bir ayar mevcut değilse, art arda kısa kaplama turları (~2 s) ve ardından FIB frezeleme gerçekleştirilerek kolayca bulunabilirler. Numunenin, lamel kenarlarının etrafındaki koruyucu organometalik tabakada belirgin bir saçak olmadan orta akımlarda (~100 pA) hala başarılı bir şekilde kesilebildiğinden emin olun. GIS iğnesinin hem zamanı hem de mesafesi (numuneye göre) dikkate alınması gereken önemli parametrelerdir. GIS iğnesini oda sıcaklığı ayarlarında (yani 45 °C) çalıştırmayın, ancak yine de eşit bir kaplama (25-27 °C) sağlamak için mümkün olduğunca soğukta çalıştırın. - Bir SEM ızgarasına genel bakış kaydedin ve floresan yığınlarının kaydedildiği ızgara karelerini bulmak için FLM genel bakışlarıyla 2B korelasyon gerçekleştirin. Izgara karelerini bulmak için her iki görünümü de manuel olarak inceleyin veya çeşitli yazılım paketlerini7,10,12 kullanın. Burada odak noktası, görünümler arasında izotropik ölçekleme ile 3B katı gövde dönüşümünü kullanan 3B korelasyon araç kutusu (3DCT)7'dir. 3DCT'lerin işlevlerinde mükemmel bir gözden geçirme çevrimiçi olarak mevcuttur13.
- Hem FLM hem de SEM ızgara genel görünümünde (sağ tıklama) ızgara çubukları veya destek filmindeki delikler gibi yer işaretleri gibi en az dört karşılık gelen konumu seçin ve işaretleyin ve işaretli noktalar arasındaki dönüşümü hesaplayın (korelasyon).
- Ardından, işaretçileri FLM yığınlarının alındığı ilgili ızgara karelerinin ortasına yerleştirin ve SEM görünümündeki konumlarını tahmin edin (korelasyon; Şekil 4A).
- Her ilişkili ızgara karesi için, tercih edilen FIB frezeleme açısında (45° ön eğim mekiği için 10°-25°) düşük akımlı (≤10 pA) bir iyon ışını (IB) görüntüsü alın. Floresan verileriyle eşleşen bir görüş alanı (yani konum ve büyütme) seçin. 200 gözenekli ızgara için, ızgara çubukları da dahil olmak üzere tek ızgara kareleri içerecek şekilde floresan ve FIB/SEM verilerini alın (bkz. Şekil 3A ve Şekil 4A).
NOT: Kriyo-ET sırasında önemli açısal aralığın kaybolmasını önlemek ve yeterli sayıda referans boncuğunun tanımlanmasına izin vermek için frezeleme mümkün olduğunca sığ bir açıyla yapılmalıdır. Örneğin: 17°'lik bir kademe eğimi, 45°'lik bir mekik ön eğimi ve dilüme göre 52°'lik bir FIB ışın eğimi ile, lamel ön eğimi 10°'dir ve bu, birçok TEM kriyo tutucusunun maksimumu olan -50° ila +70° eğilerek TEM'de tercih edilen ±60° açısal aralığı hemen hemen karşılar. - Floresan ve iyon ışını görünümünde karşılık gelen boncukların tanımlanmasına yardımcı olması için aynı karenin SEM görüntüsünü alın.
- Aşağıdaki (Şekil 4B) adımlarda açıklandığı gibi 3DCT ile her konum için dekonvolvasyonlu 3D FLM yığınının ve 2D iyon ışını görünümünün kaydını gerçekleştirin.
- Karşılık gelen yeniden dilimlenmiş 3D FLM yığınını ve iyon ışını (IB) görünümünü 3DCT'ye yükleyin.
NOT: Çok renkli floresan verileri, en fazla üç ayrı tek kanallı yığın dosyası olarak yüklenebilir. - Floresan verilerinde 4 referans boncuğu seçin ve sinyalin x, y ve z'de Gauss uydurması yoluyla 3D konumlarını belirlemek için konumlar listesine sağ tıklayın. IB görüntüsünde karşılık gelen boncukları seçin ve bir ilk 3D korelasyonu gerçekleştirin (korelasyon).
- Kayda hızlı bir şekilde daha fazla boncuk eklemek ve bağıntının doğruluğunu kontrol etmek için floresan görüntüsüne yinelemeli olarak daha fazla boncuk ekleyin, 3B konumlarını iyileştirin ve IB görünümündeki konumlarını tahmin edin. 3DCT'de, korelasyon tutarlılığını değerlendirmek için kök-ortalama-kare hatası (RMSE) değerlerisağlanır 7.
- RMSE değerlerinin küçük olduğundan ve yerelleştirme doğruluğu (~300 nm) mertebesinde olduğundan emin olun. Korelasyonun doğruluğunu belirlemek için, kayıt adımı sırasında kasıtlı olarak hem floresan hem de iyon ışınında açıkça tanımlanabilen bazı referans boncukları dışarıda bırakın. Bunu, iyon ışını görüntüsünde tahmin edilen ve gerçek konumlarını kontrol ederek yapın. Tahmin edilen pozisyon gerçek pozisyondan önemli ölçüde farklıysa, ilk korelasyonu yeni bir referans seti ile tekrarlayın.
NOT: 6-8 boncuğun ilişkilendirilmesinin, FLM yığınlarının ve IB görünümlerinin doğru kaydı için yeterli olduğu kanıtlanmıştır. Bununla birlikte, geniş bir z değeri aralığında (örneğin, ızgara çubuğundaki veya komşu karelerdeki boncukları seçerek) daha fazla referans (12-15'e kadar) eklemek, korelasyonun doğruluğunu artırabilir.
- RMSE değerlerinin küçük olduğundan ve yerelleştirme doğruluğu (~300 nm) mertebesinde olduğundan emin olun. Korelasyonun doğruluğunu belirlemek için, kayıt adımı sırasında kasıtlı olarak hem floresan hem de iyon ışınında açıkça tanımlanabilen bazı referans boncukları dışarıda bırakın. Bunu, iyon ışını görüntüsünde tahmin edilen ve gerçek konumlarını kontrol ederek yapın. Tahmin edilen pozisyon gerçek pozisyondan önemli ölçüde farklıysa, ilk korelasyonu yeni bir referans seti ile tekrarlayın.
- Hedeflenen hücresel sinyalleri seçin, 3B konumlarını FLM yığınına sığdırın ve IB görünümünde hedef konumları tahmin etmek için dönüştürmeyi uygulayın (Şekil 4B).
NOT: IB listesinde bir karşılığı olmayan FLM konumları listesindeki herhangi bir giriş, tahmin edilmesi gereken bir sinyal olarak değerlendirilecektir.
- Karşılık gelen yeniden dilimlenmiş 3D FLM yığınını ve iyon ışını (IB) görünümünü 3DCT'ye yükleyin.
- Her ilişkili kare için, ilgilenilen özelliklerin tahmin edilen konumlarını FIB-SEM cihazına aktarın ve lamel frezeleme modellerini yerleştirin (Şekil 4C). Konumları manuel olarak aktarın (örneğin, hücreler veya referans boncukları gibi görünür yer işaretlerine olan mesafeyi ölçerek) veya örneğin SerialFIB14'te uygulandığı gibi otomasyon ve komut dosyası oluşturmayı kullanın. Hücre başına birden fazla sinyal varsa, verimi artırmak için desenleri aynı lamelin içine mümkün olduğunca çok ilgi çekici nokta (POI) içerecek şekilde yerleştirin.
- Önce kaba ve sonra ince freze lamelleri 150-250 nm'lik bir nihai kalınlığa kadar öğütün. Lamelin sarkmasına neden olan ve böylece daha önce edinilen FLM yığınlarına göre ilgilenilen gerçek özelliğin hareketine neden olan adımlardan (örneğin, gerilim giderici kesikler15) kaçının. Manuel3 veya otomatik14,16,17,18 FIB öğütme prosedürlerini kullanın. Her iki yöntemde de, ilgilenilen özelliğin lamelin merkezinde kalmasını sağlayın ve simetrik olarak üstten ve alttan inceltin.
- Her lamel için frezelemenin doğruluğunu değerlendirmek için, adım 3.4'teki ile aynı kaydı yapın. Bununla birlikte, bu sefer, FIB frezelemeden sonra son IB görüntüsünü kullanın ve ilgilenilen özelliklerin tahmin edilen konumlarının son lamel içinde yer alıp almadığını kontrol edin. Alternatif olarak, 3DCT'nin çıktısından ve özel komut dosyalarından19 elde edilen FLM yığınlarının döndürülmüş projeksiyonlarını son IB görüntüsüyle kaplayın (Şekil 4C, küçük ek).

Şekil 4: 3D bağıntılı FIB frezeleme prosedürü . (A) Şebekenin FLM (solda) ve SEM (sağda) genel bakışlarının 2D-2D korelasyonu, daha önce floresan yığınlarının alındığı ızgara karelerini bulmak için kullanılır. (B) Seçilen her kare için, 3DCT'de (renkli kutular) karşılık gelen referans konumlarının 3D-2D kaydından sonra, FLM verilerinde ilgilenilen biyolojik özelliklerin konumları seçilir. İyon ışını görüntüsündeki (kırmızı daireler) karşılık gelen konumların tahminine dayanarak, lamel hazırlığı için yerler seçilir. (C) Taramalı elektron mikroskobu (SEM) ve iyon ışını (IB) görüntüleri, frezeleme sırasında hedefi merkezde tutmak için kullanılır. 150-250 nm'lik nihai kalınlıklar, sonraki işlemler için yeterli bulunmuştur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Bağıntılı TEM
- Izgaraları TEM'e yükleyin, lamel yönünün (kesme veya yönlendirme işaretlerinden anlaşıldığı gibi) eğim eksenine dik olduğundan emin olun.
NOT: Farklı üreticilerin mikroskopları, örneğin Tomo5, TOM veya SerialEM20 gibi çeşitli yazılımlar kullanılarak kontrol edilebilir. Burada odak noktası ikincisidir. - Lamel içeren her ızgara karesi için ızgara montajı ve genel bakışlar edinin. Büyütme ve pozlama süresinin, toplam elektron dozuna önemli ölçüde katkıda bulunmadan TEM görüntülerindeki referans boncuklarını görselleştirmek için uygun olduğundan emin olun. Her lamelin yüksek çözünürlüklü TEM haritalarını (montajlarını) edinin.
- Kayıt ve 3B-2B, FLM yığınını TEM ızgara karesi ve 3DCT'deki lamel genel bakışlarıyla ilişkilendirir. Floresan (x, y, z - gauss uyumu) ve transmisyon elektron mikroskobu görüntülerinde karşılık gelen boncuk konumlarını seçerek adım 3.6'da açıklananla aynı prosedürü kullanın. Ardından, FLM kanallarında ilgilendiğiniz pozisyonları seçin ve bunları TEM genel bakışlarına aktarın. Gerekirse, FLM ile düşük büyütmeli TEM arasında ilk korelasyonu ve düşük büyütmeli TEM arasında ikinci korelasyonu içeren iki aşamalı bir prosedür kullanın (Şekil 5).
- Konumları manuel olarak (yer işaretlerine olan mesafeleri ölçerek), SerialEM20'de bulunan kayıt ve harita araçlarını veya CorRelator21 gibi harici yazılımları aktarın.
- Eğim serisini ilişkili konumlarda ayarlayın ve çalıştırın. Uygun bir büyütme, bulanıklaştırma ve toplam doz kullanın (ayrıntılar için Malzeme Tablosuna ve Tablo 1'e bakın). Alımı, lamel tarafından belirlenen ön eğimde başlatın (ayrıca adım 3.4'teki nota bakın) ve bir doz simetrik eğim şeması22 kullanın. El ile veya toplu alım kullanın.

Şekil 5: TEM'deki ilişkili pozisyonların lokalizasyonu. Başarılı bir 3D-bağıntılı FIB frezeleme ve transmisyon elektron mikroskobuna aktarıldıktan sonra, kriyo-ET (kırmızı daireler) için potansiyel bölgeleri lokalize etmek için FLM yığınlarındaki referans boncukları (renkli kutular) ve TEM genel bakışları arasındaki her öğütülmüş kare için 3D-2D kaydı gerçekleştirilir. Daha sonra tomogramları daha hassas bir şekilde ayarlamak için daha yüksek büyütmeli lamel genel bakışları (yakınlaştırma) elde edilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Protokol, EH alanı içeren ve endositoz proteini 1 (Ede1) bağımlı endositik protein birikintisini (END) ve otofajik cisimlerdebozunmasını ve sıkışmasını keşfetmek için kullanılan boru hattının bir incelemesini sağlar 8. END, S. cerevisiae'de sıvı-sıvı fazla ayrılmış bir bölmedir ve başarısız endositik olaylardan sonra klatrin aracılı endositozda (CME) yer alan çeşitli proteinleri tamponlar. Ana bileşenlerinden biri, bir CME bileşeni ve bu yeni LLPS bölmesinin bozulması için seçici bir otofaji reseptörü olarak ikiye katlanan Ede1'dir. Buna göre, Ede1 aşırı ekspresyonu endositozun erken aşamalarına müdahale ettiğinden ve bu nedenle yapısal olarak LLPS'yi indüklediğinden, END'leri görselleştirmek için alkol dehidrojenaz (ADH) promotörü kontrolü altında Ede1'in (EGFP-Ede1) bir EGFP füzyonu kullanıldı.
EGFP-Ede1 aşırı eksprese eden maya hücreleri ve 1 μm referans belirteçleri ile daldırmada donmuş bir ızgarada, GFP kanalında FLM yığını alımı için beş konum seçildi (Şekil 6A; TFS Görüşü; konfokal mod, 300 nm odak adımı boyutu, 10 μm aralığı). Izgara, FIB cihazına (Quanta 3D FEG) aktarıldı ve FLM yığınlarının elde edildiği ızgara kareleri, floresan ve SEM ızgara genel bakışlarının 2D-2D korelasyonu gerçekleştirilerek tanımlandı (adım 3.2'yi karşılaştırın).
Seçilen karelerin her biri için, iyon ışını görüntüleri düşük bir akımda (10 pA, 1200x büyütme) alındı ve karşılık gelen referans konumları 3DCT'de kaydedildi. İlgilenilen biyolojik özelliğe sahip konumların seçilmesinden ve FLM yığını içindeki 3 boyutlu konumlarına yerleştirilmesinden sonra, bulunan dönüşüm varsayılan END konumlarına uygulandı ve lamel hazırlama alanları seçildi (Şekil 6B). Burada gösterilen örneklerde ızgara yüzeyine göre 11° eğimli bir FIB kirişi kullanılmıştır (45° FIB mekik ön eğimi; 18° kademe eğimi). İlgilenilen pozisyonlar aktarıldı ve FIB desenleri, FIB görüntüsündeki belirgin yer işaretlerine (örneğin, delikler, buz kirlilikleri, referans boncukları) göre tahmin edilen konumların mesafesi ölçülerek manuel olarak çizildi (Şekil 6D). Kaydın doğruluğu, FLM ve IB görüntüsünde açıkça tanımlanabilen boncukların kasıtlı olarak dışarıda bırakılması ve ardından iyon ışını görünümünde gerçek ve tahmin edilen konumlarının karşılaştırılmasıyla değerlendirildi (örneğin, Şekil 6B, C'deki elmas). Şekil 6C'de gösterilen karenin korelasyonunun doğru olduğu bulundu (yani, FLM boncuk konumlarının tahmin edilen konumu, karşılık gelen IB konumları ve kayıt için 3DCT tarafından bildirilen alt piksel RMSE değerleri ile mükemmel bir şekilde çakıştı). Böylece, lameller tahmin edilen konumlarda (B Bölgesi) kesildi ve ~200 nm kalınlığa kadar ince frezelendi (son model ofseti).
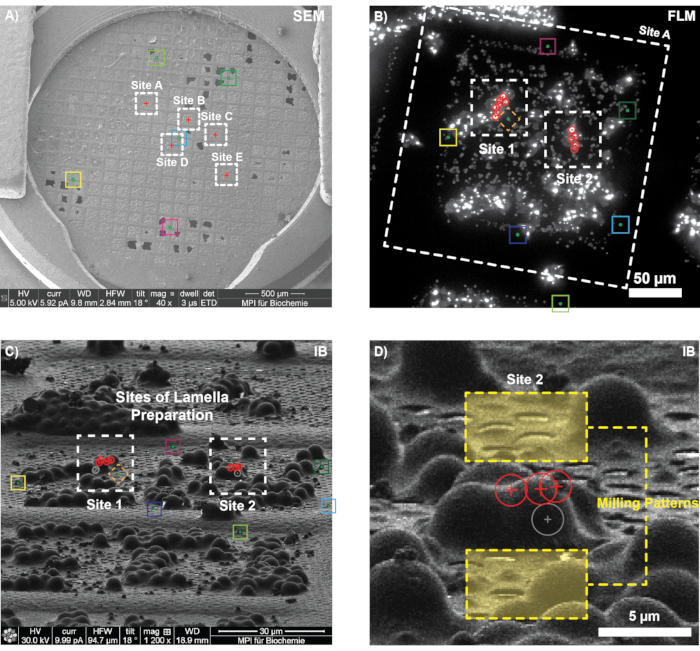
Şekil 6: Mayadaki endositik protein birikintilerinin (END) 3D bağıntılı hedeflemesi için temsili sonuçlar. (A) Frezelemeden önce ızgaraya SEM genel bakışı. Renkli kutular, floresan yığınlarının önceden alındığı ızgara karelerini gösterir. (B-C) Bir ızgara karede 3B korelasyon. FLM verilerine (B, burada maksimum yoğunluk projeksiyonu olarak gösterilmiştir) ve iyon ışını görüntüsüne (C) karşılık gelen birkaç referans boncuğu (renkli kutular) kaydettikten sonra, 3D kaydın doğruluğu, elmasla gösterilen boncuğun konumu tahmin edilerek doğrulandı. Daha sonra, iki potansiyel öğütme sahası için iyon ışını görünümünde hedef sinyalin konumları (kırmızı daireler) tahmin edildi. (D) Üç hedef noktanın (kırmızı daireler) ve ilk frezeleme modellerinin (sarı kutular) tahmin edilen konumlarını gösteren B Sahasının yakınlaştırılması. Dördüncü bir floresan punktumun diğer punktadan çok daha düşük olduğu ve bu nedenle frezeleme sırasında hedeflenmediği tahmin edildi (gri daire). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Başarılı bir FIB frezelemesi ve ızgaranın kriyo-transmisyon elektron mikroskobuna aktarılmasından sonra (Titan Krios 300 kV'da çalıştırıldı ve bir Gatan K2 doğrudan elektron dedektörü ve Bioquantum enerji filtresi ile donatıldı), SerialEM'de bir ızgaraya genel bakış kaydedildi ve lamelli kareleri bulmak için kullanıldı. Her lamel için genel bakış görüntüleri elde edildi ve FLM verileri, karşılık gelen referans boncukları kullanılarak 3DCT'ye (3D-2D) kaydedildi. İlgilenilen biyolojik özelliklerin konumları (Şekil 7A) daha sonra referans boncuklarından hesaplanan dönüşüm kullanılarak tahmin edildi. Daha yüksek büyütme oranlarında kaydedilen lamel görünümleri dikildi ve ilgi çekici yerler açıkça görülebilen yer işaretleri (örneğin, referans boncukları) kullanılarak ilişkilendirildi. Alternatif olarak, klasik CLEM genel bakışları çeşitli yazılımlarda üretilebilir10,12.
Korelasyona dayanarak, Şekil 7A'da gösterilen lamel için tomogram edinimi için dört potansiyel bölge bulundu. Bununla birlikte, bu aynı zamanda 3D ile ilişkili FIB-frezeleme sırasında hedeflenmeyen bir konumu (Şekil 6D; gri daireyi karşılaştırın) ve buz kirliliği tarafından engellenen bir konumu (Şekil 7; gri kutular) içerir. Buna göre, tomogramlar sadece iki pozisyon için kaydedilebilirdi (Şekil 7B). Genel olarak, ~%75'lik bir korelasyon başarısı, yani TEM ve END yapılarına transferden kurtulan lameller tahmin edilen bölgelerde bulundu (12 ilişkili bölge). Tomogram rekonstrüksiyonu, segmentasyon ve şablon eşleştirmeden sonra, bireysel END yapıları kendi doğal bağlamları içinde görselleştirilebilir (Şekil 7C,D). Bu, END'i çevreleyen fenestrat endoplazmik retikulumu (ER), ara sıra temas eden lipid damlacıklarını ve LLPS bölmesinden çıkarılan ribozomları içerir. Birlikte ele alındığında, bu, 3D bağıntılı FIB frezelemenin, bozulmamış hücrelerden nadir biyolojik süreçlerin moleküler düzeyde bilgisini nasıl sağlayabileceğini gösterir.
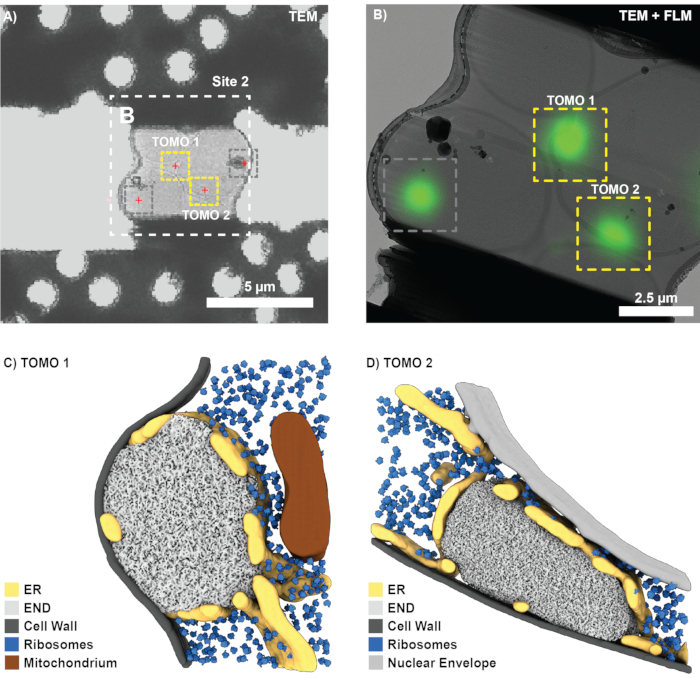
Şekil 7: END'i cryo-ET ile görselleştirmek için temsili sonuçlar. (A) Şekil 6'da gösterilen öğütme sahasının düşük büyütmeli TEM genel görünümü, ilgilenilen biyolojik özellikleri (kırmızı çarpılar) lokalize etmek için FLM maksimum yoğunluk projeksiyonu (Şekil 6B) ile kolayca ilişkilendirilebilir. (B) İkinci adımda, daha yüksek büyütmeli (dikişli) bir görünüm ilişkilendirilebilir ve tomogram alımı için konumlar (sarı kutular) ayarlanır. Düzlem dışı sinyalden kaynaklanan konumlar (gri kutu, Şekil 6D'yi karşılaştırın) göz ardı edildi. (C-D) Bu 3D bağıntılı FIB yaklaşımını kullanarak, endositik protein birikimi (END) doğal ortamında görselleştirilebilir. Endoplazmik retikulum (ER), ribozomlar, zarlar ve lipid damlacıkları gibi yapılar tanımlanabilir ve görselleştirilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Plazma Temizleyici Ayarları | |||
| Harrick Plazma Temizleyici PDG-3XG: | Radyo Frekansı ayarı: "HI", 30 s; N2 plazma | ||
| Piston Ayarları | |||
| TFS Vitrobot Mk IV: | % 100 nem; leke kuvveti = 8; lekelenme süresi = 10 sn; bekleme süresi 0 sn; (bu, çoğu süspansiyon ve yapışkan hücre için çalışmalıdır) | ||
| FIB CBS Pozisyonları ve Zamanlamaları | |||
| Quanta 3D FEG: | Eğim = 0, Dönüş = -180, Z konumu = 13.5, Sıcaklık ayar noktası = 26.15° , Zaman = 8 sn | ||
| TFS Scios: | Eğim = 0, Döndürme = -180, Z konumu = 9,8, Sıcaklık ayar noktası =28°C, Süre = 7 sn | ||
| TFS Aquilos 1: | Yazılım önceden tanımlanmış konum, Sıcaklık ayar noktası = 28° , Zaman = 7 sn | ||
| TFS Aquilos 2: | Yazılım önceden tanımlanmış konum, Sıcaklık ayar noktası = 28°, Süre = 7 sn | ||
| FIB Püskürtme Kaplayıcı Ayarları | |||
| Çekirdek Sistemi: | Çekirdek hazırlık odasında: 10 mA, 40 s | ||
| TFS Scios: | 10 W, 500 V, 250 mA, 0,2 mbar, 15 sn | ||
| TFS Aquilos 1: | 1kV, 10 mA, 10 Pa, 15 sn | ||
| TFS Aquilos 2: | 1kV, 10 mA, 10 Pa, 15 sn | ||
| Tomogram Alımı | |||
| Titan Krios Gi2 | K2 kamera, Gatan Bioquantum enerji filtresi | ||
| 20 eV yarık; 2 ° adımlarla doz simetrik eğim şeması (Hagen); +10°'den (lamel ön eğim!) +70° ve -50°'ye kadar başlayın | |||
| Titan Krios Gi4 | Şahin 4; Selectris X enerji filtresi | ||
| 10 eV yarık; 2 ° adımlarla doz simetrik eğim şeması (Hagen); +10°'den (lamel ön eğim!) +70° ve -50°'ye kadar başlayın | |||
| FLM Satın Alma | |||
| Corrsight (Konfokal Mod) | Amaç: Zeiss EC Plan-Neofluar 40×/0.9 NA Pol; Yığın toplama parametreleri: xy piksel boyutu = 161.25 nm, z adım boyutu = 300 nm. | ||
| Leica SP8 Kriyo-Konfokal | Amaç: Leica HCX PL APO 50x / 0.90 CLEM; Yığın toplama parametreleri: xy piksel boyutu = 84 nm, z adım boyutu = 300 nm. | ||
Tablo 1: Test edilen ekipmanların ve önerilen ayarların listesi.
Tartışmalar
1. Protokoldeki kritik adımlar
Hücre kültürü ve ızgara daldırma parametrelerinin optimizasyonu bu iş akışı için esastır. Bir projenin başlangıcında, etiketleme stratejilerini, hücrelerin ve referans boncuklarının dağılımını optimize etmek ve farklı ızgara hazırlama ve lekeleme parametrelerini test etmek için zaman ayırmaya değer. Optimum şekilde daldırılarak dondurulan bir numuneyle çalışmak, sonraki işlemleri önemli ölçüde kolaylaştıracaktır.
Herhangi bir TEM deneyinde olduğu gibi, vitreus örnekleri gereklidir. HeLa gibi büyük memeli hücreleri için, ızgara karesi başına 1-2 hücre tercih edilir, ancak hücreler yine de daha yüksek yoğunlukta camsı olabilir. İsteğe bağlı olarak, memeli hücrelerinde (örneğin, HEK293, HeLa) vitrifikasyon,23 daldırmadan 10 dakika önce kültür ortamına eklenen %2.5-10 (h/h) gliserol ile inkübe edilerek iyileştirilebilir. Mümkünse, hücrelerin mükemmel yerleşimini ve dağılımını sağlamak için ızgara deseni kullanılabilir, böylece vitrifikasyonu ve daha sonra korelasyonu iyileştirir24.
İş akışı sırasında belirli hücreler seçilebilse de, ilgilenilen biyolojik özelliği gösteren çok az sayıda hücre genel verimi önemli ölçüde azaltacaktır. POI pozitif hücrelerde korelasyonu geliştirmek için yeterince parlak floroforlar kullanılmalıdır. Bu özellikle endojen ekspresyon seviyelerinde önemlidir. Kriyo koşulları altında, mVenüs'ün artan parlaklığı 25 ve kriyokoşulları 26 altında standart GFP filtre kurulumları için uygun olmasını sağlayan hipsokromik kayması nedeniyle genellikle EGFP'den daha iyi performans gösterdiğini bulduk. Nokta benzeri olmayan hedef yapılar için, dalga boyu ve lokalizasyon doğruluğu (Abbe kırınım sınırı) arasındaki değiş tokuş da dikkate alınmalıdır.
Verimli 3D korelasyon ayrıca ızgaraların mekanik olarak kararlı olmasını ve büyük bir özenle ele alınmasını gerektirir. Karbon destekli standart altın veya bakır ızgaralar kullanılabilirken, projeye bağlı olarak daha sert SiO2 filmler kullanılarak başarı oranı önemli ölçüde artırılabilir. Bununla birlikte, (a) mekanik stabilitenin veya (b) kriyo-kırışıklığı27 azaltmak için eşleşen termal genleşme katsayılarının (substrat ve film) başarılı 3D korelasyonu için en önemli faktör olup olmadığı henüz kesin olarak belirlenmemiştir. Ayrıca, kırılgan Au ızgaralarını toplamak için polidimetilsiloksan kaplı kaplar kullanılabilir5.
Numune stabilitesini sağlamanın yanı sıra, FIB frezeleme sırasında optimum hedefleme için uygun olan yüksek kaliteli floresan yığınları elde etmek için FLM görüntüleme parametrelerinin dikkatli bir şekilde seçilmesi gerekir. Bu bağlamda, FLM verileri üzerinde farklı gürültü giderme28 veya evrişim giderme tekniklerinin test edilmesi de tavsiye edilir, çünkü bu, referansların ve hücresel sinyallerin lokalizasyonunu önemli ölçüde iyileştirebilir. Floresan sinyalini FIB-SEM görüntüleriyle ilişkilendirirken, referans boncuklarının iyi bir örneklemesi önemlidir. Hücrelerin etrafına ve muhtemelen farklı z yüksekliklerinde iyi dağılmış olmalıdırlar. Ayrıca, kasıtlı olarak referans modelinin dışında bırakılan ancak gözle açıkça ilişkilendirilebilen boncukların tahmin edilen ve gerçek konumlarını kontrol ederek korelasyonun tutarlılığını doğrulamak da iyi bir uygulamadır. Kayıt tutarlılığını kontrol etmek için 3DCT'nin RMSE değerleri de her zaman dikkate alınmalıdır.
Öğütülmüş malzemenin ve artık suyun FIB-SEM odasından birikmesi (yani yeniden kontaminasyon), her iki tarafına amorf malzeme ekleyerek etkili lamel kalınlığını artırdığından, ince öğütülmüş lamellerin mikroskopta uzun süre tutulması, ek elektron saçılma olayları nedeniyle genellikle TEM veri kalitesini düşürür. Buna göre, frezeleme çoğunlukla iki aşamalı bir şekilde gerçekleştirilir: ilk olarak, tüm pozisyonlar kabaca (yani yaklaşık 800 nm'ye kadar) ve daha sonra ince bir şekilde (~150-250 nm'ye kadar) frezelenir ve son lamel tamamlandıktan hemen sonra ızgara boşaltılır. Bununla birlikte, daha iyi korelasyon başarısı, ilgilenilen pozisyonların saha bazında işlenmesiyle elde edilebilir, bu nedenle aynı lamel üzerinde doğrudan birbiri ardına kaba ve ince frezeleme yapılır, çünkü bu, bükülme veya deformasyon için zaman bırakmaz. Ancak bu, sistemin yeniden kirlenme oranına bağlı olarak ızgara başına üretilebilecek maksimum lamel sayısını azaltır. 20 nm/s hız için 1-1,5 saat içinde 4-6 lamel üretilir.
Tüm ızgaranın veya kaba öğütülmüş lamellerin >300 nm) hareketi, zayıf veya başarısız korelasyona neden olacaktır (ayrıca aşağıda tartışılan sınırlamalara bakınız). Bu nedenle, örneğin FIB frezeleme öncesinde, sırasında ve sonrasında IB görüntüleri karşılaştırılarak düzenli olarak kontrol edilmelidir. Önemli hareket (>300 nm) gösteren siteler atılmalıdır. Bu hareketlerden kaçınmak için numune hazırlamayı (yani, ızgara tipi, hücre yoğunluğu ve dalma parametrelerinin seçimi; protokol bölüm 1'e bakın) ve frezeleme stratejisini optimize edin. Lamel bükülmesi, adım 3.6'da açıklandığı gibi saha bazında frezeleme ve lamel genişliğinin azaltılması ile önemli ölçüde azaltılabilir. Daha önce de belirtildiği gibi, gerilim giderici kesimler15 lamel bükülmesini azaltmak için tasarlanmış olsa da, genellikle ayrılmış lamelin uyumlu bir hareketine neden olur ve böylece korelasyonu etkili bir şekilde önler. Bu sorunu çözmek için entegre FLM sistemleri kullanılabilir.
2. Yöntemin değiştirilmesi ve sorun giderme
Kriyo koşullarına gitmeden önce canlı hücre görüntülemede numunenin kapsamlı bir karakterizasyonunun yapılması şiddetle tavsiye edilir. Hücresel numuneleri, tedavi şemalarını optimize etmek ve kriyo iş akışına girmeden önce ne tür bir sinyal bekleneceğini bilmek, başarı oranını önemli ölçüde artırabilir.
Burada sunulan iş akışında, numuneleri görüntülemek için kriyo aşamalı bağımsız bir floresan mikroskobu kullanılır, ardından ızgaralar odaklanmış iyon ışını mikroskobuna aktarılır. Bununla birlikte, FIB-SEM odasına bir floresan mikroskobunun entegre edildiği sistemlerde test edilmiştir ve bu nedenle floresan görüntülerielde etmek için numune transferi gerekmez 29,30,31. Bu tür entegre sistemler kullanılarak, son lamelleri kirletme riskini artırmadan hedef floresan sinyalinin varlığını kontrol etmek için FIB frezeleme sırasında ve sonrasında ilgilenilen konumlar görüntülenebilir. Bununla birlikte, kullanılan mikroskopların optik parametrelerini akılda tutmak önemlidir, çünkü örneğin, düşük bir NA objektifi, referans boncuklarının ve hedef sinyallerin lokalize edilebileceği hassasiyeti sınırlayacaktır. Bununla birlikte, FLM yığınları sürekli olarak güncellenebildiğinden ve güncel SEM ve IB görünümleriyle karşılaştırılabildiğinden, entegre FLM kurulumları, ızgaraların ve lamellerin hafif deformasyonlarıyla daha iyi başa çıkmaya yardımcı olacaktır.
FIB frezeleme ve TEM veri toplama arasındaki lamelin floresan görüntülemesine alternatif olarak, lamellerin doğru yerleştirildiğini ve frezelendiğini doğrulamak için TEM sonrası korelasyon kullanılabilir 5,6.
Bağıntılı iş akışının tüm adımlarında, ancak özellikle TEM sırasında, FIB-SEM/TEM görüntülerinde yansıtılan floresan verilerinin bir katmanının oluşturulması önerilir. Bu tür klasik CLEM görünümleri, hücrelerin hangi kısmının lamellerin içinde bulunduğunu daha sezgisel olarak anlamaya yardımcı olur. Bu aynı zamanda korelasyonun doğruluğunu doğrulamak için yararlı bir akıl sağlığı kontrolü görevi görür.
3. Yöntemin sınırlamaları
3D bağıntılı FIB yaklaşımı, referans boncuklarla sağlanabilen numuneler gerektirir. Buna göre, bu yöntem şu anda daldırmalı donmuş ızgaralarla sınırlıdır. Yüksek basınçlı (HPF) dondurulmuş (doku) numuneler için şu anda sadece 2D-2D korelasyonları gerçekleştirilebilir. Potansiyel olarak, dahili referans belirteçleri (örneğin, organeller, lekeli lipit damlacıkları) bu soruna bir çözüm olabilir32,33. Nihai korelasyon başarı oranı, numune kalitesi, floresan mikroskobu kurulumu, lamel kalınlığı ve hedeflenen yapının boyutu dahil olmak üzere birçok faktöre bağlıdır. Açıklanan 3D kayıt yaklaşımını kullanan korelasyon doğruluğunun, nihai IB görüntüsünde 200-300 nm aralığında olduğu tahmin edilmektedir, bu da kabaca FIB ile öğütülmüş lamellerin tipik kalınlığınakarşılık gelir 7. Buna göre, bundan çok daha küçük hücresel yapıların şu anda hedeflenmesi zor olacaktır. Ek olarak, frezeleme sahasındaki aşırı hareket (>300 nm), FIB/SEM cihazlarına entegre FLM kurulumlarıyla potansiyel olarak ele alınabilecek bir sorun olan korelasyonun doğruluğunu da azaltır. Frezeleme sırasında güçlü deformasyon veya bükülme gösteren lameller, her durumda, sonraki iş akışından hariç tutulmalıdır.
Genel olarak, kriyo-floresan görüntüleme şu anda Abbe kırınım kriteri ile sınırlıdır. Süper çözülmüş kriyo-FLM yöntemlerinin daha rutin uygulaması (ve ticarileştirilmesi) ile, özellikle anında operasyon için FIB / SEM'e entegre edildiğinde, hücresel yapıların daha doğru hedeflenmesi mümkün olabilir.
4. Yöntemin önemi
Özellikle hedefsiz ve korelasyon sonrası tekniklerle karşılaştırıldığında, 3D korelasyonlu FIB frezeleme yaklaşımı, zaman ve kaynak tüketen TEM adımından önce uygun pozisyonların seçilmesine olanak tanır. Böylece daha verimli veri toplama ve proje planlaması sağlar. Ayrıca, ilişkili floresan verileri, tomogramları yorumlamak ve kriyo-ET sonuçlarını çok ölçekli projelere entegre etmek için, özellikle yapılandırılmamış protein düzenekleri veya şablon eşleştirme ve subtomogram ortalaması için çok küçük olanlarla uğraşırken çok önemli olabilecek bir bilgi katmanı ekler.
5. Önemi ve gelecekteki potansiyel uygulamaları
HPF numunelerinden kriyo-kaldırma 34,35, kriyo-FIB-SEM hacim 36 ve süper çözünürlüklü floresan görüntüleme26,37,38,39 gibi gelişmiş iş akışlarıyla birlikte, 3D hedefli lamel hazırlama, yalnızca izole hücrelerdeki biyolojik süreçleri diseksiyon değil, aynı zamanda doku ve hasta numunelerini FIB frezeleme ve kriyo-elektron tomografisi için erişilebilir hale getirme olasılığı sunar. Bu nedenle, patolojik süreçlerin yüksek çözünürlükte diseksiyonuna izin verecek ve böylece nano ölçekte bir biyopsiye doğru ayrılmaz bir yapı taşı olacaktır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
BT altyapısını desteklediği için Inga Wolf'a, hesaplama desteği için Florian Beck'e ve makalenin eleştirel okuması için Oda H. Schiøtz'a teşekkür ederiz. Finansman kısmen Alexander von Humboldt'un Philipp S. Erdmann'a geri dönenler bursu ve Florian Wilfling'e EMBO Uzun Vadeli Bursu ALTF 764-2014 aracılığıyla sağlandı. Anna Bieber, Boehringer Ingelheim Fonds Ph.D. bursu tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Autogrids | Thermo Fisher Scientific / Homemade | 1036173 (no cutout), 1205101 (with cutout) | |
| C-rings | Thermo Fisher Scientific | 1036171 | |
| Corrsight with cryo module | Thermo Fisher Scientific | FLM Alternative 1 | |
| Dynabeads MyOne COOH | Thermo Fisher Scientific | 65011 | recommended 1 µm fiducial beads |
| EM Grids R1/4 SiO2 | Quantifoil | N1-S13nAu20-01 | |
| Falcon 4 camera w. post-column Selectris X energy filter | Thermo Fisher Scientific | Camera/Filter Alternative 1 | |
| FIB Aquilos 1 | Thermo Fisher Scientific | FIB Alternative 1 | |
| FIB Aquilos 2 | Thermo Fisher Scientific | FIB Alternative 2 | |
| FIB Quanta 3D FEG | Thermo Fisher Scientific | FIB Alternative 3 | |
| FIB Scios | Thermo Fisher Scientific | FIB Alternative 4 | |
| K2 summit camera w. post-column energy filter 968 Quantum K2 | Gatan | Camera/Filter Alternative 2 | |
| Leica TCS SP8 with cryo module | Thermo Fisher Scientific | FLM Alternative 2 | |
| Plasma Cleaner PDC-3XG | Harrick | ||
| Teflon Sheet (0.25 mm) | plastx24.de | 11645 | Cut to same dimensions as filter paper |
| TEM Titan Krios XFEG 300 kV Gi2 | Thermo Fisher Scientific | TEM Alternative 1 | |
| TEM Titan Krios XFEG 300 kV Gi4 | Thermo Fisher Scientific | TEM Alternative 2 | |
| THUNDER Imager EM Cryo CLEM | Thermo Fisher Scientific | FLM Alternative 3 | |
| Vitrobot Mark IV | Thermo Fisher Scientific | alternativevly, use manaual plunger | |
| Whatman filter paper | Sigma Aldrich | 10311807 | 55 mm diamater; needs to be cut to fit the Vitrobot |
Referanslar
- Beck, M., Baumeister, W. Cryo-Electron tomography: Can it reveal the molecular sociology of cells in atomic detail. Trends in Cell Biology. 26 (11), 825-837 (2016).
- Plitzko, M., Villa, E., Schaffer, M., Baumeister, W. Opening windows into the cell focused-ion-beam milling for cryo-electron tomography. Current Opinion in Structural Biology. 23, 771-777 (2013).
- Schaffer, M., et al. Optimized cryo-focused ion beam sample preparation aimed at in situ structural studies of membrane proteins. Journal of Structural Biology. 197 (2), 73-82 (2017).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nature Methods. 18 (2), 186-193 (2021).
- Klein, S., Wachsmuth-Melm, M., Winter, S. L., Kolovou, A., Chlanda, P. Cryo-correlative light and electron microscopy workflow for cryo-focused ion beam milled adherent cells. Methods in Cell Biology. 162, Elsevier Inc. 273-302 (2021).
- Klein, S., et al. Post-correlation on-lamella cryo-CLEM reveals the membrane architecture of lamellar bodies. Communications Biology. 4 (1), 1-12 (2021).
- Arnold, J., et al. Site-Specific Cryo-focused ion beam sample preparation guided by 3D correlative microscopy. Biophysical Journal. 110 (4), 860-869 (2016).
- Wilfling, F., et al. A selective autophagy pathway for phase-separated endocytic protein deposits. Molecular Cell. 80 (5), 764-778 (2020).
- Scientific volume imaging, Nyquist calculator. , Available from: https://svi.nl/NyquistCalculator (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huygens Professional version 19.04. , Scientific Volume Imaging. The Netherlands. Available from: http://svi.nl (2021).
- de Chaumont, F., et al. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 9 (7), 690-696 (2012).
- Arnold, J. 3DCT. , Available from: https://3dct.semper.space/ (2021).
- Klumpe, S., et al. A modular platform for streamlining automated cryo-FIB workflows. bioRxiv. , 444745(2021).
- Wolff, G., et al. Mind the gap: Micro-expansion joints drastically decrease the bending of FIB-milled cryo-lamellae. Journal of Structural Biology. 208 (3), 0-3 (2019).
- Buckley, G., et al. Automated cryo-lamella preparation for high-throughput in-situ structural biology. Journal of Structural Biology. 210 (2), 107488(2020).
- Tacke, S., et al. A streamlined workflow for automated cryo focused ion beam milling. bioRxiv. , 963033(2020).
- Zachs, T., et al. Fully automated, sequential focused ion beam milling for cryo-electron tomography. eLife. 9, e52286(2020).
- Fung, H. K. H. tools3dct. , Available from: https://github.com/hermankhfung/tools3dct (2021).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Yang, J. E., Larson, M. R., Sibert, B. S., Shrum, S., Wright, E. R. CorRelator: Interactive software for real-time high precision cryo-correlative light and electron microscopy. Journal of Structural Biology. 213 (2), 107709(2021).
- Hagen, W. J. H., Wan, W., Briggs, J. A. G. Implementation of a cryo-electron tomography tilt-scheme optimized for high resolution subtomogram averaging. Journal of Structural Biology. 197 (2), 191-198 (2017).
- Bäuerlein, F. J. B., et al. In situ architecture and cellular interactions of polyQ inclusions. Cell. 171 (1), 179-187 (2017).
- Toro-Nahuelpan, M., et al. Tailoring cryo-electron microscopy grids by photo-micropatterning for in-cell structural studies. Nature Methods. 17 (1), 50-54 (2020).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Kaufmann, R., et al. Super-resolution microscopy using standard fluorescent proteins in intact cells under cryo-conditions. Nano Letters. 14 (7), 4171-4175 (2014).
- Booy, F. P., Pawley, J. B. Cryo-crinkling: what happens to carbon films on copper grids at low temperature. Ultramicroscopy. 48 (3), 273-280 (1993).
- Krull, A., Buchholz, T. O., Jug, F. Noise2void-Learning denoising from single noisy images. Proceedings of the IEEE Computer Society Conference on Computer Vision and Pattern Recognition. 2019, 2124-2132 (2019).
- Gorelick, S., et al. PIE-scope, integrated cryo-correlative light and FIB/SEM microscopy. eLife. 8, 1-15 (2019).
- Delmic METEOR. , Available from: https://www.delmic.com/en/products/cryo-solutions/meteor (2021).
- T. F. Scientific. iFLM. , Available from: https://assets.thermofisher.com/TFS-Assets/MSD/Datasheets/iflm-aquilos-datasheet-ds0366.pdf (2021).
- Mahamid, J., et al. Liquid-crystalline phase transitions in lipid droplets are related to cellular states and specific organelle association. Proceedings of the National Academy of Sciences of the United States of America. 116 (34), 16866-16871 (2019).
- Scher, N., Rechav, K., Paul-Gilloteaux, P., Avinoam, O. In situ fiducial markers for 3D correlative cryo-fluorescence and FIB-SEM imaging. iScience. 24 (7), 102714(2021).
- Mahamid, J., et al. A focused ion beam milling and lift-out approach for site-specific preparation of frozen-hydrated lamellas from multicellular organisms. Journal of Structural Biology. 192, 262-269 (2015).
- Schaffer, M., et al. A cryo-FIB lift-out technique enables molecular-resolution cryo-ET within native Caenorhabditis elegans tissue. Nature Methods. 16 (8), 757-762 (2019).
- Wu, G. -H., et al. Multi-scale 3D cryo-correlative microscopy for vitrified cells. Structure. 28 (11), 1231-1237 (2020).
- Liu, B., et al. Three-dimensional super-resolution protein localization correlated with vitrified cellular context. Scientific Reports. 5, 13017(2015).
- Weisenburger, S., Jing, B., Renn, A., Sandoghdar, V. Cryogenic localization of single molecules with angstrom precision. SPIE NanoScience + Engineering. 8815, (2013).
- Tuijtel, M. W., Koster, A. J., Jakobs, S., Faas, F. G. A., Sharp, T. H. Correlative cryo super-resolution light and electron microscopy on mammalian cells using fluorescent proteins. Scientific Reports. 9 (1), 1-11 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır