Method Article
Yağsız ve Obez Farelerden Primer Murin Adipositlerinin İzolasyonu ve Kültürlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Olgun adipositlerin büyüklüğü ve kırılganlığı, çalışmaları ve izolasyonları için mevcut teknik ve araçları sınırlamıştır. Burada, farklı yağ depoları ve fare diyetleri için kolayca uyarlanabilen olgun murin adipositlerinin izolasyonu için bir protokol açıklanmaktadır.
Özet
Yağ dokusu esas olarak hacimce olgun, lipit yüklü adipositlerden oluşur. Bu postmitotik hücreler, enerji depolama ve mobilizasyonunda, termoregülasyonda ve endokrin faktörlerin salgılanmasında kritik bir rol oynar. Kalori dengesizliğine bağlı olarak beyaz yağ dokusunun genişlemesi, hem mevcut adipositlerin büyümesine hem de adiposit progenitör hücrelerinden ek adipositlerin oluşmasına neden olur. Adipositleri etkileyenler de dahil olmak üzere beyaz yağ dokusunda obeziteye bağlı değişiklikler, tip 2 diyabet ve 13 kanser türü gibi çok sayıda komorbidite ile ilişkilidir. Adipositlerin hastalığa nasıl katkıda bulunduğunu incelemenin önündeki önemli bir engel, olgun adipositlerin kolayca izole edilememesi ve kültürlenememesidir. Bu makale, murin yağsız ve obez adipositlerini erkek ve dişi C57BL / 6 farelerinin deri altı ve viseral yağ depolarından izole etmek için bir protokolü açıklamaktadır. Protokol, izole edilmiş primer adipositlerin bir membran adiposit agregat sisteminde 2 haftaya kadar nasıl kültürlenebileceğini detaylandırarak, ko-kültür deneylerinde, lipoliz deneylerinde veya adiposit tarafından salgılanan faktörleri içeren şartlandırılmış ortamların toplanması yoluyla fonksiyonel analizlerini kolaylaştırır. Ek olarak, protokol, bazal membran matris kubbelerinde yağ dokusu eksplantlarının kültürlenmesi ve birincil izole adipositlerin görüntülenmesi için yöntemleri özetlemektedir. Daha da önemlisi, bu yaklaşım, floresanla aktive edilen hücre sınıflandırması (FACS) kullanılarak yağ dokusunda yerleşik adiposit progenitör hücrelerinin izolasyonu için mevcut protokollerle entegre edilebilir. Birlikte, bu protokoller araştırmacılara yağsız ve obez, erkek ve dişi farelerden adipositleri, adiposit progenitör hücrelerini ve tüm yağ dokusunu işlevsel olarak incelemek için araçlar sağlar.
Giriş
Amerika Birleşik Devletleri'nde yetişkin obezite prevalansının 2030 yılına kadar %50'ye ulaşması beklenmektedir1 ve bu da obezitenin hücresel ve fizyolojik etkilerinin daha iyi anlaşılmasını zorunlu kılmaktadır. Obezite, enerjinin yağ olarak depolanmasının artmasına bağlı olarak beyaz yağ dokusunun genişlemesine neden olan kalori dengesizliği ile karakterizedir. Yağ dokusu genişlemesi, hem yeni adipositlerin oluşumu (hiperplazi) hem de mevcut adipositlerin boyutunun artması (hipertrofi) yoluyla meydana gelebilir. Her iki süreç de yağ dokusunun genişlemesine neden olsa da, hipertrofik genişleme, metabolik sağlığın azalması ve metabolik bozuklukların daha yüksek insidansı ile çakışır 2,3. Yağ dokusunun karmaşıklıklarının daha iyi anlaşılması, metabolik bozuklukları ve tip 2 diyabet ve kanserler dahil olmak üzere obezite ile ilişkili diğer komorbiditeleri düzenleyen moleküler mekanizmalar hakkında bilgi sağlayacaktır.
Yağ dokusu, enerji depolama ve termoregülasyondaki rolü nedeniyle uzun zamandır takdir edilmektedir. Bununla birlikte, daha yakın zamanlarda, yağ dokusu, metabolitlerin, lipitlerin ve peptitlerin salgılanmasından sorumlu önemli bir metabolik sinyal dokusu olarak ortaya çıkmıştır 4,5. Adipokinler olarak adlandırılan bu yağ dokusu türevli moleküller, lokal ve sistemik olarak sinyal verir ve enerji homeostazını, bağışıklık fonksiyonunu, vasküler dinamikleri ve daha fazlasını düzenleyebilir 5,6,7. Olgun adipositler, yağ dokusundaki hücrelerin yaklaşık %50'sini oluşturur ve yağ dokusu hacminin büyük çoğunluğunu temsil eder8. Daha da önemlisi, çalışmalar adipositlerin birçok alt popülasyondan oluştuğunu bulmuştur 9,10. Bu nedenle, adiposit progenitör hücreleri, cinsiyet ve yağ dokusu deposu gibi faktörlere dayalı olarak farklı olgun adiposit popülasyonları oluşturur. Bu olgun adipositler, diyet ve obezitedeki değişikliklerle daha fazla modüle edilebilir, bu da transkripsiyonel olarak farklı olan ve farklı parakrin imzaları ifade eden adiposit alt popülasyonları oluşturur 9,11,12,13,14,15,16 . Karmaşıklıklarına ve fizyolojik önemlerine rağmen, olgun adipositleri izole etme ve kültürleme yeteneği, bu hücrelerin incelenmesinin önünde belirgin bir engel olmaya devam etmektedir.
Olgun adipositleri izole etmek için kullanılan şu anda mevcut yöntemler, adiposit progenitör hücrelerinden (APC'ler), floresan aktive hücre sınıflandırma ve santrifüjleme tabanlı tekniklerden farklılaşma kullanır, ancak bunların hepsinin kendi dezavantajları vardır. APC'lerin matür adipositlere in vitro veya ex vivo farklılaşması, matür adipositleri geliştirmek için yaygın olarak kullanılmaktadır. Bununla birlikte, bu yapay olarak farklılaşmış hücreler, bir büyük lipid damlacığı17 içeren in vivo olgun adipositlerin uniloküler fenotipinden ziyade birçok küçük lipid damlacığı içeren çok gözlüklüdür. Ayrıca, çalışmalar in vitro farklılaşmış hücrelerin, in vivo17'de bulunan izole olgun adipositlerden transkripsiyonel olarak farklı olduğunu bulmuştur. Daha da önemlisi, in vitro farklılaşma, yağsız ve obez adipositler arasındaki farkı yakalayamaz. Floresanla aktive edilen hücre sınıflandırması (FACS), belirli hücre popülasyonlarını dokudan izole etmek için yaygın olarak kullanılır; bununla birlikte, olgun adipositler, büyük boyutları ve kırılgan zarları nedeniyle FACS koşulları altında kolayca patlayabilir ve bu da bunu olgun adiposit izolasyonu için verimsiz bir yöntem haline getirir. Mevcut diğer protokoller, zamanla kültürdeki olgun adipositler için toksik olabilen büyük miktarlarda serbest lipid birikimine neden olur.
Burada, murin olgun adipositlerinin beyaz yağ dokusundan izolasyonu için bir protokol tarif ediyoruz. Bu protokol, orijinal olarak Harms ve ark.17 tarafından oluşturulan olgun adiposit agrega kültürleri için protokolden uyarlanmıştır; Bununla birlikte, burada açıklanan santrifüjleme tabanlı yaklaşım, yaygın laboratuvar ekipmanı kullanır ve adipositleri küçük miktarlarda (~ 0.5 g) yağ dokusundan verimli bir şekilde izole edebilir. Bu kolayca uyarlanabilir bir sistemdir ve olgun murin adipositlerini erkek ve dişi farelerden, viseral ve deri altı yağ depolarından ve farklı diyet koşullarından izole etmek için modifikasyonlar dahildir.
Protokol
Açıklanan tüm hayvan deneyleri, Utah Üniversitesi Hayvanların Kullanımı ve Bakımı Komitesi tarafından onaylandı. Bu protokol, vücut ağırlıkları 20-45 g arasında değişen, 8-16 haftalık C57BL / 6 erkek ve dişi farelerden olgun adipositlerin izolasyonu için optimize edilmiştir. Bu çalışmada kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda verilmiştir.
1. Çözelti hazırlama
- Kollajenaz tamponu hazırlayın. 100 mg kollajenaz tozu, 1 mL 1 M HEPES tamponu, 500 μL 100x P188, 50 μL 1 M CaCl2, 0.05 g BSA ve 48.45 mL Orta 199 ekleyin. Solüsyonu steril olarak süzün, alikotlayın ve -20 ° C'de saklayın.
- Hücre kültürü ortamı yapın. 500 mL DMEM, 50 mL FBS, 5 mL Penisilin-Streptomisin ve 5 mL L-glutamin takviyesini birleştirin.
2. Farelerden beyaz yağ dokusu depolarının toplanması
- Her farklı depo ve durum için uygun şekilde 200 μL HBSS içeren 1 x 10 cm'lik bir plaka hazırlayın ve buzun üzerine yerleştirin.
- Hayvanları hayvan barınağından alın ve Kurumun Hayvan Bakım ve Kullanım Komitesi'nin yönergelerine uygun olarak farelere ötenazi yapın. Burada hayvanlara derin anestezi altında servikal çıkık ile ötenazi uygulandı.
- Uygunsa her farenin ağırlığını tartın ve kaydedin.
- Dış yüzeyi kaplamak için% 70 etanol püskürterek fareyi sterilize edin.
- Fareden uygun yağ pedlerini toplayın18,19.
NOT: Dokuyu tabağa yerleştirmeden önce lenf düğümlerini deri altı deposundan çıkarmaya özen gösterin. - Her bir yağı tartın ve ağırlığı kaydedin.
- Yağ pedini buz üzerinde hazırlanan 10 cm'lik tabağa yerleştirin.
3. Beyaz yağ dokusu eksplantlarının hazırlanması
NOT: Bu adım isteğe bağlıdır.
- Diseksiyona başlamadan en az 12 saat önce, bazal membran matrisini (Matrigel) 4 °C'de buz üzerinde çözdürün ve bir kutu steril 200 μL pipet ucunu 4 °C'de soğutun.
- Soğutulmuş pipet uçları kullanarak, bir kubbe oluşturmak için 80 oyuklu bir kültür plakasının her bir oyuğunun ortasına 24 μL bazal membran matrisi pipetleyin (Şekil 1A). Matrisi kısmen katılaştırmak için plakayı 30 dakika boyunca inkübatöre (37 °C,% 5 CO2) yerleştirin.
- Doku hazırlayın: Steril diseksiyon makası kullanarak, her numuneden 0.1 g doku tartın ve buz üzerinde PBS'ye yerleştirin.
- Steril forsepslerle, önceden tartılmış dokuyu kısmen katılaşmış matris kubbesine gömün. Gömülü dokunun üzerine 30 μL bazal membran matrisi ekleyin. Dokuyu bazal membran matrisine yerleştirmek için plakayı 30 dakika inkübatöre geri koyun.
NOT: Dokuyu bazal membran matrisine gömmek, dokunun yüzmek yerine kültürde kalmasını sağlamak için çok önemlidir. Bu, dokunun sağlığını ve kalitesini korur (Şekil 1B). - Her oyuğa 1 mL büyüme ortamı (% 10 FBS ile DMEM) ekleyin ve inkübatöre geri dönün.
4. Kollajenaz tedavisi
- Gereken kollajenaz çözeltisi miktarını hesaplayın. Tablo 1'e bakın.
- DNaz ile kollajenaz çözeltisi hazırlayın. 1 mL kollajenaz çözeltisi başına 0.00017 g DNaz ekleyin. Karıştırmak için girdap.
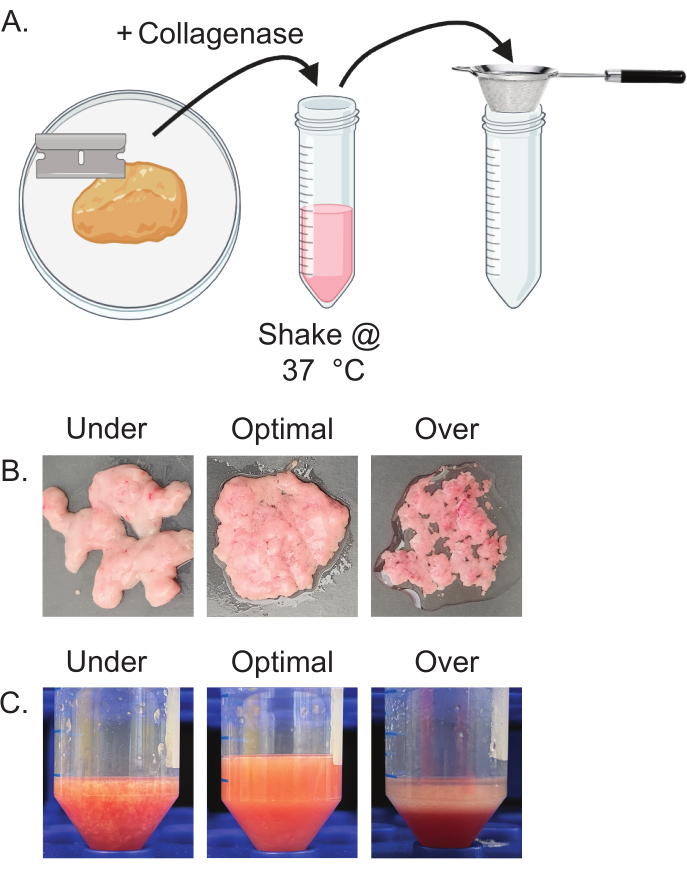
- Bir tıraş bıçağı kullanarak, doku homojen görünene kadar izole edilen yağ dokusunu kıyın (Şekil 2A). Kıyılmış dokuyu steril 50 mL'lik bir konik tüpe aktarın.
NOT: Fazla kıymayın. Doku homojen ve macun kıvamında göründüğünde kıyma işlemi tamamlanır. Az kıyılmış doku tıknaz ve heterojen görünür ve aşırı kıyılmış doku serbest lipitlerin salınmasına neden olur (Şekil 2B). - Adım 4.1'de hesaplanan hacimleri kullanarak kıyılmış yağ dokusuna hazırlanan kollajenaz ve DNaz solüsyonunu ekleyin. İyice birleştirmek için 7-10 saniye boyunca maksimum hızda girdap. 50 mL konik tüpleri 220 rpm, 37 °C'ye ayarlanmış bir çalkalayıcıya yatay olarak yerleştirin.
- 10 dakika çalkalayın, ardından 5 saniye girdap yapın ve numuneleri kontrol edin. Tamamen sindirilmiş numuneler, görünür kümeler veya doku parçaları olmadan homojen görünecektir. Numuneler tam olarak sindirilmezse, her 2 dakikada bir kontrol ederek çalkalayıcıda sindirmeye devam edin (Şekil 2C).
NOT: Aşırı sindirmeyin. Kollajenaz çözeltisinde aşırı zaman, adipositlerin parçalanmasına ve lipitlerin salınmasına neden olabilir. - Sindirilmiş dokuyu bir elekten geçirerek 50 mL'lik yeni bir konik içine geçirmek için serolojik bir pipet kullanın. Kollajenazı nötralize etmek için elek boyunca bir konik içine doku + kollajenaz çözeltisinin hacmine eşit bir hacim FBS ekleyin.
NOT: Filtrelemeden sonra elekte az miktarda doku kalacaktır.
5. Dokuyu yıkamak
NOT: Aşağıdaki tüm adımları steril bir doku kültürü başlığında tamamlayın.
- Her koşul için 10 mL ılık kültür ortamı ile 1 x 15 mL tüp hazırlayın.
- Tüpleri adım 4.6'dan itibaren Tablo 1'de belirtilen sıcaklıkta 3 dakika boyunca 300 x g'da döndürün.
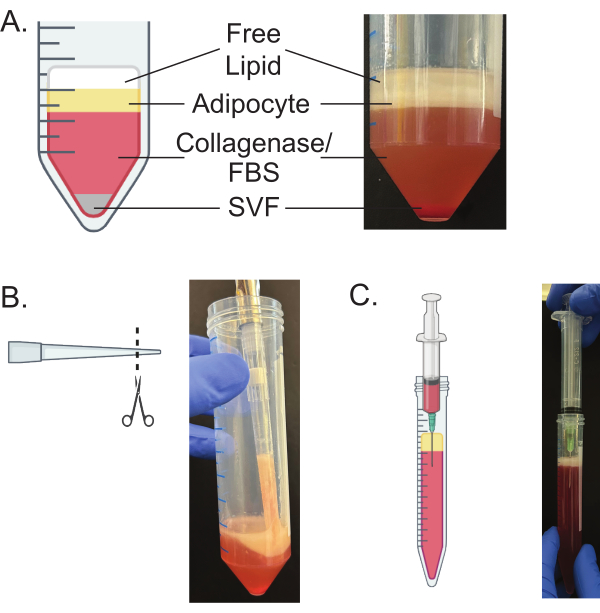
NOT: Santrifüjleme sıcaklığının, yağ dokusunun izole edildiği farelerin cinsiyetine göre değiştirilmesi gerekir; bu sıcaklıklar Tablo 1'de verilmiştir. - Eğirme işleminden sonra dokunun dört katmana ayrıldığından emin olun (Şekil 3A).
NOT: En üst tabaka serbest lipitlerdir, ikinci tabaka olgun adiposit tabakasıdır, üçüncü tabaka kollajenaz ve FBS'dir ve dördüncü tabaka en alta peletler yapan stromal vasküler fraksiyondur (SVF)20,21. - Serbest lipitlerin üst tabakasını 200 μL'lik bir pipetle dikkatlice atın.
- Üst tabakayı çıkardıktan sonra, olgun adipositleri 10 mL büyüme ortamı ile hazırlanan 15 mL'lik tüpe aktarmak için alt kısmı kesilmiş bir p1000 pipeti kullanın (Şekil 3B).
- İsteğe bağlı: Primer adiposit progenitör hücrelerini (APC'ler) izole etmek için, tüpleri 10 dakika boyunca 300 x g'da tekrar döndürün. Daha sonra Liu ve ark.22, Cho ve ark.23 veya benzeri ile adiposit progenitör hücre izolasyonuna geçin.
- 15 mL'lik tüpleri olgun adipositlerle birlikte, beyaz tabaka ortam boyunca dağılana kadar 3-5 kez hafifçe ters çevirin.
- Adiposit ve ortam katmanlarının ayrılmasını sağlamak için tüpleri Tablo 1'de belirtilen sıcaklıkta 10 dakika dik olarak dinlendirin.
- 10 dakikalık dinlenmeden sonra, katmanların ayrılmasını daha da teşvik etmek için tüpleri oda sıcaklığında 1 dakika boyunca 100 x g'da döndürün. Döndürmeyi takiben, numuneler Şekil 3A'da gösterildiği gibi tekrar dört katmana ayrılacaktır.
- Serbest lipitlerin üst tabakasını bir pipetle çıkarın ve atın.
- 5 mL'lik bir şırıngaya bağlı 21 G'lik bir iğne kullanarak, iğnenin alt kısmı olgun adiposit tabakasından temiz olana kadar iğneyi tüpün kenarından aşağı kaydırın (Şekil 3C). İğnenin üst kısmının ve şırınganın alt kısmının olgun adiposit tabakasını rahatsız etmediğinden emin olun.
- Kültür ortamını ve hücresel kalıntıları çıkarmak için şırıngayı yavaşça yukarı çekin.
NOT: Ortam çıkarılırken, iğne ucunun olgun adiposit tabakasından uzak olduğundan emin olun. - Her tüpe yavaşça 10 mL kültür ortamı ekleyin.
- 5.6-5.11 arasındaki adımları tekrarlayın. Daha fazla kültür ortamı eklemeyin.
- Jel yüklemeli pipet uçlarını kullanarak, kalan ortamı olgun adiposit tabakasının altından çıkarmak için pipet ucunu tüpün kenarından aşağı kaydırın.
6. Paketleme
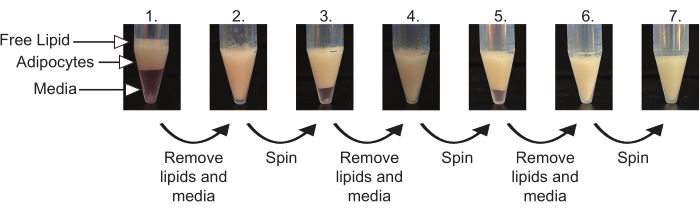
- Hücreleri, Tablo 1'de belirtilen sıcaklıkta 1 dakika boyunca 100 x g'da santrifüjleyin. Bir pipet kullanarak serbest lipitleri (hücrelerin üzerindeki berrak yağ tabakası) çıkarın. Bir jel yükleme ucu kullanarak adipositlerin altındaki kültür ortamını çıkarın. Adiposit tabakasının bozulmasını en aza indirmeye özen gösterin (Şekil 4).
- Tüm kültür ortamı ve serbest lipitler çıkarılana kadar (tipik olarak 3-5 kez) adım 6.1'i tekrarlayın. Hücre paketi beyaz renkte olmalı, hücrelerin üzerinde görünür serbest lipidler veya hücrelerin altında ortam olmamalıdır (Şekil 4).
7. Kaplama ve fonksiyonel tahliller
- Hücre kültürü için olgun adipositlerin kaplanması
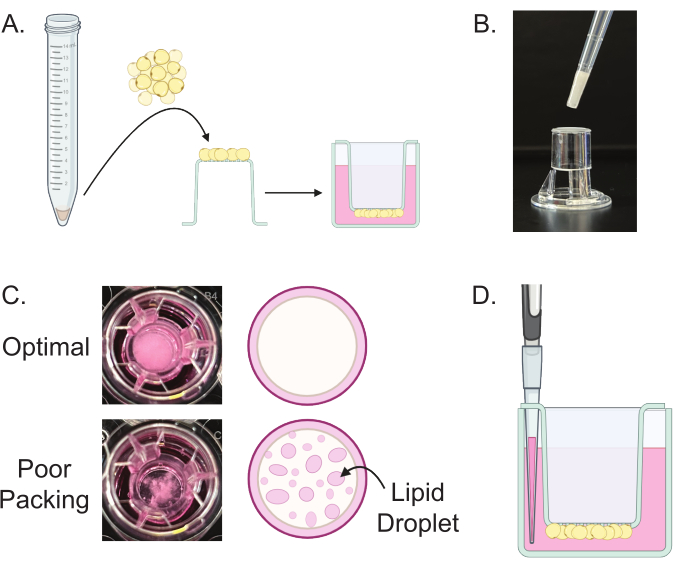
- Hücre kültürü eklerini doku kültürü ile muamele edilmiş 24 oyuklu bir plakadan çıkarın ve bunları zar tarafı yukarı bakacak şekilde davlumbazın yüzeyine yerleştirin.
- Plakanın alternatif kuyucuklarını 1 mL ılık kültür ortamı ile doldurun.
- Kesilmiş bir p200 pipet ucu kullanarak, adım 6.2'den itibaren 30 μL paketlenmiş olgun adipositi bir transwell ekinin üstüne yerleştirin (Şekil 5A,B).
- Kuyu ekini dikkatlice alın ve ters çevirin ve 24 oyuklu plakada önceden doldurulmuş bir kuyuya yerleştirin (Şekil 5A). Plakayı% 5 CO2 ile 37 ° C'ye ayarlanmış inkübatöre dikkatlice yerleştirin.
NOT: Düzgün bir şekilde paketlenmiş adipositler, yukarıdan bakıldığında görünür berrak serbest lipid damlacıkları olmayan opak bir tabaka oluşturmalıdır (Şekil 5C). - Olgun adipositler üzerindeki ortamı her 2-7 günde bir 14 güne kadar değiştirin.
- Ortamı kuyucuklardan çıkarmak için, transwell'i yerinde tutun ve medyayı transwell ekinin yan tarafındaki küçük açıklıklardan dikkatlice çıkarmak için bir p200 pipeti kullanın (Şekil 5D).
- Ortam çıkarıldıktan sonra, transkuyuyu yerinde tutarken, kuyunun yan duvarına çok yavaş bir şekilde 1 mL ortam ekleyin.
NOT: Ortamı çok yavaş eklemeye ve çıkarmaya dikkat edin. Ortam hızlı bir şekilde değiştirilirse adipositler zardan kolayca ayrılabilir.
- Lipoliz testi
- Plaka yağ dokusu adım 3.4'te tarif edildiği gibi eksplantlar veya adım 7.1'de tarif edildiği gibi olgun adipositler.
NOT: Hücreler veya doku, lipoliz testi yapılmadan önce en az 24 saat fenol kırmızısı içermeyen ortamda kültürlenmelidir. - Çözelti hazırlama: 5 g BSA'yı 100 mL DMEM içinde çözerek DMEM'de (fenol kırmızısı olmayan) %5'lik bir BSA çözeltisi hazırlayın. BSA tamamen çözülene kadar birleştirmek için hafifçe ters çevirin.
- Kontrol ve stimülasyon ortamları için çalışma çözümleri hazırlar. Kontrol ortamı için, %5 BSA DMEM ortamını araçla birleştirin. Stimülasyon ortamı için,% 5 BSA DMEM ortamını 5 μM CL-316,243 ile birleştirin. Kullanmadan önce kontrol ve stimülasyon ortamını 37 °C'ye ısıtın.
- Ortamı kuyulardan çıkarın ve 1 mL ılık DPBS ile yıkayın. Kuyucukları, kontrol veya stimülasyon ortamı kuyusu başına 500 μL ile doldurun. 37 ° C'de,% 5 CO2'de inkübe edin.
- Lipoliz testini başlattıktan 1 saat, 2 saat, 4 saat ve 24 saat sonra, her bir oyuktan 100 μL ortamı bir mikrosantrifüj tüpüne toplayın ve 100 μL uygun kontrol veya stimülasyon ortamı ile değiştirin.
NOT: Numuneler bu noktada -20 °C'de saklanabilir. - Gliserol Kolorimetrik Testi, ticari olarak temin edilebilen ücretsiz bir gliserol kiti (Malzeme Tablosuna bakınız) veya benzerini kullanarak çalıştırın.
- Reaktifleri kitte belirtildiği gibi hazırlayın.
- Numuneleri çözün ve pipetleyerek nazikçe karıştırın.
- Gliserol standart çözeltisini kullanarak yedi noktalı, 2 katlı seri seyreltme ile standart bir eğri hazırlayın.
- 25 μL numuneyi veya standardı, şeffaf tabanlı 96 oyuklu bir plakanın her bir oyuğuna aktarın.
- Numune veya standart çözelti içeren her oyuğa 100 μL serbest gliserol tahlil reaktifi ekleyin.
- Oda sıcaklığında 15 dakika inkübe edin, ardından 540 nm'de absorbansı okuyun (Şekil 6A-D).
- Plaka yağ dokusu adım 3.4'te tarif edildiği gibi eksplantlar veya adım 7.1'de tarif edildiği gibi olgun adipositler.
- Görüntüleme
- Görüntüleme slaytlarını hazırlayın. Slaytları hazırlamak için, her bir görüntüleme aralayıcısından arka kağıt katmanını çıkarın ve slaytın üzerine yerleştirin. Her slaytta iki görüntüleme ara parçası yan yana yerleştirilebilir.
- 200 μL'lik bir kesilmiş pipet ucu kullanarak, 6.2. adımdan 30 μL paketlenmiş adipositleri bir mikrosantrifüj tüpüne aktarın.
- Boyama karışımını hazırlayın. PBS'de 5 μg / mL'de plazma membran boyama çözeltisi örneği başına 200 μL ve 4.5 μg / mL'de Hoechst hazırlayın. Numunelere leke karışımı ekleyin ve hafifçe çalkalayın.
- Numuneleri oda sıcaklığında 30 dakika boyayın. Numuneleri ışıktan koruyun.
- Boyama tamamlandıktan sonra numuneleri yıkayın. Her numuneye 500 μL PBS ekleyin ve birleştirmek için hafifçe sallayın. 5 dakika bekletin. 1 dakika boyunca 100 x g'da döndürün, ardından jel yüklemeli bir pipet ucuyla ortamın hücrelerin altından ortamı çıkarın.
- Slaytları hazırlayın. Yapışkan tabakayı ortaya çıkarmak için görüntüleme ara parçalarının üst tarafındaki şeffaf plastik filmi çıkarın.
- Lekeli adiposit tüpüne 500 μL PBS ekleyin ve hafifçe karıştırın.
- Hızlı bir şekilde, olgun adipositlerin yüzeye çıkmasına izin vermemek için, 200 μL adipositleri görüntüleme slaytındaki ara parçaya yerleştirmek için kesilmiş bir p35 pipet ucu kullanın.
- Ara parçanın üzerine bir kapak fişi yerleştirin.
- Hemen görüntülemeye devam edin (Şekil 6C). Görüntülemedeki bir gecikme, zar işaretleyicisinin kanamasına neden olabilir.
Sonuçlar
Şekil 2'de gösterildiği gibi, uygun kıyma (Şekil 2B) ve sindirim (Şekil 2C), sağlam olgun adipositlerin izolasyonu için önemlidir. Yetersiz kıyma ve yetersiz sindirim, bağ dokusundan yetersiz ayrılma nedeniyle düşük olgun adiposit verimine neden olabilir. Görsel olarak bu, kıyma işleminden sonra kalan lifli doku ve kollajenaz solüsyonunda görünür topaklar ile gözlemlenebilir. Ek olarak, aşırı kıyma ve aşırı sindirim, olgun adipositlerin patlaması nedeniyle düşük verime neden olur. Görsel olarak bu, beyaz opak tabakanın kaybına ve büyük, berrak, serbest bir lipit tabakasının birikmesine neden olur. Uygun olmayan kıyma veya sindirim seviyeleri, zayıf adiposit izolasyonuna neden olur.
Yağ dokusunun uygun şekilde hazırlanması ve sindirilmesi, Şekil 3'te görüldüğü gibi dokunun dört ayrı katmana ayrılmasıyla sonuçlanacaktır. Serbest lipitlerin salınmasına neden olan adipositlerin bir miktar patlaması kaçınılmazdır; Bununla birlikte, uygun kıyma ve sindirim, minimum adiposit yırtılmasını sağlayacaktır. Kalan serbest lipid tabakası ve ortam, adipositlerin paketlenmesi sırasında çıkarılacaktır (Şekil 4). Adipositlerin uygun şekilde paketlenmesi, olgun adipositlerin verimli izolasyonu için gereklidir. Kalan herhangi bir serbest lipit veya ortam, zayıf izolasyona neden olacak ve kaplama, lipoliz ve hücre görüntüleme gibi aşağı akış fonksiyonel tahlillerini olumsuz yönde etkileyecektir.
Bu protokol, olgun adipositlerin temiz bir şekilde hazırlanmasını sağlar. Hücre görüntüleme ve lipoliz deneyleri, hücresel fonksiyonu değerlendirmek ve olgun adipositlerin izolasyon sonrası ve kültürlemeden sonra iki haftaya kadar işlevini koruduğunu göstermek için yapılabilir. Lipoliz testi, olgun adipositlerin, β-3 adrenerjik reseptörün uyarılması üzerine serbest gliserol salınımı yoluyla hücresel sinyalleşmeye yanıt verme yeteneğini koruduğunu gösterir (Şekil 6A, B). Bu yetenek, kültürde 2 hafta sonra bile korunur ve 24 saat boyunca kültürlenen yağ dokusu eksplantlarının lipoliz aktivitesi ile oldukça karşılaştırılabilir (Şekil 6C, D). Düşük kaliteli adipositler zayıflamış lipoliz gösterecektir. İzole adipositlerin hücre görüntülemesi, tek bir büyük lipid damlacığı içeren yuvarlak ve sağlam uniloküler matür adipositleri gösterir. Düşük kaliteli adiposit izolasyonları, patlamış adipositlerin göstergesi olan esas olarak büyük, hücre dışı yağ damlacıkları gösterecektir.

Şekil 1: Yağ dokusu eksplantlarının gömülmesi. (A) Dokuyu gömmeden önce kısmen katılaşmış bazal membran matris kubbesinin görüntüsü. (B) Uygun olmayan ve uygun doku gömmenin temsili görüntüleri. Doku, kubbenin kısmen veya tamamen üzerinde yüzüyor gibi göründüğü için yanlış gömme görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 2: Yağ dokusunun uygun kıyma ve sindirim şeması. (A) Doku kıyma ve sindirim adımlarının şematik gösterimi 4.2-4.6. (B) Yetersiz, optimal ve aşırı kıyılmış dokunun temsili görüntüleri. Kıyılmış doku, orijinal şeklini koruyan büyük parçalara sahiptir. Aşırı kıyılmış doku, dokuyu çevreleyen serbest lipitlerde gözle görülür bir artışa neden olur, bu da berrak ve yağlı görünür. (C) Yetersiz, optimal ve aşırı sindirilmiş dokunun temsili görüntüleri. Yetersiz sindirilmiş doku, çözelti içinde kalan tüm doku parçalarını içerir. Aşırı sindirilmiş doku, çözeltiden hızla ayrılan büyük bir serbest lipit tabakası sergiler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3: Sindirilmiş yağ dokusu katmanlarının ayrılması. (A) Adım 5.3'ü takiben mevcut olan katmanların şematik ve temsili görüntüsü. (B) Olgun adiposit tabakasını 50 mL konik tüpten çıkarmak için kesilmiş bir pipet ucunun kullanılması. (C) Kültür ortamını olgun adiposit tabakasının altından çıkarmak için iğne ve şırınga için uygun teknik ve yerleştirme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 4: Olgun adipositlerin sıralı paketlenmesi. Olgun adipositlerin paketlenmesinin sıralı görüntüleri. Serbest lipitler, adipositler ve ortam katmanları etiketlenir. Her dönüşün ardından serbest lipitler ve ortamlar uzaklaştırılır. Bu, bir dönüşten sonra adipositlerden hiçbir ortam veya serbest lipit ayrılmayana kadar tekrarlanır. Son görüntü, iyi paketlenmiş olgun adipositlerin temsilcisidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Olgun adipositlerin kaplanması ve kültürlenmesi. (A) Olgun adipositlerin kaplamasının şeması. Kesilmiş bir p200 pipet ucu kullanılarak, paketlenmiş adipositler bir hücre kültürü ekinin zarına yerleştirilir. Ek daha sonra önceden doldurulmuş kültür ortamı kuyucuklarına ters çevrilir. (B) Kesilmiş pipet ucunu, adipositleri transwell eki üzerine bırakan kesilmiş pipet ucunu gösteren olgun adipositlerin kaplanmasının temsili bir görüntüsü. (C) Kuyucukların üstünden görüldüğü gibi, uygun şekilde paketlenmiş ve kötü paketlenmiş adipositlerin transkuyularla kaplanmış şemaları ve temsili görüntüleri. Düzgün paketlenmiş adipositler beyaz ve opak görünürken, zayıf paketlenmiş adipositler berrak lipid damlacıklarının oluşumuna neden olur. (D) Kültür ortamını değiştirmek için kullanılan tekniğin şeması. Ortamı transwell ekinin yan duvarındaki açıklıklardan dikkatlice çıkarmak için bir p200 pipet ucu kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
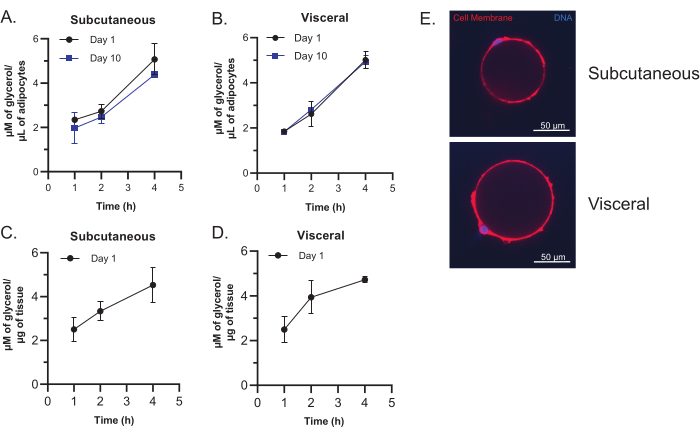
Şekil 6: Olgun adipositlerin görüntülenmesi ve lipoliz testi. (A,B) Deri altı (A) ve viseral (B) olgun adipositlerden gliserol salınımı. Adipositler, normal bir yemek diyeti ile beslenen 16 haftalık C57BL / 6 erkek farelerden izole edildi. 30 μL adiposit, adım 7.1'de tarif edildiği gibi kaplandı ve 1 veya 10 gün boyunca kültürlendi. Adipositler 1 saat, 2 saat ve 4 saat boyunca 5 μM CL-316,243 ile muamele edildi ve süpernatanlar toplandı ve serbest gliserol için analiz edildi. (C,D) Subkutan (C) ve viseral (D) yağ dokusu eksplantlarından gliserol salınımı. Normal bir yemek diyeti ile beslenen 18 haftalık C57BL / 6 dişi farelerden yağ dokusu izole edildi. 0.1 g yağ dokusu eksplantı, adım 3.1-3.4'te tarif edildiği gibi kaplandı ve 24 saat boyunca kültürlendi. Adipositler 1 saat, 2 saat ve 4 saat boyunca 5 μM CL-316,243 ile muamele edildi ve süpernatanlar toplandı ve serbest gliserol için analiz edildi. N = A-D için 3 teknik kopya. Tüm veriler ortalama ± standart sapmadır. (E) İzole edilmiş deri altı ve viseral olgun adipositlerin temsili görüntüleri. Adipositler, normal bir yemek diyeti ile beslenen 16 haftalık C57BL / 6J erkek farelerden izole edildi. Adipositler plazma membran boyası (kırmızı) ve Hoechst nucleus boyası (mavi) ile boyandı. Ölçek çubukları: 50 μm; Büyütme: 60x. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Seks | Perhiz | Depo | Kıyma zorluğu | Kollajenaz: Doku oranı | Önerilen sindirim süresi (dk) | Sıkma sıcaklığı. | Yıkama sıcaklığı. |
| Dişi | Normal yemek | Subkutan | Sert | 2:1 | 12 | RT | 37 °C |
| Visseral | Orta | 1:1 | 8 | RT | 37 °C | ||
| Yüksek yağlı diyet | Subkutan | Kolay | 1:1 | 8 | RT | 37 °C | |
| Visseral | Kolay | 1:1 | 8 | RT | 37 °C | ||
| Erkek | Normal yemek | Subkutan | Sert | 2:1 | 14 | 4 °C | RT |
| Visseral | Orta | 1:1 | 10 | 4 °C | RT | ||
| Yüksek yağlı diyet | Subkutan | Kolay | 1:1 | 10 | 4 °C | RT | |
| Visseral | Kolay | 1:1 | 10 | 4 °C | RT |
Tablo 1: Cinsiyet, depo ve diyete özgü değişiklikler. Diğer depolara göre "Kolay", "Orta" veya "Sert" olarak tanımlanan her dokunun kıyma zorluğu. Gerçek kıyma süresinin araştırmacıya ve dokuya bağlı olarak değişeceğini unutmayın. Kollajenaz: Adım 4.1'de hazırlanan kollajenaz + DNaz çözeltisinin hacim (mL) olarak listelenen doku oranı, doku ağırlığına (g) eşittir. Sindirim süresi yaklaşık bir tahmindir, ancak gerçek sindirim süresi kıyma ve dokuya göre değişecektir. Araştırmacılar sindirimi protokolde açıklandığı gibi değerlendirmelidir. Sıkma sıcaklığı ve yıkama sıcaklığı erkek ve dişi fareler arasında farklılık gösterir. RT oda sıcaklığını gösterir.
Tartışmalar
Primer adipositlerin izole edilmesi ve kültürlenmesi çok zordur, çünkü kolayca yırtılırlar ve büyük boyutları, akış sitometrisi gibi yaygın primer hücre izolasyon araçlarının kullanımını engeller. Burada açıklanan protokol, çeşitli aşağı akış uygulamaları için kullanılabilen temiz ve işlevsel olgun adipositler verir. Daha da önemlisi, bu protokol, olgun adipositlerin diğer hücresel kalıntılardan ve serbest lipid tabakasından ayrılmasına izin vererek etkili görüntüleme, kültürleme ve lipoliz testlerine izin verir. Protokol, stromal vasküler fraksiyon ve APC'lerin izolasyonu için yayınlanmış protokoller22,23 ile kolayca birleştirilebilir. Bu protokol ayrıca, lipoliz testleri ve tüm yağ dokusundan salgılanan faktörlerin toplanması gibi sonraki uygulamalar için kullanılabilen yağ dokusundan tüm doku eksplantlarının hazırlanması ve kültürlenmesi için bir prosedürü detaylandırır.
Kritik hususlar arasında uygun kıyma, sindirim ve serbest lipid tabakasının çıkarılması yer alır. Düzgün kıymayı sağlamak için, işlem boyunca dokunun görsel görünümünü yakından izlemek önemlidir. Dokunun optimal bir kıymasını elde etmek için gereken zaman ve çaba, yağ dokusu deposuna, diyet müdahalelerine (yüksek yağlı diyet gibi) ve araştırmacıya bağlı olarak değişecektir. Gerekirse makas gibi diğer kıyma araçları dahil edilebilir, ancak bu burada araştırılmamıştır. Unutulmamalıdır ki, aşırı kıymadan kaçınılmalıdır, çünkü adipositleri yırtacaktır, bu sadece anında verimi azaltmakla kalmaz, aynı zamanda serbest lipid tabakasının kalan adipositler üzerindeki zararlı etkisinden dolayı toplam verimi ve adiposit kalitesini de azaltır. Uygun bir kıymaya benzer şekilde uygun sindirim, yağ dokusu deposuna, diyet müdahalelerine, farelerin yaşına vb. bağlı olacaktır. DNazın kollajenaza eklenmesi, hücresel kalıntılardan kaynaklanabilecek sindirim sırasında adipositlerin toplanmasını önlemeye yardımcı olur. Bu nedenle dokuların sindirim süresi oldukça değişkendir. Sindirim süreleri için sağlanan tahminler, Tablo 1'de bulunabilecek bir kılavuz görevi görür.Bununla birlikte, dokuların düzgün bir şekilde sindirilmesini sağlamanın en iyi yolu, dokuyu süreç boyunca ve protokolde açıklandığı gibi görsel olarak incelemektir. Cinsiyete dayalı olarak önerilen Tablo 1'de ayrıntıları verilen farklı santrifüjleme ve yıkama sıcaklıkları, olgun adipositlerin hem serbest lipid tabakasından hem de diğer hücresel kalıntılardan ve SVF'den uygun şekilde ayrılması için gereklidir; Alternatif sıcaklıkların kullanılması, agregasyon ve adiposit patlaması nedeniyle olgun adipositlerin kaybına neden olabilir.
Her adımda serbest lipid tabakasının çıkarılması kritik öneme sahiptir ve bunun yapılmaması, kaplama, görüntüleme ve lipoliz testi için aşağı akış komplikasyonları ortaya çıkaracaktır. Ayrıca, prosedür boyunca serbest lipid tabakasının sürekli varlığı, lipotoksisiteye bağlı olarak ek adiposit ölümüne neden olacak ve genel verim ve kaliteyi önemli ölçüde etkileyecektir. Olgun adiposit izolasyonunun etkinliğini en üst düzeye çıkarmak genellikle arzu edilirken, bazı olgun adipositlerin pahasına bile olsa serbest lipid tabakasının çıkarılması, protokolün sonunda olgun adiposit veriminde genel bir artışa neden olacaktır.
Prosedürün sınırlamaları numune sayısını içerir. Ortamın ve serbest lipid tabakasının çıkarılması tarafından tüketilen titizlik ve zaman nedeniyle, prosedür genellikle bir seferde altı numune ile sınırlıdır. Önemli ölçüde daha fazla numunenin işlenmesi, birincil adipositlerin çok uzun süre serbest lipitlere maruz kalmasına ve toplam verimin düşmesine neden olacaktır. Bununla birlikte, ek personel numune sayısında bir artışa izin verebilir. Kıyma işleminden fonksiyonel teste kadar geçen süre kritiktir, çünkü besiyerinin ve serbest lipid tabakasının çıkarılmasındaki aşırı gecikmeler ek olgun adiposit patlamasına neden olur. Protokol, olgun adipositlerin alt popülasyonlarını ayırma yeteneğinde daha da sınırlıdır.
Olgun adipositleri incelemek için mevcut yöntemler öncelikle APC'lerin izolasyonuna ve ardından bu hücrelerin ex vivo farklılaşmasına dayanır. Çip üzerinde organ modeli ve trans kuyu ko-kültürleri dahil olmak üzere ek yöntemler geliştirilmeye başlanmıştır18,24. Bununla birlikte, bu ex vivo farklılaşmış adipositlerin, yağ dokusundaki olgun adipositlerden transkripsiyonel ve morfolojik olarak farklı olduğu gösterilmiştir17. Morfolojik olarak, ex vivo diferansiye adipositler multiloküler, in vivo izole adipositler ise unilokülerdir. Bu protokol, en az 5 g yağ dokusu gerektiren diğer protokollere kıyasla 0,5 g yağ dokusundan olgun adipositleri başarılı bir şekilde izole etmek ve kültürlemek için önceki raporlara17,25 göre modifiye edilmiş ve optimize edilmiştir25 . Son olarak, bu çalışma, kılavuzlar Tablo 1'de yer alsa da, somut süreler, santrifüjleme sıcaklıkları ve kollajenaz miktarları yerine protokoldeki temel adımların başarılı bir şekilde tamamlandığını görsel olarak göstermeyi amaçlamıştır. Bu parametrelerin, yağ dokusu deposu, cinsiyeti ve hayvanın yağlanması gibi faktörlere göre ayarlanması gerekir ve bunların tümü, bu protokolde olgun adipositlerin sindiriminin verimliliğini ve temiz bir şekilde ayrılmasını etkileyebilir.
Toplamda, prosedür, toplanan fare sayısına ve bireysel yağ dokusu örneklerinin sayısına bağlı olarak 3-4 saat sürer. Olgun adipositlerin fonksiyonel rolünü kültürleme ve değerlendirme yeteneğinin, adiposit biyolojisinin kendisinin (örneğin, metabolizma, besin kullanımı ve izleme) ve adipositlerin APC'ler, kanser hücreleri ve bağışıklık sistemi hücreleri gibi diğer hücre tipleriyle etkileşiminin incelenmesi için birçok alt uygulamayı mümkün kılması beklenmektedir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yazarlar, 5 For The Fight ve Huntsman Kanser Enstitüsü (KIH), V Kanser Araştırmaları Vakfı (KIH) ve DK133455'dan (KIH) hibe desteğine teşekkür etmek istemektedir. Biorender ile oluşturulan protokolün şemaları. Ek olarak, yazarlar görüntüleme yardımı için Stephanie Giagnocavo'ya ve Utah Üniversitesi'ndeki Hücre Görüntüleme Çekirdeği'ne ve el yazması hakkında geri bildirim için Mark Lee'ye teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100x Poloxamer 188 solution | Sigma | P5556-100mL | |
| 15 mL conical | Cellstar | 188261 | |
| 21 G Needle | BD | 305165 | |
| 5 mL Syringe | BD | 309646 | |
| 50 mL Conical | Cellstar | 227261 | |
| 6.5 mm Transwell with 0.4 µm Pore Polycarbonate Membrane Insert | Corning | 3413 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7906-100G | |
| CaCl2 | Sigma | C1016-500gm | |
| CellMask Plasma Membrane Stains | Thermo Fisher Scientific | C10045 | |
| CL 316243 disodium salt | Tocris | 1499 | |
| Collagenase Powder | Sigma | C6885 | |
| DMEM | Gibco | 11995-040 | |
| DMEM no pheonol Red | Gibco | A14430-01 | |
| DNase I | Sigma-Aldrich | 10104159001 | |
| Fetal Bovine Serum (FBS) | Gibco | A56708-01 | |
| Fisherbrand Tissue Path Superfrost Plus Gold Slides | Fisher scientific | 1518848 | |
| Gel Loading Pipet Tip | Fisher scientific | 02-707-181 | |
| GlutaMAX Supplement | Gibco | 35050061 | |
| Glycerol Assay Kit | Abcam | AB133130 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco | 14025-092 | |
| HEPES Buffer | Sigma | 83264-100ml-F | |
| Heraeus Megafuge 16R Centrifuge | Thermo Scientific | 75004271 | |
| Hoechst 33342 Solution | Thermo Fisher Scientific | 62249 | |
| Incubating Mini Shaker | VWR | 12620-942 | |
| Medium 199 | Sigma-Aldrich | M4530 | |
| Microscope Cover Glasses | VWR | 16004-302 | |
| PBS | Gibco | 10010023 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | |
| SecureSeal Imaging Spacers | Grace Biolabs | 654006 | |
| Seive (SteeL Fine Mesh Cocktail Strainer) | OXO | 3112000 | https://www.oxo.com/steel-fine-mesh-cocktail-strainer-660.html |
Referanslar
- Ward, Z. J., et al. Projected U.S. state-level prevalence of adult obesity and severe obesity. N Engl J Med. 381 (25), 2440-2450 (2019).
- Vishvanath, L., Gupta, R. K. Contribution of adipogenesis to healthy adipose tissue expansion in obesity. J Clin Invest. 129 (10), 4022-4031 (2019).
- Longo, M., et al. Adipose tissue dysfunction as determinant of obesity-associated metabolic complications. Int J Mol Sci. 20 (9), 2358 (2019).
- Funcke, J. B., Scherer, P. E. Beyond adiponectin and leptin: Adipose tissue-derived mediators of inter-organ communication. J Lipid Res. 60 (10), 1648-1684 (2019).
- Johnston, E. K., Abbott, R. D. Adipose tissue paracrine-, autocrine-, and matrix-dependent signaling during the development and progression of obesity. Cells. 12 (3), 407 (2023).
- Koenen, M., Hill, M. A., Cohen, P., Sowers, J. R. Obesity, adipose tissue and vascular dysfunction. Circ Res. 128 (7), 951-968 (2021).
- Liu, P., et al. Transcriptomic and lipidomic profiling of subcutaneous and visceral adipose tissues in 15 vertebrates. Sci Data. 10 (1), 453 (2023).
- Wu, Y., Li, X., Li, Q., Cheng, C., Zheng, L. Adipose tissue-to-breast cancer crosstalk: Comprehensive insights. Biochim Biophys Acta Rev Cancer. 1877 (5), 188800 (2022).
- Emont, M. P., et al. A single-cell atlas of human and mouse white adipose tissue. Nature. 603 (7903), 926-933 (2022).
- Nahmgoong, H., et al. Distinct properties of adipose stem cell subpopulations determine fat depot-specific characteristics. Cell Metab. 34 (3), 458-472.e6 (2022).
- Hildreth, A. D., et al. Single-cell sequencing of human white adipose tissue identifies new cell states in health and obesity. Nat Immunol. 22 (5), 639-653 (2021).
- Maniyadath, B., Zhang, Q., Gupta, R. K., Mandrup, S. Adipose tissue at single-cell resolution. Cell Metab. 35 (3), 386-413 (2023).
- Gao, Y., et al. Adipocytes promote breast tumorigenesis through taz-dependent secretion of resistin. Proc Natl Acad Sci U S A. 117 (52), 33295-33304 (2020).
- Cornide-Petronio, M. E., Jimenez-Castro, M. B., Gracia-Sancho, J., Peralta, C. New insights into the liver-visceral adipose axis during hepatic resection and liver transplantation. Cells. 8 (9), 1100 (2019).
- Verma, S., et al. Zinc-alpha-2-glycoprotein secreted by triple-negative breast cancer promotes peritumoral fibrosis. Cancer Res Commun. 4 (7), 1655-1666 (2024).
- Min, S. Y., et al. Diverse repertoire of human adipocyte subtypes develops from transcriptionally distinct mesenchymal progenitor cells. Proc Natl Acad Sci U S A. 116 (36), 17970-17979 (2019).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Rep. 27 (1), 213-225.e5 (2019).
- Chaurasiya, V., et al. Human visceral adipose tissue microvascular endothelial cell isolation and establishment of co-culture with white adipocytes to analyze cell-cell communication. Exp Cell Res. 433 (2), 113819 (2023).
- Galmozzi, A., Kok, B. P., Saez, E. Isolation and differentiation of primary white and brown pre-adipocytes from newborn mice. J Vis Exp. 167, e62005 (2021).
- Farrar, J. S., Martin, R. K. Isolation of the stromal vascular fraction from adipose tissue and subsequent differentiation into white or beige adipocytes. Methods Mol Biol. 2455, 103-115 (2022).
- You, X., Gao, J., Yao, Y. Advanced methods to mechanically isolate stromal vascular fraction: A concise review. Regen Ther. 27, 120-125 (2024).
- Liu, Q., et al. Progenitor cell isolation from mouse epididymal adipose tissue and sequencing library construction. STAR Protoc. 4 (4), 102703 (2023).
- Cho, D. S., Doles, J. D. Preparation of adipose progenitor cells from mouse epididymal adipose tissues. J Vis Exp. 162, e61694 (2020).
- Lauschke, V. M., Hagberg, C. E. Next-generation human adipose tissue culture methods. Curr Opin Genet Dev. 80, 102057 (2023).
- Alexandersson, I., Harms, M. J., Boucher, J. Isolation and culture of human mature adipocytes using membrane mature adipocyte aggregate cultures (MAAC). J Vis Exp. 156, e60485 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır