Gram Staining of Bacteria from Environmental Sources
Source: Laboratories of Dr. Ian Pepper and Dr. Charles Gerba - The University of Arizona
Demonstrating Author: Luisa Ikner
The spectrum of research in environmental microbiology is broad in scope and application potential. Whether the work is bench-scale with known bacterial isolates, or in the field collecting soil or water samples containing unknown bacterial isolates, the ability to quickly and visually discern culturable populations of interest remains of great import to environmental microbiologists even today with the abundance of molecular techniques available for use. This video will demonstrate one such technique, known as Gram staining.
1. Sample Collection
- Collect soil sample and transport to the laboratory for microbial analysis.
- In the lab, weigh a 10 g sample using an analytical balance.
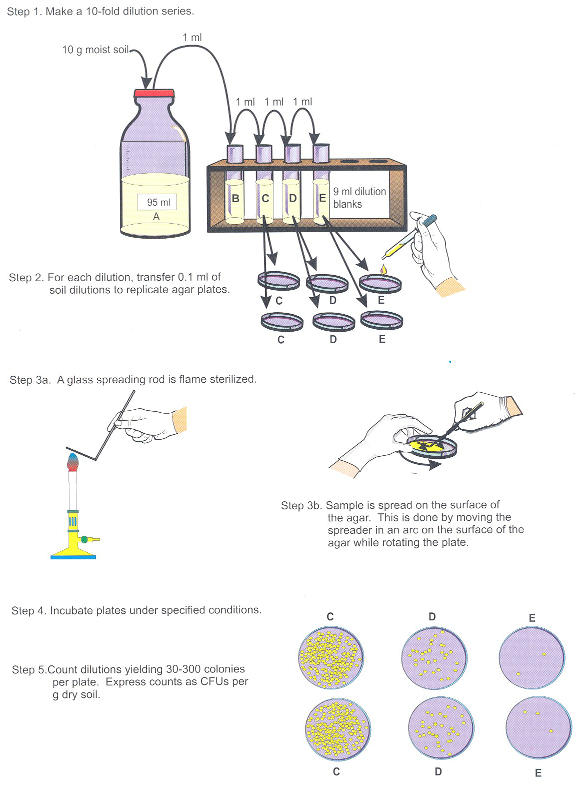
- Dilute the sample 1:10 into 95 mL of phosphate-buffered saline (10 parts soil is equivalent to 5 parts aqueous liquid), and vortex to mix (Figure 2, Step 1).
- Perform subsequent 1:10 dilutions up to at least 10-5 g soil per mL, and spread-plate selected dilutions in replicates of two or three onto
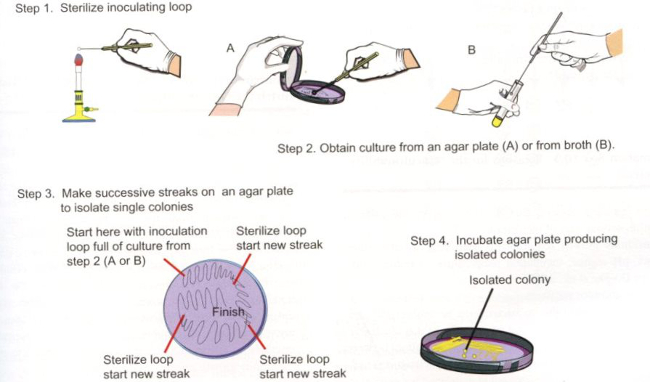
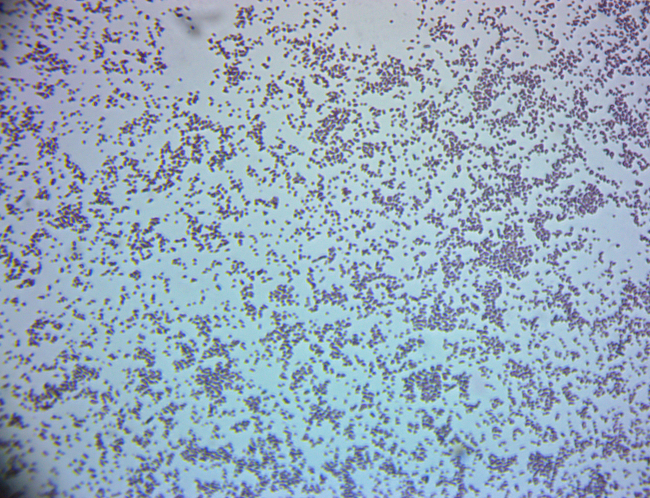
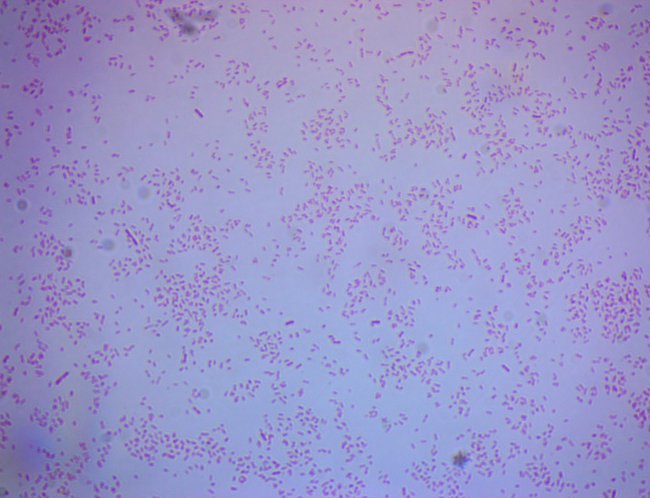
The Gram stain is used in the many sub-fields of both environmental and clinical microbiology. Water quality scientists may use the Gram stain as a confirmatory tool for the detection of fecal bacteria in water samples. Bacterial isolates from soils are Gram stained in order to further characterize culturable soil communities. For environmental microbiologists, Gram stain aids in the categorization of bacterial populations according to cell wall structure. This, in turn, provides information about the general ability of
Skip to...
Videos from this collection:

Now Playing
Gram Staining of Bacteria from Environmental Sources
Environmental Microbiology
99.2K Views

Determinazione del contenuto di umidità del suolo
Environmental Microbiology
358.2K Views

Tecnica asettica nelle scienze ambientali
Environmental Microbiology
125.7K Views

Visualizzazione dei microrganismi del suolo tramite il test su vetrino a contatto e microscopia
Environmental Microbiology
42.0K Views

Funghi filamentosi
Environmental Microbiology
56.8K Views

Estrazione del DNA di comunità da colonie batteriche
Environmental Microbiology
28.7K Views

Rilevamento dei microrganismi ambientali tramite PCR ed elettroforesi su gel
Environmental Microbiology
44.4K Views

Analisi dell'RNA di campioni ambientali mediante RT-PCR
Environmental Microbiology
40.2K Views

Quantificazione di microrganismi e virus ambientali mediante qPCR
Environmental Microbiology
47.7K Views

Analisi della qualità dell'acqua tramite organismi indicatori
Environmental Microbiology
29.3K Views

Isolamento di batteri fecali da campioni d'acqua mediante filtrazione
Environmental Microbiology
39.1K Views

Rilevamento di batteriofagi in campioni di matrici ambientali
Environmental Microbiology
40.5K Views

Coltura e conta di batteri da campioni di suolo
Environmental Microbiology
183.3K Views

Analisi della curva di crescita batterica e sue applicazioni ambientali
Environmental Microbiology
295.3K Views

Enumerazione delle alghe tramite metodo di coltivazione
Environmental Microbiology
13.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved