13.3 : قانون التركيز والمعدّل
يتأثر معدل التفاعل بتركيزات المواد المتفاعلة. قوانين المعدل (قوانين المعدل التفاضلي) أو معادلات المعدل هي تعبيرات رياضية تصف العلاقة بين معدل التفاعل الكيميائي وتركيز المواد المتفاعلة.
على سبيل المثال ، في تفاعل عام aA + bB ⟶ المنتجات ، حيث تكونa and b معاملات متكافئة ، يمكن كتابة قانون المعدل على النحو التالي:
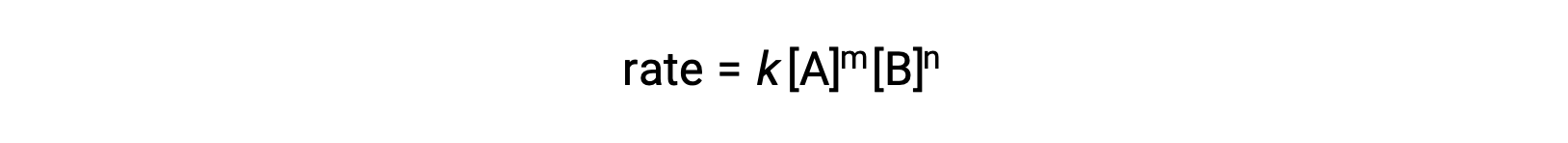
[A] و [B] يمثلان التركيزات المولية للمواد المتفاعلة ، و k هو ثابت المعدل ، وهو خاص بتفاعل معين عند درجة حرارة معينة.
الأُسّان m و n عبارة عن أوامر رد فعل وعادة ما تكون أعدادًا صحيحة موجبة ، على الرغم من أنها يمكن أن تكون كسورًا أو سالبة أو صفرًا.
يتم تحديد ثابت المعدل k وأوامر التفاعل m و n بشكل تجريبي من خلال ملاحظة كيفية تغير معدل التفاعل كتركيزات من المتفاعلات تغيرت. ثابت المعدل k مستقل عن تراكيز المادة المتفاعلة ، لكنه يختلف باختلاف درجة الحرارة.
تصف أوامر التفاعل في قانون المعدل الاعتماد الرياضي للمعدل على تركيزات المادة المتفاعلة. الإشارة إلى قانون المعدل العام (المعدل = k[A]m[B]n)، يكون التفاعل m ترتيبًا بالنسبة إلى A و n ترتيب بالنسبة إلى B. على سبيل المثال، إذا كان m = 1 و n = 2، يكون التفاعل من المرتبة الأولى في الترتيب A والثاني في B. الترتيب العام للتفاعل هو ببساطة مجموع أوامر كل متفاعل. بالنسبة لمثال قانون المعدل هنا ، يكون التفاعل من الدرجة الثالثة بشكل عام (1 + 2 = 3).
تتمثل إحدى الطرق التجريبية الشائعة لتحديد قوانين المعدل في طريقة المعدلات الأولية. تتضمن هذه الطريقة قياس معدلات التفاعل لتجارب تجريبية متعددة أجريت باستخدام تركيزات مختلفة من المتفاعلات الأولية. تسمح مقارنة المعدلات المقاسة لهذه التجارب بتحديد أوامر التفاعل ، وبالتالي ، ثابت المعدل ، اللذين يتم استخدامهما معًا لصياغة قانون معدل.
قد تعرض قوانين المعدل أوامر جزئية لبعض المواد المتفاعلة ، وأحيانًا يتم ملاحظة أوامر التفاعل السلبية عندما تؤدي الزيادة في تركيز أحد المتفاعلات إلى انخفاض معدل التفاعل. من المهم ملاحظة أن قوانين المعدل يتم تحديدها عن طريق التجربة فقط ولا يتم التنبؤ بها بشكل موثوق من خلال قياس العناصر المتفاعلة.
يحدد ترتيب التفاعل العلاقة بين معدل التفاعل وتركيز المواد المتفاعلة أو المنتجات.
في تفاعل صفري الترتيب، لا يكون لتركيز المواد المتفاعلة أي تأثير على معدل التفاعل ، الذي يظل ثابتًا طوال الوقت.
في تفاعل من الدرجة الأولى ، يتناسب معدل التفاعل بشكل مباشر وخطي مع التغير في تركيز المادة المتفاعلة. مع انخفاض تركيز المادة المتفاعلة ، ينخفض معدل التفاعل أيضًا بشكل متناسب.
في التفاعلات من الدرجة الثانية أو الأعلى ، يتناسب معدل التفاعل مع القيمة الأسية للمتفاعلات. لذلك ، مع تقدم التفاعل وانخفاض تركيز المواد المتفاعلة ، ينخفض معدل التفاعل بشكل كبير.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.3: Rate Laws.
From Chapter 13:

Now Playing
13.3 : قانون التركيز والمعدّل
Chemical Kinetics
30.2K Views

13.1 : معدّل التفاعل
Chemical Kinetics
51.4K Views

13.2 : قياس معدّلات التفاعل
Chemical Kinetics
24.7K Views

13.4 : تحديد ترتيب التفاعل
Chemical Kinetics
55.2K Views

13.5 : قانون المعدّل المتكامل: اعتماد التركيز على الوقت
Chemical Kinetics
34.6K Views

13.6 : نصف عمر التفاعل
Chemical Kinetics
34.4K Views

13.7 : نظية الاصطدام
Chemical Kinetics
81.2K Views

13.8 : مخطّطات أرهينيوس
Chemical Kinetics
38.7K Views

13.9 : آليات التفاعل
Chemical Kinetics
25.5K Views

13.10 : خطوات تحديد المعدّل
Chemical Kinetics
31.8K Views

13.11 : التحفيز
Chemical Kinetics
26.7K Views

13.12 : الانزيمات
Chemical Kinetics
80.8K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved