13.3 : Закон о концентрации и скорости
На скорость реакции влияют концентрации реагентов. Законы нормы (законы о дифференциальной скорости) или уравнения ставок — это математические выражения, описывающие соотношение между скоростью химической реакции и концентрацией ее реагенты.
Например, в общей реакции AA + BB ⟶ продукты, где a и b являются стехиометрическими коэффициентами, закон о ставке можно записать как:
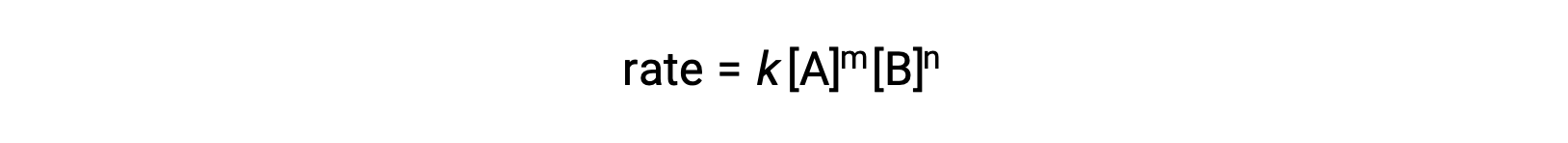
[A] и [B] представляют собой молярные концентрации реагенты, а k — константу скорости, которая характерна для конкретной реакции при определенной температуре.
Экспоненты m и n являются порядками реакции и обычно являются положительными целыми числами, хотя они могут быть дроби, отрицательными или нулевыми.
Константа скорости k и порядки реакции m и n определяются экспериментально путем наблюдения за изменением скорости реакции по мере изменения концентраций реагенты. Константа скорости k не зависит от концентраций реагент, но изменяется в зависимости от температуры.
В указаниях на реакцию в законе о ставке описывается математическая зависимость скорости от концентраций реагент. Ссылаясь на общий закон о ставке (Rate = k[A]m[B]n), реакция является порядком m относительно ПОРЯДКА A и n относительно B. например, если m = 1 и n = 2, Реакция является первой в порядке А и второй в B. Общий порядок реакции — это просто сумма ордеров для каждого реагент. Например, закон ставок здесь, реакция является третьим общим порядком (1 + 2 = 3).
Общий экспериментальный подход к определению норм внесения является методом начальных ставок. Этот метод включает в себя измерение скорости реакции для нескольких экспериментальных исследований, проведенных с использованием различных начальных концентраций реагент. Сравнение измеренных ставок для этих испытаний позволяет определить порядок действий и, впоследствии, константу ставок, которая вместе используется для формулирования закона ставок.
Законы о норме могут представлять дробные приказы для некоторых реагенты, а иногда при увеличении концентрации одного реагент происходит снижение скорости реакции. Важно отметить, что законы о частоте определяются только экспериментом и не могут быть надежно предсказаны стехиометрией реакции.
Порядок реакции определяет соотношение между скоростью реакции и концентрацией реагенты или продуктов.
•в реакции нулевого порядка концентрация реагенты не оказывает никакого влияния на скорость реакции, которая остается постоянной на протяжении всего процесса.
•в реакции первого порядка скорость реакции прямо и линейно пропорциональна изменению концентрации реагент. По мере снижения концентрации реагент скорость реакции также пропорционально уменьшается.
•в реакциях второго порядка или более высокого порядка скорость реакции пропорциональна экспоненциальному значению реагенты. Поэтому по мере развития реакции и снижения концентрации реагенты скорость реакции уменьшается экспоненциально.
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 12.3: Законы о тарифе.
Из главы 13:

Now Playing
13.3 : Закон о концентрации и скорости
Химическая кинетика
30.2K Просмотры

13.1 : Скорость реакции
Химическая кинетика
51.4K Просмотры

13.2 : Измерение скорости реакции
Химическая кинетика
24.6K Просмотры

13.4 : Определение порядка реакции
Химическая кинетика
55.2K Просмотры

13.5 : Закон интегрированной скорости: зависимость концентрации от времени
Химическая кинетика
34.6K Просмотры

13.6 : Период полураспада реакции
Химическая кинетика
34.4K Просмотры

13.7 : Зависимость температуры от скорости реакции
Химическая кинетика
81.2K Просмотры

13.8 : Графики Аррениуса
Химическая кинетика
38.7K Просмотры

13.9 : Механизмы реакции
Химическая кинетика
25.5K Просмотры

13.10 : Шаги, определяющие скорость
Химическая кинетика
31.8K Просмотры

13.11 : Катализ
Химическая кинетика
26.7K Просмотры

13.12 : Ферменты
Химическая кинетика
80.8K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены