13.3 : Concentrazione e legge cinetica
La velocità di una reazione è influenzata dalle concentrazioni di reagenti. Le leggi sui tassi (leggi differenziali dei tassi) o equazioni di velocità sono espressioni matematiche che descrivono la relazione tra la velocità di una reazione chimica e la concentrazione dei suoi reagenti.
Ad esempio, in una reazione generica aA + bB ⟶ prodotti, dove a e b sono coefficienti stechiometrici, la legge del tasso può essere scritta come:
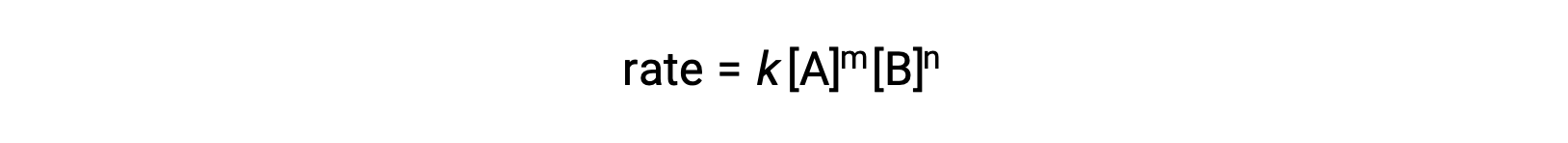
[A] e [B] rappresentano le concentrazioni molare dei reagenti, e k è la costante di velocità, che è specifica per una particolare reazione ad una temperatura specifica.
Gli esponenti m e n sono gli ordini di reazione e sono tipicamente interi positivi, anche se possono essere frazioni, negative o zero.
La costante di velocità k e gli ordini di reazione m e n sono determinati sperimentalmente osservando come cambia la velocità di una reazione man mano che cambiano le concentrazioni dei reagenti. La costante di velocità k è indipendente dalle concentrazioni reagenti, ma varia con la temperatura.
Gli ordini di reazione in una legge sui tassi descrivono la dipendenza matematica del tasso dalle concentrazioni reagenti. Riferendosi alla legge generica sui tassi (tasso = k[A]m[B]n), la reazione è m ordine rispetto all'ordine A e n rispetto a B. Per esempio, se m = 1 e n = 2, la reazione è di primo ordine in A e secondo ordine in B. L'ordine di reazione complessivo è semplicemente la somma degli ordini per ogni reagente. Per la legge sui tassi di esempio qui, la reazione è il terzo ordine complessivo (1 + 2 = 3).
Un approccio sperimentale comune alla determinazione delle leggi sui tassi è il metodo dei tassi iniziali. Questo metodo prevede la misurazione delle velocità di reazione per più prove sperimentali effettuate utilizzando diverse concentrazioni iniziali di reagenti. Il confronto dei tassi misurati per queste prove consente di determinare gli ordini di reazione e, successivamente, la costante di velocità, che insieme vengono utilizzati per formulare una legge sui tassi.
Le leggi sui tassi possono mostrare ordini frazionari per alcuni reagenti, e gli ordini di reazione negativa sono talvolta osservati quando un aumento della concentrazione di un reagente causa una diminuzione della velocità di reazione. È importante notare che le leggi sui tassi sono determinate solo dall'esperimento e non sono previste in modo affidabile dalla stechiometria di reazione.
L'ordine di reazione determina la relazione tra la velocità di reazione e la concentrazione di reagenti o prodotti.
• In una reazione di ordine zero, la concentrazione dei reagenti non ha alcun effetto sulla velocità della reazione, che rimane costante per tutto il tempo.
• In una reazione di primo ordine, la velocità di reazione è direttamente e linearmente proporzionale alla variazione della concentrazione reagente. Man mano che la concentrazione del reagente diminuisce, anche la velocità di reazione diminuisce proporzionalmente.
• Nelle reazioni di secondo ordine o di ordine superiore, la velocità di reazione è proporzionale al valore esponenziale dei reagenti. Pertanto, man mano che la reazione progredisce e la concentrazione dei reagenti diminuisce, la velocità di reazione diminuisce esponenzialmente.
Questo testo è adattato da Openstax, Chemistry 2e, Section 12.3: Rate Laws.
Dal capitolo 13:

Now Playing
13.3 : Concentrazione e legge cinetica
Cinetica chimica
30.2K Visualizzazioni

13.1 : Velocità di reazione
Cinetica chimica
51.5K Visualizzazioni

13.2 : Misurazione della velocità di reazione
Cinetica chimica
24.7K Visualizzazioni

13.4 : Determinazione dell'ordine di reazione
Cinetica chimica
55.2K Visualizzazioni

13.5 : Integrazione della legge cinetica: la dipendenza della concentrazione dal tempo
Cinetica chimica
34.6K Visualizzazioni

13.6 : Emivita di una reazione
Cinetica chimica
34.5K Visualizzazioni

13.7 : Dipendenza dalla temperatura dalla velocità di reazione
Cinetica chimica
81.2K Visualizzazioni

13.8 : Diagramma di Arrhenius
Cinetica chimica
38.7K Visualizzazioni

13.9 : Meccanismi di reazione
Cinetica chimica
25.5K Visualizzazioni

13.10 : Fasi di determinazione della velocità
Cinetica chimica
31.8K Visualizzazioni

13.11 : Catalisi
Cinetica chimica
26.7K Visualizzazioni

13.12 : Enzimi
Cinetica chimica
80.9K Visualizzazioni