Method Article
الكبار والعضلات والهيكل العظمي الجنينية Microexplant الثقافة وعزل خلايا جذعية عضلية هيكلية
In This Article
Summary
الجزئي تشريح تقنية explants هو أسلوب قوي وموثوق بها من أجل عزل التكاثري خلايا عضلات الهيكل العظمي من العضلات ، والأحداث أو البالغين الجنينية كمصدر للخلايا الجذعية العظمية العضلية. فريد ، كانت هذه الخلايا المشتقة clonally الهيكل العظمي لإنتاج خطوط الخلايا الجذعية العضلية تستخدم لزرع في الجسم الحي.
Abstract
مثقف من الاجنة والبالغين خلايا عضلات الهيكل العظمي لديها عدد من الاستخدامات المختلفة. الجزئي تشريح explants تقنية وصفها في هذا الفصل هو وسيلة قوية وموثوق بها من أجل عزل أعداد كبيرة نسبيا من التكاثري خلايا عضلات الهيكل العظمي من العضلات ، والأحداث أو البالغين الجنينية كمصدر للخلايا الجذعية العظمية العضلية. وقد استخدم واضعو الدقيقة تشريح الثقافات يزدرع لتحليل خصائص نمو خلايا العضلات والهيكل العظمي في العضلات من النوع البري والتصنع. كل واحد من مكونات نمو الأنسجة ، يمكن تحليل بقاء الخلية وهي الانتشار ، الشيخوخة والتمايز بشكل منفصل باستخدام الأساليب المذكورة هنا. يمكن تأسيس الأثر الصافي لجميع عناصر النمو من خلال وسائل لقياس معدلات نمو ازدراع. ويمكن استخدام أسلوب الدقيقة يزدرع لإنشاء الثقافات الأساسي من مجموعة واسعة من أنواع مختلفة من العضلات والأعمار ، وكما هو موضح هنا ، وقد تم تكييفه من قبل المؤلفين لتمكين عزلة الجنينية السلائف العضلات والهيكل العظمي.
فريد ، استخدمت الدقيقة يزدرع الثقافات لاشتقاق نسيلي (أصل واحد الخلية) الهيكل العظمي الخلايا الجذعية العضلية (SMSC) خطوط التي يمكن توسيعها واستخدامها في عمليات زرع في الجسم الحي. زرعها في الجسم الحي SMSC تتصرف على النحو الوظيفي ، وأنسجة معينة ، والخلايا الأقمار الصناعية التي تسهم في تجديد عضلة الهيكل العظمي ولكن الألياف التي يتم الاحتفاظ أيضا (في محراب الخلية الأقمار الصناعية) ، ومجموعة صغيرة من الخلايا الجذعية غير المتمايزة التي يمكن إعادة معزولة في الثقافة باستخدام أسلوب الدقيقة ازدراع.
Protocol
ويمكن استخدام نهجين لعزل خلايا عضلات الهيكل العظمي التكاثري. في الأنسجة العضلية الأولى هي هضم إنزيمي لعزل الخلايا واحد من قبل الطلاء 1. الأسلوب الثاني هو يزدرع قطعة من النسيج العضلي في الثقافة للسماح للخلايا أن تنمو من خلال الاحتضان 2 ، 3. ووصف الطريقة الثانية في هذا البروتوكول. زراعة الأنسجة نفسها له جذوره في الثقافة ازدراع. كان العام 2007 في الذكرى 100 للتجارب الكلاسيكية هاريسون الذي حصل على الخلايا العصبية التي يحتضنها الامتداد explants العصبية في اعدام 4 قطرات من الليمفاوية. وقد استخدمت تقنيات يزدرع الثقافة وصقلها في مجموعة متنوعة من السياقات المختلفة في السنوات التي تلت ذلك 100 كوسيلة لتوليد الثقافات الأولية التكاثري الكبار والخلايا الجنينية 4 ، 5. المبدأ الكامن وراء هذه التقنية يزدرع ، ومع ذلك ، لا يزال هو نفسه ، للحد من الصدمات من العزلة الخلية الأولية من خلال الحفاظ على البنية الثلاثية الأبعاد للأنسجة الأم أثناء المراحل المبكرة الحاسمة للنمو الخلايا في الوقت الذي توفر الخلايا تعدى مع الاعلامية الغذائية الغنية تتكاثر فيه. في العضلات والهيكل العظمي هناك ميزة إضافية للاستخدام الثقافة يزدرع لأن فعل تقطيع الأنسجة العضلية الصدمة يحاكي العضلات الألياف ، وعلى الزناد المعتاد لتنشيط الخلايا الأقمار الصناعية ، والهجرة وانتشار 3 و 6. الكبار الفضائية العضلات والهيكل العظمي خلايا (وتسمى أيضا myoblasts) هي الخلايا الجذعية التكاثري السكان المسؤولين عن إصلاح الألياف العضلية ونمو يصل إلى 7.
explants تقليد العضلات والهيكل العظمي وبالتالي في البيئة الحية لتجديد وتنشيط عضلة الساق الهجرة الخلية والانقسام. في الجنين ، فإن غالبية الهيكل العظمي والعضلات الفقارية (الجذع والأطراف العضلات) مستمد من somites ، على الرغم من somitomeres والأقواس خيشومي تؤدي إلى عضلات الرأس 8 و 9. ويمكن التعرف على myotome كما مجموعتين متميزتين من Myf - 5 معربا عن الخلايا الجذعية الموجودة في حواف الظهرية ، الإنسي والجانبية للالجسيدة التفريق ، على التوالي. على التوالي ، وهذه الخلايا تولد العضلات فوق المحور الخلفي ، والتي تفرق في الموقع ، والعضلات البطنية والجانبية تحت المحور (الأطراف والبطن وعضلات الجهاز التنفسي) والتي تتطلب هجرة الخلايا الجذعية العضلية من الجسيدة 10. الخلايا الجذعية الجنينية الهجرة العضلات هو تحت سيطرة باكس 3 11. Myf - 5 التعبير أمر أساسي لإنشاء عضلات الجنينية واستمرت هذه الأهمية الى العضلات بعد الولادة حيث يعيش أكثر من 98 ٪ من الخلايا الأقمار الصناعية يمكنهم التعبير عن Myf - 5 12. Myf - 5 ولذلك فإن علامة محددة وموثوق بها من تكاثر السكان العضلات والهيكل العظمي الخلايا الجذعية في أنسجة البالغين والجنينية. يمكن عزل الخلايا الجنينية الجذعية العضلية (وتسمى أيضا أسلاف الخلايا في العضلات ، والعضلات والهيكل العظمي السلائف ، myoblasts أو الخلايا الجنينية حتى الأقمار الصناعية) من somites من أجنة الفئران ، فرخ الضفدع والمرحلة المبكرة من 13. من اجل عزل الثقافات المنشأ العضلي من عضلات الهيكل العظمي للأجنة الجنينية من كبار السن واضعي تكيفت هذه التقنية لازدراع microdissected الأنسجة الجنينية. ويستخدم نهج مماثل من قبل وآخرون كوسو (14). السكان لتوليد الخلايا نسيلي من 14 الجسيدة الجنينية.
1. في خلية ثقافة المختبر من خلايا جذعية عضلية هيكلية (SMSC)
SMSC خطوط خلية خلية واحدة من أصل والتي استمدت من المرحلة الابتدائية clonally الهيكل العظمي الثقافات يزدرع العضلات. يمكن تربيتها أنهم باستخدام معيار منهجية زراعة الأنسجة إذا لم يتم اتخاذ العناية الكافية. وارتفعت درجة حرارة علما أنه ما لم يرد خلاف ذلك ، يتم تنفيذ جميع التلاعبات صفها تحت ظروف معقمة باستخدام غطاء تدفق الصفحي (الفئة 1 أو الفئة 2 العقيمة مجلس الوزراء) وجميع الكواشف الثقافة إلى 37 درجة مئوية في حمام الماء قبل استخدامه.
- لجلب SMSC من تخزين النتروجين السائل (أنظر القسم 1.2 لتجميد أسفل طريقة) يجب إذابة cryovials بسرعة ونقلها إلى محتويات prewarmed 5 مل (37 درجة مئوية) مستنبت DF10 الطرد المركزي على الفور (ز 1000 لمدة 3 دقائق) لإزالة DMSO . أفضل طريقة لتحسن الخلايا عن طريق تكرار pipetting كميات صغيرة من مستنبت قبل تحسنت في القنينة قبل ان ينتقل الى أنبوب الطرد المركزي. وينبغي إجراء عملية ذوبان الخلايا بسرعة جدا لأن الخلايا تحتوي cryopreserved DMSO 10 ٪ التي هي سامة على الخلايا في درجة حرارة الغرفة (LD50 حوالي 2 دقيقة).
- الطرد المركزي التالي هو إزالة طاف ويتم غسل الخلايا من خلال إعادة تعليق الخلية بيليه في 5 مل مزيد DF10 ، ثم الطرد المركزي كما كان من قبل.
- يتم نقل الخلية المختلطة بيليه ثم للمرة الثانية مع 5 مل من DF10 وتعليق خلية صغيرة مما أدى إلى 25 سم 2 لقد ثقافة البلاستيكssel.
- تتم المحافظة على الثقافات عند 37 درجة مئوية في حاضنة مرطب يحتوي على 5 ٪ CO 2 في الجو. إلا إذا استخدمت السفن مع غطاء المصفاة ، يجب أن يكون غطاء القارورة خففت قليلا لعدة ساعات للسماح للهواء في سفينة الثقافة لكي تتوازن مع الحاضنة وتحمض المتوسط الثقافة. ويتم رصد الرقم الهيدروجيني للمتوسط عن طريق دمج الفينول الحموضة صبغة حمراء المؤشر إلى الوسط الثقافي.
- ويجب دائما أن تراقب إذابة الخلايا لمدة 24 ساعة بعد الطلاء وإعادة تغذيها مع المتوسط DF10 جديدة لضمان إزالة الحطام الخلية والسموم المتبقية (انظر الحواشي 1 و 2).
1.1. ثقافة فرعية
SMSC للخطوط الثابتة ، عندما تصل خلايا حوالي 95 ٪ التقاء ، ينبغي إزالتها من السفينة ثقافتهم ، المخفف ، ووضع في وعاء جديد لتمكين المزيد من النمو. ويمكن تحقيق هذا الإجراء فرعية عن طريق عدد من الإجراءات الأنزيمية مختلفة ، ويجري التربسين / EDTA الأكثر استخداما (انظر الملاحظة 3). ومن المعتاد (وجيد) لممارسة زراعة خلايا في الكثافة والتي تتطلب أن يكون subcultured لهم في اليوم الثالث للنمو. يمكن لمعظم خطوط الخلية SMS أن يتحقق هذا عن طريق تقسيم الخلايا 10/01 في كل ثقافة فرعية. يسمح هذا الرصد الدقيق للخلايا وتمكن أولئك الذين يؤدون وزراعة الأنسجة لتحديد السلوك غير عادية على الفور النمو (على سبيل المثال تحقيق نمو أسرع) والتي يمكن أن تشير إلى تغييرات المظهري إلى خط الخلية مثل التحول أو تخفيض في موت الخلايا المبرمج الناجمة عن التكيف مع الظروف الثقافة. بالإضافة إلى ذلك ، روتين ثابت ودقيق subculturing يقلل بشكل كبير من حدوث مثل هذه الأحداث.
- للثقافة فرعية باستخدام التربسين (trypsinisation) تتم إزالة السفن من الحاضنة والمتوسطة على التخلص منها بواسطة الطموح.
- ثم يتم غسلها مرتين مع الخلايا العقيمة الكالسيوم والمغنيسيوم خالية من الفوسفات مخزنة المالحة (PBS) ، و 10 مل في الغسيل ، وإزالة كل وقت عن طريق الشفط.
- أن يفرق بين الخلية أحادي الطبقة (25 مم 2 قارورة) 1 1 مل يضاف التربسين / EDTA واليسار على الخلايا في درجة حرارة الغرفة لدقائق حتى 3 2 الخلايا تبدأ في فصل (انظر الملاحظة 4). ويمكن ملاحظة هذا من قبل المستخدم من ذوي الخبرة والثقوب الصغيرة التي تشكل في المونولاير مبهمة بعض الشيء ، حين يقام القارورة إلى النور (انظر الملاحظة 5). في حين ينبغي trypsinised الخلايا وقتا كافيا لضمان تعليق خلية واحدة ، ينبغي الحرص على عدم إفرط في التعريض للنور لSMSC trypsinisation لأن هذا سيؤدي إلى مستويات عالية من موت الخلايا والتعلق الفقراء عند إعادة الخلايا مطلي.
- يضاف إلى وقف رد الفعل التربسين ، المحتوية على مصل المتوسطة (DF10) كحد أدنى من حجم 2 (أي ضعف حجم الحل التربسين). عندما subculturing على 25 مم 2 القارورة أنها مريحة لإضافة 9 مل DF10 في هذه المرحلة. ويمكن بعد ذلك تقسيم 1 / 10 من خلايا يتم بسهولة عن طريق تمييع 1 مل من تعليق الخلية الجديدة الناتجة إلى القارورة 25 مم 2 الثقافة جنبا إلى جنب مع مواصلة مل 9 المتوسطة DF10 الطازجة. ويمكن استخدام الخلايا المتبقية للتوسع الخلية (نقل إلى أحد أكبر سفينة) ، cryopreserved (انظر القسم 1.2) أو عدها ومطلي في أطباق التجريبية أو الآبار أو لوحات لفحوصات الانتشار والبقاء على قيد الحياة ، والتمايز ، والنمو عامل العلاج أو لأغراض أخرى (انظر أدناه).
1.2. الحفظ بالتبريد من خطوط الخلايا الأولية والثقافات
- لخلايا الحفظ بالتبريد وفصلها عن أحادي الطبقة من أجل ثقافة فرعية (القسم 3.1.1) ومكعبات بواسطة الطرد المركزي (3 دقائق في 1000 ز).
- تتم إزالة طاف بواسطة الطموح والخلايا بدقة وبسرعة إعادة علقت في 10 مل من تجميد المزيج باستمرار (DMSO 10 ٪ في DF10) قبل أن يتم إعادة مكعبات بواسطة الطرد المركزي.
- هذه المرة هو بيليه إعادة معلقة في تجميد كافية للسماح باستمرار المزيج 0.5 مل من التعليق في الخلية cryovial (انظر الجدول رقم 1) ووضعها على الفور الى 80 درجة مئوية خلال الليل.
- يتم نقلها إلى Cryovials النيتروجين السائل في اليوم التالي للتخزين الطويل الأجل (انظر الملاحظة 6). كما هو الحال مع ذوبان الجليد من الخلايا ، يجب أن تتم هذه العملية بسرعة من الحفظ بالتبريد. بينما DMSO هو لحماية أغشية الخلايا أثناء التجميد هو شديدة السمية للخلايا في عدم تجميد درجات الحرارة.
1.3. تحديد أرقام الخليوي
- ويمكن لتحديد تركيز الخلية من خلية واحدة تعليق (ثقافة فرعية التالية) يمكن استخدام haemocytometer نويباور. ويجب لضمان دقة فرز ساترة تكون مثبتة على قاعدة haemocytometer (انظر الملاحظة 7).
- ثم يتم وضع قطرة صغيرة من الخلايا التعليق على مقربة من حافة ساترة ، وسيتم تناولها من خلال العمل الشعري.
- ثم يتم عد الخلايا باستخدام مجهر مقلوب مع المرحلة على النقيض من الإضاءة. لزيادة دقة تركيز الخلية النهائي ، جينبغي ells في غرفة الفرز لا تتداخل ، اذا ينبغي أن تضعف تعليق الخلية الأصلية ، وإعادة فرز الخلايا. وينبغي تجنب تراكمها التي تفارق شامل للخلايا أثناء trypsinisation وينبغي أن تحسب 100-200 الخلايا على مساحة المعروفة للحصول على تقدير دقيق لعدد الخلايا. وهناك طريقة مريحة باستخدام haemocytometer نويباور هو عدد الخلايا في مجموعات أو أكثر من 16 2 مربع. ثم يتم الحصول على كثافة الخلية في الملليمتر الواحد بقسمة مجموع عدد مجموعات تحسب (مثلا 2) ، وضرب من قبل 10 4. على سبيل المثال ، أحصى أكثر من 100 خلية مجموعات 2 16 × مربع = 100 / 2 = 5 × 10 5 خلية / مل.
2. إنشاء الابتدائية Microexplant العضلات والهيكل العظمي الثقافات
ويمكن استخدام الأولية الدقيقة يزدرع الثقافة لعزل SMSC من أي العضلات الهيكلية بما في ذلك الوصول إلى العضلات الفردية للهند الصدارة وأطرافه ، والحجاب الحاجز والظهر وعضلات البطن. ووصف طريقة لاستخلاص الثقافات microexplant من عضلات الأحداث والبالغين بالتفصيل سميث وسكوفيلد 3 وبعد ذلك استخدمت على نطاق واسع لاستخلاص الخلايا SMS من الأحداث ، وعضلات الفأر الكبار والمسنين. ويمكن أيضا أن تستخدم أسلوب تربيتها لاستخلاص خلايا عضلات الهيكل العظمي من السمك 24 والعضلات والهيكل العظمي البشري (راو وسميث ، غير منشور). ويتضح من ثمرة SMSC ماوس microexplant العضلات في الشكل 1A ، ب. تم تعديل طريقة لعزل الخلايا الجنينية السلائف العضلات (انظر القسم 3). الطريقة الأساسية هي كما يلي :
- ويتحقق تشريح العضلات العقيم من الهدف (ق) من ماوس اعدام حديثا باستخدام أدوات معقمة ونظيفة مجال العمل واستخدام الرش ليبرالية من الايثانول 70 ٪.
- تغسل العضلات المعزولة من خلال اثنين من التغييرات DF20 متوسطة وتوضع في المتوسط DF20 الطازجة في طبق 2 60 ملم. باستخدام مجهر تشريح العضلات ستيريو microdissected بعناية تحت ظروف معقمة لاستبعاد الدهون ، والنسيج الضام والعظام.
- ثم يتم قطع قطعة العضلات تنظيف 400 إلى مكعبات 3 ميكرون والتي ، وذلك باستخدام ملقط صائغ ثانية ، يتم وضعها بشكل فردي في المركز 60 بئرا لوحة 96 - جيدا يحتوي على 50 ميكرولتر DF20 (انظر الملاحظة 8). ويتم فحص الآبار تحت المجهر وضعت في الحاضنة. تمتلئ الآبار المالحة الخارجي مع لمنع جفاف الآبار التي تحتوي على explants (3).
- وسجل مرفق Microexplant وثمرة الحضانة بعد 24-48 ساعة ، وبعد ذلك على فترات ح 48-72 (اعتمادا على معدل نمو العضلات المستزرعة).
- للتوسع وعزل الخلايا SMS ، ينبغي رصد الثقافات ثمرة للخلايا منفردة مع SMSC التشكل في الغالب ، أي الخلايا mononucleate كروية عالية مع الانكسارية التي تنمو في مجموعات في مجموعها (انظر الشكل 3.1B).
- بمجرد إنشاء ثمرة يزدرع الآبار الفردية يتم تغذية (انظر الملاحظة 9) من خلال إضافة 50 ميكرولتر زيادات متوسطة عندما المتوسطة acidifies بسبب كثافة الخلايا المتزايد. عند البئر الكامل وخلية ثقافة متكدسة تقريبا ، ويتم تغذية الآبار عن طريق استبدال 50 ٪ من المتوسط في كل مرة للتأكد من المحافظة على عوامل "تكييف" يفرز من قبل خلايا (انظر التعليقات على وسط مكيفة تحت الاستنساخ ؛ القسم 2.1). لقمع التمايز ، يتم تبديل في الامتداد التقاء يزدرع الابتدائي 60-70 ٪ في المتوسط عن طريق استبدال الكالسيوم المنضب DF20 المتوسطة للكالسيوم المنضب DMEM/F12 (جميع الملاحق لا تزال هي نفسها) لتغذية الخلايا 3.
- يزدرع يمكن إعداد المتوسطة مشروطة من الثقافات في هذه المرحلة وتخزينها لاستخدامها خلال توسيع واستنساخ SMSC الابتدائي (لأسلوب الاستنساخ ، انظر القسم 2.1 ، و الشكل 1C). وsubcultured الثقافات باستخدام الأسلوب dispase (انظر القسم 3.5).
- ويمكن تحليل SMSC المستمدة Clonally في الجسم الحي عن طريق الحقن العضلي (الشكل 3.1 حارس مرمى) 19.
- ويمكن القيام بها على خطوط Karyotyping SMSC المستمدة clonally مضاعفا لتأكيد حالة (انظر القسم 2.2 ، 3.1 لتر الشكل) 25.
- ويمكن تكييف هذه الطريقة لزرع عضلة الجنينية (القسم 3).
2.1. نسيلي اشتقاق
الابتدائي الثقافات myoblast ازدراع (الشكل 1A ، ب) هي أداة مفيدة ودقيقة لإقامة مجموعة متنوعة من المعلمات النمو المختلفة في عضلات الهيكل العظمي من النوع البري ومتحولة. نسيلي الاشتقاق ، والعزل من خط الخلية من خلية واحدة ، هي خطوة أساسية في عزل الخلايا الجذعية العضلية الهيكلية ، ويمكن أن تستخدم أيضا لخطوط SMSC subclone transfected مع ثوابت رني أو الجينات المحورة. أنشأت الثقافات يزدرع SMSC والابتدائية وكثافة عالية ، وسوف تعتمد cras " ح "(فصل من صحن ويموت) إذا طلي بها في كثافة منخفضة جدا خلية ، وذلك لأن العوامل الافراج SMSC للذوبان والتي هي مطلوبة للحفاظ على نمو وبقاء الخلية. محاكاة لثقافة عالية الكثافة وامداد هذه العوامل أثناء عملية الاستنساخ ، يتم استنساخ SMSC في النفس مكيفة المتوسط. تم العثور على إضافة المتوسطة مكيفة لأنها ضرورية للسماح لتتكاثر الخلايا الفردية في بيئة معزولة.
- مستعدة المتوسطة مشروطة من SMSC تنتشر تربيتها لمدة 48 ساعة بين 33 و 75 ٪ التقاء.
- تتم إزالة وسائل الإعلام التي تزرع هذه الخلايا بعد 48 ساعة وتمت تصفيتها باستخدام حقنة 0.2 ميكرون التصفية ، وهذا يضمن للعقم المتوسطة مكيفة ويزيل جميع الخلايا المتبقية والحطام.
- يتم خلط هذه الوسيلة المكيفة في نسبة 1:1 مع مستنبت الطازجة (المتوسطة الاستنساخ ، وانظر الملاحظة 10) ، ويتم استخدام وسائل الإعلام عن ثقافة استنساخ خلية واحدة.
- خلية واحدة لتحقيق التخفيفات الخلايا نأت الى تعليق خلية واحدة بواسطة trypsinisation دقيق (التي أنشئت SMSC) أو dispase العلاج (الثقافات يزدرع الابتدائي) والمخففة لتركيز خلية واحدة لكل 100 ميكرولتر المتوسطة الاستنساخ.
- ويمكن بعد 50 ميكرولتر من هذا التعليق الخلية تكون مطلية في كل من الآبار 60 مركزا لوحة 96 - جيدا.
- ويسمح للخلايا التي نعلق الحضانة عند 37 درجة مئوية في 5 ٪ CO 2 ثم لمدة 6 ساعات ، وكذلك كل وسجل بدقة عن وجود الخلايا. يتم خصم الآبار التي تحتوي على 0 أو أكثر من خلية واحدة في هذه المرحلة.
- ويلاحظ بعناية الآبار التي تحتوي على خلية واحدة واحدة وتعلق رصدها بعناية مستعمرة المستمدة من هذه الخلية واحدة (يوميا خلال الأيام القليلة الأولى) للتأكد من أن واحدا فقط مستعمرة ، والمستمدة من خلية واحدة ، موجودة. وقد استمدت فقط من خطوط الخلايا التي تحتوي على آبار 1 الخلية. الشكل 1C الإلكتروني يوضح التوسع في مثل هذه المستعمرة خلية واحدة مشتقة.
- بمجرد أن تصل إلى نقطة التقاء في مستعمرة لوحة 96 - جيدا يمكن subcultured ليصبح واحدا جيدا لوحة 48 - جيدا.
- ويمكن عندئذ للخطوط الخلايا المستنسخة يمكن توسيع بعناية في 24 -- 6 وألواح جيدا حتى خلايا كافية متوفرة لوحة في قارورة 25 2 سم.
- يمكن إثبات المنشأ العضلات والهيكل العظمي لهذه الثقافات من خلال التعبير عن Myf - 5 (الشكل 1F) أو غيرها من الهياكل العظمية العضلية علامات محددة مثل MyoD وباكس 7.
- في هذه المرحلة يتم تجميد خطوط منصبه قبل مزيد من التوسع (انظر الجدول 1).
2.2. Karyotyping
Karyotyping وسيلة هامة من النمط الظاهري الخلية الرصد. وينبغي karyotyped خطوط الخلايا التي يجنيها الاشتقاق نسيلي للتأكد من أنها قد احتفظت تكملة كروموسوم مضاعفا دون إعادة ترتيب الكروموسومات الإجمالي مما قد يؤثر على النمط الظاهري الخاصة بهم.
- karyotyping للخلايا تزرع في مرحلة متأخرة الأسي (80 ٪ متموجة) في أوعية الثقافة 25 سم 2 (2 يوما بعد subculturing) لزيادة نسبة الخلايا الإنقسامية في الثقافة.
- ويتم تغذية أربع وعشرين ساعة قبل karyotyping الخلايا مع 10 مل المتوسطة ثقافة جديدة. ثم يضاف 0.2 مل من كولشيسين ملغ / 10 مل (انظر الملاحظة 11) إلى الخلايا التي يتم تحضين لح 1 مرة أخرى في 37 درجة مئوية.
- بعد 1 ساعة ، والخلايا تخضع لإجراءات trypsinisation فرعية القياسية إلا أنه يتم الاحتفاظ كلا من الثقافة والمتوسطة يغسل PBS لزيادة عدد الخلايا الإنقسامية المقطوع.
- فصل الخلايا ، يتم الاحتفاظ بها شباك المتوسطة ويغسل PBS في 1000 لمدة 3 دقائق ز لخلايا بيليه وطاف. إزالتها والتخلص منها في التبييض
- ومن ثم بيليه الخلية إعادة علقت في 5 مل من كلوريد البوتاسيوم 0.0075 M للدقيقة 4 بالضبط ، قبل الخلايا مرة أخرى مكعبات بواسطة الطرد المركزي.
- ويستنشق معظم طاف ، وترك كمية صغيرة (~ 5-10 ميكرولتر) في أنبوب لاعادة تعليق. Resuspend الخلايا عبها قاعدة الأنبوب الصقر حتى يتم التوصل إلى المزيج الخلية. ثم توضع الخلايا على الجليد والثلج ثابتة في تثبيتي الباردة الطازجة (الميثانول : حمض الخليك الجليدية في نسبة 3:1) كما يلي : يضاف 10 مل من ببطء تثبيتي ، قطرة قطرة إلى الخلايا الصغيرة من الزجاج باستخدام ماصة باستير ( هذا يمنع تكتل الخلية).
- وتوضع الخلايا على الثلج لمدة 30 دقيقة ثم مكعبات بعد بواسطة الطرد المركزي التي هي الخلية بيليه إعادة معلقة في تثبيتي الطازجة 0.5 مل.
- ويتم إنتاج الشرائح بإسقاط تعليق خلية ثابتة على إعداد الشرائح (انظر القسم 3.2.2.1) الذي عقد في زاوية 45 درجة. لضمان حسن متباعدة الطورية ينتشر ينبغي أن تعقد ماصة لا يقل عن 30 سم فوق الشريحة.
- لتصور الكروموسومات ، ملطخة الشرائح لمدة 2 دقيقة في ليشمان وصمة عار ، المخفف مع ثلاثة مجلدات من الحموضة عازلة Gurr 6.8 فقط قبل استخدامه.
- تجفف الشرائح عند درجة حرارة الغرفة والتي تقام في المتوسط DePex المتزايدة.
معشوقة = "jove_step"> 2.2.1. إعداد الشرائح لKaryotyping
- وتعد الشرائح الزجاجية (شرائح مجهرية مميزة ، VWR الدولية ، المملكة المتحدة) لاستخدامها في بروتوكول karyotyping بين عشية وضحاها عن طريق وضعها في وعاء (زجاج) كبيرة من حامض الكبريتيك.
- ثم توضع شرائح تحت الماء الجاري لمدة 8 الصنبور ساعة ويتم تخزينها في الإيثانول حتى 70 ٪ المطلوبة.
- قبل الاستخدام ، ينبغي شطفها تحت المياه الجارية الشرائح الحنفية عن 30 دقيقة أخرى ، والهواء المجفف في درجة حرارة الغرفة ل02/01 ساعة.
3. إنشاء الابتدائية الصغرى ، يزدرع الثقافات من الأجنة
واستخدمت ثلاث سلالات الماوس للتحقق من صحة هذه الطريقة والبرية من نوع (C57BL/10) مع MDX وCAV3KO (المسوخ التصنع على حد سواء). كان الفأر MDX dystrophin التي تعاني من نقص نشأت عفويا في C57BL/10 ، حصل هذا الخط من المختبر Bullfield في عام 1991 ومنذ ذلك الحين حافظت باستمرار في مستعمرة الفطرية لدينا 26. كانت ولدت الفئران CAV3KO التصنع ، والتي تحتوي على طفرة في الجين caveolin - 3 ، على خلفية لمدة 10 C57BL/10 أجيال قبل أن يتم استخدامها في هذه الدراسة 27. ولدت كل سطر ماوس الشخصية ثمرة ، وانتشار والبقاء بقوة استنساخه المرحلة الجنينية التي كانت محددة ومختلفة عن كل سلالة. تم تكييف البروتوكولات التالية لأجنة من سميث وسكوفيلد PN (1994) 3 ، أساسا ، في ميريك 21.
3.1. كوكتيل الجنين
- للحصول على نظم الأجنة ، يتم تعيين أزواج على النحو التزاوج (1:1) الطبيعية والإناث في كل صباح لفحص المقابس المهبلية. في يوم من الكشف عن المكونات ، كما يتم احتساب أجنة E0.5 أيام (12 ساعة بعد الإخصاب).
- بمجرد أن يتم الكشف عن المقابس المهبل تتم إزالة الذكور من القفص لضمان دقة التدريج الجنينية.
- عند الوصول إلى المرحلة المطلوبة الجنينية (E11.5 لE17.5) هي التي قتلت الأمهات خلع عنق الرحم ، وحلق في البطن ، وممسوح الجلد والمناطق المحيطة بها مع الكحول 70 ٪ ويتم إزالة الرحم عن طريق شق البطن الأفقي أدلى به تشريح أدوات معقمة.
- ثم يتم غسل الرحم مرة واحدة في المدارس الابتدائية المتوسطة يزدرع الثقافة (PECM) قبل وضعها في صحن صغير يحتوي PECM الطازجة قبل تشريح.
- يتم تشريح E11.5 لE17.5 الأجنة من الرحم باستخدام مجهر تشريح وضعت بشكل فردي في أطباق بتري تحتوي PECM استعدادا لmicrodissection تفصيلا.
3.2. جنين Microdissection
- وكذلك تشريح الأجنة الفردية لعزل المناطق الغنية في العضلات والهيكل العظمي (انظر الشكل 2A). الخلفية والأمامية (تحت المحور عضلات الهيكل العظمي) هي تشريح بها ، فضلا عن الجدار العلوي والسفلي الجسم (عضلات الهيكل العظمي فوق المحور في الغالب). للقيام بذلك شق على طول القفص الصدري ، ويتم إنشاء البطن والحوض للسماح إزالة الأعضاء الداخلية للجنين.
- لإثراء لالهيكل العظمي الخلايا الجذعية الجنينية العضلات (eSMSc) ، ثم تتم إزالة الرأس والحبل الشوكي وجميع الأجهزة الداخلية.
- كبار السن في الأجنة (E15.5 - E17.5 الأجنة) فإنه من الممكن أيضا لإزالة الجلد والغضروف / العظام مرة أخرى لزيادة نسبة الخلايا العضلية في الثقافات.
3.3. إعداد الثقافات Microexplant الأجنة
- بمجرد أن يتم تشريح الأمامية ، hindlimbs والعلوي والسفلي من الجسم خارج الجدران فإنها توضع في PECM الطازجة وكذلك لإنتاج microdissected مكعبات صغيرة من أنسجة متساوية في الحجم (~ 0.5 مم 3 ؛ الشكل 2A).
- ثم يتم وضع هذه الآبار في microexplants 60 مركزا لوحة 96 - جيدا (واحد لكل بئر ازدراع) التي تحتوي على PECM 50μL لكل بئر. درس في جنين وضعت ما لا يقل عن 60 بئرا يحتوي على 1 يزدرع لكل بئر.
- يمكن للزراعة الأجنة يمكن تقسيم المركز 60 بئرا في مناطق تدل حيث تم اشتقاق من ازدراع (2B الشكل). هذا التصميم يسمح تحتوي كل منها على 15 بئرا ، على التوالي ، forelimb ، العلوي جدار الجسم ، وانخفاض hindlimb explants جدار الجسم 21.
3.4. رصد ثمرة
معدل نمو هو مقياس موثوق لمعدل نمو الجنين explants العضلات والهيكل العظمي ، وتحت ظروف محكومة بعناية الموصوفة هنا هو تكرار للغاية.
- يتم تحضين Explants عند 37 درجة مئوية و 5 ٪ CO 2 لمدة 3 أسابيع ، وسجل في اليوم 3 ، 7 ، 14 و 21 من زراعة باستخدام مجهر مقلوب. وسجل Explants وفقا لمستوى التقاء الخلايا في كل فرد بشكل جيد (الشكل 3A ، ه).
- يمكن التقاط صور فوتوغرافية للثقافات ، على سبيل المثال ، وذلك باستخدام كاميرا SLR تعلق على المجهر و100 ASA فوجي (لون) أو TMAX كوداك (أبيض وأسود) فيلم المهنية (الشكل 3F)
- والهيكل العظميعضلات معينة يمكن أن تستخدم الأجسام المضادة المحددة لMyf - 5 لإثبات المنشأ العضلات والهيكل العظمي من eSMSc ، اعتمادا على سلالة 80 95 ٪ من الخلايا المعزولة باستخدام هذه الطريقة هي Myf - 5 إيجابية. ويمكن أيضا علامات أخرى مثل MyoD وباكس 7 يمكن استخدامها لإثبات المنشأ العضلات والهيكل العظمي من سكان هذه الخلية. في حين أن هذه الخلايا تحتوي على نسبة عالية جدا من الخلايا الجذعية الجنينية الهيكلية العضلية التي لا يمكن أن يفترض (وخصوصا لصغار الأجنة) أنهم جميعهم من أصل الهيكل العظمي والعضلات أو أنها كلها الخلايا الجذعية. لعزل الخلايا الجذعية السكان نقية من الضروري لاستخلاص clonally الثقافات يزدرع الأولية كما هو موضح في القسم 2.1.
3.5. Subculturing Explants الجنينية الأولية
يمكن subcultured متموجة مرة واحدة ، والثقافات يزدرع عرض الميزات المورفولوجية للSMSC (الشكل 3F) على النحو التالي 3 ، 21 :
- تتم إزالة مستنبت من آبار مختارة وتصفيتها باستخدام محقنة 0.2 ميكرومتر R_ Acrodisc تصفية والاحتفاظ بها لاستخدامها كوسيط مكيفة. ويمكن تخزين المتوسطة في 4 درجة مئوية لمدة 1 أسبوع.
- يضاف 100 ميكرولتر من 1:10 dispase مخففة في كل بئر PECM لوحات وعادت بعدها إلى الحاضنة 37 درجة مئوية لمدة 20 دقيقة.
- ثم يتم استخدام تلميح ماصة لكشط بلطف خلايا خففت من سطح البئر.
- ثم يتم طرد تعليق الخلية في 1000 لمدة 3 دقائق ز إلى الخلايا وإزالة بيليه طاف والمهملة.
- هي خلايا إعادة علقت في 200 ميليلتر من مزيج من 01:01 المتوسطة وPECM مكيفة.
- ينقل المزيج إلى 48 خلية ، كذلك لوحات لمزيد من التوسع.
- ويمكن لتحليل المختبر في الخلايا تكون مطلية على كثافة خلايا 5 × 3 10 / سم 2 إما في 48 - جيدا لوحات (يحتوي كل منها على 9 مم 2 ساترة زجاجية معقمة) ، أو في 8 جيدا الشرائح الزجاجية الغرفة. لتزرع الخلايا تحليل التمايز بين عشية وضحاها لالتقاء 50-60 ٪ قبل أن يتم نقلهم إلى متوسطة التمايز الإباحية (انظر القسم 4 في التفاصيل لطريقة المختبر) لمدة 3 أيام ، قبل التثبيت.
4. وفي تحليل المختبر من خلايا جذعية عضلية هيكلية والثقافات الابتدائية
4.1. إعداد خلايا
- ومطلي Dispase (القسم 3.3) الابتدائي subcultured الثقافات يزدرع الجنينية في وسط PECM / مشروطة على coverslips في 48 لوحات جيدة في كثافة 3 × 10 3 خلية / سم 2 ، وسمح لنعلق.
- لتقييم موت الخلايا المبرمج وcoverslips الانتشار يتم غسلها مرتين في برنامج تلفزيوني ، ثابتة في بارافورمالدهيد 4 ٪ (انظر القسم 4.2) في برنامج تلفزيوني لمدة 20 دقيقة في درجة حرارة الغرفة ، تليها أخرى 10 دقيقة يغسل PBS.
- أعد Coverslips يمكن تخزينها بهذه الطريقة في 4 درجة مئوية لمدة تصل إلى 1 في الاسبوع برنامج تلفزيوني أو برنامج تلفزيوني / جليكاين.
4.2. إعداد تثبيتي لامتصاص العرق
- في غطاء الدخان ، تزن 4 بارافورمالدهيد ز (منهاج العمل ؛ سيغما الدريخ ، المملكة المتحدة) وإضافة إلى زجاجة من 100 مل من برنامج تلفزيوني العقيمة مع مغناطيسي. وينبغي ارتداء قناع الوجه وقفازات للحماية.
- في غطاء الدخان ، يتم تسخين المحلول ويحرك باستمرار على موقد المغناطيسي حتى يذوب المسحوق. هذا يستغرق حوالي 50-10 دقيقة عند 65 درجة مئوية. يجب توخي الحذر لمنع ارتفاع درجات الحرارة فوق 70 درجة مئوية ، وهناك خطر من الحل تنفجر في درجات حرارة عالية.
4.3. موت الخلايا المبرمج والفحص الانتشار
- هي ملطخة coverslips ثابتة (كما أعدت في القسم 4.1) مع 10 ميكروغرام / مل لمدة 3 دقائق دابي.
- تغسل Coverslips مرة واحدة في برنامج تلفزيوني (5 to10 دقيقة) ومعكوس على بقعة vectashield تصاعد المتوسطة على شريحة زجاجية 17 و 18.
- وختم حواف ساترة مع طلاء الأظافر (انظر الملاحظة 12).
- للتخزين ، يتم التفاف الشرائح في احباط وضعت عند 20 درجة مئوية.
- لفرز الأصوات ، وينظر إلى الشرائح تحت مضان (فلتر الأشعة فوق البنفسجية) على المجهر تستقيم وسجل للخلايا أفكارك والإنقسامية باستخدام graticule العدسة. تحسب العشرين شبكات موزعة بشكل عشوائي (وتمثل الخلايا ~ 1000) ، وتتميز الخلايا كما هو مبرمج شكليا وغير مبرمج أو الإنقسامية (الشكل 3 ز).
- يتم حساب الأرقام القياسية لأفكارك والإنقسامية كنسبة من مجموع الخلايا.
4.4. المناعية
ويمكن أيضا خلايا ثابتة على coverslips تستعمل لالمناعية. لا بد منه لاسترجاع مستضد به أن يكون coverslips طنجرة الضغط بإحكام على الشرائح الزجاجية باستخدام مشابك الورق القياسية. يمكن استخدامها لتحديد Immunostaining الخلايا المتكاثرة ، وذلك باستخدام أجسام مضادة لKi67 (1 / 1 ، 000 تمييع) ، لتأسيس الهوية ، وذلك باستخدام أجسام مضادة لMyf - 5 (1 / 1 ، 000 تمييع) ، أو للتحقيق في التعبير الجيني (انظرالقسم 4.5). لا يمكن أن يتحقق Immunostaining باستخدام عدد من الأساليب ، في أعقاب (الموصوفة في الفقرة (28 ، 29)) وتستخدم بشكل روتيني من قبل المؤلفين :
- سيترات الصوديوم هو العازلة قبل ساخنة في طنجرة الضغط. لاسترجاع مستضد ، توضع الشرائح التي تحتوي على نسج مقطوع في المخزن المؤقت يسخن ويسخن تحت ضغط لمدة 2 دقيقة. ويتحقق من خلال الضغط بقوة تأمين غطاء طنجرة الضغط ، ووضع على الوزن. بمجرد استرجاع 2 دقيقة الوقت قد انقضى على طنجرة الضغط ومن ثم وضعت بعناية تحت ماء الصنبور البارد تشغيل لتخفيف الضغط. عازلة لمنع الغليان تصل ، ينبغي الحرص على عدم إزالة الغطاء حتى التعادل مع الضغط والضغط الجوي. هو انخفاض ضغط بما فيه الكفاية عندما يمكن إزالتها بسهولة الوزن (بدون قوة) ، وإزالة الغطاء. ثم تتم إزالة الشرائح العازلة من وغسلها في درجة حرارة الغرفة في برنامج تلفزيوني لمدة 10 دقيقة.
- هي الشرائح قبل حظرها من قبل غمر المياه لها في 3 ٪ بيروكسيد / الصنبور الهيدروجين لمدة 5 دقائق ثم يغسل ثلاث مرات في برنامج تلفزيوني + 0.05 ٪ توين 20 (10 دقيقة لكل غسل).
- ويتحقق عن طريق حجب حضانة و 30 دقيقة في TNB حظر العازلة (المتوفرة في عدة TSA) في درجة حرارة الغرفة.
- غير المخفف الضد الابتدائية في TNB عازلة للتخفيف المناسبة (التي وصلت في المعايرة ، انظر الملاحظة 12) وحضنت بين عشية وضحاها في 4 درجات مئوية (أو بدلا من 1-2 ساعات في درجة حرارة الغرفة).
- بعد دقيقة يغسل three 10 في برنامج تلفزيوني + 0.05 ٪ توين 20 ، يتم تحضين الشرائح : 1 ساعة عند درجة حرارة الغرفة في الضد المناسبة second biotinylated مخففة في TNB العازلة.
- بعد دقيقة يغسل مزيد three 10 في برنامج تلفزيوني + 0.05 ٪ توين 20 ، يتم تحضين الشرائح لمدة 30 دقيقة في Streptavidin - HRP (المنصوص عليها في عدة TSA) 1:100 المخفف في المخزن ثم TNB غسلها ثلاث مرات (10 دقيقة لكل منهما) في PBS + 0.05 ٪ توين 20.
- ثم يضاف إلى كل قسم لمدة تتراوح بين 8 و 15 دقيقة (يجب الحصول على وقت دقيق من قبل تجارب التحسين) ؛ Biotinyl tyramide (TSA عدة كاشف التضخيم).
- التضخيم التالية ، وغسل الشرائح ثلاث مرات (10 دقيقة لكل منهما) في برنامج تلفزيوني + 0.05 ٪ توين 20 ثم احتضان لمدة 30 دقيقة في SA - HRP.
- الثلاثة التالية يغسل مزيد (10 دقيقة لكل منهما) في برنامج تلفزيوني + 0.05 ٪ توين 20 ، تصور استخدام 3،3 _ - diaminobenzidine مولد اللون tetrahydrochloride (DAB) لمدة 5 إلى 10 دقيقة. ثم حمل على اثنين يغسل الماء قبل النهائي في counterstaining الشرائح في haematoxylin وcoverslipping. DAB هو مادة مسرطنة معروفة ويجب التعامل معها بحذر (كما هو الحال بالنسبة الكولشيسين ، القسم 3.2.2).
4.5. التفاضل
- ويمكن أيضا SMSC مطلي على coverslips أو الشرائح الغرفة (انظر الملاحظة 13) قبل أن تكون متباينة لتحليل myotube التثبيت.
- لهذه التجارب هي مطلي الخلايا في مناطق ذات كثافة من 10 / 4 سم 2 ، وسمح لإرفاق مدة 6 إلى 8 (ح)
- ثم يتم تبديل الخلايا في التمايز في ظروف متساهل لمدة 3 أيام (انظر الملاحظة 14).
- وتتألف المتوسطة تمايز DMEM + 0.5 ٪ FCS تستكمل مع مصل الحصان 2 ٪ و 1 ٪ الجلوتامين. يتم استبدال هذه الوسيلة تمايز الثقافة الإباحية على فترات 48 ساعة.
- ثم يتم إصلاحها في Coverslips بارافورمالدهيد 4 ٪ على النحو الوارد أعلاه (الأقسام 3.4.1 و 3.4.2).
4.6. ترنسفكأيشن من SMSC : التعبير عن الجينات المحورة ويبني shRNAi
الخلايا الجذعية والثقافات وصهر الابتدائي لترنسفكأيشن مع وجود غالبية وسائل معدل ترنسفكأيشن SMSC والابتدائية في خلايا العضلات والهيكل العظمي منخفضة جدا (<10 ٪) ، ومنع استخدام الأساليب ترنسفكأيشن عابر. للتغلب على هذا كان من الممارسات المعتادة في مختبرنا لعزل المشتقات نسيلي من ثقافات transfected التحوير (انظر القسم 3.2.1) ترنسفكأيشن التالية مع فوسفات الكالسيوم أو lipofectamine. بدلا من ذلك يمكن استخدام الخلايا transfected بكفاءة يبني حزم عدوى فيروسي. ويبين الشكل 1M التعبير مستقرة غالاكتوزيداز - β في PD50A ، وهو مشتق SMSC نسيلي معزولة تحت العدوى اختيار G418 التالية مع pIRV ، وهو تكرار معيبة الارتجاعي تحمل جينات المقاومة وneo/G418 β - غالاكتوزيداز (19). كان يستخدم هذا الخط لإظهار الخلية رسميا بأن تتصرف كما SMSC الخلايا الجذعية في الجسم الحي وظيفية (انظر الشكل 3.1). في حين أن الجيل خط خلية نسيلي مستقرة التعبير عن الجين غير المرغوب فيه علامة في التجارب المجراة زرع الخلايا الجذعية ، بل هو طريقة تستغرق وقتا طويلا وغير مرضية للتحليل وظائف الجينات في المختبر. لهذه الأسباب قد وضعت في كتاب مؤخرا تعديلا الأمثل للكاشف Lipofectamine ترنسفكأيشن عام 2000 والتي هي قادرة على تحقيق معدلات ترنسفكأيشن من 60 الى 70 ٪. هذا يسمح للتحليل وظائف الجينات باستخدام ترنسفكأيشن عابرة من الجينات المحورة أو يبني رني إلى SMSC أو الثقافات يزدرع الابتدائي (الشكل 3H ، ط). الكتاب استخدام دبوس الشعر القصير رني ناقلات (pSHAG رني) (30) لتوليد بنيات shRNAi قادرة على استهداف محددة للتعبير الجينات مرنا في SMSC. نجاح هذه التقنية يعتمد على shRNAi عنصرين هما : (أ) وسيلة فعالة ترنسفكأيشن و (ب) تصميم تسلسل دبوس الشعر القصير الذي يعترف تحديدا الجين المستهدف. A shRNAi الموجهة لبناء يمكن استخدامها للتحقق من صحة eGFP الأسلوب ضربة قاضية رني (الشكل 3J ، م).
4.7. محسن LipofectamineTM ترنسفكأيشن بروتوكول عام 2000 لSMSC
- ومطلي الخلايا في 05-10 أبريل خلية / سم 2 إلى شرائح غرفة في 250 ميكرولتر مستنبت DF10 والمثقفين لمدة 18 ساعة للوصول إلى نقطة التقاء 95 ٪ (الأمثل لالتقاء كل سطر الخلية تأسست من خلال تقييم معدلات ترنسفكأيشن بكثافات مختلفة).
- لكل بئر ، يضاف 0.5 ميكروغرام من الحمض النووي (ناقلات shRNAi ، الجينات المحورة) إلى 33 ميكرولتر من المصل خالية DMEM تستكمل مع الجلوتامين 2 مم والمختلط برفق في أنبوب إيبندورف العقيمة.
- لكل بئر ، يتم تخفيف حدة 1،25 ميكرولتر من Lipofectamine 2000 في 33 ميكرولتر مزيد من المصل خالية المتوسطة DMEM + الجلوتامين ، مختلطة بلطف والاحتفاظ في درجة حرارة الغرفة لمدة 5 دقائق
- وثم يمزج الحمض النووي وأضاف lipofectamine بسرعة معا ، مختلطة برفق لمدة 60 ق التي pipetting وحضنت في درجة حرارة الغرفة ثم لمدة 19 دقيقة للسماح DNA Lipofectamine 2000 لتشكيل المجمعات.
- لترنسفكأيشن ، يضاف 66 ميكرولتر من مزيج معقد من كل غرفة البئر وهزت بلطف الشرائح لمدة 10 ق لضمان التوزيع العادل للمجمعات.
- يتم تحضين الخلايا 24-72 ساعة عند 37 درجة مئوية و 5 ٪ CO 2. هو اكتشافه لأول مرة اعتمادا على بناء ، والتعبير الجيني وظيفية أو ضربة قاضية shRNAi بين 8 و 24 ساعة بعد ترنسفكأيشن.
5. ممثل النتائج
عندما يتم بعناية explanted explants من العضلات والهيكل العظمي للبالغين أو من أجنة سوف تبدأ explants لتوليد الخلايا في غضون بضع ساعات الى 72 ساعة من الحضانة عند 37 درجة مئوية (5 ٪ CO 2 / الهواء) (الشكل 3A). الوقت الذي يستغرقه لهذا أن يحدث يعتمد على مصدر explants : explants الجنينية سوف تتفوق بسرعة أكبر من البالغين explants العضلات الهيكلية القديمة. تجربتنا في توقيت هو ثمرة استنساخه للغاية 3 و 29. وسوف توسع من السكان الخلية يحدث على مدى فترة من الأيام (explants الجنين) أو أسابيع (أقدم explants العضلات والهيكل العظمي) لتوليد كثافة عالية في مجموعها الثقافات الخلية SMS الابتدائي (انظر الشكل 3B - F التوضيح من هذه الثقافات). الشكلان 1 و 3 تظهر نتائج ممثل الاشتقاق ناجحة وثقافة العضلات والهيكل العظمي explants الجنينية ، والاشتقاق نسيلي في الجسم الحي زرع العضلات والهيكل العظمي المستمدة الخلايا الجذعية للبالغين ، ووضع العلامات β - غالاكتوزيداز ، وkaryotyping myf - 5 المناعية من SMSC الجنينية لتوضيح منشأ العضلة الهيكلية . السكان الخلية ويبين الشكل 3 نتيجة ثمرة ممثل التهديف (باستخدام Myf - 5 المناعية لتصور SMSC) ، ومورفولوجيا الخلايا العضلية الجنينية الأولية ؛ تلوين دابي لموت الخلايا المبرمج وبروتوكول ترنسفكأيشن shRNAi. ويمكن الاطلاع على مزيد من التفاصيل في الشكل الاساطير المتعلقة هذين الرقمين. الشكل 2 يوضح الإجراء من تشريح الدقيقة الجنين المخصب لتوليد السكان من الخلايا الجذعية الجنينية الهيكل العظمي العضلي.
الجدول 1 : جدول حساب لتقدير عدد cryovials اللازمة لبقاء الخلية القصوى خلال تجميد الخلية أسفل البروتوكولات
| لوحة / قارورة / غرفة الشريحة | حجم متوسط الثقافة | PBS يغسل | حجم التربسين | تجميد عدد من أسفل قنينة (3.1.2) |
| 96 - جيدا | 50 ميكرولتر | 2 X 100 ميكرولتر | 25 ميكرولتر | N / A |
| 48 - جيدا | 150 ميكرولتر | 2 X 200 ميكرولتر | 50 ميكرولتر | N / A |
| 24 إضافة | 500 ميكرولتر | 2 X 700 ميكرولتر | 200 ميكرولتر | N / A |
| 6 جيدا | 3 تراخيص | 2 X 3 تراخيص | 500 ميكرولتر | 1 |
| صغيرة (25 سم 2) | 10 ملل | 2 X 10 مليليتر | 1 مل | 2 |
| المتوسط (80 سم 2) | 10 ملل | 2 X 10 مليليتر | 3 تراخيص | 4 |
| كبير (175 2) | 10 ملل | 2 X 10 مليليتر | 5 ملل | 8 |
| غرفة البئر | 500 ميكرولتر | 2 X 500 ميكرولتر | 100 ميكرولتر | N / A |
N / A = لا ينطبق ؛ أرقام الخلية كانت منخفضة جدا لتجميد باستمرار ما لم تجمد آبار متعددة أسفل معا.
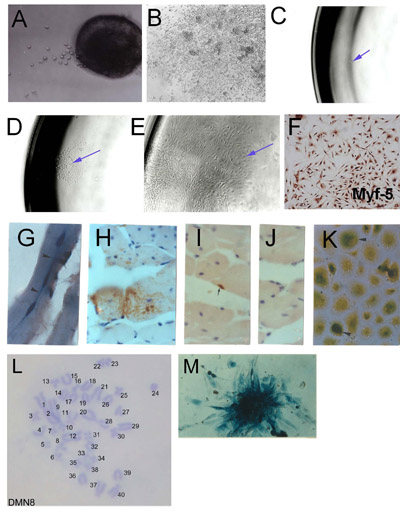
الشكل 1. عزل الخلايا الجذعية العضلية الهيكلية (SMSC) من microexplants : (أ) في وقت مبكر من نمو عضلات الهيكل العظمي explanted الكبار (يوم 2) (ب) ثمرة يزدرع تأسست المجمعة تظهر الثقافات وارتفاع كثافة الخلية. الاشتقاق من نسيلي SMSC (C) في خلية واحدة معزولة جيدا لوحة 96 (D) مستعمرة من أصل خلية واحدة (E) تأسست السكان نسيلي (F) التحقق من الهوية باستخدام SMSC Myf - 5 المناعية. الخلايا المشتقة من SMSC استنساخ PD50A (التعبير عن β - غالاكتوزيداز) في الفئران المضيف في 3 أشهر (G) و (HJ) 14 شهرا بعد حقن الخلايا في العضلات PD50A 2000 الظنبوبي الأمامي الماوس (G) ثلاثة تنصهر مؤخرا (نوى موقعا مركزيا ) β - غالاكتوزيداز إيجابية الخلايا (الأزرق وصمة عار) في الألياف العضلية (المقطع الطولي) (H) مساهمة واسعة من غالاكتوزيداز - β إيجابية الخلايا (البني وصمة عار ، الكشف عن الألغام المضادة للβ - غالاكتوزيداز الضد) في الألياف العضلية (المقطع العرضي ) (I) β - غالاكتوزيداز إيجابية الخلايا الأقمار الصناعية (البني وصمة عار ، الكشف عن الألغام المضادة للβ - غالاكتوزيداز الضد) (J) الثانوي السيطرة الضد (أي تلطيخ) (K) β - غالاكتوزيداز إيجابية الخلايا (الأزرق وصمة عار) عندما تتكاثر في ثقافة معزولة عن حقن العضلات المضيفة 12 شهرا بعد الحقن. (L) النمط النووي لSMSC خط الماوس نسيلي (DMN8) تظهر العادي الكيمياء النسيجية تكمل كروموسوم (M) ضعفاني تظهر β - غالاكتوزيداز التعبير في مستعمرة من الخلايا PD50A ( الشكل 3.1 ز ، ك ، وهي مستنسخة بإذن من الصحافة [أكر] وسميث وسكوفيلد ، 1997).
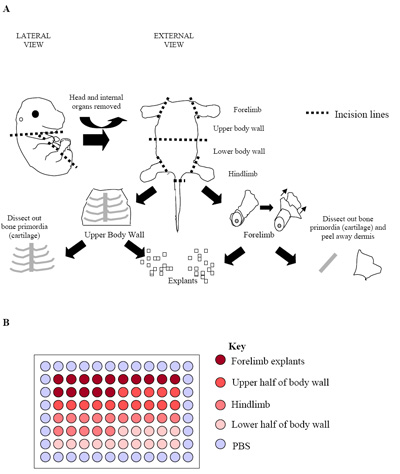
الشكل 2. (أ) رسم توضيحي لعملية تشريح الجنين. هذا الرقم يمثل الجنين E15.5 حيث يمكن بسهولة العظام البدائية (الغضروف) أن يتم تحديد وتشريح خالية من الأنسجة العضلية العظمية المحيطة. في هذه المرحلة ، والأجنة في مرحلة لاحقة (E15.5 E17.5) ، كما تم عزل الأدمة لتعظيم نسبة الحصول على خلايا عضلات الهيكل العظمي. (ب) الإعداد للثقافات يزدرع الأساسي في لوحة 96 - جيدا. وقد استخدم كل جنين لانتاج واحدة لوحة كما رأينا أعلاه. الممارسة المعتادة هي لوحة من ثلاثة أجنة متماثلة منفصلة (ثلاث لوحات = 180 بئرا) لتحديد معدلات نمو.
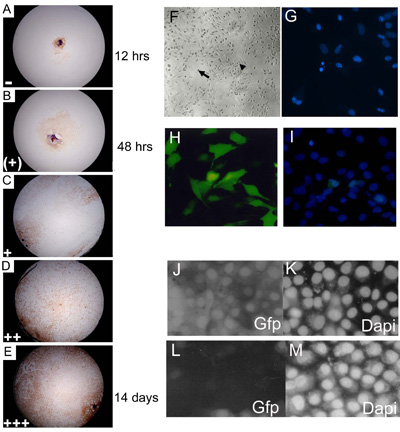
الشكل 3. وسجل الجنينية الثقافات يزدرع الابتدائي في 3 و 7 و 14 و 21 يوما للثقافة وتعيين ممثل للمستوى ثمرة التقاء مستوى. (AE) C57BL10 E15.5 الابتدائي الثقافات يزدرع الجنينية ملطخة Myf - 5 لتوضيح 0 14 ٪ () ؛ 15 24 ٪ (+) ؛ 25 49 ٪ (+) ؛ 50 74 75 100 ٪ (++)؛٪ ( + + +) مستويات للالتقاء. وقد تضاعفت نسبة من الآبار تظهر كل مستوى من مستويات نمو (في كل يوم من التهديف) من قبل عدد التعسفي (= 1 ؛ (+) = 2 ؛ + = 3 ؛ + + = 4 و + + + = 5) ، قبل جمع البيانات لإعطاء قيمة ثمرة النهائي. حوالي 85 ٪ من eSMSc (C57BL/10) من النوع البري الرئيسي وصمة عار للعلامة الخلية العضلية الهيكلية Myf - 5. التكبير هو 10. (F) تأسست الجنينية الثقافات والخصائص المورفولوجية للSMSC الكبار ، وخلايا القطبين (سهم صغير) والخلايا monomorphic كروية (السهم كبير) (G) تحديد تفتيت نوى به أفكارك تلوين دابي (مرحبا) مستويات عالية (~ 75 ٪) من ترنسفكأيشن لبناء GFP - معربا عن خطوط الخلايا في SMS باستخدام الأسلوب الأمثل Lipofectamine ترنسفكأيشن 2000 (I) عد من إجمالي عدد الخلايا غير مدعومة ملون مباين دابي. رني باستخدام pSHAGshRNAigfp (JM) تلغي التعبير في GFP SMSC (انظر (29) للحصول على مثال هذا البناء المستخدمة كعنصر تحكم) (J) التحكم (ترنسفكأيشن وهمية) تظهر التعبير GFP في خط SMSC GFP (K) دابي السيطرة (L) shRNAiGfp 24 ساعة بعد ترنسفكأيشن (M) دابي السيطرة للخلايا shRNAiGfp transfected في (L).
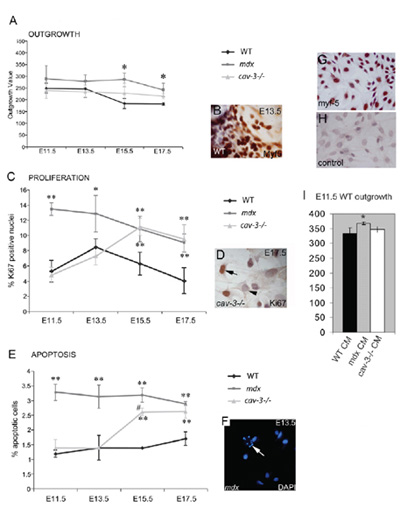
الشكل 4. التصنع ، الجنينية Myf5 إيجابية myoblast hyperproliferative هي وعرضة للموت الخلايا المبرمج. (أ) معدل نمو من myoblasts جنينية من ثقافة يزدرع العضلات طق زيادة في كل من المسوخ MDX E11.5 والمسوخ (-/-)CAV - 3 في E15.5 E17.5 وبالمقارنة مع explants WT مثقف بشكل متواز. (B) A - يزدرع Myf5 immunostained (C) المفرط لمن myoblasts الجنينية في MDX من المسوخ والمسوخ E11.5 (-/-)CAV - 3 من E15.5 ، على النحو الذي يحدده Ki67 إيجابية تفاعلية مناعية (D) (E) من موت الخلايا المبرمج ارتفاع E11.5 في الأجنة MDX ومن E15.5 في الأجنة (-/-)CAV - 3 ، كما يتضح من تلطيخ دابي (F) ؛ السهم في F يشير إلى الخلية أفكارك. * P <0.05 مقارنة مع وزن ** ؛ ع <0.01 مقارنة مع وزن ؛ * ع <0.05 عند مقارنة مع CAV MDX - 3 (-/-)(G ، H) E15.5 مثقف WT myoblasts الأولية الجنينية مع Myf5 تلطيخ. (G) ، وزيادة عنصر تحكم الضد الثاني (H) (I) ويبلغ معدل وزن ثمرة explants E11.5 (* P <0.05) في المتوسط E11.5 يزدرع مكيفة MDX (CM) ، ولكن ليس في CAV - 3 (-/-)أو WT CM. أشرطة الخطأ تشير SD يرد هذا الرقم في إطار حقوق التأليف والنشر للمؤلفين ونشرت لأول مرة من قبل الشركة من علماء الأحياء في ميريك وآخرون ، 2009.
6. الملاحظات : خطوات حاسمة والتعديلات الممكنة
- عند إذابة الخلايا قد تعلق في كثافة الخلايا منخفضة جدا فإنه من الحكمة ليحل محل سوى نصف المتوسط لمنع انهيار الثقافة.
- SMSC معزولة عن التصنع العضلات عرضة للموت الخلايا المبرمج ويجب أن تعامل بعناية خاصة. وينبغي أن نمت SMSC التصنع (مثل خط خلية DFD - 13 ، التي أنشئت من الهيكل العظمي والعضلات التي تم الحصول عليها من خلال 5 أسابيع من العمر التصنع (MDX) الفئران) في كثافة أعلى من المعتاد للخلية myoblasts. هي أيضا cryopreserved مثل خطوط الخلايا الحساسة للموت الخلايا المبرمج في الكثافات السكانية المرتفعة (انظر الأقسام 1.1 و 1.2) (19).
- طريقة بديلة لإزالة الخلايا من أحادي الطبقة تستخدم dispase ، والتي توفر طريقة ألطف من تفكك الخلية ، مع الاستفادة التي يمكن الاضطلاع بها في حضور FCS والكالسيوم (وكلاهما موجود في DF10). ولذلك يمكن أن تستخدم لDispase فرعية وتوسيع الأولية يزدرع العضلات والهيكل العظمي والثقافات earlystage استنساخ SMSC (أنظر القسم 2 و 3).
- وينبغي للحصول على أكبر قوارير يمكن تحجيمها كمية التربسين / EDTA المستخدمة على النحو التالي : 75 مم 2 قارورة (3 مل التربسين) و 175 مم 2 قارورة (5 مل التربسين). وبالمثل بالنسبة للمناطق أصغر سطح تقليل كمية التربسين المستخدمة (انظر الجدول 1).
- بدلا من ذلك ، يمكن رصد تفارق باستخدام مجهر مقلوب ، ينصح هذا للمبتدئين.
- ويتم عادة الحفظ بالتبريد من خطوط الخلايا خارج باستخدام متموجة كبيرة (175 ملم 2) سفينة من البلاستيك. ويمكن الحصول على ما بين 7 و 9 من cryovials سفينة واحدة كبيرة مثل هذه ، اعتمادا على ملف بقاء خط الخلية التي يجري cryopreserved. ثقافات الابتدائية وخطوط الخلايا التي أنشئت حديثا وغالبا ما تكون صهر جدا لتجميد إجراءات أسفل. لتحسين الانتعاش والنجاح باستمرار تجميد هذه الخلايا يمكن استخدامها نهجين (منفردة أو مجتمعة). يمكن (أ) يمكن زيادة محتوى FCS لتجميد أسفل خليط من 10 ٪ (بحد أقصى 50 ٪). (ب) أن تباطأ تجميد العملية من خلال وضع أسفل cryovials في المرحلة بخار N2 ل24/12 ساعة قبل ان ينتقل الى المرحلة قنينة السائل.
- وهناك طريقة مريحة للتحقق من التعلق الراسخ للساترة haemacytometer هو البحث عن خواتم نيوتن (تأملات في الزجاج قوس قزح) على ساترة أو بدلا من ذلك ، لعقد haemacytometer رأسا على عقب على يد مفتوحة.
- ويمكن استخدام وهناك تباين في الأسلوب يزدرع على المدى القصير الثقافات لاستخدامها في المقايسات المناعية ، والانتشار أو موت الخلايا المبرمج. توضع على الزجاج explants Microdissected باستخدام الشرائح الغرفة 8 أيضا. طريقة بديلة لاستخدام 9 ملم 2 coverslips وضعت في 24 لوحات جيدة. في كلتا الحالتين يتم نقل اثنان explants إلى كل بئر في 150 متوسطة DF20 ميكرولتر. بدلا من ذلك ، يمكن subcultured الثقافات الابتدائي بحلول الأسلوب dispase ومطلي خارجا على coverslips وضعت في 24 لوحات جيدة أو مباشرة إلى شرائح 8 الغرفة جيدا.
- للتحليل الكمي لمعدلات نمو لا تقل عن 60 بئرا يحتوي على 1 يزدرع لكل بئر وضعت ، في العضلات / سلالة الماوس. لوضع معايير النمو لسلالة يجب أن تستخدم ما لا يقل عن ثلاثة حيوانات منفصلة. ليست لوحات وتغذية الآبار الفردية في حين يجري وسجل ثمرة.
- لخطوط الاستنساخ SMSC ثبت كافية لخلايا ثقافة واحدة في مزيج 01:01 المتوسطة مكيفة والمتوسطة DF10. لexplants الأولية أنه من الضروري زيادة محتوى المصل من مستنبت إلى 20 ٪.
- كولشيسين هو شديدة السمية ومسرطنة معروفة ويجب التعامل مع الرعاية المناسبة. تغطية بقفاز مزدوجة ويعملون في حدود علبة المعينة أمر ضروري. جميع المستهلكات (أي جيلسونتوضع نصائح) في كوب من المبيض (5 ٪ هيبوكلوريت الصوديوم) قبل التخلص منها بين عشية وضحاها مع كميات وفيرة من المياه في اليوم فولو فوتبال شي الجناحين.
- نستخدم حاليا الأجسام المضادة الأولية محددة لKi67 وMyf 5 في كل 01/01 التخفيف ، 000. التخفيف الأمثل لأجسام مضادة الأساسي يجب أن يكون تجريبيا المنشأة لكل الأجسام المضادة لاستخدامها ، وأيضا بشكل مثالي لمجموعات مختلفة من الأجسام المضادة نفسها ، حتى عندما تم الحصول عليها من المصدر نفسه.
- ويمكن أيضا أن تكون غرفة الشرائح المستخدمة في هذا الاختبار. قبل تحديد الخلايا في PFA 4 ٪ ، تتم إزالة الخلايا المتوسطة الثقافة وغسلها مرتين مع 37 ◦ C العقيمة برنامج تلفزيوني. غرف جيدا ، ويتم إزالة الصمغ وحشية والشرائح الزجاجية وضعت في جرة مل 50 Coplin زجاجية تحتوي الطازجة بارافورمالدهيد 4 ٪ في درجة حرارة الغرفة ، والتي هزت ثم برفق على شاكر R_ التلفيف الكرسي الهزاز لمدة 25 دقيقة. ثم تغسل الشرائح مرتين في برنامج تلفزيوني (درجة حرارة الغرفة) وتستخدم إما مباشرة أو تخزينها في برنامج تلفزيوني في 4 ◦ C (على المدى القصير ؛ 1-2 أسابيع) للتحليل (IHC) المناعى.
- يمكن إذا كان المطلوب أكثر اتساعا تشكيل myotube تكون متمايزة الأولية خلايا عضلات الهيكل العظمي لمدة تصل إلى 8 أيام.
Discussion
ويمكن استخدام الثقافات يزدرع Microdissected موثوق لعزل السكان وبتكاثر الخلايا التي تحتوي على نسبة عالية جدا (~ 85 ٪) من Myf - 5 التكاثري إيجابية الخلايا الجذعية العضلية الهيكلية (SMSC). في ظل الظروف الثقافة خاضعة لرقابة صارمة وصفها هنا يمكن استخدامها الثقافات يزدرع الأولية لتوصيف سلوكيات نمو SMSC الماوس متحولة وراثيا ، ويمكن استخدامها كوسيلة لتوليد myotubes لتحليل مفصل في المختبر لعمليات المفاضلة. صيانة دقيقة والتلاعب في هذه الثقافات يمكن على المدى الطويل والثقافة ، والتوسع. باستخدام الأساليب المذكورة هنا فإنه من الممكن أيضا أن تستمد نسيلي الجذعية خطوط الخلية العضلية الهيكلية من ثقافات يزدرع عن طريق تخفيف خلية واحدة. لتحقيق انتشار الخلايا وحيدة معزولة أثناء إجراء الاستنساخ ، "متوسطة مشروطة" يستخدم لمحاكاة الشرط الطبيعي من هذه الخلايا لثقافة عالية الكثافة. الأسلوب هو المعمول به (مع التعديل) إلى الأنسجة ، الجنينية الكبار والمسنين البالغين ، وبالإضافة إلى الماوس يمكن استخدامها لعزل خلايا من عضلات الهيكل العظمي من الأنواع الأخرى بما في ذلك الإنسان (راو وسميث ، غير منشورة) ، وأسماك الفرخ الجنين ( سمك السلمون) 24. ويمكن تحليل SMSC المستمدة Clonally في الجسم الحي بواسطة زرع العضلي وتحت هذه الظروف حقن SMSC سوف تتحد مع myotubes المضيف لتشكيل الألياف العضلية الهجين. SMSC حقن العضل لا تشكل الأورام والتي وجدت في العضلات المضيف في موقف الخلية الأقمار الصناعية أكثر من سنة بعد الحقن ، مما يشير إلى أنها تخضع لرقابة الذاتية من قبل الأقمار الصناعية الخلايا الجذعية niche.These الخلية يمكن إعادة معزولة عن حقن كما يستضيف SMSC التكاثري أكثر من 12 شهرا بعد حقن المضيف 19.
Disclosures
Acknowledgements
نشكر باتريك Paddison عن هديته للناقلات المكوك shRNAi. ولدت انجيلا سلون صورة رني GFP في الشكل 3. ونشكر أيضا هيئات التمويل التالية لدعمها :
العضلات منح الحملة عدد الضمور RA2/592/2 ؛ الشرر منح عدد 02BHM04 ، عدد الملكي منح جمعية 574006.G503/1948./JE BBSRC ومنح عدد 6/SAG10077.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
References
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved