Method Article
성인 및 배아 골격근의 Microexplant 문화 및 골격 근육 줄기 세포의 분리
요약
마이크로 해부 explants 기술은 골격 근육 줄기 세포의 원천으로 청소년, 성인이나 배아 근육에서 proliferative 골격근 세포를 분리를위한 강력하고 안정적인 방법입니다. 유니 클리,이 세포는 clonally 생체내 이식에 사용되는 골격 근육 줄기 세포 라인을 생산하기 위해 파생되었습니다.
초록
교양 배아와 성인 골격 근육 세포가 다른 용도 수가 있습니다. 이 장에서 설명하는 마이크로 해부 explants 기술은 골격 근육 줄기 세포의 원천으로 청소년, 성인이나 배아 근육에서 proliferative 골격근 세포의 비교적 큰 숫자를 분리를위한 강력하고 안정적인 방법입니다. 저자는 야생 유형 및 dystrophic 근육에서 골격근 세포의 성장 특성을 분석하는 마이크로 해부 explant 문화를 사용했습니다. 조직 성장의 각각의 구성 요소는, 즉 세포 생존, 증식, 노화와 분화는 별도로 여기에서 설명한 방법을 사용하여 분석하실 수 있습니다. 성장의 모든 구성 요소의 그물 효과가 explant의 파생물 속도를 측정에 의해 설립 수 있습니다. 마이크로 explant 방법은 여기에 설명한 바와 같이, 배아 골격 근육 엽 성의 전구 물질의 격리를 활성화하는 저자에 의해 적응되어, 다른 근육 유형과 연령대의 다양한 기본 문화를 확립하고 사용할 수 있습니다.
유니 클리, 마이크로 explant 문화가 파생하는 데 사용되었습니다 clonal (단일 세포 기원) 골격근의 줄기 세포 (SMSC) 확장 및 생체내 이식에 사용할 수있는 라인. 생체내 이식 SMSC에서와 같이 기능, 조직을 특정, 위성 세포 행동 이것은 골격근 섬유 재생에 기여뿐만 아니라 마이크로 explant 방법을 사용 문화에 다시 절연 수 있습니다 undifferentiated 줄기 세포의 작은 수영장으로 (위성 세포 틈새)을 유지하는.
프로토콜
두 가지 방법은 proliferative 골격 근육 세포를 분리하기 위해 고용 수 있습니다. 최초의 근육 조직에서 효소 한 밖으로 도금하기 전에 단일 세포를 분리 소화하고 있습니다. 두 번째 방법은 세포 배양 2, 3 중에 밖으로 성장할 수 있도록 문화에 근육 조직의 조각 explant하는 것입니다. 두 번째 방법은이 프로토콜에 설명되어 있습니다. 조직 문화 자체는 explant 문화의 뿌리가 있습니다. 2007 년 그가 림프 4 방울 매달려에 신경 explants을 잠복기로 신경 세포의 outgrowths를 획득하는 해리슨의 고전적인 실험의 100 주년했다. Explant 문화 기술은 성인과 배아 세포 4, 5의 proliferative 차 문화를 창출하는 수단으로 장인이 100 년 서로 다른 맥락의 다양한 사용하고 세련되었습니다. explant 기술 뒤에 원리는하지만, 동일하게 유지, 풍부한 영양 미디어로 뚫고 나올 때까 세포를 제공하면서 셀 가지의 중요한 초기 단계 동안 상위 조직의 3 차원 구조를 유지하여 기본 셀 분리의 외상을 최소화하기 위해 분아 따위에 의해 번식하는 인치 골격 근육에있는 근육 조직을 절단하는 행위는 근육 섬유의 외상, 위성 세포 활성화, 마이 그 레이션 및 확산 3, 6에 대한 일반적인 방아쇠를 모방하기 때문에 explant 문화를 사용하는 추가적인 장점이 있습니다. 성인 골격 근육 위성 세포 (myoblasts도라고도 함) 근육 섬유 수리 및 성장 7 책임 proliferative 줄기 세포의 인구입니다.
골격 근육 explants 따라서 재생 근육의 생체내 환경에서을 모방하고 줄기 세포의 마이 그 레이션 및 부문을 자극. somitomeres 및 아가미의 아치는 머리 8, 9의 근육을 일으키다 있지만 배아에서 척추 골격 근육의 대부분 (트렁크 및 사지 근육)은 somites에서 유래. myotome은 두 가지 별개의 그룹으로 확인할 수 있습니다 Myf - 5 각각 차별 체절의 지느러미, 중간과 측면 가장자리에 위치하고 표현 줄기 세포. 각각이 전지는 현장에서 차별 뒷면의 epaxial 근육을 생성하고, 체절 10 ~ 근육 줄기 세포의 마이 그 레이션을 필요로 복부와 측면 hypaxial 근육 (팔다리, 복부 및 호흡기 근육). 배아 근육 줄기 세포의 마이 그 레이션 인원 3 11의 통제하에있다. Myf - 5 표현 배아 근육 설립이 중요성이 출생 후의 근육을 계속하는 것이 필수적입니다 어디 활성화 위성 세포의 98 % 이상 표현 Myf - 5 12. Myf - 5 그러므로 성인과 배아 두 조직의 proliferating 골격 근육 줄기 세포 인구의 신뢰성 및 특정 마커입니다. 배아 근육 줄기 세포는 (또한 불리는 근육 세포 progenitors, 골격 근육 엽 성의 전구 물질, myoblasts 또는 배아 인공 위성 세포) 초기 마우스, 병아리와 개구리 배아 13 somites에서 격리 수 있습니다. 이전 배아 저자의 배아 골격 근육에서 myogenic 문화를 분리하기 위해서는 배아 조직에 대한 microdissected explant 기술을 적응있다. 비슷한 접근 방식은 Cossu 외 사용됩니다. 14 배아 체절 14에서 clonal 세포 인구를 생성합니다.
1. 골격근의 줄기 세포의 체외 세포 문화 (SMSC)
SMSC는 clonally 기본 골격 근육 explant 문화에서 파생된되었습니다 단세포 원산지 세포 라인입니다. 그들은 충분한 신경을 촬영하는 경우 표준 조직 문화 방법론을 사용하여 양식 수 있습니다. 달리 지시하지 않는 한, 설명된 모든 조작이 층류 후드 (클래스 1 또는 클래스 2 살균 캐비닛) 및 모든 문화 시약을 사용하여 무균 조건 하에서 수행되며, 그 참고 ° C 물 목욕에 사용하기 전에 37 기까지입니다.
- 액체 질소 저장 (방법 다운 냉동 섹션 1.2 참조)에서 SMSC 가져 cryovials가 빠르게 해동 및 내용 5 ML prewarmed로 전송해야합니다 (37 ° C) 즉시 원심 분리에 대한 DF10 문화 매체 (3 분 1천g)는 DMSO를 제거하는 . 세포를 해동하는 가장 좋은 방법은 원심 튜브로 전송하기 전에 유리병에 미리 예열 문화 매체의 소량의 반복 pipetting 수단입니다. cryopreserved 세포가 상온에서 세포 (LD50 약 2 분)에 독성 10 % DMSO를 포함부터 해동 세포의 과정은 매우 신속하게 진행해야합니다.
- 추가로 5 ML DF10에 다시 보류 세포 펠렛에 따라 원심 분리가 뜨는가 제거되고 세포가 씻어 있으며, 다음과 같은 원심 분리기.
- 펠렛은 다음 5 DF10의 ML과 결과 세포 현탁액 두 번째 시간을 혼합하는 세포는 작은 25cm이 플라스틱 문화 적로 전송됩니다ssel.
- 문화가 37 유지 ° humidified 인큐베이터에 C가 공중에서 5 % CO 2를 포함하는. 혈관이 필터링 모자와 함께 사용하지 않는 한, 술병의 뚜껑은 약간 문화 혈관에 공기가 보육과 평형과 문화 미디어를 시어지다 수 있도록 몇 시간 동안 느슨하게해야합니다. 매체의 산도는 문화 매체에 페놀 빨간색 염료의 산도 표시기를 통합에 의해 모니터링됩니다.
- 해동 세포는 항상 (주 1 및 2 참조) 세포 파편 및 잔류 독소의 제거를 위해 신선한 DF10 매체와 도금 후 다시 먹은 후 24 H를 모니터링해야합니다.
1.1. Subculture
설립 SMSC 라인의 경우, 세포가 약 95 %의 합류에 도달했을 때 그들은 그들의 문화 선박에서 제거 희석 및 추가 성장을 활성화하는 새로운 그릇에 배치해야합니다. 이 subculture 절차는 트립신 / EDTA (에틸렌 다이아 민 테트라 초산)가 가장 자주 (참고 3 참조) 사용중인 다른 효소 절차의 숫자에 의해 얻을 수 있습니다. 그것은 그들이 성장의 세 번째 날에 subcultured을 요구 밀도에 세포를 성장 일반 (좋은) 연습입니다. 대부분의 SMS 세포 라인이 각 subculture에 분할 세포 10분의 1에 의해 얻을 수 있습니다. 이것은 세포의주의 모니터링을 허용하고 즉시 변형이나 문화 환경에 적응에 의한 apoptosis의 감소로 세포 라인 phenotypic 변화를 나타낼 수있는 비정상적인 성장을 행동 (예를 들어 빠르게 성장)를 식별하기 위해 조직 문화를 공연들을 수 있습니다. 또한 일관되고 신중 subculturing 루틴은 크게 이러한 이벤트의 발생을 줄일 수 있습니다.
- 트립신 (trypsinisation)를 사용 subculture에 대한 선박은 인큐베이터와 열망에 의해 삭제들은 중간에서 제거됩니다.
- 전지는 다음 멸균과 함께 두 번 세탁 칼슘과 마그네슘이없는 식염수 (PBS), 씻어 당 10 ML은 흡인하여 각 시간을 제거 인산 버퍼입니다.
- 세포 monolayer (25mm 2 플라스크 1) ML 세포 (참고 4 참조) 분리를 시작 때까지 1 트립신 / EDTA (에틸렌 다이아 민 테트라 초산)가 추가되고 2 3 분 상온에서 세포에 남아 있습니다.을 떼어 놓다하기 이것은 술병이 (참고 5 참조)은 불빛에 개최되는 약간 불투명 monolayer의 형성 작은 구멍으로 경험 사용자가 볼 수 있습니다. 세포는 단일 세포 현탁액을 보장하기 위해 충분한 시간을 trypsinised해야하는 동안이 세포 죽음과 세포가 다시 도금 아르 가난한 첨부 높은 수준의 결과 때문에,주의가 trypsinisation에 SMSC 필름 따위를 지나치게 노출하다하지 않도록해야합니다.
- 중지하려면 트립신 반응, 혈청 함유 배지 (DF10은) 2 볼륨 (즉, 트립신 솔루션의 두 볼륨)의 최소한 추가됩니다. 25mm 두 플라스크를 subculturing 때이 단계 9 ML DF10를 추가하는 것이 편리합니다. 세포의 10분의 1 분할 그러면 쉽게 신선한 DF10 매체의 추가 구 ML 함께 새로운 25mm 두 문화 술병으로 인한 세포 현탁액 1 ML을 diluting하여 만들 수 있습니다. 나머지 세포는 (참조 cryopreserved 셀 확장 (큰 선박으로 환승), 사용 (제 1.2를 참조) 또는 계산 및 확산과 생존 assays, 차별화, 성장 인자 치료 또는 다른 목적을 위해 실험적인 요리, 우물이나 접시에 도금 수 있습니다 아래).
1.2. 셀 라인과 차 문화의 Cryopreservation
- cryopreservation 전지는 subculture 위해 monolayer (제 3.1.1)에서 dissociated 및 원심 분리 (1,000그램 3 분)에 의해 pelleted이됩니다.
- 뜨는은 흡인하여 제거하고 세포가 신중하고 신속하게뿐입니다 그들은 원심 분리에 의해 다시 pelleted 전에 믹스 다운 프리즈 10 ML (DF10에서 10 % DMSO)에 다시 정지.
- 이 시간은 펠렛은 (표 1 참조) cryovial 당 세포 현탁액의 0.5 ML 수 있도록 믹스 다운 충분한 동결에 다시 중단하고 즉시 ° C 야간 80에 배치됩니다.
- Cryovials는 장기 저장 (주 6 참조) 다음날 액체 질소로 전송됩니다. 마찬가지로 세포의 해동과 cryopreservation의이 과정은 신속하게 진행해야합니다. DMSO는 동결 중에 세포 점막에 대한 보호하는 동안 그것은 비 - 냉동 온도에서 세포 매우 유해합니다.
1.3. 휴대폰 번호를 결정
- 단일 세포 현탁액 (다음 subculture)의 세포 농도를 확인하려면 노이 바 우어의 혈구계 사용할 수 있습니다. coverslip을 계산의 정확성을 보장하기 위해하는 것은 안전 (주 7 참조) 혈구계베이스에 마운트해야합니다.
- 세포 현탁액의 작은 방울은 다음 coverslip의 가장자리 가까이에 위치하고 있으며 모세관 현상에 의해 이동하게됩니다.
- 전지는 다음 위상 콘트라스트 조명과 거꾸로 현미경을 사용하여 계산됩니다. 최종 세포 농도, C의 정확도를 높이려면그들은 원래 세포 현탁액을 희석해야하며 세포가 다시 계산 할 경우 계산 챔버의 엘스는 중복 안됩니다. Clumping는 trypsinisation 동안 세포의 철저한 분리로 피해야한다 그리고 알려진 표면 영역 100-200 전지는 휴대폰 번호의 정확한 견적을 얻기 위해 계산해야합니다. 노이 바 우어의 혈구계를 사용하여 편리한 방법은 2 개 이상 16 평방 세트에서 세포를 계산하는 것입니다. 밀리리터 당 셀 밀도는 다음 계산 세트의 숫자 (예 : 2) 전체를 분리하고 10 4로 곱하여 얻어진다. 예를 들어, 100 세포는 2 x 16 픽셀의 사각형 세트 = 2분의 100 = 5 × 10 5 세포 / ML 이상시켰다.
2. 기본 골격 근육 Microexplant 문화를 구축
차 마이크로 explant 문화 포어 개별 근육과 팔다리 뒷다리, 다이어프램, 뒤로 복부 근육을 포함한 모든 접근이 골격근에서 SMSC을 분리하는 데 사용할 수 있습니다. 청소년과 성인에서 근육 microexplant 문화를 파생하는 방법은 스미스와 스코필드 3 자세히 설명하고 이후 청소년, 성인 및 노인 마우스 근육에서 SMS 세포를 유도하기 위해 광범위하게 사용되고 있습니다. 방법은 또한 물고기 24 인간의 골격근 (라오와 스미스되지 않은)에서 교양 골격 근육 세포를 추출하는 데 사용할 수 있습니다. 마우스 근육 microexplant에서 SMSC의 파생물은 그림 1A, B의 그림입니다. 방법은 배아 근육 전구체 세포 (3 항 참조)의 격리를 위해 수정되었습니다. 다음과 같이 기본적인 방법은 다음과 같습니다 :
- 갓 학살 마우스 타겟 근육 (들)의 무균 절개는 불임 악기, 깨끗한 작업 공간 및 70 % 에탄올 스프레이 자유로운 사용을 사용하여 이루어진다.
- 절연 근육 DF20 매체의 두 가지 변경을 통해 세탁 있으며, 60mm 두 접시에 신선한 DF20 매체에 게재됩니다. 스테레오 해부 현미경의 근육을 사용하는 것은 신중하게 지방, 결합 조직 및 뼈 제외 무균 조건 하에서 microdissected 있습니다.
- 청소 근육 조각 그러면 보석상의 집게를 사용하여, 50 μL DF20을 (주 8 참조)가 포함된 96 - 웰 플레이트의 중심에 개별적으로 60 우물을 배치, 400 μm의 세 조각으로 절단됩니다. 웰스는 현미경으로 검사하고 인큐베이터에 배치됩니다. 외부 웰스는 explants (3)이있는 우물 밖으로 건조 방지하기 위해 식염수로 가득합니다.
- Microexplant 첨부 파일 및 파생물은 24-48 H 보육 후 이후 48-72 H 간격 (교양되는 근육의 성장 속도에 따라)에서 점수입니다.
- SMS 세포의 확장과 고립에 대한, 가지 문화는 개별적으로 주로 SMSC 형태 (그림 3.1b 참조) 통합 클러스터의 성장과 함께 높은 refractivity 즉 구면 mononucleate 세포와 세포에 대한 모니터링해야합니다.
- 매체 증가 세포 밀도로 인해 acidifies 때 일단 explant의 가지는 개인 우물은 중간의 50 μL 단위의 추가에 의해 (주 9 참조) 공급 아르 설립. 우물이 완전하고 거의 합류 문화 셀 때, 우물은 세포에 의해 분비 "에어컨"요소 (; 섹션 2.1 복제 아래 에어컨 매체에 주석을 참조)의 유지를 보장하기 위해 매체를 각 시간의 50 % 교체하여 공급하고 있습니다. 차별을 억제하기 위해 60~70%의 코플루엔스 기본 explant의 outgrowths에서는 세포 3 수유를위한 칼슘 고갈 DMEM/F12 (모든 보충은 동일하게 유지)에 대한 DF20 매체를 대체하여 칼슘 고갈 매체로 전환하고 있습니다.
- 에어컨 매체가이 단계에서 문화의 준비 및 기본 SMSC (복제 방법, 섹션 2.1, 그림 1C F 참조)의 확장과 복제하는 동안 사용하기 위해 저장할 수 있습니다 Explant. 문화는 dispase 방법 (제 3.5 참조)를 사용 subcultured 있습니다.
- Clonally 파생 SMSC는 근육내 주사 (그림 3.1 GK) 19 생체내 분석할 수 있습니다.
- Karyotyping는 (섹션 2.2, 그림 3.1 리터 참조) 25 diploid 상태를 확인 clonally 파생 SMSC 라인에서 수행하실 수 있습니다.
- 이 방법은 culturing 배아 근육 (제 3) 적용할 수 있습니다.
2.1. Clonal 유도
기본 explant의 myoblast 문화 (그림 1A, B)는 야생 형 및 돌연변이 골격 근육에서 다른 성장 매개 변수의 다양한 설정을위한 유용하고 정확한 도구입니다. Clonal 파생, 하나의 세포에서 세포 라인의 고립은 골격 근육 줄기 세포의 분리에 필수적인 단계이며 RNAi 구조 또는 transgenes와 transfected subclone SMSC 라인에도 사용하실 수 있습니다. 설립 SMSC 및 기본 explant 문화는 매우 밀도 의존하고 있으며 것입니다 "크하H "(접시에서 분리하고 죽어) 너무 낮은 세포 밀도에서 밖으로 도금하는 경우. 성장과 세포 생존을 유지하는 데 필요한 SMSC 자료 수용성 요소. 고밀도 문화를 시뮬레이트하는 동안 이러한 요소들을 공급하기 때문에이가 복제 프로세스는, SMSC는 자기 냉방 매체 복제됩니다. 냉방 매체뿐만 아니라 개별 세포가 고립된 환경에서 세포 분열 따위에 의해 번식 수 있도록 필수적인 것으로 판명되었다.
- 에어컨이 매체는 33의 75 % 합류 사이 48 H에 대한 교양 proliferating SMSC에서 준비가되어 있습니다.
- 이러한 세포가 재배되는 미디어는 48 H 후 제거하고 0.2 μm의 주사기 필터를 사용하여 필터링, 이것은 에어컨 매체의 불임을 보장하고 모든 잔여 세포와 찌꺼기를 제거합니다.
- 이 시설이 매체는 새로운 문화 매체와 1:1 비율 (복제 매체, 주 10 참조)에 혼합하고 단세포 복제에 대한 문화 매체로 사용됩니다.
- 단세포 dilutions 세포를 달성하기 위해서는주의 trypsinisation (SMSC 설립) 또는 dispase 처리 (주 explant 문화)에 의해 하나의 세포 현탁액에 dissociated 100 μL 복제 매체 당 하나의 세포의 농도로 희석하고 있습니다.
- 이 세포 현탁액의 50 μL은 다음 96 잘 판의 중심 60 우물의 각으로 도금 수 있습니다.
- 세포가 37 부화하여 첨부할 수있게됩니다 ° C 5 % 6 H 각 잘에 대한 CO 2는 다음 조심스럽게 세포의 존재에 대한 점수입니다. 0 또는 세포 하나 이상을 포함 웰스는이 단계에서 할인됩니다.
- 하나의 연결된 세포를 포함하는 웰스는 신중하게 언급하고이 단일 세포에서 파생 식민지는 신중하게하는 하나의 세포에서 파생된 하나의 식민지가, 존재하기 위해 (매일 처음 몇 일 동안) 모니터입니다. 셀 라인은 한 세포를 포함하는 우물에서 파생되었다. 그림 1C - E는 같은 단세포 파생 식민지의 확장을 보여줍니다.
- 일단 식민지가가 48 잘 플레이트 잘 하나에 subcultured 수있는 96 - 웰 플레이트에 합류 도달합니다.
- 충분한 세포가 25cm이 플라스크에 번호판을 사용할 수 있습니다까지 6 - 잘 접시 - 복제 세포 라인은 다음 신중하게 24으로 확장하실 수 있습니다.
- 이러한 문화의 골격 근육의 기원은 Myf - 5의 표현 (그림 1 층) 또는 MyoD 및 인원 7 같은 다른 골격근 특정 마커에 의해 입증하실 수 있습니다.
- 이 단계에서 라인은 (표 1 참조) 더 확장하기 전에 아래 냉동 있습니다.
2.2. Karyotyping
Karyotyping 모니터링 셀 표현형의 중요한 방법입니다. clonal 파생하여 파생 세포 라인들은 자신의 표현형 영향을 미칠 수 총 염색체 rearrangements없이 diploid의 염색체 보완을 유지했는지 확인하기 위해 karyotyped해야합니다.
- karyotyping 세포에 대한 문화 mitotic 세포의 비율을 최대화하기 위해 25cm 두 문화 선박 후반 지수 단계 (80 % 합류) (이일 subculturing 이후)으로 성장하고 있습니다.
- 세포를 karyotyping 전에 스물 네 시간 10 ML 신선한 배지로 공급하고 있습니다. 10 MG / ML 콜히친 (참고 11 참조)의 0.2 ML 그 다음 37 추가 1 H에 대한 incubated하는 세포에 추가됩니다 ° C.는
- 1 H 후에, 세포는 배지와 PBS의 세척 모두 수확 mitotic 세포의 수를 최대화하기 위해 유지되는 경우를 제외하고 표준 trypsinisation의 subculture 절차에 따라 달라질 수 있습니다.
- dissociated 세포, 중간 및 PBS의 세척은 3 펠릿 세포로 분 및 뜨는 제거하고 표백제로 삭제.위한 1천g에 늘인 아르 유지
- 세포가 다시 원심 분리에 의해 pelleted되기 전에 세포 펠릿 그런 다음, 정확히 4 분에 대한 0.0075 M의 칼륨 염화물 5 ML에 다시 일시 중지되었습니다.
- 뜨는의 대부분은 다시 중단을위한 튜브에 소량 (~ 50-100 μL)를 떠나, aspirated입니다. 휴대 슬러리를 얻을 때까지 팔콘 튜브의 기반을 flicking하여 세포를 Resuspend. 다음과 같이 : 세포 그러면 갓 만들어진 얼음처럼 차가운 정착액 (3시 1분 비율 빙초산 메탄올) : 얼음위에 위치하고 해결되는 정착액의 10 ML 천천히 작은 유리 파스퇴르 피펫을 사용하여 세포 dropwise 추가됩니다 ( 이것은) 세포 clumping을 방지합니다.
- 세포는 세포 펠렛은 0.5 ML 신선한 정착액에 다시 정지하는 후 원심 분리하여 pelleted 후 30 분 얼음에 위치하고 있습니다.
- 슬라이드는 45 °의 각도에서 개최 준비 슬라이드 (제 3.2.2.1 참조)에 고정 세포 현탁액을 놓아 생산됩니다. 잘 간격 metaphase을 보장하기 위해서는 피펫 적어도 30cm 슬라이드 위에 개최한다 펼쳐집니다.
- 염색체를 시각화하기 위해 슬라이드는 사용하기 직전 귀르 버퍼 산도 6.8의 세 볼륨 희석, 레쉬맨의 스테인 2 분 스테인드 있습니다.
- 슬라이드는 실온에서 건조하고 DePex 장착 중간에 마운트됩니다.
2.2.1. Karyotyping에 대한 슬라이드 준비
- 유리 슬라이드 (프리미엄 현미경 슬라이드, VWR 인터내셔널, 영국)는 황산의 큰 (유리) 용기에 하루를 배치하여 karyotyping 프로토콜에 사용하기 위해 준비하고 있습니다.
- 슬라이드는 다음 8 H에 대한 수돗물을 실행에 따라 배치하고 필요한 때까지 다음 70 % 에탄올에 저장되어 있습니다.
- 사용하기 전에 슬라이드가 추가로 30 분 수돗물을 실행하고 1-2 H. 위해 상온에서 공기 건조에 따라 씻어서해야
3. 태아에서 차 마이크로 explant 문화 구축
쓰리 마우스 종자는 MDX 및 CAV3KO (dystrophic의 돌연변이 모두)와 함께이 방법을 (C57BL/10) 야생 - 타입을 확인하는 데 사용되었습니다. dystrophin - 결함 MDX 마우스가 C57BL/10에서 자발적으로 시작된,이 라인은 1991 년 불필드 실험실에서 얻은되었으며 이후 지속적으로 우리의 근친 식민지 26 유지되었습니다. caveolin - 3 유전자의 돌연변이 포함되어 CAV3KO의 dystrophic 마우스는,이 연구 27 사용되기 전에 10 세대에 대한 C57BL/10 배경에 자란 있었다. 각 마우스 라인은 각 변형에 대한 배아 단계 구체적이고 달랐다 견고하게 재현할 가지, 증식 및 생존 프로파일을 생성. 다음 프로토콜은 스미스와 본질적 여사 21로 스코필드 PN (1994) 3에서 태아에 대한 적응했다.
3.1. 배아 컬렉션
- 취득하려면 배아를 개최, 쌍은 자연 (1:1) matings로 설정하고 여성은 질 플러그 매일 아침 확인합니다. 플러그 감지 당일, 배아는 E0.5 일 (12 H 포스트 - 수정)로 계산됩니다.
- 질 플러그가 감지되었습니다되면 수컷은 배아 준비의 정확성을 보장하기 위해 케이지에서 제거됩니다.
- 원하는 배아 단계는 (E17.5에 E11.5) 어미가 자궁 전위에 의해 사망에 도달하면 복부가 면도이며, 피부와 주변 지역은 70 % 알코올로 채취되고 자궁이 수평으로 복부 절개를 통해 제거 멸균 해부 악기를 사용했다.
- 자궁은 다음 해부하기 전에 신선한 PECM을 포함하는 작은 그릇에 배치되기 전에 기본 explant 문화 매체 (PECM)에 한 번 세탁 있습니다.
- E17.5 배아에 E11.5은 해부 현미경을 사용하여 자궁의 해부 및 자세한 microdissection을위한 준비에 PECM가 포함된 배양 접시에 각각 배치됩니다.
3.2. 배아 Microdissection
- 개인 배아는 더욱 골격근 풍부한 영역 (그림 2A 참조) 분리를 해부하고 있습니다. 뒷다리와 앞발은 (hypaxial 골격 근육)뿐만 아니라 위턱과 아래턱에 몸 벽 (주로 골격 근육 epaxial)로, 밖으로 해부하고 있습니다. 이 흉부의 길이를 따라 절개하려면, 복부 및 골반은 배아의 내부 장기를 제거할 수 있도록 만들어집니다.
- 배아 골격 근육 줄기 세포 (eSMSc)를 풍성하게하기 위해, 머리, 척수 및 모든 내부 장기가 다음 제거됩니다.
- 이전 배아 (E15.5 - E17.5 배아)에서 그것은 문화의 근육 세포의 비율을 높일 다시 피부와 연골 / 뼈를 제거하는 것도 가능합니다.
3.3. 엠브료 Microexplant 문화를 설정
- 그들은 신선한 PECM에 배치됩니다 밖되면 앞발, hindlimbs과 위턱과 아래턱에 몸 벽은 해부되었습니다 더욱 평등한 크기 (~ 0.5 mm 3; 그림 2A)의 조직의 작은 조각을 만들어 microdissected.
- 이러한 microexplants 그때마다 잘 50μL PECM를 포함하는 96 - 웰 플레이트의 중심 60 우물 (한 explant 당 자)에 부착 할 것입니다. 물론 당 1 explant를 포함하는 60 우물의 최소 설립되며, 당 난자는 공부했습니다.
- culturing의 배아의 중심 60 우물은 explant합니다 (그림 2B)에서 파생된 곳을 나타내는 지역으로 세분화 수 있습니다. 이 디자인은 각각 15 우물 각각 포함, forelimb, 상체 벽, hindlimb 낮은 신체 벽면 explants 21에게 있습니다.
3.4. 모니터링 가지
가지 속도는 배아 골격 근육 explants의 성장률의 신뢰성 측정하고 여기에서 설명한 신중하게 제어 조건 하에서 높은 재현할 수 있습니다.
- Explants가 37 incubated 아르 ° C, 5 % 3 주 동안 CO 2와 거꾸로 현미경을 사용하여 culturing의, 3 7 14 21번째 날에었다. Explants는 (그림 3A, 전자) 잘 각각의 세포의 합류의 수준에 따라 점수입니다.
- 문화의 사진 이미지는 현미경과 100 ASA 후지 (컬러) 또는 코닥 티맥스 (흑백) 전문 필름 (그림 3 층). 연결된 SLR 카메라를 사용하는 예를 들어, 취할 수 있습니다
- 골격근육 특정 Myf - 5에 대한 특정 항체가 Myf - 5 긍정적 긴장에서이 방법을 사용하여 격리 세포의 80 95 %에 따라, eSMSc의 골격 근육 출처를 증명하는 데 사용할 수 있습니다. 이러한 MyoD 및 인원 7 같은 다른 마커 이러한 셀 인구의 골격 근육 출처를 증명하는 데 사용할 수 있습니다. 이러한 세포는 그들이 골격근의 원산지의 모든 아니면 그들이 모두 줄기 세포있다는 것을 (특히 젊은 배아)을 가정 수없는 배아 골격 근육 줄기 세포의 매우 높은 비율을 포함하는 동안. 순수한 줄기 세포의 인구를 분리하기 위해이 섹션 2.1에서 설명한대로 clonally 기본 explant 문화를 유도하는 것이 필요합니다.
3.5. Subculturing 기본 배아 Explants
SMSC (그림 3 층)의 형태학의 기능을 표시되면 합류, explant 문화는 다음 세, 21로 subcultured 수 있습니다
- 문화 매체는 0.2 μm의 Acrodisc R_ 주사기 필터를 사용하여 필터링 선택한 우물에서 제거하고 에어컨 매체로 사용하기 위해 유지됩니다. 매체는 1 주일 동안 4 ° C에 저장할 수 있습니다.
- PECM에 dispase 희석 1시 10분 100 μL은 각 잘 추가하고 번호판은 다음 20 분에 대해 37 ° C 배양기로 반환됩니다.
- 피펫 팁 그런 다음 부드럽게 잘의 표면에서 느슨하게 세포를 긁어하는 데 사용됩니다.
- 세포 현탁액은 다음 펠릿 세포 표면에 뜨는 제거하고 삭제합니다 3 분 1천그램에 centrifuged입니다.
- 전지는 냉방 매체와 PECM의 1시 1분 믹스 200 μL에 다시 일시 중지됩니다.
- 셀 혼합은 더욱 확장 48 잘 접시로 전송됩니다.
- 시험 관내 분석 세포에서 48 - 잘 플레이트 (각각 9mm이 멸균 유리 coverslip을 포함) 또는 8 잘 유리 챔버 슬라이드에 중 2 5 X 10 3 셀 / cm의 밀도에 도금 수 있습니다. 그들이 차별 화를 허용 매체로 전송되기 전에를위한 차별화 분석 세포는 고정하기 전에 3 일간 (체외 방법 세부 사항에 대한 제 4 참조) 50~60%의 합류로 하룻밤 성장하고 있습니다.
4. 골격근의 줄기 세포와 차 문화의 체외 분석
4.1. 셀의 준비
- Dispase subcultured (제 3.3) 기본 배아 explant 문화 3 X 10 3 셀 / cm 2 밀도에서 48 잘 접시에 coverslips에 PECM / 에어컨 매체 도금 및 첨부할 수 있습니다.
- apoptosis 및 확산 coverslips의 평가 추가 10 분 PBS 세척 다음, 실온에서 20 분 PBS에 (4.2 절 참조) 4 % paraformaldehyde에 고정, PBS로 두 번 씻어 수 있습니다.
- Coverslips이 방법은 최대 PBS 또는 PBS / 글리신 1 주일 동안 4 ° C에 저장할 수 있습니다 준비.
4.2. Paraformaldehyde 정착액의 준비
- 펌 모자, 4g의 무게를 paraformaldehyde (PFA, 시그마 - 알드리치, 영국) 및 자기 활동가와 멸균 PBS의 100 ML의 유리병에 추가할 수 있습니다. 얼굴 마스크와 장갑은 보호를 위해 착용한다.
- 가루가 해소 때까지 연기 후드에서 솔루션은 자기 열판에서 가열하고 계속 흔들 것입니다. 이것은 65 ° C.에서 약 50-10 분 소요 케어가 70 위 상승 온도를 방지하기 위해 이동해야 ° C 높은 온도에서 폭발 솔루션의 위험이 있기 때문입니다.
4.3. Apoptosis 및 확산 분석
- 고정 coverslips는 (제 4.1에서와 같이 준비) 10 μg / 3 분 ML DAPI 물들일 수 있습니다.
- Coverslips는 PBS (5 to10 분)에 한 번 세탁하고 유리 슬라이드 17, 18 매체를 장착 vectashield의 장소로 바뀌 있습니다.
- coverslip의 가장자리는 손톱 니스 (참고 12 참조)와 함께 봉인된 있습니다.
- 스토리지, 슬라이드는 호일에 싸여 있으며 20 ° C.에 배치
- 카운트 들어, 슬라이드는 수직 현미경에 형광 (UV 필터)에서 볼 수 있으며 접안 렌즈의 경위 선망을 사용하여 apoptotic과 mitotic 세포에 대한었다. 스물 무작위로 배포 격자가 계산됩니다 (~ 1000 세포를 대표하는), 그리고 세포가 morphologically (그림 3 G)가 아닌 apoptotic, apoptotic 또는 mitotic 같은 특징이 있습니다.
- Mitotic 및 apoptotic 인덱스는 전체 세포의 비율로 계산됩니다.
4.4. Immunohistochemistry
coverslips에 고정 세포 immunohistochemistry에도 사용할 수 있습니다. 사용 항원 검색을위한 압력 밥솥의 coverslips는 단단히 표준 종이 클립을 사용하여 유리 슬라이드에 첨부해야합니다. Immunostaining는 (참조 Myf - 5 (1 / 1, 000 희석)에 항체를 사용하여 정체성을 확립하기 위해, Ki67 (1 / 1, 000 희석)에 항체를 사용하여, proliferating 세포를 식별하거나 유전자 발현을 조사하는 데 사용할 수 있습니다제 4.5). Immunostaining는 방법 번호, 다음 ((28, 29)에서 설명)는 저자에 의해 정기적으로 사용하는을 사용하여 얻을 수 있습니다 :
- 나트륨 구연 산염 버퍼는 압력 밥솥에서 미리 가열합니다. 항원 검색을 위해, sectioned 조직을 포함하는 슬라이드는 온수 버퍼에 넣습니다 2 분 압력 하에서 가열. 압력이 단단히 압력 밥솥의 뚜껑을 잠금 및 무게에 배치함으로써 달성됩니다. 2 분 검색 시간이 경과되면 압력 밥솥 다음 신중하게 압력을 줄이기 위해 차가운 수돗물을 실행하는 아래에 배치됩니다. 최대 끓는 버퍼를 방지하기 위해주의가 압력이 대기압과 같도록 때까지 뚜껑을 제거하지 않도록해야합니다. 무게가 쉽게 제거 (강제하지 않고)와 뚜껑 제거 수있을 때 압력이 충분히 줄일 수있다. 슬라이드는 다음 버퍼에서 제거하고 10 분 공간 온도를 PBS로 씻어 있습니다.
- 슬라이드 5 분 3 % 과산화수소 / 수돗물 물에서 그들을 immersing 후 PBS로 세 번 씻어하여 사전에 차단 + 0.05 % 트윈 20 (세척 당 10 분).
- 차단은 상온에서 TNB 차단 버퍼에 30 분 보육 (TSA 키트에 공급)에 의해 이루어진다.
- 차 항체는 적절한 희석 (적정가에 도착, 주 12 참조) TNB 버퍼에 희석하여 4 박 incubated 수 있습니다 ° C (또는 상온에서 또는 1-2 H).
- PBS 세 10 분 세척 + 0.05 % 트윈 20 다음, 슬라이드는 TNB 버퍼에 희석 해당 biotinylated 두번째 항체에 실온에서 1 H에 대한 incubated 수 있습니다.
- PBS에 대한 세 10 분 세척 + 0.05 % 트윈 20 다음, 슬라이드는 TNB 버퍼에 1:100 희석 Streptavidin - HRP 30 분 (TSA 키트에서 제공)에 대한 incubated하고 다음 (10 분 각각)에서이 세 번 씻어 PBS + 0.05 % 트윈 20.
- Biotinyl의 tyramide (증폭 시약, 키트 TSA)은 다음 8시 사이에 15 분 (정확한 시간은 최적화 실험에 의해 얻은한다)의 각 섹션에 추가됩니다.
- 다음 확대, 세차 세 번 (10 분마다) 후 PBS에서 + 0.05 % 트윈 20 SA - HRP 30 분 부화를 슬라이드.
- 세 이상 세척 (10 분마다) PBS에서 + 0.05 % 트윈 20 다음, 3,3을 사용하여 시각화 5-10 분 _ - diaminobenzidine tetrahydrochloride chromogen (DAB). 다음 haematoxylin에서 슬라이드를 counterstaining하고 coverslipping 전에 물을 두 최종 세척을 수행합니다. DAB는 알려진 발암 물질이며 (콜히친, 섹션 3.2.2에 대한)를 유의해서 다루어 져야합니다.
4.5. 차별
- (참고 13 참조) coverslips 또는 챔버 슬라이드에 도금 SMSC는 또한 myotube 분석을위한 고정하기 전에 차별하실 수 있습니다.
- 이 실험을 위해 세포를 10 4 / cm 2 밀도에 도금과 6-8 H. 위해 첨부 허용
- 전지는 다음 삼일 (참고 14 참조) 차별화 허용 조건에 전환됩니다.
- 차별화 매체는 DMEM으로 구성되어 있습니다 + FCS 2 %의 목마 혈청과 1 %의 글루타민과 함께 보충 0.5 %. 이 차별화 허용 배지 48 H 간격으로 대체됩니다.
- Coverslips 그때 (제 3.4.1 및 3.4.2) 위와 같이 4 % paraformaldehyde에 고정됩니다.
4.6. SMSC의 Transfection : Transgenes 및 shRNAi 구조 표현
줄기 세포 및 기본 문화는 transfection에 불응하고 방법의 과반수로 SMSC 및 기본 골격 근육 세포에 transfection 속도가 과도 transfection 방법의 사용을 방지, (<10 %) 매우 낮습니다. 이것이 transgene transfected 문화 (제 3.2.1 참조) 인산 칼슘 또는 lipofectamine과 함께 다음과 transfection에서 clonal derivates을 분리하기 위해 연구실에서 표준 연습을했습니다을 극복합니다. 또는 세포가 효율적으로 virally 패키지 구성의 감염을 사용하여 transfected 수 있습니다. 그림 1m가 PD50A, pIRV, 복제와 함께 G418의 선택에 따라 다음과 감염 격리 clonal SMSC 유도체의 β - galactosidase의 안정적인 표현을 보여줍니다 neo/G418 저항 및 β - galactosidase (19)에 대한 유전자를 운반 결함이 레트로 바이러스. 이 세포 라인은 공식적으로 SMSC는 (그림 3.1 참조)에서 생체내 기능 줄기 세포로 동작 것을 증명하기 위해 사용되었다. 마커 유전자를 표현하는 안정적인 clonal 세포주의 생성은 생체내 줄기 세포 이식 실험에 대해 바람직하지만, 그것은 체외에서 유전자 기능을 분석 시간이 오래 걸릴 만족스럽지 방법입니다. 이러한 이유로 저자는 최근 60-70%의 transfection 속도를 전달할 수있는 Lipofectamine 2000 transfection 시약의 최적화된 수정을 개발했습니다. 이것은 transgenes 또는 RNAi의 과도 transfection을 사용하여 유전자 기능의 분석 SM으로 구성 가능SC 또는 기본 explant 문화 (그림 3H, I). 저자는 SMSC의 mRNA 표현의 유전자 특정 대상 수 shRNAi 구조를 생성하는 짧은 헤어핀 RNAi 벡터 (pSHAG RNAi) (30)를 사용합니다. shRNAi 기술의 성공은 두 가지 요소에 따라 다릅니다 (A) 효율적인 transfection 방법 및 구체적 대상 유전자를 인식 짧은 헤어핀 시퀀스 (B) 설계. shRNAi은 eGFP는 RNAi의 분해 방법 (그림 3j, M)를 확인하는 데 사용할 수있는 이동 구축.
4.7. SMSC에 대한 최적화된 LipofectamineTM 2000 Transfection 프로토콜
- 세포 4월 5일에서 10일까지 셀 / 250 μL DF10 문화 매체 챔버 슬라이드에 cm 2 도금 및 95 %의 합류 (최적의 각 세포 라인에 대한 합류 다른 밀도에 transfection 속도를 평가에 의해 설립되었습니다)에 도달하려면 18 H에 대한 양식입니다.
- 각 글쎄요, DNA (shRNAi 벡터, transgenes)의 0.5 μg 2 밀리미터의 글루타민과 함께 보충 및 살균 Eppendorf 튜브에 부드럽게 혼합 혈청없는 DMEM 33 μL에 추가됩니다하십시오.
- 각 잘 들어, Lipofectamine 2000 1.25 μL는 별도로, 혈청이없는 배지 DMEM + 글루타민의 추가 33 μL의 희석 부드럽게 혼합하여 5 분 실온에서 보존됩니다
- DNA와 lipofectamine 믹스는 다음 급속하게 함께 추가 pipetting 60 s에 대한 부드럽게 혼합 후 DNA Lipofectamine 2000 단지가 형성 수 있도록 19 분 실온에서 incubated입니다.
- transfection 들어, 복잡한 믹스의 66 μL 잘 각 챔버에 추가 및 슬라이드는 부드럽게 단지 동등한 배급을 보장하기 위해 10 S에 대한 누볐어 있습니다.
- 전지는 37 ° C와 5% CO 2에서 24-72 H에 대한 incubated 수 있습니다. 구조, 기능 유전자 발현 또는 shRNAi의 분해에 따라 먼저 8 24 H 사후 transfection 사이에 감지됩니다.
5. 대표 결과
explants가 신중하게 성인 골격 근육이나 배아에서 explanted 때 explants 37에서 배양 72 시간에 몇 시간 이내에 세포 ° C (5 % CO 2 / 공기) (그림 3A).을 생성하기 시작합니다 이러한 문제가 발생하는 이동 시간은 explants의 소스에 따라 다릅니다 배아 explants 더 빨리 나이가 성인 골격 근육 explants보다 크다 것입니다. 우리의 경험에 가지의 타이밍은, 29 세 높은 재현할 수 있습니다. 세포 인구의 확장 (이 문화 그림에 대한 그림 3B - F 참조) SMS 전지 차 문화를 통합 고밀도를 생성하는 일 (배아 explants) 또는 주 (이전 골격 근육 explants)의 기간 동안 발생합니다. 그림 1 & 3 골격근과 배아 explants, clonal 파생과 골격 근육 기원을 설명하기위한 성인 줄기 세포, β - galactosidase 라벨, karyotyping 및 배아 SMSC의 myf - 5 immunohistochemistry를 파생 골격근의 생체내에서 이식을 성공적으로 유도와 문화의 대표적인 결과를 보여 . 배아 근육 차 세포의 형태와,, apoptosis와 shRNAi의 transfection 프로토콜 DAPI의 얼룩 세포 인구 그림 3 가지 점수의 대표 결과를 (SMSC를 시각화하는 Myf - 5 immunohistochemistry를 사용하여)를 보여줍니다. 더 자세한 사항은이 두 인물에 관한 그림 전설에서 찾을 수 있습니다. 그림 2는 배아 골격 근육 줄기 세포의 농축 인구를 생성하는 배아 마이크로 절개의 절차를 설명합니다.
표 1 : 계산 테이블 프로토콜 다운 세포 동결 동안 최대 세포 생존에 필요한 cryovials의 수를 추정
| 플레이트 / 플래 스크 / 챔버 슬라이드 | 문화 매체 볼륨 | PBS는 씻는다 | 트립신의 볼륨 | 튜브 다운 프리즈 개수 (3.1.2) |
| 96 - 웰 | 50 μL | 2 X 100 μL | 25 μL | N / A |
| 48 - 잘 | 150 μL | 2 X 200 μL | 50 μL | N / A |
| 24 잘 | 500 μL | 2 X 700 μL | 200 μL | N / A |
| 6 - 웰 | 3 MLS | 2 X 3 MLS | 500 μL | 1 |
| 소형 (25cm 2) | 10 MLS | 2 X 10 MLS | 1 ML | 2 |
| 중간 (80cm 2) | 10 MLS | 2 X 10 MLS | 3 MLS | 4 |
| 대형 (175cm 2) | 10 MLS | 2 X 10 MLS | 5 MLS | 8 |
| 챔버 잘 | 500 μL | 2 X 500 μL | 100 μL | N / A |
N / A = 해당 사항 없음; 여러 개의 우물이 함께 내려 냉동 중이 아니라면 휴대폰 번호는 아래 고정가 너무 낮아되었습니다.
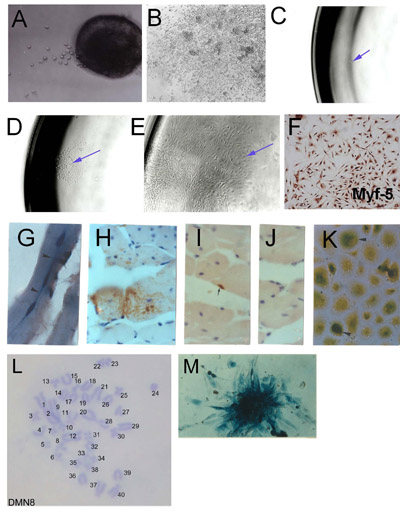
그림 1. microexplants에서 골격근의 줄기 세포 (SMSC)의 분리 : explanted 성인 골격 근육 (2 일)에서 (A) 초기 가지 집계 문화와 높은 세포 밀도를 보여주는 (B) 설립 explant의 파생물.. SMSC의 Clonal 유도. (C) 단일 세포가 96 잘 접시에 고립. Myf - 5 immunohistochemistry를 사용하여 SMSC의 정체성 (D) 단세포 원산지 콜로니. (E) clonal 인구를 설립. (F) 확인. SMSC 클론 삼개월에서 호스트 마우스에 PD50A (β - galactosidase를 표현) (G) 및 (HJ)에서 파생된 세포가 14개월 마우스 정강뼈 앞쪽에 근육.로 2000 PD50A 세포의 사후 주입 (G) 3 최근 (중앙에 위치한 핵 융합 근육 섬유에서) β - galactosidase 양성 세포 (얼룩 파랑) (세로 섹션).의 (H) 광범위한 기여 β - galactosidase - 긍정적인 근육 섬유의 세포 (안티 - β - galactosidase의 항체에 의해 감지 얼룩 갈색) (가로 섹션 .) (I) β - Galactosidase - 긍정적인 인공 위성 세포 (안티 - β - galactosidase의 항체에 의해 감지 얼룩 갈색). (J) 차 항체 제어 (NO 얼룩). (K) β - Galactosidase 양성 세포 (얼룩 파란색) 주입 호스트 근육으로부터 격리 때 문화의 세포 분열 따위에 의해 번식 십이개월 후 사출. (L) PD50A 세포의 식민지에서 β - galactosidase의 표현을 보여주는 정상 diploid의 염색체 보완합니다. (M) Histochemistry를 보여주는 마우스 clonal SMSC 라인 (DMN8)의 핵형 ( AACR 언론, 스미스와 스코필드, 1997)에서 허가를 재현 그림 3.1 G, K,.
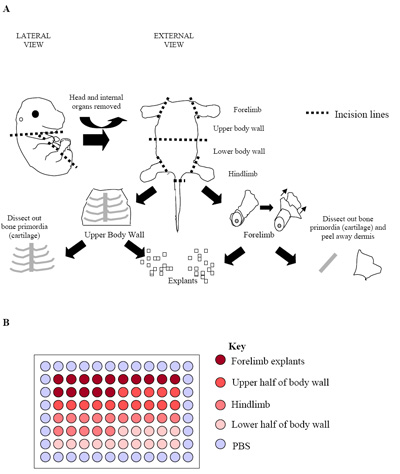
그림 2. 배아 해부 과정 (A) 일러스트. 그림 (연골) 원시 뼈가 쉽게 식별 및 주변 뼈근육조직을 무료 해부 될 수 E15.5 배아를 나타냅니다. 이 단계에서, 그리고 나중에 무대에서 배아 (E15.5 E17.5), 진피도 얻은 골격근 세포의 비율을 최대화하기 위해 제거되었습니다. (B) 96 - 웰 플레이트에 기본 explant 문화의 설치 프로그램을 실행합니다. 각각의 배아는 위의 볼로 하나 플레이트를 생산하기 위해 사용되었다. 평소 연습 판입니다 가지 속도를 확립 세 별도의 배아 (세명 플레이트가 = 180 우물)의 복제를 시작합니다.
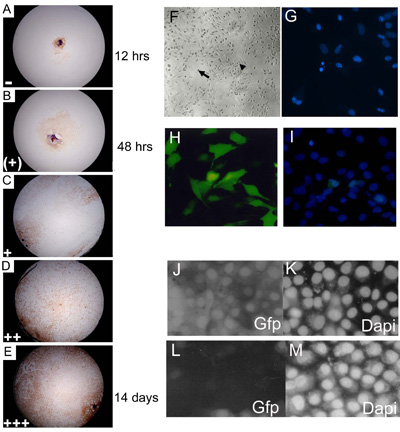
그림 3. 배아 주 explant 문화는 문화 3, 7, 14 21 일 동안 점수와 코플루엔스 수준의 가지 수준의 담당자에게 할당되었습니다. 15 24% (+),, 25 49% (+); 50 74% (++); 75 100 % (0 14% ()를 설명하기 Myf - 5 물들일 (AE) C57BL10 E15.5 기본 배아 explant 문화 + + +) 합류 수준. 데이터를 collating 전에 가지의 각 수준 (점수의 매일)에 보여주는 웰스의 비율은 임의의 숫자 (+ + = 4 + + + = 5; (+) = 2,, + = 3 = 1) 곱한되었습니다 최종 파생물의 가치를 제공합니다. 야생 형 (C57BL/10) 기본 eSMSc의 약 85 %는 골격근 세포 마커 Myf - 5 얼룩. 확대는 10입니다. (F) 설립 배아 문화가 어른 SMSC, 양극성 세포 (작은 화살표)와 구면 monomorphic 세포 (대형 화살표)의 형태학의 특성을했습니다. DAPI의 얼룩을 사용하여 apoptotic 핵 fragmenting의 (G) 확인. (HI) 높은 수준의가 (~ 75 %) 최적화된 Lipofectamine 2000 transfection 방법. (I) 총 휴대폰 번호의 계산을 사용하여 SMS 세포 라인에 GFP - 표현 구조의 transfection의 DAPI counterstain하여 주었입니다. pSHAGshRNAigfp (JM)를 사용하여 RNAi (이 건설 컨트롤로 사용의 예를 들어 (29 참조)) SMSC에서 GFP의 표현을 말살. GFP SMSC 라인에서 GFP 발현을 보여주는 (J) 컨트롤 (모의 transfection). (K) DAPI 제어 . transfection 후 (L) shRNAiGfp 24 H. (M)에 shRNAiGfp transfected 세포에 대한 DAPI 제어 (L).
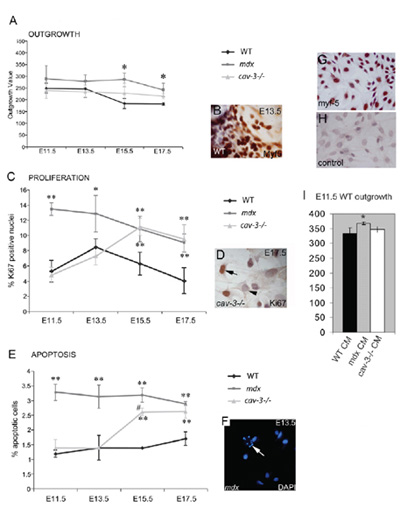
그림 4. Dystrophic, 배아 Myf5 - 긍정적인 myoblast는 hyperproliferative 및 apoptosis하는 경향이 있습니다. 근육 explant 문화에서 배아 myoblasts의 (A) 가지 속도 IS는 병렬로 교양 WT explants과 비교하면 E11.5에서 MDX 돌연변이와 E15.5 E17.5과에서 CAV - 3 (-/-)의 돌연변이에 모두 증가했다. (B) Myf5 - immunostained explant. (C) MDX의 배아에서 E11.5에서와 같은 Ki67 - 긍정적인 immunoreactivity (D)에 의해 결정 E15.5 E11.5에서 MDX에서 돌연변이와 CAV - 3 (-/-)의 돌연변이에 배아 myoblasts의 Hyperproliferation가. (E) 고가 apoptosis 와 같은 DAPI의 얼룩 (F)로 표시 CAV - 3 (-/-)의 배아에서 E15.5에서, F 지점에있는 화살표 apoptotic 세포 수 있습니다. * P <0.05은 WT에 비해, ** P <0.01은 WT에 비해, * P Myf5 얼룩과 <0.05 CAV - 3 (-/-) (G, H)와 MDX 비교 E15.5 기본 교양 WT 배아 myoblasts. (G)와 두 번째 항체 제어 (H). (I) E11.5 WT의 explants의 파생물 율은 E11.5 MDX explant - 에어컨 매체 (CM)에 (* P <0.05) 증가하지만, CAV - 3 (-/-) 또는 WT CM. 오류 바 SD이 수치는 작성자 저작권의 보호를받는 재현하고 첫번째 여사 외., 2009 년 생물학의 회사에 의해 출판 되었음 나타냅니다.
6. 참고 사항 : 중요한 단계 가능한 수정
- 해동 세포가 매우 낮은 세포 밀도에 첨부되면 그것은 단지 문화 충돌을 방지하기 위해 절반 매체를 대체하는 조심스러운 것입니다.
- dystrophic 근육으로부터 격리 SMSC는 apoptosis에 감염될 수 있으며 특히 신경을 써서 다루해야합니다. Dystrophic의 SMSC는 (예 : 5 주 된 dystrophic (MDX) 생쥐에서 얻은 골격근에서 설립되었습니다 dfd - 13 세포주, 등) myoblasts을 위해 평소보다 높은 세포 밀도에서 성장해야합니다. 이러한 apoptosis에 민감한 세포 라인도 높은 밀도 (제 1.1과 1.2를 참조) (19)에 cryopreserved 있습니다.
- monolayer의 세포를 제거하는 다른 방법은 그것이 FCS와 칼슘 (DF10에있는 두)의 존재에서 수행 할 수있는 장점과 함께, 세포 분리의 gentler 방법을 제공 dispase를 활용합니다. Dispase 따라서 subculture하는 데 사용 및 기본 골격 근육 explant 문화와 earlystage SMSC의 클론을 (제 2 및 3 참조) 확장할 수 있습니다.
- 다음과 같이 큰 flasks에 대한 트립신 / EDTA (에틸렌 다이아 민 테트라 초산) 사용 수량은 최대 크기를 조정해야합니다 : 75mm 2 플라스크 (3 ML 트립신)와 175mm이 플라스크를 (5 ML 트립신). 마찬가지로 작은 표면 영역에 대한 (표 1 참조) 사용 트립신의 양을 줄일 수 있습니다.
- 또는 분리가 거꾸로 현미경을 사용하여 모니터링할 수 있습니다, 이것은 초보자를위한 권장합니다.
- 세포 라인의 Cryopreservation은 일반적으로 합류 대형 (175mm 2) 플라스틱 용기를 사용하여 수행됩니다. 7 일 사이 9 cryovials는 cryopreserved중인 세포주의 생존 프로파일에 따라 하나의 큰 혈관에서 얻을 수 있습니다. 차 문화와 새로 설립 세포 라인은 종종 절차를 동결하는 것은 매우 내화물 있습니다. 복구 및 두 가지 방법은 (별도 또는 조합)를 사용할 수있는 이러한 세포를 동결의 성공을 향상시킬 수 있도록 지원합니다. (A) 혼합 아래로 동결의 FCS 컨텐츠는 10 % (50 % 최대)에서 증가 수 있습니다. (B) 과정을 아래 동결은 액상에 튜브를 전송하기 전에 12-24 H에 대한 N2의 기상 단계에서 cryovials을 배치 느려질 수 있습니다.
- haemacytometer의 coverslip의 사무소 첨부 파일을 확인하는 편리한 방법은 오픈 손에 거꾸로 haemacytometer를 잡아 coverslip이나 또는 뉴턴의 반지 (유리의 무지개 반사)을 찾는 것입니다.
- explant 방법의 변형은 immunohistochemistry, 증식 또는 apoptosis assays에 사용하기 위해 단기 문화 고용 수 있습니다. Microdissected explants는 8 잘 챔버 슬라이드를 사용하여 유리에 표시됩니다. 다른 방법은 9mm 24 - 잘 접시에 배치 2 coverslips를 사용하는 것입니다. 두 경우 모두 두 explants 150 μL DF20 매체의 각 잘으로 전송됩니다. 또한, 주 문화는 dispase 방법으로 subcultured하고 또는 직접 8 잘 챔버 슬라이드에 24 - 잘 접시에 배치 coverslips에 밖으로 도금 수 있습니다.
- 가지 속도의 정량 분석을 위해 당 1 explant를 포함하는 60 우물 최소 잘 근육 / 마우스 스트레인 따라 설립됩니다. 적어도 세 별도의 동물을 사용해야하는 부담에 대한 성장 매개 변수를 설정합니다. 가지가 채점되는 동안 접시 및 개인 우물이 공급되지 않습니다.
- 복제 설립 SMSC 선은 에어컨 매체와 DF10 매체의 1:1 혼합의 문화 단일 세포로 충분합니다. 기본 explants을 위해 그것은 20 %로 문화 매체의 혈청 내용을 높일 필요가 있습니다.
- 콜히친는 매우 독성과 발암 물질 알려진이고 적절한 유의해서 다루어 져야합니다. 더블 gloving 및 지정된 트레이의 굴레에서 작업하는 것이 필수적입니다. 모든 disposables (예 : 길슨팁)는 밤새 물이 풍부한 양의 follo - 날개 하루 처리하기 전에 (5 % 나트륨 차아 염소 산염) 표백제의 비커에 넣습니다.
- 현재 1분의 1, 000 희석 각 Ki67과 Myf - 5에 맞는 기본 항체를 사용합니다. 차 항체에 대한 최적의 희석은 동일한 출처에서 얻은 경우에도 동일한 항체의 다른 배치를위한 이상도 사용되고 각 항체에 대한 경험적으로 확립해야합니다.
- 챔버 슬라이드도이 분석에 사용할 수 있습니다. 4퍼센트 PFA에 세포를 고정하기 전에, 문화 매체를 제거하고 세포 37 ◦ C 멸균 PBS로 두 번 씻어. 잘 실, 가스켓 및 접착제를 제거하고 유리는 부드럽게 25 분 지로 - 로커 R_ 쉐이크에 누볐어있다 상온에서 신선한 4 % paraformaldehyde를 포함하는 50 ML 유리 코플린 병에 배치 슬라이드. 슬라이드가 다음 PBS로 두 번 씻어 (상온) 및 중 4 즉시 사용하거나 PBS에 저장됩니다 ◦ C (단기; 1-2주) immunohistochemical (IHC) 분석을 위해.
- 더 광범위한 myotube 형성이 필요한 경우 기본 골격 근육 세포는 최대 8 일 동안 차별하실 수 있습니다.
토론
Microdissected explant 문화가 안정 reproducibly proliferative Myf - 5 긍정적인 골격 근육 줄기 세포 (SMSC)의 매우 높은 비율 (~ 85 %)이있는 세포 인구를 분리하는 데 사용할 수 있습니다. 엄격하게 통제 문화 조건 하에서 기본 explant 문화는 유전자 돌연변이 마우스 SMSC의 성장 동작을 특성화하고 차별화 프로세스의 체외 분석에 대한 자세한위한 myotubes를 생성하는 수단으로 사용될 수 사용할 수 있습니다 여기에 설명되어 있습니다. 이러한 문화의주의 유지 관리 및 조작은 장기적인 문화와 확장이 가능합니다. 방법을 사용하면 단일 세포 희석에 의해 explant 문화 clonal 골격 근육 줄기 세포 라인을 도출하는 것이 가능하다 여기에서 설명한. 복제 절차 중에 절연된 단일 세포의 증식, "시설이 매체는"고밀도 문화에 대해 이러한 세포의 정상적인 요구 사항을 모방하는 데 사용됩니다 달성하려면 다음과 같이하십시오. 방법은 (배아, 성인 및 노인 - 성인 조직에 (수정)를 적용하고 마우스 이외에 인간 (라오와 스미스되지 않은)를 포함한 다른 종류의 골격 근육 세포, 병아리의 배아와 물고기를 격리하는 데 사용할 수 있습니다 연어) 24. Clonally 파생 SMSC는 근육내 이식에 의해 생체내에서 분석하고 이러한 조건 하에서 SMSC는 하이브리드 근육 섬유를 형성하기 위해 호스트 myotubes와 결합됩니다 주입 수 있습니다. Intramuscularly 주입 SMSC는 종양을 형성하지 않으며 년 이상 주사 후 위성 세포 위치에 호스트 근육에서 발견되었고, 그들은 위성 줄기 세포 niche.These 세포에 의해 내생 통제의 대상이되는 제안 주입에서 다시 격리 수 있습니다 이상 십이개월 19 호스트 주사 후 proliferative SMSC로 개최합니다.
공개
감사의 말
우리는 shRNAi 셔틀 벡터 자신의 선물 패트릭 패디슨 감사합니다. 안젤라 슬로언는 그림 3에서 GFP RNAi 이미지를 생성. 우리는 그들의 지원에 대해 다음과 기금 단체에도 감사 :
근육질 영양 장애 캠페인 부여 번호 RA2/592/2은, 부여 번호 02BHM04, 더 로열 학회 부여 번호 574006.G503/1948./JE 및 BBSRC 부여 번호 6/SAG10077 스팍스.
자료
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
참고문헌
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유