Method Article
Adultas y embrionarias del músculo esquelético Cultura Microexplant y aislamiento de células madre de músculo esquelético
En este artículo
Resumen
El micro-disección técnica de explantes es un método robusto y fiable para el aislamiento de proliferación células del músculo esquelético de los músculos menores, adultas o embrionarias como fuente de células madre de músculo esquelético. Excepcionalmente, estas células han sido derivadas por clonación para producir músculo esquelético líneas de células madre utilizadas en el trasplante de vivo.
Resumen
Cultivos de células embrionarias y adultas del esqueleto muscular tienen un número de diferentes usos. El micro-disección técnica de explantes se describe en este capítulo es un método robusto y fiable para el aislamiento de un número relativamente grande de proliferación células del músculo esquelético de los músculos menores, adultas o embrionarias como fuente de células madre de músculo esquelético. Los autores han utilizado micro-disección cultivos de explantes de analizar las características de crecimiento de las células del músculo esquelético en los músculos de tipo silvestre y distrófica. Cada uno de los componentes del crecimiento de los tejidos, es decir, la supervivencia celular, proliferación, senescencia y diferenciación puede ser analizado por separado utilizando los métodos descritos aquí. El efecto neto de todos los componentes del crecimiento puede ser establecida por medio de la medición de las tasas de explante consecuencia. El método de micro-explante se pueden utilizar para establecer cultivos primarios de una amplia gama de tipos de músculos diferentes y edades y, como se describe aquí, ha sido adaptado por los autores para permitir el aislamiento de las embrionarias precursores del músculo esquelético.
Excepcionalmente, micro-explante culturas se han utilizado para obtener clones (origen de célula única) de células madre de músculo esquelético (SSS), las líneas que se pueden expandir y utilizada en el trasplante de vivo. SMSC En vivo trasplantado se comportan como funcionales, específicos de tejido, las células satélite que contribuyen a la regeneración de la fibra muscular esquelética, sino que también se mantiene (en el nicho de células satélite), un pequeño grupo de células madre indiferenciadas que pueden ser re-aislado en cultivo utilizando el método de micro-explante.
Protocolo
Dos métodos se pueden emplear para aislar proliferativa células del músculo esquelético. En los tejidos musculares son digeridos enzimáticamente primero en aislar células individuales antes de enchapado 1. El segundo método consiste en piezas de explantes de tejido muscular en la cultura que permiten a las células crecer durante la incubación, 2, 3. El segundo método se describe en este protocolo. El cultivo de tejidos en sí tiene sus raíces en la cultura de explante. El año 2007 fue el 100 º aniversario de los experimentos clásicos de Harrison en el que obtuvo crecimientos de neuronas mediante la incubación de los explantes nerviosas cuelgan gotas de la linfa 4. Técnicas de explante cultura han sido utilizados y desarrollados en una variedad de contextos diferentes en los siguientes 100 años como un medio para generar proliferación de cultivos primarios de células embrionarias adultas y 4, 5. El principio detrás de la técnica de explante, sin embargo, sigue siendo el mismo, para minimizar el trauma de la celda de aislamiento primario, manteniendo la estructura tridimensional del tejido padres durante las etapas cruciales primeros años de derivación de células mientras que proporciona a las células superando con un medio nutritivo rico en el que proliferan. En el músculo esquelético es una ventaja adicional al uso de la cultura explante debido a que el acto de cortar el tejido muscular trauma imita la fibra muscular, el modo habitual de activación de las células satélite, las migraciones y la proliferación de 3, 6. Células adultas de músculo esquelético por satélite (también llamadas mioblastos) son la población de células madre proliferativa responsable de la reparación de la fibra muscular y el crecimiento de 7.
Explantes de músculo esquelético así imitar el ambiente in vivo de la regeneración muscular y estimular la migración de células madre y la división. En el embrión, la mayoría de los vertebrados del músculo esquelético (músculos del tronco y extremidades) se deriva de los somitas, aunque somitomeres y arcos branquiales dan lugar a la musculatura de la cabeza 8, 9. El miotoma pueden ser identificados como dos grupos distintos de Myf-5 que expresan las células madre localizadas en los bordes dorsal, medial y lateral de la diferenciación somitas, respectivamente. Respectivamente, estas células generan los músculos epiaxiales de la espalda, que se diferencian in situ, y la musculatura hypaxial ventral y lateral (extremidades, abdomen y los músculos respiratorios), que requiere la migración de las células madre de músculo de la somite 10. Madre embrionarias migración de las células del músculo está bajo el control de Pax 3 11. Myf-5 expresión es esencial para el establecimiento de la musculatura del embrión y esta importancia persiste en los músculos después del parto, donde más del 98% de las células satélite activado expresar Myf-5 12. Myf-5 es por lo tanto, un marcador confiable y específica de la población de la proliferación de células madre del músculo esquelético en los tejidos, tanto adultas como embrionarias. Las células madre embrionarias del músculo (también llamados células progenitoras de las células musculares, los precursores del músculo esquelético, mioblastos o células embrionarias, incluso vía satélite) se puede aislar de los somitas de la etapa inicial de embriones de ratón, de pollo y la rana 13. Con el fin de aislar cultivos miogénica de la musculatura del esqueleto embrionario de embriones más viejos que los autores han adaptado la técnica de explante microdissected de tejidos embrionarios. Un enfoque similar es usado por Cossu et al. 14 para generar poblaciones clonales de células embrionarias a partir de los 14 somite.
1. Cultivo in vitro de células de células madre de músculo esquelético (SMSC)
SMSC son líneas celulares de origen unicelular que se han clones derivados de cultivos primarios de músculo esquelético explante. Pueden ser cultivadas utilizando la metodología estándar de cultivo de tejidos, si se toma el suficiente cuidado. Tenga en cuenta que, a menos que se indique lo contrario, todas las manipulaciones descritas se llevan a cabo en condiciones asépticas con una campana de flujo laminar (clase 1 o clase 2 armario estéril) y todos los reactivos de la cultura se calienta a 37 ° C en un baño de agua antes de su uso.
- Para llevar SMSC de almacenamiento de nitrógeno líquido (ver sección 1.2 para congelar por el método) crioviales deben descongelarse con rapidez y el contenido transferido a 5 ml precalentado (37 ° C) DF10 medio de cultivo para la centrifugación inmediata (1.000 g durante 3 min) para eliminar el DMSO . El mejor método para descongelar las células se realiza por medio de la pipeta repetición de pequeñas cantidades de medio de cultivo pre-calentado en el vial antes de transferir al tubo de centrífuga. El proceso de descongelación de las células deben llevarse a cabo muy rápidamente ya que las células criopreservadas contener un 10% DMSO, que es tóxico para las células a temperatura ambiente (DL50 de aproximadamente 2 min).
- Después de la centrifugación el sobrenadante se elimina y se lavan las células son de volver a suspender el pellet de células en un 5 ml DF10, centrifugar como antes.
- El pellet de células se mezcla por segunda vez con 5 ml de DF10 y la suspensión celular resultante se transfiere a una pequeña de 25 cm 2 ve la cultura de plásticossel.
- Cultivos se mantienen a 37 ° C en una incubadora humidificada con 5% de CO 2 en el aire. A menos que los barcos se utilizan con una gorra de filtrado, la tapa del frasco debe ser ligeramente floja durante varias horas para permitir que el aire en el recipiente de cultivo para que se equilibre con la incubadora y se acidifica el medio de cultivo. pH del medio se controla por medio de la incorporación de un indicador rojo fenol pH medio de contraste en el medio de cultivo.
- Las células descongeladas siempre debe ser monitoreado las 24 h después de la siembra y re-alimentados con frescos DF10 medio para asegurar la eliminación de los desechos celulares y toxinas residuales (ver notas 1 y 2).
1.1. Subcultura
Para establecer las líneas de SSS, cuando las células alcanzan aproximadamente el 95% de confluencia, deben ser removidos de su recipiente de cultivo, se diluye y se coloca en un recipiente fresco para permitir un mayor crecimiento. Este procedimiento subcultura se puede lograr por medio de un número de diferentes procedimientos enzimáticos, la tripsina / EDTA es el más frecuente (ver nota 3). Es usual (y buena) la práctica para hacer crecer células en las densidades que se les exige que se subcultivan en el tercer día de crecimiento. Para la mayoría de las líneas celulares SMS esto se puede lograr por las células de división de 10/01 en cada subcultura. Esto permite un monitoreo cuidadoso de las células y permite que los que realizan el cultivo de tejidos para identificar de inmediato el comportamiento del crecimiento inusual (por ejemplo, un crecimiento más rápido), que podrían indicar cambios fenotípicos de la línea celular tales como la transformación o reducción de la apoptosis causada por la adaptación a las condiciones de cultivo. Además, una rutina consistente y cuidadosa subcultivo reduce en gran medida la incidencia de estos eventos.
- Para subcultura con tripsina (tripsinización) los buques son retirados de la incubadora y su medio descartado por aspiración.
- Las células se lavan dos veces con agua estéril de calcio y magnesio libre de tampón fosfato salino (PBS), 10 ml por lavado, elimina cada vez que por aspiración.
- Disociar la monocapa de células (25 mm 2 frasco) 1 de 1 ml de tripsina / EDTA y se deja a las células a temperatura ambiente durante 2 3 minutos hasta que las células comienzan a separarse (véase Nota 4). Esto puede ser visto por los usuarios experimentados como los pequeños agujeros que se forman en la monocapa ligeramente opaca cuando el frasco se lleva a cabo a la luz (ver nota 5). Mientras que las células deben ser trypsinised durante un tiempo suficiente para asegurar una suspensión de células individuales, se debe tener cuidado de no sobreexponer SMSC a tripsinización ya que esto dará como resultado altos niveles de muerte celular y un mal agarre cuando las células se re-plateado.
- Para detener la reacción de la tripsina, medio que contiene suero (DF10) se añade a un volumen mínimo de 2 (es decir, el doble del volumen de la solución de tripsina). Cuando subcultivo un frasco de 25 mm 2, es conveniente añadir 9 ml DF10 en esta etapa. Una fracción de 1 / 10 de las células se puede hacer fácilmente mediante la dilución de 1 ml de la suspensión celular que resulta en un nuevo frasco de 25 mm cultura 2 junto con otros 9 ml de medio fresco DF10. Las células restantes pueden ser utilizados para la expansión celular (traslado a una nave más grande), criopreservados (ver sección 1.2) o contados y se colocaron en platos experimentales, los pozos o las placas de los ensayos de proliferación y la supervivencia, la diferenciación, el tratamiento del factor de crecimiento o para otros fines (ver más abajo).
1.2. La criopreservación de líneas celulares y cultivos primarios
- Para las células de criopreservación se disocian de la monocapa de subcultura (Sección 3.1.1) y se sedimentaron por centrifugación (3 min a 1000 g).
- Se elimina el sobrenadante por aspiración y las células son cuidadosamente y rápidamente se volvió a suspender en 10 ml de congelación de la mezcla hacia abajo (10% DMSO en DF10) antes de que se re-sedimentaron por centrifugación.
- Esta vez, el pellet se resuspendió en congelación suficiente hasta para permitir la mezcla de 0,5 ml de suspensión celular por criovial (ver Tabla 1) e inmediatamente se coloca en 80 ° C durante la noche.
- Crioviales se transfieren a nitrógeno líquido al día siguiente para almacenamiento a largo plazo (véase Nota 6). Al igual que con la descongelación de las células, este proceso de criopreservación debe llevarse a cabo rápidamente. Mientras que el DMSO es de protección para las membranas celulares durante la congelación es muy tóxico para las células a temperaturas bajo cero no.
1.3. Determinar el número de células
- Para determinar la concentración de células de una suspensión de células individuales (subcultura siguientes) un hemocitómetro Neubauer se puede utilizar. Para garantizar la exactitud de la cuenta del cubreobjetos debe ser montado de manera segura en la base hemocitómetro (véase Nota 7).
- Una pequeña gota de suspensión celular se coloca cerca del borde del cubreobjetos y se tendrán por acción capilar.
- Células se contaron usando un microscopio invertido con una iluminación de contraste de fase. Para aumentar la precisión de la concentración final de células, el canas en la cámara de recuento no deben solaparse, si lo hacen la suspensión de células originales se deben diluir y las células re-contados. Aglutinación debe ser evitado por la disociación completa de las células durante tripsinización y 100-200 células en una superficie conocida se debe contar para obtener una estimación precisa del número de células. Un método conveniente el uso del hemocitómetro Neubauer es contar las células en dos o más conjuntos de 16 cuadrados. La densidad de células por mililitro se obtiene dividiendo el total por el número de conjuntos de contado (por ejemplo 2) y multiplicando por 10 4. Por ejemplo, contaba con más de 100 celdas de 2 x 16 conjuntos de cuadrados = 100 / 2 = 5 x 10 5 células / ml.
2. El establecimiento de cultivos primarios de músculo esquelético Microexplant
Primaria micro-explante cultura puede ser usado para aislar SMSC de cualquier músculo esquelético accesibles incluyendo los músculos individuales de los miembros anteriores y las extremidades traseras, el diafragma, la espalda y los músculos abdominales. El método para calcular las culturas microexplant de los músculos jóvenes y adultos se describe en detalle por Smith y Schofield 3 y posteriormente ha sido utilizado ampliamente para obtener células SMS de los músculos menores, ratones adultos y ancianos. El método también puede ser utilizada para obtener cultivos de células de músculo esquelético de los peces 24 y el músculo esquelético humano (Rao y Smith, inédito). Consecuencia del SMSC de un microexplant músculo de ratón se ilustra en la Figura 1a, b. El método ha sido modificado para el aislamiento de células embrionarias precursoras del músculo (ver sección 3). El método básico es el siguiente:
- La disección aséptica del músculo de la blanco (s) de un ratón recién sacrificado se realiza con instrumentos esterilizados, un área de trabajo limpia y el uso liberal de la pulverización de etanol al 70%.
- Músculos aislados se lavan a través de dos cambios de DF20 medio y se colocan en medio DF20 fresco en un plato de 60 mm 2. Usando una disección de músculos estereomicroscopio son cuidadosamente microdissected en condiciones estériles para excluir grasa, tejido conectivo y el hueso.
- Limpiar las piezas del músculo se cortan en cubos de 3 400 m, que, con las pinzas de joyería s, se colocan individualmente en el centro de 60 pozos de una placa de 96 pocillos con 50 l DF20 (véase Nota 8). Wells se observan bajo el microscopio y se colocan en la incubadora. Los pozos exteriores están llenos con solución salina para evitar que se sequen los pozos que contienen los explantes (3).
- Apego Microexplant y la consecuencia se califica a las 24-48 h de incubación y, posteriormente, a intervalos de 48 a 72 h (en función de la tasa de crecimiento de los músculos que se cultivan).
- Para la expansión y el aislamiento de las células de SMS, las culturas consecuencia debe ser un seguimiento individual de las células con morfología predominantemente SMSC, es decir, las células mononucleadas de la esférica con alta refracción que se dan en grupos de agregación (ver Figura 3.1b).
- Una vez consecuencia explante se establece pozos individuales se alimentan (ver Nota 9) por la suma de incrementos de 50 l de medio cuando el medio se acidifica debido a la densidad creciente de la célula. Cuando el pozo está lleno y de cultivo celular casi confluentes, los pozos son alimentados por la sustitución de 50% del medio de cada vez para asegurar el mantenimiento de "acondicionamiento" de factores secretados por las células (ver comentarios en el medio condicionado en la clonación, la sección 2.1). Para suprimir la diferenciación, a crecimientos del 60-70% confluencia de explantes primarios se conectan en calcio agotado medio sustituyendo DF20 medio de calcio-agotadas DMEM/F12 (todos los complementos siguen siendo los mismos) para la alimentación de las células 3.
- Explante medio condicionado se puede preparar a partir de cultivos en esta etapa y se almacena para su uso durante la expansión y la clonación de SMSC principal (para el método de la clonación, vea la Sección 2.1, Figura 1c f). Culturas se subcultivan utilizando el método de dispasa (ver sección 3.5).
- SMSC clonal derivados pueden ser analizadas en vivo por inyección intramuscular (Figura 3.1 gk) 19.
- El cariotipo puede ser llevado a cabo en la clonación derivados de líneas de SSS para confirmar el estado diploide (ver Sección 2.2, Figura 3.1 l) 25.
- Este método puede ser adaptado para el músculo cultivo embrionario (Sección 3).
2.1. Derivación clonal
Cultivos primarios de explantes de mioblastos (Figura 1a, b) son una herramienta útil y precisa para el establecimiento de una variedad de parámetros de crecimiento diferentes en los músculos esqueléticos de tipo salvaje y mutante. Derivación de clones, el aislamiento de una línea celular de una sola célula, es un paso esencial en el aislamiento de las células del músculo esquelético madre y también se puede utilizar para subclonar líneas SMSC transfectadas con las construcciones de RNAi o transgenes. Establecido cultivos de explantes SMSC y primaria son altamente dependientes de la densidad y cras "h "(separar del plato y morir) en caso de plateado a cabo en muy baja densidad de las células. Esto se debe a factores SMSC versión soluble que se requieren para mantener el crecimiento y la supervivencia celular. Para simular una cultura de alta densidad y el suministro de estos factores durante el proceso de clonación, SMSC son clonados en sí mismo un medio condicionado. La adición de medio condicionado se encontró que era esencial para permitir que las células individuales a proliferar en un entorno aislado.
- Medio condicionado se prepara a partir SMSC la proliferación de cultivos durante 48 horas entre el 33 y el 75% de confluencia.
- Los medios de comunicación en el que estas células se cultivan se retira después de 48 horas y se filtra utilizando un filtro de 0,2 micras jeringa, lo que garantiza la esterilidad del medio condicionado y elimina todas las células residuales y los desechos.
- Este medio condicionado se mezcla en una proporción de 1:1 con medio de cultivo fresco (medio de la clonación, ver nota 10) y se utiliza como medio de cultivo para la clonación de células individuales.
- Para lograr un solo diluciones de células células se disocian a una suspensión de células individuales por tripsinización cuidado (establecido SMSC) o el tratamiento dispasa (cultivos primarios de explantes) y se diluye a una concentración de un celular por cada 100 l medio de la clonación.
- 50 l de esta suspensión celular puede ser chapada en cada uno de los centro de 60 pozos de una placa de 96 pocillos.
- Las células se permite adjuntar de incubación a 37 ° C en 5% CO 2 durante 6 horas y así cada uno es cuidadosamente anotado por la presencia de células. Pozos que contienen 0 o más de una celda se descuentan en esta etapa.
- Pozos que contienen una celda adjunta solo son cuidadosamente observado y la colonia derivadas de esta célula es vigilada cuidadosamente (todos los días durante los primeros días) para asegurarse de que una sola colonia, derivado de una sola célula, está presente. Líneas celulares se obtuvieron a partir de los pozos que contienen sólo una célula. Figura 1c-e ilustra la expansión de una colonia de células individuales derivados.
- Una vez que la colonia llega a la confluencia en la placa de 96 pozos que se pueden subcultivar en un pocillo de una placa de 48 pocillos.
- Las líneas celulares clonados pueden ser cuidadosamente ampliado en 24 - y las placas de 6 pocillos hasta que las células se disponga de la placa en un frasco de 25 cm 2.
- El origen del músculo esquelético de estas culturas puede ser demostrado por la expresión de Myf-5 (Figura 1 F) o de otro tipo específico de los músculos esqueléticos-marcadores como MyoD y Pax 7.
- En esta etapa, las líneas se congelaron antes de que una mayor expansión (ver Tabla 1).
2.2. Cariotipo
El cariotipo es un método importante de control fenotipo celular. Líneas celulares derivadas por derivación clonal debe cariotipo para asegurarse de que han conservado un complemento cromosómico diploide sin bruto reordenamientos cromosómicos que podrían afectar a su fenotipo.
- Para que las células se cultivan cariotipo con la última fase exponencial (80% confluente) en 25 recipientes de cultivo cm 2 (2 días después de subcultivo) para maximizar la proporción de las células mitóticas en la cultura.
- Veinticuatro horas antes de que el cariotipo de las células se alimentan con 10 ml de medio de cultivo fresco. 0,2 ml de 10 mg / ml de colchicina (véase Nota 11) se añade a las células que se incubaron durante 1 hora a 37 ° C.
- Después de 1 h, las células son sujetos al procedimiento de tripsinización subcultura estándar, excepto que tanto el medio de cultivo y lavados con PBS se mantienen para maximizar el número de células mitóticas cosechado.
- Las células disociadas, mantiene a medio y lavados con PBS se hacen girar a 1.000 g durante 3 minutos para que sedimenten las células y el. Sobrenadante retirado y desechado en cloro
- El pellet de células se vuelve a suspender en 5 ml de cloruro de potasio 0,0075 M de exactamente 4 minutos, antes de que las células se sedimentaron por centrifugación de nuevo.
- La mayor parte del sobrenadante se aspira, dejando una cantidad pequeña (~ 50 a 100 l) en el tubo para la re-suspensión. Resuspender las células agitando por la base del tubo Falcon hasta una suspensión de células se logra. Las células se colocan en hielo y se fija en recién hecho helada fijador (metanol: ácido acético glacial en una proporción de 3:1) de la siguiente manera: 10 ml de fijador se añade lentamente, gota a gota a las células utilizando una pequeña pipeta Pasteur de vidrio ( esto evita aglomeración de células).
- Las células se colocan en hielo durante 30 minutos y luego se sedimentan por centrifugación después de que el sedimento celular se resuspendió en 0,5 ml de fijador fresco.
- Las diapositivas se producen al dejar caer la suspensión de células fijas en portaobjetos preparados (ver Sección 3.2.2.1) en un ángulo de 45 °. Para asegurar bien espaciadas metafase se propaga la pipeta debe celebrarse por lo menos 30 cm por encima de la diapositiva.
- Para visualizar los cromosomas, los portaobjetos se tiñeron durante 2 minutos en Leishman manchas, se diluye con tres volúmenes de buffer de pH 6,8 Gurr justo antes del uso.
- Los portaobjetos se secan a temperatura ambiente y se montaron en medio DePex montaje.
2.2.1. Preparación de las placas de cariotipo
- Portaobjetos de vidrio (diapositivas premium microscopio, VWR International, Reino Unido) se preparan para su uso en el protocolo de cariotipo mediante la colocación de noche en una de gran tamaño (de vidrio) de contenedores de ácido sulfúrico.
- Los portaobjetos se coloca bajo el chorro de agua del grifo durante 8 horas y se almacenan en etanol al 70% hasta su utilización.
- Antes de su uso, las diapositivas se deben enjuagar con agua corriente durante 30 minutos y se secó al aire a temperatura ambiente durante 1-2 h.
3. El establecimiento de Primaria Micro-explante culturas a partir de embriones
Tres cepas de ratón se utiliza para validar este método, de tipo salvaje (C57BL/10), junto con mdx y CAV3KO (ambos mutantes distróficos). El ratón con deficiencia de distrofina mdx se originó de forma espontánea en C57BL/10, esta línea fue obtenido por el laboratorio Bullfield en 1991 y desde entonces se ha mantenido continuamente en nuestra colonia innata 26. Ratones CAV3KO distrófica, que contiene una mutación en el gen de la caveolina-3, fueron criados en el fondo C57BL/10 durante 10 generaciones antes de ser utilizado en este estudio 27. Cada línea de ratones generó un perfil consecuencia, la proliferación y la supervivencia con firmeza reproducible que era embrionaria fase específica y diferente para cada cepa. Los siguientes protocolos se han adaptado para los embriones de Smith y Schofield PN (1994) 3, en esencia como en Merrick 21.
3.1. De recogida de embriones
- Para obtener embriones etapas, los pares se configuran como naturales (1:1) apareamientos y hembras comprobar todas las mañanas de tapones vaginales. El día de la detección de conexión, los embriones son considerados como E0.5 días (12 horas después de la fecundación).
- Una vez que se conecta la vagina se han detectado los machos se retiran de la caja para asegurar la exactitud de la puesta en escena de embriones.
- Cuando la etapa embrionaria deseado se alcanza (E11.5 E17.5 a) las madres se sacrificaron por dislocación cervical, el abdomen se rasura, la piel y sus alrededores se limpia con alcohol al 70% y se extirpa el útero a través de una incisión abdominal horizontal realizadas con instrumentos de disección estéril.
- El útero se lava una vez en el principal medio de explante cultura (PECM) antes de ser colocado en un plato pequeño con PECM fresco antes de la disección.
- E11.5 E17.5 embriones que se disecan del útero usando un microscopio de disección y se colocan individualmente en placas de Petri que contiene PECM en la preparación para microdisección detallada.
3.2. Embrión Microdisección
- Embriones individuales son más diseccionados para aislar las zonas ricas en el músculo esquelético (ver Figura 2a). Traseras y patas delanteras (hypaxial los músculos esqueléticos) son disecados, así como la parte superior e inferior de la pared del cuerpo (músculos esqueléticos predominantemente epiaxiales). Para hacer esto de una incisión a lo largo del tórax, el abdomen y la pelvis se creó para permitir que los órganos internos del embrión a ser eliminado.
- Para enriquecer las células embrionarias madre del músculo esquelético (eSMSc), la cabeza, la médula espinal y todos los órganos internos son removidos.
- En los antiguos embriones (E15.5-E17.5 embriones), también es posible para eliminar la piel y el cartílago / hueso nuevo para aumentar la proporción de células musculares en los cultivos.
3.3. Configuración de cultivo de embriones Microexplant
- Una vez que las extremidades anteriores, patas traseras y la parte superior e inferior de las paredes del cuerpo han sido disecados que se colocan en PECM fresco y más microdissected para producir pequeños cubos de tejido del mismo tamaño (~ 0,5 mm 3; Figura 2a).
- Estos microexplants entonces se ponen en el centro de 60 pozos de una placa de 96 pozos (un explante por pozo), que contiene PECM 50μL por pozo. Un mínimo de 60 pozos que contienen un explante por tanto se establecen, por embrión estudiados.
- Para los embriones de cultivo del centro de 60 pozos se puede subdividir en las regiones donde se denota el explante se deriva de (Figura 2b). Este diseño permite que cada 15 pozos que contienen, respectivamente, miembros anteriores, la pared superior del cuerpo, extremidades posteriores e inferiores explantes pared del cuerpo 21.
3.4. Monitoreo consecuencia
Tasa de derivación es una medida fiable de la tasa de crecimiento de los explantes de embriones músculo esquelético y en las condiciones cuidadosamente controladas aquí descrito es altamente reproducible.
- Los explantes se incubaron a 37 º C y 5% de CO 2 durante 3 semanas y anotó a los 3 días, 7, 14 y 21 de cultivo mediante un microscopio invertido. Explantes son calificadas de acuerdo al nivel de la confluencia de las células de cada individuo así (Figura 3a, e).
- Las imágenes fotográficas de las culturas se pueden tomar, por ejemplo, utilizando una cámara SLR acoplado al microscopio y 100 ASA Fuji (color) o TMAX Kodak (blanco y negro) profesionales de cine (Figura 3f).
- Un esqueletomuscular específica de anticuerpos específicos para Myf-5 se pueden utilizar para demostrar el origen del músculo esquelético de eSMSc, dependiendo de la cepa 80 95% de las células aisladas con este método son Myf-5 positivos. Otros marcadores como MyoD y Pax 7 también se puede utilizar para demostrar el origen del músculo esquelético de estas poblaciones celulares. Mientras que estas células contienen una proporción muy elevada de las células embrionarias madre del músculo esquelético que no se puede asumir (sobre todo para los embriones más jóvenes) que todos ellos son de origen músculo esquelético o de que son las células madre. Para aislar pura poblaciones de células madre es necesario obtener por clonación cultivos primarios de explantes como se describe en la Sección 2.1.
3.5. Subcultivo embrionarias explantes primarios
Una vez confluentes, cultivos de explantes mostrar las características morfológicas de SMSC (Figura 3f) puede ser la siguiente subcultivo 3, 21:
- El medio de cultivo se extrae de los pozos seleccionados, filtrados con un 0,2 micras Acrodisc R_ filtro de jeringa y conservados para uso como medio condicionado. El medio puede ser almacenado a 4 ° C durante 1 semana.
- 100 L de 01:10 dispasa diluido en PECM se añade a cada pocillo y las placas luego regresó a la incubadora a 37 ° C durante 20 min.
- Una punta de la pipeta se utiliza para raspar suavemente las células desprendido de la superficie del pozo.
- La suspensión celular se centrifuga a 1.000 g durante 3 minutos para que sedimenten las células y el sobrenadante se extrae y se desecha.
- Las células son resuspendidas en 200 l de una mezcla 1:1 de medio condicionado y PECM.
- La mezcla de células se transfiere a 48 y placas de expansión.
- Para el análisis in vitro de las células puede ser chapada a una densidad de 5 x 10 3 células / cm 2, ya sea en placas de 48 pocillos (cada uno con una 9 mm 2 cubreobjetos estériles) o de 8-bien portaobjetos de vidrio de cámara. Para las células de diferenciación análisis se cultivaron durante la noche a 50-60% de confluencia antes de ser transferidos al medio de diferenciación permisiva (ver sección 4 para más detalles en el método in vitro) por 3 días, antes de la fijación.
4. Análisis in vitro de células madre de músculo esquelético y cultivos primarios
4.1. Preparación de las células
- Dispasa subcultivaron (sección 3.3) cultivos primarios de explantes de embriones se colocan en un medio de PECM / acondicionado en cubreobjetos en placas de 48 pocillos a una densidad de 3 x 10 3 células / cm 2 y que se pueden conectar.
- Para la evaluación de la apoptosis y la proliferación cubreobjetos se lavan dos veces en PBS, se fijaron en paraformaldehído al 4% (ver sección 4.2) en PBS durante 20 minutos a temperatura ambiente, seguido por otros 10 minutos de lavado PBS.
- Cubreobjetos preparado de esta forma se puede almacenar a 4 ° C durante un máximo de 1 semana en PBS o PBS / glicina.
4.2. Preparación de fijador paraformaldehído
- En una campana extractora, pesan 4 g de paraformaldehído (PFA, Sigma-Aldrich, Reino Unido) y añadir a una botella de vidrio de 100 ml de PBS estéril con un agitador magnético. Una máscara de la cara y se deben usar guantes de protección.
- En una campana de extracción, la solución se calienta y se agita continuamente sobre una placa magnética hasta que el polvo se disuelva. Esto toma aproximadamente 50-10 min a 65 ° C. Se debe tener cuidado para evitar que el aumento de la temperatura por encima de 70 ° C, ya que hay un riesgo de explosión de la solución a altas temperaturas.
4.3. La apoptosis y la proliferación de ensayo
- Cubreobjetos fija (preparado como en la sección 4.1) se tiñen con 10 mg / ml DAPI durante 3 min.
- Cubreobjetos se lavan una vez en PBS (5 a 10 min) y se invierte en un lugar de Vectashield medio de montaje sobre un portaobjetos de vidrio 17, 18.
- Los bordes del cubreobjetos se sellan con esmalte de uñas (ver nota 12).
- Para el almacenamiento, las diapositivas se envuelven en papel de aluminio y se coloca a 20 ° C.
- Para el conteo, los portaobjetos se observa bajo fluorescencia (filtro UV) en un microscopio vertical y anotó para la apoptosis y mitosis con una retícula ocular. Veinte redes distribuidas al azar se cuentan (en representación de ~ 1.000 células), y las células se caracteriza morfológicamente como no-apoptóticos, apoptosis o mitosis (Figura 3 g).
- Los índices de mitosis y apoptosis se calculan como un porcentaje del total de células.
4.4. Inmunohistoquímica
Células fijadas en cubreobjetos también pueden ser utilizados para inmunohistoquímica. Para la recuperación de antígenos mediante un cubreobjetos olla a presión deben estar firmemente adheridos a portaobjetos de cristal utilizando clips de papel estándar. Inmunotinción se puede utilizar para identificar la proliferación de células, utilizando un anticuerpo para Ki67 (1 / 1, 000 de dilución), para establecer la identidad, utilizando un anticuerpo para Myf-5 (1 / 1, 000 de dilución), o para investigar la expresión de genes (véaseSección 4.5). Inmunotinción se puede lograr utilizando una serie de métodos, de acuerdo al (descrito en (28, 29)) se utiliza habitualmente por los autores:
- Buffer citrato de sodio se precalienta en la olla a presión. Para la recuperación de antígenos, las diapositivas que contienen tejido seccionado se colocan en el buffer se calienta y se calienta bajo presión durante 2 min. La presión se logra afianzando firmemente la tapa de la olla a presión y puesta en el peso. Una vez que el tiempo de 2 minutos de recuperación ha transcurrido la olla a presión es cuidadosamente colocado bajo el chorro de agua fría para reducir la presión. Para evitar que el buffer hirviendo, se debe tener cuidado de no quitar la tapa hasta que la presión se ha igualado con la presión atmosférica. La presión se reduce suficientemente, cuando el peso se puede quitar fácilmente (sin fuerza) y se quita la tapa. Las diapositivas se elimina de la memoria intermedia y se lavan en PBS temperatura ambiente durante 10 minutos.
- Las diapositivas son pre-bloqueada por inmersión en 3% de peróxido de hidrógeno / agua del grifo durante 5 minutos y luego se lavan tres veces en PBS + 0,05% de Tween 20 (10 min por lavado).
- El bloqueo se consigue mediante una incubación de 30 minutos en tampón de bloqueo TNB (incluido en el kit TSA) a temperatura ambiente.
- Anticuerpo primario es diluido en tampón de TNB a la dilución adecuada (llegó a por titulación, véase la nota 12) y se incubó durante la noche a 4 ° C (o bien 1 a 2 horas a temperatura ambiente).
- Después de tres lavados de 10 min en PBS + 0,05% de Tween 20, los portaobjetos se incubaron durante 1 hora a temperatura ambiente en la correspondiente anticuerpo biotinilado segundo diluido en buffer de TNB.
- Después de un lavado min otros tres 10 en PBS + 0,05% de Tween 20, los portaobjetos se incubaron durante 30 minutos en estreptavidina-HRP (proporcionado en el kit TSA) diluido 1:100 en tampón TNB y luego se lavan tres veces (10 minutos cada uno) en PBS + 0,05% de Tween 20.
- Tyramide biotinil (reactivo de amplificación; TSA kit) se añade a cada sección de entre 8 y 15 minutos (el tiempo exacto debe obtenerse por medio de experimentos de optimización).
- Amplificación siguiente, lavar los portaobjetos tres veces (10 minutos cada uno) en PBS + 0,05% de Tween 20 y luego se incuban durante 30 minutos en SA-HRP.
- Después de tres lavados más (10 minutos cada uno) en PBS + 0,05% de Tween 20, visualiza utilizando 3,3 _-diaminobenzidine tetrahydrochloride cromógeno (DAB) de 5 a 10 min. A continuación, llevar a cabo dos lavados en agua antes de final de la contratinción diapositivas en hematoxilina y cubreobjetos. DAB es un conocido carcinógeno y debe ser manejado con cuidado (como por colchicina, Sección 3.2.2).
4.5. Diferenciación
- SMSC chapada en cubreobjetos o cámara de diapositivas (véase Nota 13) también se pueden diferenciar antes de la fijación para el análisis myotube.
- Para estos experimentos las células se sembraron a una densidad de 10 4 / cm 2 y que se pueden conectar de 6 a 8 h.
- Células se conmuta en condiciones de diferenciación permisiva durante 3 días (ver Nota 14).
- Medio de diferenciación está compuesto por DMEM + 0,5% de FCS complementado con suero de caballo al 2% y 1% de glutamina. Este medio de diferenciación cultura permisiva se sustituye a intervalos de 48 horas.
- Cubreobjetos se fijan en paraformaldehído al 4% que el anterior (secciones 3.4.1 y 3.4.2).
4.6. La transfección de SMSC: la expresión de transgenes y construcciones de shRNAi
Las células madre y cultivos primarios son refractarios a la transfección y con una mayoría de los métodos de la tasa de transfección en las células musculares esqueléticas SMSC y primaria es muy baja (<10%), evitando el uso de métodos de transfección transitoria. Para superar esto, ha sido una práctica habitual en nuestro laboratorio para aislar a los derivados de clones transgénicos de cultivos transfectados (véase la Sección 3.2.1) transfección siguientes con fosfato de calcio o lipofectamina. Alternativamente las células pueden ser transfectadas de manera eficiente con la infección por virus de las construcciones de envasado. Figura 1 m muestra la expresión estable de β-galactosidasa en PD50A, un derivado de SMSC clonal aislados en la infección de selección G418 siguientes pIRV, una réplica defectuosa retrovirus portan los genes de resistencia neo/G418 y β-galactosidasa (19). Esta línea celular se utilizó para demostrar formalmente que SMSC se comportan como células madre funcionales in vivo (ver Figura 3.1). Mientras que la generación de una línea celular estable clonal expresión de un gen marcador es deseable para los experimentos in vivo trasplante de células madre, que es un método lento y poco satisfactorio de analizar la función de genes in vitro. Por estas razones, los autores han desarrollado recientemente una modificación de optimizar el reactivo de transfección Lipofectamine 2000, que es capaz de ofrecer tasas de transfección de 60 a 70%. Esto permite el análisis de la función génica mediante transfección transitoria de los transgenes o RNAi construye en SMSc o cultivos primarios de explantes (Figura 3 horas, i). Los autores utilizan una horquilla corta RNAi vector (pSHAG RNAi) (30) para generar las construcciones shRNAi capaz de genes específicos de orientación de la expresión del ARNm de SMSC. El éxito de la técnica shRNAi depende de dos elementos: (a) un método de transfección eficiente y (b) el diseño de una secuencia de horquilla corta que reconoce específicamente el gen diana. A shRNAi dirigido a construir eGFP se puede utilizar para validar el método de RNAi desmontables (Figura 3J, m).
4.7. Optimizado LipofectamineTM 2000 Transfección Protocolo de SMSC
- Las células se colocan de 5 a 10 4 células / cm 2 en la cámara de diapositivas en 250 l medio cultural DF10 y se cultivaron durante 18 h para alcanzar el 95% de confluencia (confluencia óptima para cada línea celular se estableció mediante la evaluación de las tasas de transfección a diferentes densidades).
- Para cada pozo, 0,5 ug de ADN (vectores shRNAi, transgenes) se añade a 33 l de suero libre de DMEM suplementado con glutamina 2 mM y se mezcla suavemente en un tubo estéril Eppendorf.
- Para cada pozo, 1,25 l de Lipofectamine 2000 por separado diluye en otros 33 l de suero libre de medio DMEM + glutamina, mezclar suavemente y mantuvo a temperatura ambiente durante 5 min
- Las mezclas de ADN y luego se lipofectamina rápidamente se suman, se mezclan suavemente durante 60 s con la pipeta y se incubaron a temperatura ambiente durante 19 minutos para permitir que el ADN Lipofectamine 2000 para formar complejos.
- Para la transfección, 66 l de mezcla compleja se añade a cada cámara de pozo y las diapositivas se mecía suavemente durante 10 s para asegurar la distribución equitativa de los complejos.
- Las células se incuban durante 24 a 72 horas a 37 ° C y 5% CO 2. Dependiendo de la construcción de expresión, el gen funcional o una caída shRNAi se detectó por primera vez entre los 8 y 24 h después de la transfección.
5. Resultados representante
Cuando los explantes son cuidadosamente explantados de músculo esquelético de adultos o de embriones de los explantes se empiezan a generar células en pocas horas a 72 horas de incubación a 37 ° C (5% de CO 2 / aire) (Figura 3). El tiempo necesario para que esto ocurra depende de la fuente de los explantes: explantes de embriones se superan con mayor rapidez que los mayores explantes de músculo esquelético adulto. En nuestra experiencia el tiempo de extensión es altamente reproducible 3, 29. La expansión de la población celular se producirá en un período de días (explantes de embriones) o semanas (mayores explantes músculo esquelético) para generar la agregación de las culturas de alta densidad celular SMS primaria (véase la Figura 3B-F para la ilustración de estas culturas). Figuras 1 y 3 muestran resultados representativos de la derivación de éxito y de la cultura del músculo esquelético y explantes de embriones, la obtención de clones e in vivo, el trasplante de los músculos esqueléticos derivados de células madre adultas, etiquetado β-galactosidasa, el cariotipo y Myf-5 inmunohistoquímica de SMSC embrionarias para ilustrar el origen del músculo esquelético de . las poblaciones de células Figura 3 muestra un resultado representativo de la puntuación consecuencia (con Myf-5 inmunohistoquímica para visualizar SMSC), la morfología de las células musculares embrionarias primarias; DAPI para la apoptosis y el protocolo de transfección shRNAi. Más detalles se pueden encontrar en la figura de leyendas relacionadas con estos dos personajes. Figura 2 se ilustra el procedimiento de micro-disección de embriones para generar poblaciones enriquecidas de células embrionarias madre del músculo esquelético.
Tabla 1: Tabla de cálculo para estimar el número de crioviales necesaria para la viabilidad celular máxima durante la congelación de células por protocolos
| Plate / frasco / cámara de diapositivas | Volumen de medio de cultivo | PBS se lava | Volumen de tripsina | Número de congelar por viales (3.1.2) |
| De 96 pozos | 50 L | 2 x 100 l | 25 l | N / A |
| 48-y | 150 l | 2 x 200 l | 50 L | N / A |
| 24 y | 500 l | 2 x 700 l | 200 l | N / A |
| 6-y | 3 ml | 2 X 3 mL | 500 l | 1 |
| Pequeña (25 cm 2) | 10 ml | 2 x 10 ml | 1 mL | 2 |
| Mediano (80 cm 2) | 10 ml | 2 x 10 ml | 3 ml | 4 |
| De gran tamaño (175 cm 2) | 10 ml | 2 x 10 ml | 5 ml | 8 |
| Cámara y | 500 l | 2 x 500 l | 100 L | N / A |
N / A = no aplicable, el número de células eran demasiado bajas para congelar abajo a menos que varios pozos fueron congelados juntos.
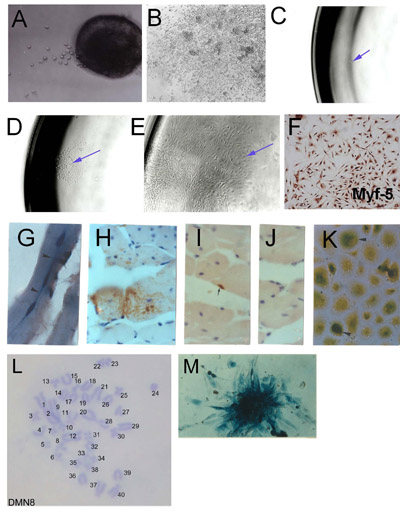
Figura 1. El aislamiento de células madre de músculo esquelético (SMSC) de microexplants: (A) fruto temprano de explantados músculo esquelético adulto (día 2) (B) Establecida consecuencia explante que muestra las culturas globales y de alta densidad celular.. Derivación clonal de SMSC. (C) una única célula aislada en una placa y 96. (D) Colonia de origen de células individuales. (E) Establecida la población clonal. (F) La verificación de la identidad SMSC usando Myf-5 inmunohistoquímica. Las células derivadas de SMSC clon PD50A (que expresan β-galactosidasa) en ratones de acogida a los 3 meses (G) y (HJ) 14 meses después de la inyección de 2.000 células de ratón PD50A en músculo tibial anterior. (G) Tres recientemente fusionada (núcleos situado en el centro ) β-galactosidasa de células positivas (la mancha azul) en las fibras musculares (sección longitudinal). (H) amplia contribución de β-galactosidasa de células positivas (mancha marrón, detectados por anticuerpos anti-β-galactosidasa) en las fibras musculares (sección transversal ). (I) β-galactosidasa positiva de las células satélite (mancha marrón, detectados por anticuerpos anti-β-galactosidasa). (J) de control de secundaria de anticuerpos (no manchas). (K) β-galactosidasa de células positivas (la mancha azul) proliferan en la cultura cuando se aíslan de los músculos inyectados de acogida 12 meses después de la inyección. (L) Cariotipo de una línea de ratones SMSC clonal (DMN8) que muestra diploide normal de cromosomas Histoquímica del complemento. (M) que muestra β-galactosidasa expresión en una colonia de células PD50A ( Figura 3.1 g, k, reproducido con permiso de AACR de prensa, Smith y Schofield, 1997).
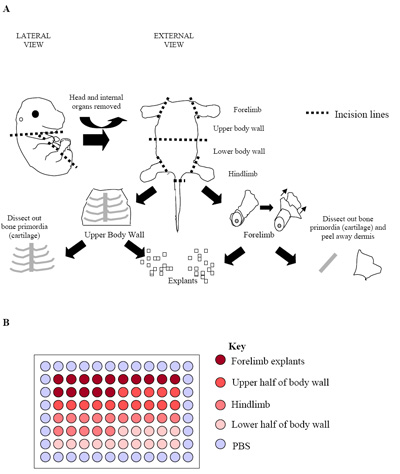
Figura 2. (A) Ilustración del proceso de disección de embriones. La cifra representa un embrión E15.5 primordial donde el hueso (cartílago) podrían ser fácilmente identificado y disecado libre de tejido muscular esquelético. En esta etapa, y en los embriones más adelante (E15.5 E17.5), la dermis también fue eliminado de la máxima proporción de células del músculo esquelético obtenidos. (B) la instalación de cultivos de explantes primarios en una placa de 96 pocillos. Cada embrión se utiliza para producir una placa como se ve arriba. La práctica habitual es que la placa de réplicas de tres embriones por separado (tres placas = 180 pozos) para establecer las tasas de derivación.
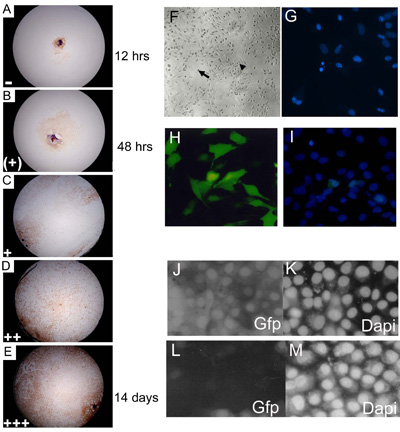
Figura 3. Embrionarias cultivos de explantes primarios se anotó a los 3, 7, 14 y 21 días de cultivo y se asigna a un representante de nivel de consecuencia del nivel de confluencia. (AE) C57BL10 E15.5 cultivos primarios de explantes de embriones teñidos con Myf-5 para ilustrar 0 14% (); 15 24% (+); 25 49% (+); 50 74% 75 100% (++); ( + + +) los niveles de confluencia. La proporción de los pozos que muestra cada nivel de extensión (en cada día de la calificación) se ha multiplicado por un número arbitrario (= 1, (+) = 2; + = 3; + + = 4 y + + + = 5) antes de cotejar los datos para dar un valor consecuencia final. Aproximadamente el 85% de tipo salvaje (C57BL/10) eSMSc tinción primaria para el marcador de las células musculares esqueléticas Myf-5. Ampliación es de 10. (F) Establecido culturas embrionarias tienen las características morfológicas del adulto SMSC, células bipolares (flecha pequeña) y esférica células monomórficas (flecha grande). (G) La identificación de fragmentación de núcleos apoptóticos mediante DAPI. (HI) Los altos niveles de (~ 75%) de la transfección de una construcción que expresan GFP en líneas celulares de SMS a través de la optimización Lipofectamine 2000 método de transfección. (I) El recuento de número total de células es ayudada por DAPI de contraste. RNAi utilizando pSHAGshRNAigfp (JM) suprime la expresión de GFP en SMSC (véase (29) para un ejemplo de esta construcción utilizada como control). (J) Control (transfección simulada) que muestra la expresión de GFP en una línea de GFP SMSC. (K) DAPI de control (L). shRNAiGfp 24 h después de la transfección. (M) de control de DAPI de células transfectadas en shRNAiGfp (L).
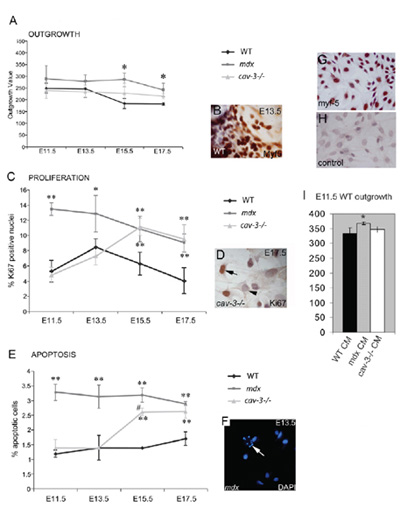
Figura 4. Distrófica, embrionarias Myf5 positivo mioblastos son hiperproliferativas y con tendencia a la apoptosis. (A) La tasa de extensión de mioblastos embrionarias a partir de la cultura del músculo explante is aumentó tanto en los mutantes mdx de E11.5 y en CAV-3 mutantes (-/-) en E15.5 E17.5 y en comparación con los explantes cultivados PESO en paralelo. (B) Un explante Myf5-immunostained. (C) hiperproliferación de mioblastos embrionarias mutantes mdx de E11.5 y en CAV-3 mutantes (-/-) de E15.5, según lo determinado por Ki67 positivos inmunoreactividad (D) (E). elevado de apoptosis en los embriones E11.5 mdx y de E15.5 en CAV-3 embriones (-/-), como se muestra por DAPI (F), la flecha en los puntos F a un celular por apoptosis. * P <0.05 en comparación con el WT; ** p <0,01 en comparación con WT: * p <0,05 cuando se compara con mdx CAV-3 (-/-) (G, H) E15.5 principales cultivos de mioblastos PESO embrionarias con tinción Myf5. (G) y un control de segundo anticuerpo (H). (I) La tasa de derivación de E11.5 explantes PESO mayor (* p <0,05) en E11.5 mdx explante medio condicionado (CM), pero no en la CAV-3 (-/-) o WT CM. Barras de error indican sd Esta figura se reproduce en los derechos de autor y los autores se publicó por primera vez por la Sociedad de Biólogos de Merrick et al., 2009.
6. Notas: los pasos críticos y posibles modificaciones
- Cuando las células descongeladas se han unido a la densidad de células muy bajo, es prudente para reemplazar sólo la mitad de la media para evitar que choque cultural.
- SMSC aisladas del músculo distrófico son susceptibles a la apoptosis y se debe tratar con especial cuidado. SMSC distrófica (como la línea celular DFD-13, que se estableció a partir del músculo esquelético obtenidos de 5 semanas de edad distróficos (mdx) ratones) deben ser cultivados en las densidades de células superior a la habitual de mioblastos. Como la apoptosis y minúsculas líneas celulares también son criopreservadas en densidades más altas (ver secciones 1.1 y 1.2) (19).
- Un método alternativo de eliminación de las células de una monocapa utiliza dispasa, que proporciona un método más suave de disociación celular, con la ventaja de que puede llevarse a cabo en presencia de FCS y el calcio (ambos presentes en DF10). Dispasa por lo tanto, se puede utilizar para ampliar la subcultura y los cultivos primarios de explantes óseos musculares y clones fase temprana SMSC (ver las secciones 2 y 3).
- Para las grandes frascos de la cantidad de tripsina / EDTA utilizados deben ser ampliados de la siguiente manera: 75 mm 2 frasco (3 ml de tripsina) y 175 mm 2 frasco (5 ml de tripsina). De manera similar para las áreas de menor superficie de reducir la cantidad de tripsina (véase el Cuadro 1).
- Por otra parte, la disociación se puede controlar mediante un microscopio invertido, esta técnica se recomienda para los principiantes.
- La criopreservación de líneas de células se realiza generalmente mediante un confluente de gran tamaño (175 mm 2) recipiente de plástico. Entre 7 y 9 crioviales se puede obtener de un buque de gran tamaño, dependiendo del perfil de la supervivencia de la línea celular se criopreservados. Cultivos primarios y las nuevas líneas celulares establecidas a menudo son muy refractarios a la congelación de los procedimientos. Para mejorar la recuperación y el éxito de la congelación de las células de estos dos enfoques se pueden utilizar (por separado o en combinación). (A) El contenido de FCS de la congelación por la mezcla puede ser mayor del 10% (hasta un máximo del 50%). (B) El congelamiento por proceso puede ser frenado por la colocación de crioviales en la fase de vapor de N2 durante 12-24 h antes de la transferencia de viales a la fase líquida.
- Una forma cómoda de ver un firme apego del cubreobjetos haemacytometer es la búsqueda de los Anillos de Newton (reflexiones arco iris en el vidrio) en el cubreobjetos o, alternativamente, para mantener la haemacytometer boca abajo sobre la mano abierta.
- Una variación del método de explante puede ser empleado a corto plazo, los cultivos para uso en ensayos de inmunohistoquímica, la proliferación o la apoptosis. Explantes microdissected se colocan en el vidrio con 8 y la cámara de diapositivas. Un método alternativo es el uso de 9 mm 2 cubreobjetos colocado en placas de 24 pocillos. En ambos casos, dos explantes se transfieren a cada pocillo en 150 l medio DF20. Por otra parte, los cultivos primarios se pueden subcultivar por el método de dispasa y chapada a cabo en cubreobjetos colocado en placas de 24 pozos o directamente en la cámara de diapositivas de 8 pocillos.
- Para el análisis cuantitativo de las tasas de derivación de un mínimo de 60 pozos que contienen un explante por tanto se establecen, por músculo / cepa de ratón. Para establecer los parámetros de crecimiento de una cepa por lo menos tres animales por separado debe ser utilizado. Placas y pozos individuales no son alimentados, mientras consecuencia se anotó.
- Para la clonación establecido líneas de SSS es suficiente para cultivar células individuales en una mezcla 1:1 de medio condicionado y medianas DF10. De explantes primarios, es necesario aumentar el contenido de suero del medio de cultivo a 20%.
- La colchicina es altamente tóxico y cancerígeno conocido y debe ser manejado con el debido cuidado. Doble guante y el trabajo en los confines de una bandeja designada es esencial. Todos los materiales desechables (por ejemplo, Gilsonconsejos) se colocan en un vaso de lejía (hipoclorito de sodio al 5%) durante la noche antes de la eliminación de grandes cantidades de agua al día si-guientes.
- En la actualidad utilizamos anticuerpos primarios específicos para Ki67 y Myf 5-cada uno a 1 / 1, 000 de dilución. La dilución óptima de anticuerpos primarios debe ser establecida empíricamente para cada anticuerpo que se utiliza y lo ideal también para los diferentes lotes del mismo anticuerpo, incluso cuando se obtienen de la misma fuente.
- Cámara de diapositivas también se pueden utilizar para este ensayo. Antes de la fijación de las células en PFA al 4%, el medio de cultivo es removido y las células se lavaron dos veces con 37 ◦ C PBS estéril. Las cámaras también, la junta y el pegamento se eliminan y el portaobjetos de vidrio colocados en un frasco de 50 ml de vidrio Coplin que contiene paraformaldehído 4% recién preparada a temperatura ambiente, que se mecía suavemente en un agitador de Gyro-Rocker R_ durante 25 minutos. Los portaobjetos se lavan dos veces en PBS (temperatura ambiente) y, o bien utilizar inmediatamente o almacenar en PBS a 4 ◦ C (a corto plazo, 1-2 semanas) para inmunohistoquímica (IHC) análisis.
- Si la formación myotube más extensa se requiere principales células del músculo esquelético se pueden diferenciar para un máximo de 8 días.
Discusión
Microdissected cultivos de explantes se puede utilizar para aislar de forma fiable y reproducible las poblaciones de células que contienen una proporción muy elevada (~ 85%) de la proliferación Myf-5 células positivas madre de músculo esquelético (SMSC). Bajo las condiciones de cultivo controladas rigurosamente descritos aquí cultivos primarios de explantes pueden ser utilizados para caracterizar el comportamiento del crecimiento de ratón genéticamente mutantes SMSC y puede ser utilizado como un medio para generar miotubos para obtener información detallada en el análisis de los procesos de diferenciación in vitro. Un cuidadoso mantenimiento y manipulación de estos cultivos a largo plazo permite a la cultura y la expansión. Utilizando los métodos descritos aquí también es posible obtener clones de músculo esquelético líneas de células madre a partir de cultivos de explantes por medio de la dilución de células individuales. Para lograr la proliferación de las células individuales aisladas durante el procedimiento de la clonación ", medio condicionado" se utiliza para imitar la exigencia normal de estas células para la alta densidad de cultivo. El método es aplicable (con) la modificación de los tejidos embrionarios, adultos y adultos mayores, y además de ratón se puede usar para aislar las células de los músculos esqueléticos de otras especies, incluyendo humanos (Rao y Smith, no publicado), embrión de pollo y el pescado ( salmón) 24. SMSC clonal derivados pueden ser analizadas en vivo por vía intramuscular trasplante y en estas condiciones inyecta SMSC se combinará con miotubos de acogida para formar fibras musculares híbrido. SMSC por vía intramuscular inyectado no forman tumores, y se han encontrado en los músculos de acogida en la posición de las células satélite más de un año después de la inyección, lo que sugiere que están sujetos a control endógeno de las células madre satélite niche.These celular puede ser re-aislado de inyección anfitriones como SMSC proliferativa más de 12 meses después de la inyección de acogida 19.
Divulgaciones
Agradecimientos
Damos las gracias a Patrick Paddison por su don de el vector lanzadera shRNAi. Angela Sloan genera la imagen de las buenas prácticas agrarias RNAi en la Figura 3. También agradecemos a los organismos de financiación siguientes por su apoyo:
Campaña de Distrofia Muscular número de concesión RA2/592/2; CHISPAS el número de concesión 02BHM04, la Real Sociedad y el número de concesión 574006.G503/1948./JE BBSRC el número de concesión 6/SAG10077.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM/F12 1:1 mix | Sigma-Aldrich | Liquid medium: (Dulbecco’s Modified Eagles’s medium and Ham’s F12 medium, 1:1 v/v) | |
| 100× Glutamine (200mM) | Sigma-Aldrich | Diluted in medium to a 1× concentration of 2 mM (Glutamine HYBRI-MAX R) | |
| Fetal calf serum (FCS) | From a number of different companies | Batch tested on primary cultures and skeletal muscle cell lines. 10-20% supplement to liquid media | |
| Heraeus Labofuge 300 | Heraeus Instruments | Lab centrifuge capable of reaching 1,000 rpm | |
| 15 ml Falcon centrifuge tubes | Fisher Scientific | Must fit lab centrifuge | |
| Tissue culture plasticware (25, 75 or 175 mm2 tissue culture vessels; 96-well tissue culture plates. 60 mm Petri dishes). | Nalge Nunc international | ||
| Humidified CO2 incubator (Heraeus) | Heraeus Instruments | Ours is copper lined, recommended for reducing contamination | |
| Sterile hood with laminar air flow (Heraeus) | Heraeus Instruments | Ours is a Class II hood – suitable for use with Human tissues | |
| Water Bath | Grant Equipment | Maintained always at 37°C | |
| Inverted microscope | Leica Microsystems | ||
| 70% Ethanol | For sterilization (animals, dissection instruments) and swabbing benches, hood, etc. | ||
| Calcium- and magnesium-free phosphate-buffered saline (PBS) | Sigma-Aldrich | Cell culture-tested PBS (Dulbecco’s formula) is purchased as a ready-mixed powder or in tablet form and made up with doubledistilled water before sterilization by autoclave. PBS consists of 2.68 mM potassium chloride (KCl); 1.47 mM potassium phosphate monobasic (KH2PO4); 0.137 M sodium chloride (NaCl); and 8.1 mM sodium phosphatedibasic (Na2HPO4). PBS can be prepared from scratch as follows: 200 mg KCl, 200 mg KH2PO4, 8 g NaCl and 1.15 g Na2HPO4/l of double-distilled water followed bysterilization by autoclave. | |
| CryoTube vials | Nalge Nunc international | ||
| A Neubauer haematocytometer and coverslips | Fisher Scientific | For estimating cell counting | |
| Hand counter | Fisher Scientific | ||
| Dissection microscope, Zeiss Stemi 1000 | Carl Zeiss, Inc. | For preparation of explants | |
| Small sterile hood | |||
| Sterile dissection instruments (including Jeweler’s forceps) | Sterilised by autoclave | ||
| Sterile plastic collecting vessels (7 ml bijou tubes or 20ml universals) | Nalge Nunc international | ||
| Warm PECM | Sigma-Aldrich | Made up in the sterile hood and warmed to 37°C in the tissue culture waterbath. DMEM:F-12 supplemented with 20% FCS, 1% glutamine and + 1% penicillin & streptomycin solution | |
| Dispase (50 μg/ml, equivalent to 6 units/mg) | Available from MP Biomedicals, UK | ||
| 10 μg/ml 4_,6 Diamidino-2-phenylindole, dihydrochloride (DAPI). | Sigma-Aldrich | For microscopic visualization of apoptosis and mitosis | |
| Vectashield fluorescent mounting fluid | Vector Laboratories | ||
| Fluorescent upright microscope with ultraviolet filter (we use a Nikon Eclipse E600) | Nikon Instruments | ||
| Digital camera and imaging software (we use a Nikon Coolpix 995 camera; A Nikon D3 camera | Nikon Instruments | ||
| OpenLab4.0a software | PerkinElmer, Inc. | ||
| Photoshop CS4 | Adobe |
Referencias
- Yaffe, D., Saxel, O. Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle. Nature. 270, 725-727 (1997).
- Askanas, V., Engel, W. K. A new program for investigating adult human skeletal muscle grown aneurally in tissue culture. Neurology. 25, 58-67 (1975).
- Smith, J., Schofield, P. N. The effects of fibroblast growth factors in long term primary culture of dystrophic (mdx) mouse muscle myoblasts. Exp Cell Res. 210, 86-93 (1994).
- Fell, H. The cell in culture. J Clin Pathol. 11, 489-495 (1958).
- Stewart, D. C., Kirk, P. L. The simultaneous measurement of several parameters of embryo heart explants growth in vitro. J Cell Physiol. 40, 183-198 (1952).
- Harvey, A. L., Robertson, J. G., Witkowski, J. A. Maturation of human skeletal muscle fibres in explant tissue culture. J Neurol Sci. 41, 115-122 (1979).
- Zammit, P. S., Heslop, L., Hudon, V., Rosenblatt, J. D., Tajbakhsh, S., Buckingham, M. E., Beauchamp, J. R., Partridge, T. A. Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers. Exp Cell Res. 281, 39-49 (2002).
- Konigsberg, I. . The embryonic origin of muscle. , (1986).
- Trainor, P. A., Tan, S. S., Tam, P. P. Cranial paraxial mesoderm: regionalization of cell fate and impact on craniofacial development in mouse embryos. Development. 120, 2397-2408 (1994).
- Tajbakhsh, S., Rocancourt, D., Cossu, G., Buckingham, M. Redefining the genetic hierarchies controlling skeletal myogenesis Pax-3 and Myf-5 act upstream of MyoD. Cell. 89, 127-138 (1997).
- Tremblay, P., Dietrich, S., Mericskay, M., Schubert, F. R., Li, Z., Paulin, D. A crucial role for Pax3 in the development of the hypaxial musculature and the longrange migration of muscle precursors. Dev Biol. 203, 49-61 (1998).
- Tajbakhsh, S., Bober, E., Babinet, C., Pournin, S., Arnold, H., Buckingham, M. Gene targeting the myf-5 locus with nlacZ reveals expression of this myogenic factor in mature skeletal muscle fibres as well as early embryonic muscle. Dev Dyn. 206, 291-300 (1996).
- Tam, P. P. A study of the pattern of prospective somites in the presomitic mesoderm of mouse embryos. J Embryol Exp Morphol. 92, 269-285 (1986).
- Cossu, G., Kelly, R., Donna, S. D. i., Vivarelli, E., Buckingham, M. Myoblast differentiation during mammalian somitogenesis is dependent upon a community effect. Proc Natl Acad Sci USA. 92, 2254-2258 (1995).
- Shainberg, A., Yagil, G., Yaffe, D. Control of myogenesis in vitro by Ca2+ concentration in nutritional medium. Exp Cell Res. 58, 163-167 (1969).
- Dodson, M. V., Martin, E. L., Brannon, M. A., Mathison, B. A., McFarland, D. C. Optimization of bovine satellite cell-derived myotube formation in vitro. Tissue Cell. 19, 159-166 (1987).
- Smith, J. Muscle Growth factors, ubiquitin and apoptosis in dystrophic muscle: Apoptosis declines with age in the mdx mouse. B Appl Myol. 6, 279-284 (1996).
- Smith, J., Fowke, G., Schofield, P. Programmed cell death in dystrophic (mdx) muscle is inhibited by IGF-II. Cell Death Differ. 2, 243-251 (1995).
- Smith, J., Schofield, P. N. Stable integration of an mdx skeletal muscle cell line into dystrophic (mdx) skeletal muscle: evidence for stem cell status. Cell Growth Differ. 8, 927-934 (1997).
- O Shea, L., Johnson, C., Rooney, M., Gleeson, R., Woods, K., Smith, J. Adipogenesis and skeletal muscle ageing. Mech Ageing Dev. 122, 1354-1355 (2001).
- Merrick, D. . A role for Igf-2 in fast skeletal muscle specification during myogenesis in dystrophic and wild type embryos [dissertation]. , (2006).
- Stadler, L. K. J., Merrick, D., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Abstr. Genet.Res. 90, 281-289 (2008).
- Merrick, D., Stadler, L. K. J., Larner, D. P., Smith, J. Morphological stem cell and fast myosin abnormalities in the cav-3 / and mdx dystrophic embryo reveal an embryonic basis for muscular dystrophy. Dis Model Mech. 2, 374-388 (2009).
- Matschak, T., Stickland, N. C., Smith, J. Explants of embryonic Atlantic salmon muscle in culture. Proc Soc Exp Biol A. 1, 23-23 (1997).
- Smith, J., Hooper, M. L. Dominance and independent segregation of metabolic cooperation competence and pluripotency in an embryonal carcinoma cell hybrid. Exp Cell Res. 181, 40-50 (1989).
- Bulfield, G., Siller, W. G., Wight, P. A., Moore, K. J. X chromosome linked muscular dystrophy (mdx) in the mouse. Proc Natl Acad Sci USA. 81, 1189-1192 (1984).
- Hagiwara, Y., Sasaoka, T., Araishi, K., Imamura, M., Yorifuji, H., Nonaka, I., Ozawa, E., Kikuchi, T. Caveolin-3 deficiency causes muscle degeneration in mice. Hum Mol Genet. 9, 3047-3054 (2000).
- Westbury, J., Watkins, M., Ferguson-Smith, A. C., Smith, J. Dynamic temporal and spatial regulation of the cdk inhibitor p57 (kip2) during embryo morphogenesis. Mech Dev. 109, 83-89 (2001).
- Merrick, D., Ting, T., Stadler, L. K. J., Smith, J. A role for Insulin-like growth factor 2 in specification of the fast skeletal muscle fibre. BMC Dev Biol. 7, 65-65 (2007).
- Paddison, P. J., Caudy, A. A., Hannon, G. J. Stable suppression of gene expression by RNAi in mammalian cells AQ4. Proc Natl Acad Sci USA. 99, 1443-1448 (2002).
- Smith, J., Merrick, D. Skeletal Muscle Microexplant Culture and Isolation of Skeletal Muscle Stem Cells. Methods in Molecular Biology. 633, (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados