Method Article
فيفو السابقين العدوى من الأنسجة الحية مع الفيروسات Oncolytic
In This Article
Summary
Oncolytic الفيروسات واعدة لمداواة السرطان. القدرة على التأكد من عينات الأنسجة infectability يعيش الحصول عليها من المرضى قبل العلاج هو ميزة فريدة من نوعها لهذا النهج العلاجي. هذا البروتوكول توضح كيفية معالجة الأنسجة ل خارج الحي العدوى بفيروس oncolytic النوعي والكمي الفيروسي لاحقة.
Abstract
Oncolytic الفيروسات (OVS) هي العلاجات التي تحاكي الرواية بشكل انتقائي في وتقتل الخلايا السرطانية 1. العديد من التجارب السريرية بتقييم فعالية مجموعة متنوعة من المنصات بما فيها oncolytic HSV ، الفيروسة الريوية وOVS الوقس لعلاج السرطان في الوقت الراهن 2-5 جارية. واحدة سمة رئيسية من الفيروسات oncolytic هو أن تكون معدلة وراثيا في التعبير عن الجينات المحورة المراسل الذي يجعل من الممكن تصور إصابة الأنسجة البيولوجية المجهري أو التلألؤ التصوير 6،7. هذه ميزة فريدة من نوعها نظرا لأنه من الممكن أن تصيب أنسجة الجسم الحي السابقين من المرضى قبل العلاج وذلك للتأكد من احتمال نجاح virotherapy oncolytic 8. ولهذه الغاية ، فمن الأهمية بمكان مناسب لعينة الأنسجة للتعويض عن عدم تجانس الأنسجة وتقييم الجدوى الأنسجة ، وبصفة خاصة للإصابة قبل 9. من المهم أيضا أن تتبع تكاثر الفيروس باستخدام الجينات المحورة إذا مراسل التي أعرب عنها منصة oncolytic فضلا عن المعايرة المباشرة للأنسجة التالية من أجل التجانس تميز بين العدوى فاشلة ومنتجة. الهدف من هذا البروتوكول هو لمعالجة هذه القضايا ، ويصف هذه الوثيقة 1. أخذ العينات وإعداد الأنسجة السرطانية للثقافة الخلية 2. تقييم جدوى استخدام أنسجة الأيضية صبغة زرقاء الامار 3. المجراة سابقا عدوى الأنسجة مثقف مع فيروس الوقس يعبر عن GFP أو يراعة luciferase 4. الكشف عن التعبير عن طريق التحوير أو مضان المجهري باستخدام نظام تصوير في الجسم الحي (IVIS) 5. الكمي من الفيروس عن طريق فحص اللوحة. هذا الأسلوب شامل يقدم العديد من المزايا بما في ذلك سهولة تصنيع الأنسجة ، والتعويض عن عدم تجانس النسيج ، والسيطرة على بقاء الأنسجة ، والتمييز بين العدوى فاشلة والعظام تكاثر الفيروس النية.
Protocol
1. معالجة الأنسجة
- للحصول على أفضل النتائج ، يجب أن يتم تنفيذ هذا البروتوكول باستخدام الأنسجة المعزولة المودعة حديثا في وسائل الإعلام التي تحتوي على 10 ٪ DMEM FBS ، 1 ٪ Pennicilin / الستبرتوميسين الحل ، والحل ب 0.1 ٪ Amphothericin مباشرة بعد عملية جراحية قبل تجهيزها. إذا لم يكن ذلك ممكنا ، يمكن ترك الأنسجة بين عشية وضحاها في هذه الوسيلة في 4 درجات قبل تجهيزها.
- قبل تجهيز العينة ، تعقيم الملقط المعدني القابل للتصرف من جانب وريش ايداعها في محلول الإيثانول 70 ٪ على الأقل 5 دقائق. أيضا بإعداد طبق بشكل جيد مع 24 2 مل من وسائل الإعلام التي تحتوي على 10 ٪ DMEM FBS ، 1 ٪ Pennicilin / الستبرتوميسين الحل ، و 0.1 ٪ B. Amphothericin
- جمع عينات الأنسجة في غطاء تدفق الصفحي ثقافة الخلية باستخدام ملقط معقم وإيداع الأموال والأنسجة في 15 سم فارغة طبق بتري ، والحفاظ على الغطاء على الجانب ، الجانب المعقمة تصل.
- في الخلية هود والثقافة ، واستخدام 2 مم خزعة لكمة للحصول على عينات مختلفة من مختلف المناطق داخل النسيج كما في الشكل 1. إيداع النوى في غطاء بتري 15 سم بمساعدة ملقط ، وترك مساحة كافية بين كل الأساسية بحيث يمكن بسهولة قطعوا على طول المحور الأفقي.
- تقسيم كل نواة في 4 / 4 حتى باستخدام شفرة حلاقة معقمة كما في الشكل 1.
- تلميح باستخدام الماصة ، وطرح كل ربع الأساسية من مجموعة أساسية معينة في بئر مختلفة من A1 إلى A4 كما في الشكل 1 ، الذي يتضمن بالفعل 1.5 مل من DMEM تحتوي على 10 ٪ FBS ، 1 ٪ Pennicilin / الستبرتوميسين الحل ، والحل ب 0.1 ٪ Amphothericin . كرر لكل الأساسية. هذا يجب أن تسمح عينة ممثلة من الورم ، مع تقليل التحيز في بئر معين / الشرط. لأفضل تمثيل ، وزيادة عدد النوى.
2. تقييم الجدوى الأنسجة
- معالجة الأنسجة التالية ، إضافة 25μl الامار الزرقاء إلى A1 و A2 # # جيدا كما هو موضح في الشكل (1) ويحضن لمدة 1 ساعة على 37 درجة في حاضنة ترطيب مع 5 ٪ CO 2.
- حضانة التالية مع الأزرق الامار ، إزالة 3 مرات 100 ميكرولتر من بئر A1 و A2 كل ونقل إلى 6 آبار مختلفة من لوحة 96 - جيدا. قراءة الإشارات باستخدام قارئ لوحة مضان (530 الإثارة ، 590 الانبعاث) والحفاظ على البيانات للسجلات.
- بعد قراءة الامار الزرقاء إشارة ، ونقل كل قطعة من النسيج باستخدام الماصة غيض من A1 إلى C1 كذلك يحتوي DMEM ، و 10 ٪ FBS + + PS AmphoB. يجب الحرص على عدم نقل كمية مفرطة من وسائل الاعلام من A1 جيدا.
- تصيب آبار A3 و A4 على التوالي مع PFU 6 10 من التعبير عن وGFP - luciferase ، معربا عن الوقس فيروس مخفف في 25 ميكرولتر من وسائل الإعلام. ويمكن أيضا أن يصاب بفيروس A2 أن يعبر عن أي التحوير بما في ذلك إعطاء شيء على الإطلاق.
- 72 ساعة في وقت لاحق ، إضافة 25 ميكرولتر الامار الزرقاء لC1 الآبار وD1 وكرر الخطوة 2.2
3. التصور والتعبير التحوير GFP بواسطة المجهر تنوير
- إزالة جميع وسائل الإعلام التي تغطي زراعة الخلايا القطع الأنسجة من أجل التقاط صور جيدة مضان.
- باستخدام مجهر تشريح مضان قادرة ، تأخذ لأول مرة في صورة النقيض من المرحلة القرار المناسب
- التبديل إلى وضع مضان والتقاط صورة باستخدام مرشح مناسب لتصور التحوير من الاهتمام في هذا GFP القضية.
- استخدام مرشح آخر لمضان الطول الموجي بقدر من احتمال ان من التحوير المصالح (مثل RFP) لالتقاط صورة للخلفية مضان
4. التصور والتعبير luciferase باستخدام نظام التصوير في فيفو (IVIS)
- تأكد من أن تتم تهيئة IVIS قبل أن تبدأ.
- في الآبار وA4 B4 ، إضافة 5 ميكرولتر من الركيزة luciferin 10 ملغ / مل ، وتخلط جيدا واحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- ضبط وقت التعرض IVIS إلى 5 ثوان ، والتقاط صورة من الآبار الخاصة بك. إذا المشبعة الصورة ، مع مرور الوقت أقل تكرار التعرض. إذا كان هناك أي إشارة ، وزيادة وقت التعرض.
- باستخدام برنامج التصوير IVIS ، يمكنك إزالة الخلفية باستخدام الإشارة من B4 جيدا وتحديد المنطقة التي تهم تحديد إشارة التلألؤ.
5. تقييم التتر الفيروسية التي مقايسة البلاك
- قبل التتر الكمي الفيروسي ، يجب أولا أن الأنسجة المتجانس للافراج عن الجسيمات الفيروسية. يمكن القيام بذلك بعد عدة أشهر في عينات الأنسجة المصابة يتم تخزينها في -80
- وزن العينة التي يجب أن يكون متجانس باستخدام مقياس تحليلي. في هذه الحالة ، سوف نستخدم عينة تم جمعها من A2 جيدا.
- مكان النسيج هو في البوليسترين 5 مل أنبوب الصقر ذهابا والقاع ، وإضافة 1 مل من برنامج تلفزيوني. تجانس النسيج باستخدام الخالط الأنسجة. إذا لزم الأمر ، في تخزين جناسة -80 لتقييم التتر الفيروسية في وقت لاحق.
- لفيروس الوقس عيار ، لوحة الأولى 1 مليون خلية U2OS في صفيحة 6 - جيدا واحتضان بين عشية وضحاها في درجة 37 ، 5 ٪ CO 2 الرطبةified الحاضنة بحيث وصلت إلى حوالي 95 ٪ confluency في اليوم التالي.
- استخدام وسائل الإعلام الحرة المصل للقيام التخفيفات المتسلسلة لفيروس ، والتأكد من نصائح لتغيير بين كل خطوة التخفيف. عادة ما نقوم به في 10 1 التخفيفات واستخدام 100 ميكرولتر تحويله إلى 900 ميكرولتر. كم من التخفيفات مصنوعة يعتمد على العائد المتوقع الفيروس.
- التالية جعل التخفيفات ، وإزالة وسائل الاعلام التي تغطي الخلايا U20S مطلي ثم إضافة 500 ميكرولتر من مخزون الفيروس المخفف (لكل تمييع) لتصيب الخلايا U2OS. احتضان الخلايا لمدة 1 ساعة على 37 درجة مئوية في حاضنة 5 ٪ CO 2 مرطب.
- خلال هذا الوقت ، الاحماء X 2 تتركز DMEM تحتوي على 20 ٪ FBS ، والحل 3 ٪ CMC في حمام المياه 37 درجة.
- بعد حضانة 1 ساعة ، وإزالة وسائل الاعلام التي تغطي الخلايا المصابة U2OS. مزيج من وحدات التخزين 01:01 CMC 3 ٪ : 2X DMEM ، و 20 ٪ FBS معا واستخدام 2 مل من هذا الخليط لتغطية كل بئر من الخلايا المصابة U2OS.
- وضع الخلايا مرة أخرى في 37 درجة 5 ٪ CO 2 حاضنة مرطب لمدة 48 ساعة.
- بعد 48 ساعة ، إضافة 2 مل من الميثانول حامض الخليك مثبت على الجزء العلوي من تراكب CMC في كل بئر ويحضن في درجة حرارة الغرفة لمدة 10 دقيقة في خلية غطاء الثقافة.
- تجاهل تراكب الثابتة وتغسل ما تبقى الخروج من الآبار باستخدام مياه الحنفية.
- وصمة عار الثابتة U2OS الخلايا مع 2ml حل الزرقاء coomassie لكل بئر واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة بسرعة منخفضة على لوحة شاكر.
- إزالة البقع coomassie من الآبار ، وتغسل الصحون استخدام مياه الحنفية. السماح ليجف مع قبالة غطاء لمدة ساعة تقريبا.
- يمكن لويحات الفيروسية الناجمة يمكن تصور بسهولة في 2C الرقم. ويمكن تخزين لوحات لأجل غير مسمى في هذه المرحلة.
- عدد اللوحات في الخطوة التخفيف حيث تتراوح بين 10 و 100 لوحات مرئية.
- ضرب عدد من اللوحات التي عدها التخفيف المستخدمة وضرب الرقم الناتج بنسبة 2 إلى إعطاء عيار في PFU / مل. على سبيل المثال ، إذا تم احتساب 25 ويحات في البئر حيث تم استخدام تخفيف مليون أمثالها ، من عيار العينة مخفف الأولي هو 25 مضروبة 1000000 مضروبا 2 أو 50000000 PFU / مل. مزيد من تقسيم هذا العدد من الوزن في البداية لقياس العينة لتقرير التتر في PFU / ز
6. ممثل النتائج :
بغية تحديد بدقة ما إذا كان الحصول على عينة جراحيا الأنسجة الطبيعية / ورم أو غير infectable مع الفيروس ، ويجب على المرء أولا التأكد من أن عينات الأنسجة على الأقل قابلة للحياة. ويبين الشكل 1A يمكن تقييم الجدوى التي تستخدم صبغة الأيضية (الامار الأزرق) وذلك على حد سواء طبيعية والأنسجة السرطانية يمكن أن تبقى نشطة عملية الأيض خلال فترة لا تقل عن 72H. هذا يشير إلى أن أنسجة الجسم الحي السابقين مثقف يمكن أن تدعم تكاثر الفيروس. وهناك ميزة كبيرة من الفيروسات oncolytic هو أنه يمكن هندستها لهم التعبير عن الجينات المحورة العلاجية أو التصوير. التين 2D - E يظهر أنه يمكن الكشف عن GFP Luciferase أو الأنسجة المصابة من خارج الحي ، ودعم كذلك أن هذه الأنسجة هي قابلة للحياة وinfectable أيضا. على الرغم من أن يترافق عادة مع زيادة التعبير التحوير تكاثر الفيروس ، فإنه لا يعني بالضرورة أن دورة حياة المنتج الفيروسية التي تؤدي إلى تضخيم الذات وانتشرت ، والتي يعتقد أنها مهمة للنشاط العلاجية. لهذا السبب ، من الضروري تحديد ما إذا كان الفيروس أنتجت أكثر مما كان يستخدم في البداية لإصابة الأنسجة. التين 2B يبين أنه عند الكمي الفيروسي بواسطة فحص اللوحة ، هو الحصول على مزيد من عدوى الفيروس بعد 72 ساعة ثم الأنسجة التي تم جمعها بعد العدوى مباشرة. عموما ، هذه البيانات تظهر أن تستأصل جراحيا نسيج الورم يمكن أن تبقى قابلة للحياة في الثقافة خلية لمدة 72 ساعة على الأقل ، وخلالها يمكن أن تدعم النسخ المتماثل الوقت الفيروسية.

الشكل 1. نظرة عامة على أخذ عينات من أنسجة / sectioning البروتوكول. تتم معالجتها عن طريق إزالة عينة الأنسجة العديد من العينات مم 2 وهي مقسمة إلى أربعة أرباع لاحقا والتي يتم توزيعها عشوائيا في آبار A1 - A4. رموز تدل على لون الكواشف المستخدمة في كل بئر. مربعات رمادية مظللة داخل الآبار تمثل كل ربع من النوى الفردية يصور 6. يتم نقل الأنسجة في A1 جيدا لحفر بئر جديدة (C1) مع وسائل الاعلام بعد القراءة الأولية الزرقاء الامار. تتم قراءة ثانية في نهاية الحضانة 72 ساعة مع الفيروسات. وتستكمل الآبار A4 و B4 مع Luciferin بعد حضانة 72 ساعة بعد الإصابة
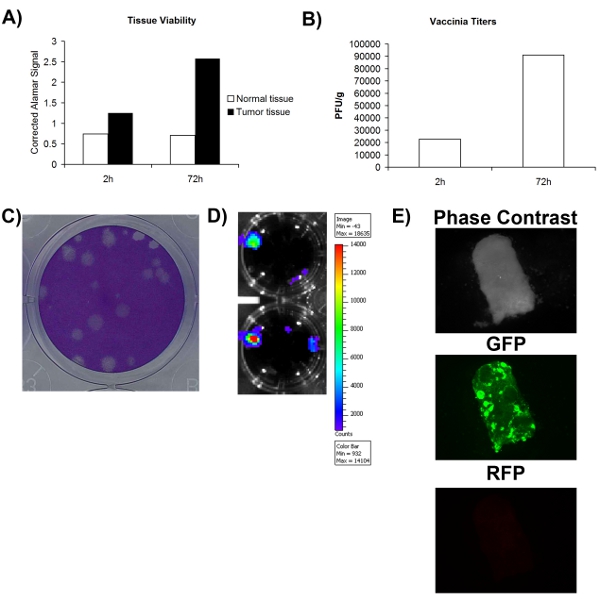
الشكل 2. سلامة وinfectability عينات الأنسجة المريضة. أ) صلاحية الأنسجة كما تقاس إشارة زرقاء الامار في 2 ساعة و 72 ساعة لجمع آخر. العمودي يمثل فارغة تصحيح الامار الزرقاء إشارة باء) العيار الحجمي للفيروس الوقسجمعها في كل غرام من عينات الأنسجة 2 و 72 ساعة بعد الاصابة. C) مثال لويحات الفيروس على الخلايا الوقس U2OS التالية تلطيخ coomassie. D) إشارة التلألؤ تم الحصول عليها من الأنسجة VV - luciferase المرضى المصابين به تصوير IVIS. E) الصور المجهري الإسفار عينة الأنسجة المريضة مصابة VV - GFP.
Discussion
واحدة من الخطوات الحاسمة في هذا البروتوكول هو الحصول على عينة الأنسجة الطازجة. وإذا وضعت العينة في الثقافة الخلية بعد انتظار طويل في غرفة العمليات في وسائل الاعلام غير ملائمة (مثل PBS) ، وهذا قد حل وسط بقاء الأنسجة ومنع infectability. من المذكرة ، الأنسجة الطبيعية هي بطبيعتها أكثر عرضة لهذه الآثار من الأنسجة السرطانية. نقطة أخرى الحاسم هو كيفية العديد من النوى المستخدمة لأخذ عينات من الأنسجة وتناسق حجمها. والتناقضات في الحجم تؤدي إلى تقلب عبر عينات من المرضى منذ عوامل مثل نقص الأكسجين والأنسجة السطحية infectectable سوف تتقلب تبعا لحجم النوى وأرباع الأساسية. في حين أن هذا يمكن أن تحل جزئيا باستخدام ماكينات تقطيع الأنسجة ، وميزة واحدة من الأسلوب المقدمة هنا هو أنه من السهل نسبيا ، وأقل عرضة للتلوث ، وقابلة للتطبيق على نطاق واسع لمجموعة متنوعة من أنواع الأنسجة ، بما في ذلك الأنسجة اللينة أو اللزجة التي لا تتقبل بسهولة لتشريح الأنسجة. خصوصا ، ويمكن زيادة عدد النوى من أجل الحصول على تمثيل أفضل الأنسجة. أيضا ، يمكن خفض النوى في أكثر من قطعة (على سبيل المثال 5-8) لاستيعاب المقايسات المحتملين الآخرين إلى أن يتم بالتوازي مثل الحمض النووي ، والجيش الملكي النيبالي ، أو استخراج البروتين. ومع ذلك ، فإن عدد القطع التي يمكن من خلالها خفض أحجام العينات لاستنساخه تعتمد على الحجم الفعلي للالنوى ، والتي يمكن تعديلها باستخدام المثاقيب مختلفة الحجم. اختياريا ، طريقة واحدة للمساعدة في الحصول على قطعة نسيج الحجم بتكاثر هو حتى من طول النوى باستخدام مسطرة قبل اقتطاع مزيد منهم الى أجزاء اصغر. بطبيعة الحال يمكن للبروتوكول يمكن تعديلها لاستيعاب الفيروسات الأخرى وقد وجدنا أن الأنسجة يمكن أن تكون قابلة للبقاء ودعم النسخ المتماثل لمدة تصل إلى 6 أيام. كذلك يمكن للبروتوكول أن تمتد إلى قياسات الجينات المحورة فيروسي ، وأعرب الأخرى بما في ذلك cytrokines. بعد الإصابة ، ويمكن أيضا أن تكون جزءا لا يتجزأ من الأنسجة في البارافين لمزيد من sectioning وتلطيخ بالطرق المناعى ، مما يسمح للمزيد من الصقل من الأنسجة الأنسجة ومدى ارتباطه عدوى فيروسية 10-12.
Disclosures
Acknowledgements
نود أن نشكر الدكتور هشام Abdelbary لتوفير العينات الجراحية الإنسان عن البيانات الواردة في الشكل 2.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| ارتفاع الجلوكوز DMEM | Hyclone | SH30243.01 | |
| المصل البقري الجنين | شركة NorthBio | NBSF - 701 | |
| Amphothericin B الحل | سيغما الدريتش | A2942 | استخدام عند 0.1 ٪ |
| Pennicilin - الستربتوميسين | سيغما الدريتش | P4333 | استخدام وبنسبة 1 ٪ |
| الامار الأزرق | Invitrogen | DAL1025 | |
| D - Luciferin البوتاسيوم الملح | منتجات التصوير الجزيئي | D - Luciferin البوتاسيوم ملح 1G | Resuspend في برنامج تلفزيوني في 10 مل / ملغ و تصفية على 0.22 ميكرون فلتر |
| MEM مسحوق | Gibco | # 41500018 | جعل النصف في الحجم المقترح لجعل MEM 2X وتصفية على 0.22 ميكرون التصفية قبل استخدامها |
| Carboxymethyl السليلوز (CMC) | سيغما الدريتش | C9481 | جعل الحل 3 ٪ في الماء منزوع الأيونات والأوتوكلاف. علما بأن مسحوق يمكن أن يستغرق بعض الوقت لresuspend |
| Coomassie بريليانت الأزرق R | سيغما الدريتش | B7920 | |
| 2 مم خزعة لكمة | Miltex | MX - 33-31 | |
| نصول مستقيمة مزدوجة الإعدادية | Personna العناية الطبية | 74-0002 | |
| مضان disection مجهر | لايكا | طراز M205 FA | |
| نظام التصوير في فيفو (IVIS) | الفرجار العلوم الحياتية | IVIS ® المجموعة 200 | |
| نسيج Tearor | منتجات Biospec | نموذج 985370-395 |
References
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved