Method Article
L'infection ex vivo de tissus vivants avec des virus oncolytiques
Dans cet article
Résumé
Les virus oncolytiques sont prometteurs pour traiter le cancer. La capacité de vérifier l'infectabilité des échantillons de tissus provenant de patients vivent avant le traitement est un avantage unique de cette approche thérapeutique. Ce protocole décrit comment traiter les tissus pour les Ex vivo un virus oncolytiques et la quantification ultérieure virale.
Résumé
Virus oncolytiques (OVS) sont les nouvelles thérapeutiques qui reproduire sélectivement dans les cellules tumorales et tuer 1. Plusieurs essais cliniques évaluant l'efficacité d'une variété de plates-formes, y compris oncolytiques HSV, réovirus, et VO vaccine comme traitement pour le cancer sont actuellement en cours 2-5. Une caractéristique clé de virus oncolytiques est qu'ils peuvent être génétiquement modifiées pour exprimer des transgènes journaliste qui permet de visualiser l'infection des tissus par microscopie ou bio-luminescence imagerie 6,7. Cela offre un avantage unique car il est possible d'infecter les tissus de l'ex vivo les patients avant le traitement afin de déterminer la probabilité de succès virothérapie oncolytiques 8. À cette fin, il est essentiel d'échantillon de tissu de façon appropriée pour compenser l'hétérogénéité des tissus et d'évaluer la viabilité des tissus, en particulier avant l'infection 9. Il est également important de suivre la réplication virale utilisant des transgènes journaliste si elle est exprimée par la plateforme oncolytiques, ainsi que par titrage direct de tissus après homogénéisation afin de discriminer entre l'infection abortive et productive. L'objet de ce protocole est de répondre à ces questions et décrit aux présentes 1. Le prélèvement et la préparation des tissus tumoraux pour les deux cultures cellulaires. L'évaluation de la viabilité des tissus en utilisant les colorants métaboliques Alamar Blue 3. Infection ex vivo des tissus cultivés avec des virus de la vaccine exprimant soit la GFP ou luciférase de luciole 4. La détection de l'expression du transgène par microscopie à fluorescence ou en utilisant un système d'imagerie in vivo (IVIS) 5. Quantification de virus par dosage de plaque. Cette méthode globale présente plusieurs avantages, notamment la facilité de traitement des tissus, la rémunération de l'hétérogénéité des tissus, le contrôle de la viabilité des tissus, et la discrimination entre l'infection abortive et les os réplication virale foi.
Protocole
1. Le traitement des tissus
- Pour de meilleurs résultats, ce protocole doit être effectuée à l'aide de tissus isolés fraîchement déposés dans des milieux DMEM contenant 10% de FBS, 1% Pennicilin / streptomycine solution, et de 0,1% Amphothericin solution B immédiatement après la chirurgie avant la transformation. Si cela n'est pas possible, les tissus peuvent être laissés la nuit dans ce milieu à 4 degrés avant la transformation.
- Avant le traitement de l'échantillon, stériliser une pince en métal et des lames jetables en les déposant dans une solution d'éthanol à 70% pendant au moins 5 minutes. Aussi préparer une plaque de 24 puits avec 2 ml de milieu DMEM contenant 10% de FBS, 1% Pennicilin / streptomycine solution, et de 0,1% Amphothericin B.
- Recueillir l'échantillon de tissu dans une hotte à flux laminaire de culture cellulaire à l'aide des pinces stérilisées et déposer le tissu dans un plat vide de 15 cm de Pétri, en gardant le couvercle sur le côté, côté stérile en place.
- Dans la hotte de culture cellulaire, l'utilisation de 2 mm biopsie afin d'obtenir différents noyaux d'une variété de régions dans le tissu comme dans la Figure 1. Dépôt des carottes dans le couvercle de l'Pétri de 15 cm à l'aide d'une pince, en laissant assez d'espace entre chaque coeur afin qu'ils puissent être facilement coupé le long de l'axe horizontal.
- Fendez chaque coeur en 4 quarts, même en utilisant une lame de rasoir stérilisée comme dans la Figure 1.
- En utilisant une pipette, mettre chaque trimestre coeur d'un noyau donné dans un puits différent de A1 à A4 comme dans la figure 1, déjà contenant 1,5 ml de DMEM contenant 10% de FBS, 1% Pennicilin / streptomycine solution, et de 0,1% Amphothericin solution B . Répétez l'opération pour chaque core. Cela devrait permettre d'échantillonnage représentatif de la tumeur, tout en minimisant les biais dans un puits donné / état. Pour une meilleure représentation, d'augmenter le nombre de cœurs.
2. Évaluation de la viabilité des tissus
- Après le traitement des tissus, ajouter 25 pi bleu Alamar à bien # A1 et A2 # comme le montre la figure 1 et incuber pendant 1 heure à 37 degrés dans un incubateur humidifié avec 5% de CO 2.
- Après incubation avec du bleu Alamar, enlever 3 fois 100 pi de chaque A1 et A2 ainsi et le transfert à 6 différents puits d'une plaque de 96 puits. Lire le signal en utilisant un lecteur de plaque à fluorescence (530 d'excitation, 590 émissions) et conserver les données pour vos dossiers.
- Après le signal bleu Alamar a été lu, le transfert de tous les morceaux de tissu en utilisant un embout de la pipette, à partir de puits A1 à C1 qui contient du DMEM, 10% de FBS + PS + AmphoB. Soyez prudent de ne pas transférer une quantité excessive de médias de puits A1.
- Infect godets A3 et A4 respectivement avec 10 6 pfu de la GFP et la luciférase exprimant exprimant virus de la vaccine dilué dans 25 ul de médias. Eh bien A2 peut être infecté par un virus qui exprime que toute transgène donnée, y compris rien du tout.
- 72 heures plus tard, ajouter 25 ul bleu Alamar aux puits C1 et D1 et répétez l'étape 2.2
3. Visualisation de l'expression du transgène GFP par microscopie de fluorescence
- Retirez tous les supports de culture de cellules couvrant les morceaux de tissu afin de prendre de bonnes photos de fluorescence.
- En utilisant un microscope à fluorescence de dissection capables, d'abord prendre une image à contraste de phase à une résolution appropriée
- Passer en mode fluorescence et prendre une photo en utilisant le filtre approprié pour visualiser le transgène d'intérêt, dans ce cas, la GFP.
- Utilisez un filtre de fluorescence pour une autre longueur d'onde dans la mesure du possible, une de celle du transgène d'intérêt (comme DP) pour prendre une photo de fluorescence de fond
4. Visualisation d'expression luciférase utilisant un système d'imagerie in vivo (IVIS)
- Assurez-vous que l'IVIS est initialisé avant de commencer.
- En format A4 et B4 puits, ajouter 5 ul de substrat luciférine 10 mg / ml, bien mélanger et laisser incuber pendant 5 minutes à température ambiante.
- Réglez le temps d'exposition IVIS à 5 secondes et prendre une photo de votre puits. Si l'image est saturée, répéter avec le temps faible exposition. S'il n'y a pas de signal, d'augmenter le temps d'exposition.
- Utilisation du logiciel d'imagerie IVIS, vous pouvez retirer de fond en utilisant le signal de même B4 et sélectionnez la région d'intérêt pour quantifier le signal de luminescence.
5. Évaluation des titres viraux par dosage de plaque
- Avant de quantifier les titres viraux, les tissus doivent d'abord être homogénéisés pour la libération des particules virales. Cela peut être fait quelques mois plus tard dans les échantillons de tissus infectés sont stockés à -80
- Peser l'échantillon qui doit être homogénéisé en utilisant une échelle d'analyse. Dans ce cas, nous allons utiliser l'échantillon prélevé dans le godet A2.
- Placer le tissu est dans un tube de 5 ml en polystyrène à fond rond faucon et ajouter 1 ml de PBS. Homogénéiser le tissu en utilisant un homogénéisateur de tissu. Si nécessaire, conserver l'homogénat à -80 pour l'évaluation des titres viraux à une date ultérieure.
- Pour un titre virus de la vaccine, première plaque 1 million de cellules U2OS dans une plaque à 6 puits et incuber pendant la nuit dans un degré 37, 5% de CO 2 et humideified tels qu'ils ont atteint environ 95% de confluence le lendemain incubateur.
- Utilisez milieux exempts de sérum pour faire des dilutions en série du virus, en veillant à changer trucs entre chaque étape de dilution. Généralement nous faisons 1 sur 10 dilutions et utiliser 100 ul de transférer dans 900 pi. Combien de dilutions sont faites dépend du rendement du virus prévu.
- Suite à faire les dilutions, retirez le support couvrant les cellules U20S plaqués, puis ajouter 500 ul de stock de virus dilué (pour chaque dilution) pour infecter les cellules U2OS. Incuber les cellules pendant 1 minutes heures à 37 degrés Celsius dans un 5% de CO 2 incubateur humidifié.
- Pendant ce temps, faites chauffer le X 2 concentrés DMEM contenant 20% de FBS, et la solution 3% de CMC dans un bain d'eau 37 degrés.
- Après l'incubation de 1 heure, retirer le support couvrant les cellules infectées U2OS. Mélanger 01:01 volumes de 3% de CMC: 2X DMEM, 20% de FBS ensemble et utiliser 2 ml de ce mélange pour couvrir chaque puits des cellules infectées U2OS.
- Mettez les cellules de retour dans un 37 degré 5% de CO 2 incubateur humidifié pour un autre 48 heures.
- Après 48 heures, ajouter 2 ml de méthanol acide acétique fixatif sur le dessus de la superposition de CMC dans chaque puits et incuber à température ambiante pendant 10 minutes dans une hotte de culture cellulaire.
- Jeter la superposition fixe et lavez restant hors des puits en utilisant l'eau du robinet.
- Colorer les cellules fixées U2OS avec 2 ml d'une solution de bleu de Coomassie par puits et incuber pendant 30 minutes à température ambiante à basse vitesse sur un agitateur assiette.
- Retirer la tache de Coomassie des puits et laver les plaques avec de l'eau du robinet. Laisser sécher avec Couvercle pendant environ une heure.
- Les plaques résultant virale peut être facilement visualisés dans la figure 2C. Les plaques peuvent être stockées indéfiniment à ce stade.
- Nombre de plaques à l'étape de dilution, où entre 10 et 100 plaques sont visibles.
- Multiplier le nombre de plaques comptées par la dilution utilisée et multiplier le nombre obtenu par 2 pour donner un titre en PFU / ml. Par exemple, si 25 plaques sont comptées dans le puits où une dilution million de fois a été utilisé, le titre de l'échantillon initial non dilué est de 25 multiplié par 1 million multiplié par 2 ou 50 millions d'UFP / ml. En outre diviser ce nombre par le poids initialement mesure pour l'échantillon de rendre compte des titres en PFU / g
6. Les résultats représentatifs:
Afin de déterminer avec précision si un échantillon de tissu obtenu chirurgicalement normale / tumeur est ou n'est pas infectables par un virus, il faut d'abord s'assurer que l'échantillon de tissu est moins viable. Figure 1A montre que la viabilité peut être évaluée en utilisant un colorant métaboliques (bleu Alamar) et que les tissus normaux et tumoraux peut rester métaboliquement active pendant une période d'au moins 72h. Ceci suggère que les tissus in vivo cultivées ex peut supporter la réplication virale. Un avantage significatif de virus oncolytiques est qu'elles peuvent être modifiées pour exprimer des transgènes thérapeutiques ou d'imagerie. Figure 2D-E montre que la GFP ou luciférase peut être détectée à partir des tissus infectés ex vivo, d'autres soutenant que ces tissus sont viables et aussi infectables. Bien que l'expression du transgène accrue est généralement associé à la réplication virale, il n'est pas nécessairement synonyme d'un cycle de vie virale productive qui conduit à l'auto-amplification et de propagation, ce qui est pensé pour être important pour l'activité thérapeutique. Pour cette raison, il est nécessaire de déterminer si davantage de virus est produit que ce qui était initialement utilisé pour infecter les tissus. Figure 2B montre que, lors de la quantification virale par dosage de plaque, plus le virus est obtenue après 72 heures, puis une infection des tissus prélevés immédiatement après l'infection. Globalement, ces données montrent que le tissu tumoral excisée chirurgicalement peuvent rester viables dans la culture cellulaire pour une période d'au moins 72 heures, au cours de laquelle la réplication virale du temps peut être pris en charge.

Figure 1. Vue d'ensemble de l'échantillonnage des tissus / sectionnement protocole. Échantillon de tissu est traité par la suppression de plusieurs noyaux 2 mm qui sont ensuite divisés en quatre quartiers qui sont distribuées au hasard dans les puits A1 à A4. Les codes de couleur indiquent les réactifs utilisés dans chaque puits. Les carrés en gris dans le puits représentent chaque trimestre depuis le 6 cœurs individuels représentés. Le tissu dans le puits A1 est transféré à un nouveau puits (C1) avec les médias après la lecture initiale du bleu Alamar. Une seconde lecture est effectuée à la fin de l'incubation de 72 heures avec des virus. Wells A4 et B4 sont complétées par Luciférine après l'incubation 72 heures post-infection
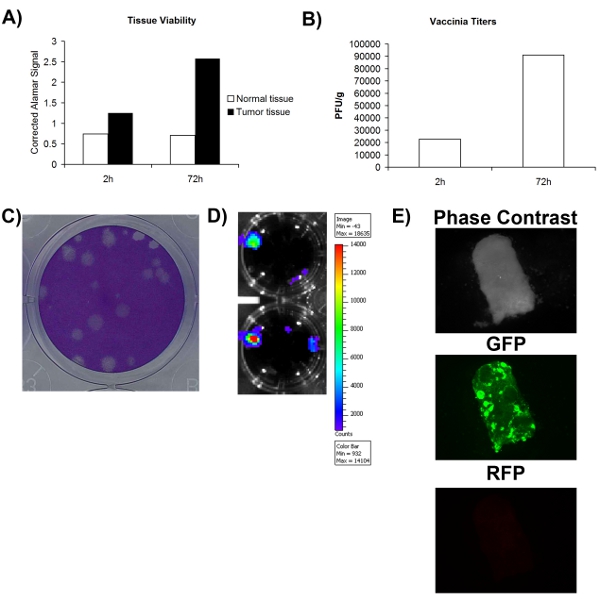
Figure 2. Viabilité et infectabilité des échantillons de tissus des patients. La viabilité des tissus A) telle que mesurée par Alamar Blue signal à 2 heures et 72 heures après la collecte. L'axe Y représente la vierge corrigées Alamar Blue signal. B) titrage de virus de la vaccinerecueillies par gramme d'échantillons de tissus 2 et 72 heures post-infection. C) Exemple de plaques virus de la vaccine sur les cellules après coloration coomassie U2OS. D) signal de luminescence obtenu à partir de patients VV-luciférase tissu infecté imagées par IVIS. E) photos microscopie à fluorescence d'échantillon de tissu du patient infecté par VV-GFP.
Discussion
Une des étapes cruciales dans ce protocole est d'obtenir des échantillons de tissus frais. Si l'échantillon est mis en culture cellulaire après une longue attente à la salle d'opération dans un média approprié (par exemple PBS), cela peut compromettre la viabilité des tissus et prévenir infectabilité. Fait à noter, les tissus normaux est intrinsèquement plus enclins à ces effets que les tissus tumoraux. Un autre point critique est le nombre de cœurs utilisés pour échantillonner les tissus et la cohérence de leur taille. Incohérences dans la taille va entraîner une variabilité entre les échantillons des patients, car des facteurs tels que l'hypoxie tissulaire et de la surface infectectable va fluctuer en fonction de la taille des noyaux et des quarts de base. Bien que cela puisse être partiellement résolu en utilisant des tissus trancheuses, un avantage de la méthode présentée ici est qu'il est relativement facile, moins sujettes à la contamination, et largement applicable à une variété de types de tissus, y compris les tissus mous ou visqueux, qui ne sont pas facilement se prêtent pour les tissus de trancher. Notamment, le nombre de cœurs peut être augmentée afin d'obtenir une meilleure représentation des tissus. En outre, les noyaux peuvent être coupées en plusieurs morceaux (ex. 5-8) pour accueillir d'autres dosages potentiel d'être fait en parallèle tels que ADN, ARN, ou l'extraction des protéines. Toutefois, le nombre de pièces dans lesquelles les noyaux peuvent être coupés à la taille reproductibles dépendra de la taille réelle des cœurs, qui peut être modifié en utilisant différents carottiers entreprises. Optionnellement, une façon d'aider à obtenir des morceaux de tissu de façon reproductible taille est d'égaliser la longueur des carottes à l'aide d'une règle avant de poursuivre en les subdivisant en petits morceaux. Le protocole peut naturellement être modifiés pour tenir compte d'autres virus et nous avons constaté que les tissus peuvent être viables et le soutien de réplication pour un maximum de 6 jours. Le protocole peut encore être étendu à d'autres mesures viro-transgènes exprimés notamment cytrokines. Après l'infection, les tissus peuvent également être inclus dans la paraffine pour les autres coupes et coloration par des méthodes immunohistochimiques, ce qui permet d'affiner davantage de l'histologie des tissus et comment il se rapporte à une infection virale 10-12.
Déclarations de divulgation
Remerciements
Nous tenons à remercier le Dr Hesham Abdelbary pour fournir des spécimens humains chirurgicales pour les données présentées dans la figure 2.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| De glucose à haute DMEM | Hyclone | SH30243.01 | |
| Sérum de veau fœtal | NorthBio Inc | NBSF-701 | |
| Amphothericin solution B | Sigma-Aldrich | A2942 | Utilisez à 0,1% |
| Pennicilin-streptomycine | Sigma-Aldrich | P4333 | Utilisez moins de 1% |
| Alamar Blue | Invitrogen | DAL1025 | |
| Sel de potassium D-luciférine | Produits d'imagerie moléculaire | D-luciférine 1g de sel de potassium | Remettre en suspension dans du PBS à 10 mg / ml et filtrer sur filtre de 0,22 um |
| MEM en poudre | Gibco | # 41500018 | Faire de la moitié du volume proposé de faire 2X MEM et filtrer sur filtre de 0,22 um avant utilisation |
| Carboxyméthyl cellulose (CMC) | Sigma-Aldrich | C9481 | Faire une solution à 3% dans de l'eau déminéralisée et autoclave. Notez que la poudre peut prendre un certain temps à remettre en suspension |
| Coomassie Brilliant Blue R | Sigma-Aldrich | B7920 | |
| 2 mm biopsie | Miltex | MX-33-31 | |
| Double Lames Prep Bord | Personna Medical Care | 74-0002 | |
| Microscope de fluorescence dissection | Leica | le modèle M205 FA | |
| L'imagerie in vivo du système (IVIS) | Caliper Life Sciences | IVIS ® série 200 | |
| Tearor tissus | Produits Biospec | modèle de 985370-395 |
Références
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon