A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
البيوكيميائية قياس حديثي الولادة نقص الأكسجة
In This Article
Summary
تم وصف طريقة لقياس علامات الحيوية في الأطفال حديثي الولادة نقص الأكسجين ، نقص التروية. هذا النهج يستخدم ارتفاع ضغط اللوني السائل (HPLC) واللوني للغاز طيف الكتلة (GC / MS).
Abstract
وتتميز الوليدية الإسكيمية نقص الأكسجين التي نضح الدم غير كافية من الأنسجة أو عدم نظامية من الأوكسجين. ويعتقد أن هذا الشرط لسبب / تفاقم الاضطرابات الولدان موثقة جيدا بما في ذلك إعاقة للجهاز العصبي 1-3. انخفض انتاج الأدينوساين ثلاثي يحدث نتيجة لنقص في الفسفرة المؤكسدة. للتعويض عن هذه الجزيئات التي تحتوي على طاقة عالية حرمان الدولة سندات الفوسفات الطاقة هي 2 المتدهورة. هذا يؤدي إلى زيادة مستويات الأدينوساين الذي تدهورت لاحقا إينوزين ، هيبوزانتين ، الزانثين ، وأخيرا إلى حمض اليوريك. يتم تنفيذ المرحلتين الأخيرتين في هذه العملية من قبل تدهور oxidoreductase الزانثين. هذا الانزيم موجود في شكل هيدروجين الزانثين في ظل ظروف normoxic ولكن يتم تحويلها إلى أوكسيديز الزانثين (XO) تحت ظروف نقص الأكسجين ضخه - 4 ، 5. خلافا نازعة الزانثين ، XO يولد بيروكسيد الهيدروجين كمنتج ثانوي للتدهور البيورين 4 ، 6. هذا بيروكسيد الهيدروجين في الجمع مع غيرها من أنواع الاكسجين التفاعلية (ريوس) التي تنتج أثناء نقص الأكسجين ، يتأكسد حمض اليوريك لتشكيل آلانتوين ويتفاعل مع الأغشية الدهنية لتوليد malondialdehyde (MDA) 7-9 ، ومعظم الثدييات ، البشر المعفاة ، تمتلك يوريكاز الانزيم الذي يحول إلى حمض اليوريك آلانتوين. في البشر ، ومع ذلك ، لا يمكن إلا أن يكون شكلتها آلانتوين ريوس بوساطة أكسدة حمض اليوريك. وبسبب هذا ، يعتبر آلانتوين أن يكون علامة من الاكسدة في البشر ، ولكن ليس في الثدييات التي لديها يوريكاز.
نحن تصف أساليب توظيف ارتفاع ضغط اللوني السائل (HPLC) والغاز اللوني الطيف الكتلي (نماذج الدوران) لقياس العلامات الحيوية من نقص التروية نقص الأكسجين الوليدي ، ويستخدم الدم البشرية لمعظم الاختبارات. ويمكن أيضا أن تستخدم دم الحيوان مع الاعتراف احتمال يوريكاز المولدة آلانتوين. وترتبط الأيضات البيورين إلى نقص الأكسجين في وقت مبكر عام 1963 وموثوقية هيبوزانتين ، الزانثين ، وجرى التحقق من حمض اليوريك كمؤشرات البيوكيميائية حديثي الولادة من نقص الأكسجة المحققون عدة 10-13. طريقة HPLC المستخدمة في القياس الكمي للمركبات البيورين سريعة وموثوق بها ، وقابلة للتكرار. تم تعديل طريقة GC / MS المستخدمة في القياس الكمي للآلانتوين ، علامة جديدة نسبيا من الاكسدة ، وآخرون من غروبر 7. هذا الأسلوب يتجنب بعض التحف ويتطلب كميات منخفضة من العينة. ووصف الأساليب المستخدمة لتوليف MMDA في أماكن أخرى 14 و 15. تم تكييفها GC / MS الكمي القائم على نجمة داود الحمراء من Paroni وآخرون. وCighetti آخرون 16 و 17. تم قياس النشاط أوكسيديز الزانثين بواسطة HPLC عن طريق قياس تحويل تيرين isoxanthopterin إلى 18. أثبت هذا النهج لتكون حساسة بما فيه الكفاية وقابلة للتكرار.
Protocol
1. جمع العينات ومعالجتها
- جمع عينات من الدم في أنبوب K3E 6ml K3 EDTA وهو يحرص على الجليد.
- في غضون 2 دقيقة من جمع وأجهزة الطرد المركزي العينة بنسبة 4 في 1500 ز لمدة 10 دقيقة درجة مئوية.
- نقل طاف (البلازما) إلى أنبوب microcentrifuge 1.5ml.
- الطرد المركزي عند درجة 4 في 18000 ز لمدة 30 دقيقة.
- إزالة aliquots طاف ونقلها إلى أنابيب microcentrifuge منفصلة للالبيورين (200μl) ، آلانتوين (50μl) ، نجمة داود الحمراء (100μl) ، وتحليل XO (120μl). يجب الحرص على عدم تلوث العينات مع خلايا الدم الحمراء. قد تحتاج إلى ضبط كميات من البلازما لنجمة داود الحمراء ، XO ، والبيورينات استنادا إلى إجمالي حجم البلازما المتوفرة.
2. إعداد المعيار الداخلي ، 2 - Aminopurine (2 - AP) ، وتحليل لالبيورين XO
- تزن خارج 0.01351g 2 - AP وإضافته إلى 8ml المياه التي تم المحمضة مع قطرات من حمض الهيدروكلوريك 2-5. إذا كان 2 - AP ليس بحل تحتاج إلى إضافة المزيد من الحامض. ضبط الحجم النهائي ل10ML.
- استخدام مطياف الأشعة فوق البنفسجية فيس لتحديد تركيز حقيقي من المخزون الخاص بك 2 - AP الحل. (λmax 315 ، ε 4000).
- بمجرد تركيز المخزون يتم تحديد 2 - AP الحل ، وحساب الكميات اللازمة لاحتواء 1x10 -7 مول 2 - AP الداخلية معيار لقياس البيورين و1x10 -8 مول 2 - AP الداخلية معيار لقياس XO.
- قسامة الكميات المحسوبة في أنابيب microcentrifuge منفصلة وتتبخر إلى جفاف في SpeedVac.
المعادلة 1 : 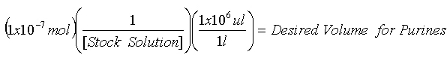
المعادلة 2 : 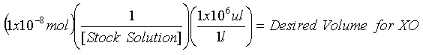
3. HPLC قياس البيورينات
- نقل البلازما (200μl) إلى Microcon YM - 10 درجة مئوية تصفية جهاز الطرد المركزي وأجهزة الطرد المركزي عند 4 في 14000 ز مقابل 1.5 ساعة.
- إزالة رشاحة ونقل إلى أنبوب microcentrifuge تحتوي 1x10 -7 مول 2 - AP. لا شك أن يسجل حجم الراشح إضافة إلى أنبوب microcentrifuge تحتوي على 2 - AP. دوامة العينات لمدة 10-20 ثانية.
- تحليل عينات مع HPLC. وتستخدم ثلاث حقن 50 ميكرولتر عن كل عينة. يتم حقن عينات من الصعود إلى Supelcosil LC - S - 18 ، 15 سم x 4.6 ملم ، 5 ميكرون العمود مجهزة LC - 18 - S Supelguard حراسة العمود. وينبغي أن تستخدم شروط التدرج وصفها في الجدول رقم 1 للحصول على الانفصال كافية الذروة : المذيبات والماء والمذيبات B - الميثانول ، والمذيبات فورمات الأمونيوم C - 50mM العازلة ، ودرجة الحموضة 5.5.
| مرة | تدفق (لتر / دقيقة) | A ٪ | ٪ B | ٪ C | |
| 1 | 1.00 | 0.0 | 0.0 | 100.0 | |
| 2 | 16.00 | 1.00 | 0.0 | 0.0 | 100.0 |
| 3 | 17.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 4 | 22.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 5 | 27.00 | 1.00 | 0.0 | 100.0 | 0.0 |
| 6 | 32.00 | 1.00 | 0.0 | 100.0 | 0.0 |
| 7 | 33.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 8 | 38.00 | 1.00 | 100.0 | 0.0 | 0.0 |
| 9 | 39.00 | 1.00 | 0.0 | 0.0 | 100.0 |
| 10 | 45.00 | 1.00 | 0.0 | 0.0 | 100.0 |
الجدول 1. المذيبات لقياس التغيرات HPLC مركبات البيورين.
- تحديد تركيز البيورينات في العينة. هيبوزانتين كميا ، الزانثين ، وحمض اليوريك عن طريق الحصول على مناطق الذروة في استبقاء وموجات موضح في الجدول رقم 2. تحديد منطقة ذروة AP - 2. تحديد نسب مجال هيبوزانتين ، الزانثين ، وحمض اليوريك إلى AP - 2 ، وتحويل النسب لتركيزات μmolar باستخدام المنحنيات القياسية.
| * الاحتفاظ الزمن | * لاحظ ماكس λ | وذكرت λ ماكس 19 | وذكرت ε ماكس 19 | |
| بوليحامض | ~ 3.5 دقيقة | 288 | 283 [2] | 11500 [2] |
| هيبوزانتين | ~ 7.0 دقيقة | 248 | 248 [1] | 10800 [1] |
| الزانثين | ~ 9.5 دقيقة | 267 | 267 [2] | 10200 [2] |
| 2 - Aminopurine | ~ 12.5 دقيقة | 305 | 314 [2] | 4000 [2] |
الجدول 2. مرات الاحتفاظ نموذجي والحد الأقصى لλ البيورينات والمعايير الداخلية. * وتصميما على استخدام HPLC isocratic فورمات الأمونيوم 50mM العازلة (درجة الحموضة 5.5) مع معدل تدفق 1mL/min. درجة الحموضة في [].
- تحليل جميع العينات في ثلاث نسخ ، وإنما تشمل فقط لتحليل القيم في وقت لاحق إذا كان معامل الاختلاف هو اقل من 10 ٪.
4. GC / MS قياس آلانتوين
- إضافة 50μl 10μM DL - آلانتوين - 5 - 13 C ؛ 1-15 N (الداخلية قياسي) في البلازما 50 ميكرولتر وضعت جانبا لمقايسة آلانتوين أثناء جمع العينات ومعالجتها.
- إضافة إلى 100 أسيتونتريل ميكرولتر هذا الحل البلازما.
- دوامة الخليط لمدة 10-20 ثانية ثم الطرد المركزي في 4 درجات مئوية في 20000 ز لمدة 10 دقيقة.
- إزالة طاف ، ووضعه في قارورة GC / MS والجافة تحت رقم 2.
- بعد التجفيف ، وإضافة 50 ميكرولتر من derivatizing كيل N - ثالثي Butyldimethylsilyl - N - methyltrifluoroacetamide (MTBSTFA) في بيريدين (1:1 المجلد / المجلد) ، وكأب وقنينات واحتضان عليهم في 50 ساعة لمدة 2 درجة مئوية هذا derivatization غلة قابلة للقياس الكمي على الدوام م / ض قمم 398.0 400.0 ولآلانتوين وDL - آلانتوين - 5 - 13 C ؛ 1-15 N ، 20 على التوالي.
- تحليل العينات على 6890N اجيلنت تكنولوجيز GC 5973 و MS مجهزة العينات السيارات. أداء فصل مركب على اجيلنت 122 5532G العمود الشعري (25.7m طول قطرها الداخلي 0.25mm). استخدام الهيليوم بوصفها الناقل للغاز في معدل تدفق 1.5 مل / دقيقة. حقن المنتج derivatized (1 ميكرولتر) في وضع تقسيم (تقسيم نسبة 20:01 ، وتدفق تقسيم 29.4 مل / دقيقة ، وتدفق إجمالي 33.8 مل / دقيقة). ضبط درجة حرارة العمود الأولية بنسبة 100 درجة مئوية ، والاستمرار في ذلك درجة الحرارة لمدة 2 دقيقة قبل زيادته الى 180 درجة مئوية في معدل 10 درجة مئوية / دقيقة. الاستمرار على درجات الحرارة لمدة 4 دقائق ثم زيادته إلى 260 درجة مئوية في معدل 20 درجة مئوية / دقيقة. المحافظة على درجة الحرارة هذه حتى نهاية المدى. بعد كل عينة نظيفة العمود مع 2 حقن الهكسين.
- كميا باستخدام آلانتوين حدد وضع رصد أيون بينما رصد 398.0 م / ض لايون آلانتوين وايون 400.0 م / ض لDL - آلانتوين - 5 - 13 C ، 1 -- 15 ن. تحويل النسب وفرة من آلانتوين أيون / (آلانتوين الثقيلة) لتركيزات من micromolar آلانتوين باستخدام منحنى أعد القياسية.
- ويتم تحليل جميع العينات في ثلاث نسخ ولكن يتم استخدام القيم فقط مع معامل الاختلاف أقل من 10 ٪ في تحليلات أخرى.
5. إعداد المعيار الداخلي ، الميثيل Malondialdehyde (MMDA) ، لتحليل MDA
- إضافة 523μl 3 - 7M 1477μl ethoxymethacrolein إلى هيدروكسيد الصوديوم في قارورة الدور السفلي 100ML. إضافة stirbar.
- ضع القارورة في حمام مائي عند 45 درجة مئوية ، ويحرك حتى رد الفعل قد ذهب إلى الاكتمال. هذا يجب أن تأخذ ما يقرب من 140 دقيقة. رصد التقدم المحرز في رد فعل من جانب إزالة قسامة 10μl السائل على فترات 10 دقيقة. تمييع كل عينة تم جمعها من قبل عامل من 10 5 50 باستخدام فوسفات البوتاسيوم العازلة ملم (الرقم الهيدروجيني 7) وقياس الامتصاصية مع فيس للأشعة فوق البنفسجية. بمجرد أن يصل الامتصاصية في 275nm تقريبا 0،658 رد فعل غير كاملة. كرد فعل تقدم ، فإن الحل بدوره الاصفر والبرتقالى ذلك الحين.
- السماح للكرد فعل على التقدم للحصول على 15 دقيقة إضافية.
- إضافة 5ml من الماء المقطر منزوع الأيونات في قاع القارورة المستديرة ونقل حل لقمع separatory. استخدام مبلغ إضافي قدره 3 مليلتر من الماء لغسل محتويات القارورة في القمع. إضافة 2ml إضافية من المياه للقمع.
- استخراج الحل 3 مرات مع 5 مل ثنائي كلورو ميثان. بعد كل استخراج تجاهل الطبقة العضوية.
- بعد استخراج الثالثة ، نقل الطبقة المائية لقاع القارورة المستديرة وrotovap للجفاف.
- Resuspend الايثانول المنتج في 3ml ونقل إلى أنبوب قبل زنه المخروطية 15ml. شطف القارورة مع الإيثانول 2ml إضافية وإضافة إلى شطف الأنبوب المخروطية.
- إضافة 5ml البنزين واحتضان الأنبوب في ماء دافئ حتى يذوب ثم المنتج المكان على الفور الأنبوب على الجليد لمدة 10 دقيقة. أجهزة الطرد المركزي لمدة 5 دقائق على 15000 ز وإزالة طاف.
- إضافة 5ml الايثانول و 5 مل الآيزوبروبيل الأثير إلى الأمطارitant. حل مرسب التي يحتضنها الأنبوب في الماء الدافئ وإمالة دوري الأنبوب بلطف جدا. حالما يتم حل متعجل ، وضع أنبوب على الجليد لمدة 10 دقيقة. تنفيذ هذا التبلور 2 أكثر الأوقات مع الايثانول والإثير الآيزوبروبيل. قد تكون شكلت بعض قطع بيضاء غير قابلة للذوبان من المنتجات.
- بعد الخطوة الأخيرة إزالة التبلور كما طاف أكبر قدر ممكن من المنتجات والجافة الناتجة في Speedvac. وزن الأنبوبة المخروطية مع المنتج توليفها.
- يضاف الماء إلى دوامة 5ml ، أنبوب ، وتصفية أي المواد الصلبة المتبقية.
- استخدام مطياف الأشعة فوق البنفسجية تجاه لتحديد تركيز MMDA النهائي. وλmax لMMDA العازلة في 50 ملي فوسفات البوتاسيوم (الرقم الهيدروجيني 7) هو 274 نانومتر مع معامل الانقراض من 29900 م -1 -1 14 سم.
6. GC / MS قياس MDA
- يعد حل التولوين 0.5mM الهيدروكسيل الأنيسول (BTH) في الايثانول بإضافة 0.11 ز BTH الى الايثانول 9ml وتعديل الحجم النهائي ل10ML. ثم نفذ إلى إضعاف بإضافة 10μl هذا الحل يتركز على الايثانول 990μl.
- يعد حل فينيل الهيدرازين 50mM بإضافة 4.92μl فينيل الهيدرازين ل995μl من الماء في أنبوب microcentrifuge الظلام. دوامة الحل.
- إضافة 5μl 10μM MMDA إلى البلازما 100μl وضعت جانبا لمقايسة MDA خلال جمع العينات ومعالجتها.
- ثم يضاف BTH 0.5mM 10μl إلى خليط MMDA / البلازما تليها إضافة 200μl سترات الصوديوم 1M عند pH 4 ، وهذا أمر بالغ الأهمية لدرجة الحموضة derivatization الصحيح للعينة. وهناك ارتفاع أو انخفاض درجة الحموضة نتيجة انحراف في مستويات MDA.
- تمييع الخليط النهائي وذلك بإضافة الماء المقطر منزوع الأيونات إلى وحدة تخزين النهائي لل480μl.
- Derivatize الحل بإضافة 20μl فينيل الهيدرازين 50mM متوجا على قنينات ويحتضنها الحل عند 25 درجة مئوية لمدة 30 دقيقة على شاكر المداري.
- إضافة 1ml من الهكسين ، لدوامة 1 دقيقة ، وأجهزة الطرد المركزي في 3000 دورة في الدقيقة لمدة 10 دقيقة.
- نقل الطبقة العضوية إلى قارورة GC / MS والتركيز على حل ل100μl بواسطة تيار 2 N.
- تحليل العينات على GC / MS باستخدام العينات السيارات. أداء فصل مركب على اجيلنت 122 5532G العمود الشعري (25.7 متر طول و 0.25 مم داخلي). استخدام الهيليوم بوصفها الناقل للغاز بمعدل تدفق 0،6-0،8 مل / دقيقة. حقن المنتج derivatized (2 ميكرولتر) في وضع تقسيم (تقسيم نسبة 20:01 ، وتدفق تقسيم 23.0 مل / دقيقة ، وتدفق إجمالي 27.1 مل / دقيقة). ضبط درجة حرارة العمود الأولية بنحو 110 درجة مئوية ، والاستمرار في ذلك لدرجة الحرارة 1 دقيقة قبل زيادته الى 250 درجة مئوية في معدل 40 درجة مئوية / دقيقة. المحافظة على درجة الحرارة هذه حتى نهاية المدى. بعد كل عينة نظيفة العمود مع 2 حقن الهكسين.
- كميا باستخدام حدد وضع نجمة داود الحمراء رصد ايون باستخدام 144.00 م / ض لنجمة داود الحمراء و158.00 م / ض لMMDA. تحويل وفرة ايون MDA / MMDA نسب لتركيزات micromolar باستخدام منحنى القياسية.
- تحليل العينات في ثلاث نسخ ، وتستخدم فقط مع قيم معامل الاختلاف أقل من 10 ٪.
7. HPLC قياس xanthine أوكسيديز
- الكشف عن وظيفة أوكسيديز الزانثين يعتمد على القدرة على قياس مستويات بحساسية ركيزة مناسبة (تيرين) فضلا عن منتجاتها (isoxanthopterin). وحضنت البلازما مع الركيزة إما ل0 دقيقة (السيطرة) أو لمدة 4 ساعات ، ويتم تحديد الحضانة الركيزة التي تعتمد على تحويل المنتج.
- إضافة 240μl 0.2 M - حمض الهيدروكلوريك تريس العازلة (9.0 درجة الحموضة) و4.63μl 7.083x10 -3 تيرين M على كل أنبوب (0 و 4H) ، ويحضن مسبقا لهم في 37 دقيقة لمدة 5 درجة مئوية.
- بدء رد فعل وذلك بإضافة إنزيم 60μl من البلازما على كل أنبوب.
- إضافة على الفور 300μl HClO 4 ٪ 4 إلى الأنبوب السيطرة (0 دقيقة) لكنه يسمح للخليط أخرى لاحتضان لمدة 4 ساعات قبل التبريد للتفاعل مع 4 ٪ 300μl HClO 4.
- بعد إضافة HClO 4 ، هزة بقوة الأنبوب ثم الطرد المركزي في 4 درجات مئوية في 15000 ز لمدة 15 دقيقة.
- إزالة 500μl من طاف وتحييد بإضافة 20μl من 5M CO 2 K 3. هزة بقوة الأنبوب ثم الطرد المركزي في 4 درجات مئوية في 15000 ز لمدة 15 دقيقة.
- إضافة 350μl من الحل لتحييد أنبوب microcentrifuge تحتوي 1x10 -8 مول 2 - AP.
- تحليل العينات على HPLC مجهزة للكشف عن مضان المسح. وتستخدم ثلاث حقن 50 ميكرولتر عن كل عينة. وسيتم حقن عينات من الصعود إلى Wacosil 5C - 18 - 200 250 مم × 6.0 مم ، العمود 5 ميكرون مجهزة عمود Supelguard حارس LC - 18 - S. وينبغي استخدام الشروط التالية للحصول على isocratic كافية فصل الذروة وتحديد الهوية : 95 ٪ 20mM KPO 4 العازلة (درجة الحموضة 2.2) والميثانول بنسبة 5 ٪ في معدل تدفق 1ml/min. تعيين الطول الموجي للكشف عن الإثارة في مضان 345 نانومتر والموجة الانبعاثاتطول عند 410 نانومتر.
- تحديد نسب pterine وisoxanthopterine لAP - 2 عن طريق الحصول على مناطق الذروة من الطيف كاشف مضان. ذروة الأولى في الطيف ، ~ 5 دقائق ، ويتوافق مع AP - 2. سوف الذروة الثانية والأكبر يكون pterine. Isoxanthopterine ذروة elutes الماضي.
- الحصول على الاختلاف في نسب منطقة ذروة isoxanthopterine/2-AP بين 0 وحضانة نقاط ساعة في غضون 4. استخدام هذه القيمة لحساب النشاط XO من المنحنيات القياسية.
- تحليل العينات في triplicates لكن استخدام القيم فقط مع معامل الاختلاف أقل من 10 ٪.
8. ممثل النتائج :
ويرد مثال على القياس الكمي للمركبات HPLC البيورين في الشكل 1A. أوقات محددة ، والاحتفاظ انبعاث موجات هيبوزانتين ، الزانثين ، وحمض اليوريك تسمح الكمي في وقت واحد من مركبات البيورين (الجدول 2). عندما يتم تشغيل الفحص بشكل صحيح ، فإن المركبات لها الانفصال والشكل الملائم الذروة ستكون حادة وحيد الواسطة. ثم يتم تحويل هذه القمم في نطاقات أو تركيزات مبين في الجدول رقم 3 ، من خلال استخدام منحنيات القياسية. لأن تجهيز العينات للفحص هذا هو الحد الأدنى ، فإن المشاكل القائمة عينة فقط التي قد تنشأ يكون lysing من خلايا الدم الحمراء. إذا كانت خلايا الدم الحمراء قبل أن يتم طرد ليز العينات ، وسوف تتخذ البلازما على اللون البرتقالي / الأحمر والتي لا يمكن استخدامها لتقييم نقص تروية ميتة. المسائل الأخرى التي قد تنشأ عند قياس البيورينات ينطوي على نظام HPLC والعمود (1B الشكل). إذا كان هناك فقاعات هواء في نظام HPLC سيتم الاحتفاظ مرات التحول والضغط HPLC سوف تتقلب بشكل كبير. إذا كانت خرطوشة الحرس يحتاج إلى تغيير ، فإن زيادة الضغط والقمم سوف تتسع وتصبح ثنائية أو ثلاثية مشروط.
| هيبوزانتين (ميكرومتر) | الزانثين (ميكرومتر) | حمض اليوريك (ميكرومتر) | أكسيداز الزانثين ((nmol المنتج) / دقيقة) | Malondialdehyde (ميكرومتر) | آلانتوين (ميكرومتر) | |
| مصطلح Normoxic | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 -- 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| الضائقة التنفسية الأجل | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 -- 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| مصطلح ميتة | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236.44 (9) | 0.95-2.15 (7) | NA |
| الخدج Normoxic | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 -- 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| الضائقة التنفسية المبكرة | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
دقيقة ماكس (ن)
الجدول 3. نطاقات الممثل لالبيورينات ، أوكسيديز الزانثين ، malondialdehyde وآلانتوين.
ويرد مثال على القياس الكمي GC / MS من آلانتوين في الشكل 2. لأنه من المعروف كتلة آلانتوين derivitized وآلانتوين derivitized الثقيلة ، حدد يمكن استخدامها لتحديد وضع أيون هذه المركبات على المواصفات الشامل. إذا تتم مقايسة بشكل صحيح ، سيتم ذروتين وحظ في الوقت نفسه الاحتفاظ. الموافق آلانتوين واحدة (398.00 م / ض) والآخر لآلانتوين الثقيلة (400.00 م / ض). ثم يتم تحويل هذه القمم في نطاقات أو تركيزات مبين في الجدول رقم 3 ، من خلال استخدام منحنى القياسية. إذا تم تشغيل مقايسة غير صحيح ، ولم derivitized عينات بشكل صحيح ، قد لا تكون موجودة قمم أو قد لا تكون ممثلة كميا. مرة أخرى ، إذا خلايا الدم الحمراء لا lysed البلازما يمكن استخدامها لتقييم الاكسدة في نقص تروية ميتة الولدان.
النتائج لتحديد مقدار MDA مماثلة لتلك التي لآلانتوين مع الاستثناء الذي لوحظ القمم اثنين في الأوقات الاحتفاظ مختلفة. ~ 3.5 دقيقة في الوقت الاحتفاظ ، وهو 144،00 م / ض الذروة لنجمة داود الحمراء والاحتفاظ في الوقت ~ 4 دقائق ، لوحظ 158.00 م / ض الذروة لMMDA (الشكل 3). ثم يتم تحويل هذه القمم في نطاقات أو تركيزات مبين في الجدول رقم 3 ، من خلال استخدام منحنى القياسية. إذا تم تشغيل الفحص بشكل غير صحيح ، أو لا derivitized عينات بشكل صحيح ، يمكن ملاحظة وجود قمم عند اختيار ل144.00m / z و158.00m / ز. وتجدر الإشارة إلى أنإذا كان هناك فائض من الدهون في البلازما من الرضاعة عن طريق الفم أو الوريد بلعة الادارة الدهون ، وسوف تتخذ البلازما على مظهر حليبي والتي لا يمكن استخدامها لتقييم الاكسدة في نقص تروية ميتة الولدان.
ويرد مثال على القياس الكمي HPLC المستندة إلى وظيفة أوكسيديز الزانثين في الشكل 4. إذا تم تشغيل الفحص بشكل صحيح ، يجب ملاحظة ثلاث قمم مع كاشف الفلورسنت ، واحدة للتيرين ، واحدة للisoxanthopterin ، وواحدة لAP - 2. ثم يتم تحويل هذه القمم في نطاقات أو تركيزات مبين في الجدول رقم 3 ، من خلال استخدام منحنى القياسية. يجب أن يكون هناك أيضا ذروة الموافق isoxanthopterin وAP - 2 على الطيف الناتجة عن كشف PDA. إذا كان نشاط انزيم غائب ، لن ذروة الموافق isoxanthopterin أن ينظر إليها. ربما لأن هذه التدابير فحص وظيفة الانزيم ، وتجميد والذوبان المتكررة من العينة يغير ذلك.
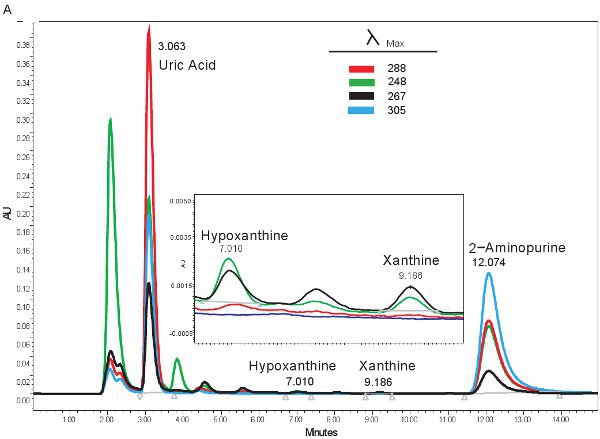
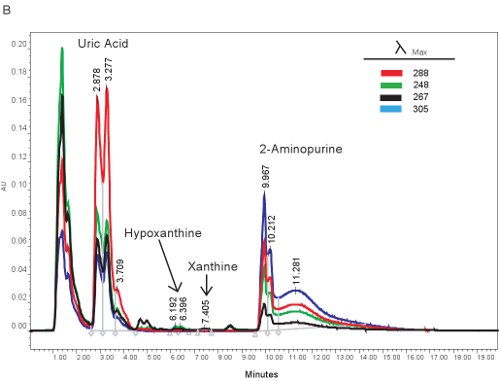
الشكل 1. HPLC الطيف لتحديد مركبات البيورين. A). ممثل النتائج إذا تم تشغيل الفحص بشكل صحيح. باء). النتائج ممثل إذا كان هناك مشكلة مع HPLC ، العمود ، أو خرطوشة الحراسة.
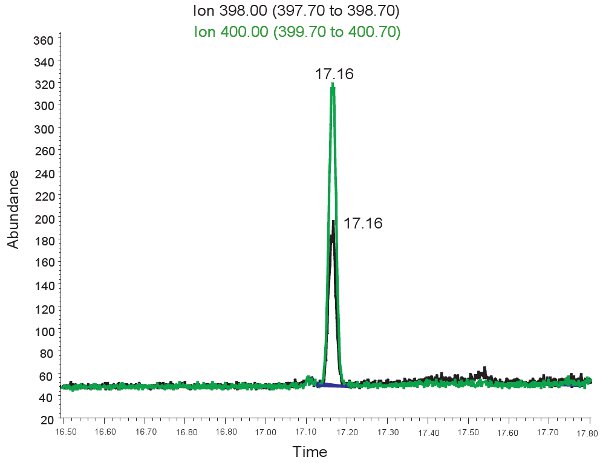
الشكل 2. GC / MS الطيف لتحديد كمية آلانتوين. ذروة في ايون 398.00 م / ض يناظر آلانتوين. في ذروة 400.00 ايون ض م / يناظر آلانتوين الثقيلة.
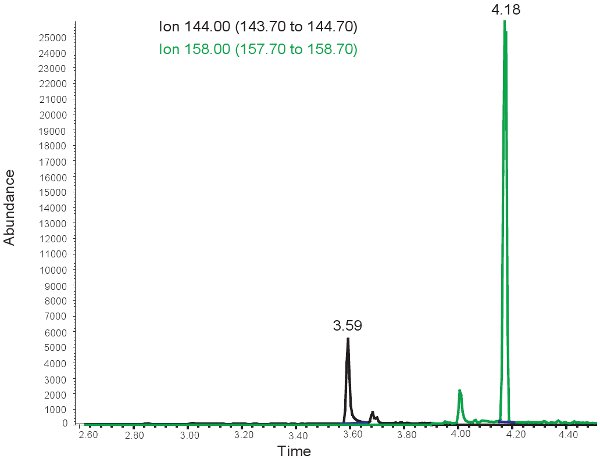
الشكل 3. GC / MS الطيف لتحديد كمية نجمة داود الحمراء ، وذروته عند 144.00 ايون ض م / يتوافق مع نجمة داود الحمراء. في ذروة 158.00 ايون ض م / يناظر MMDA.
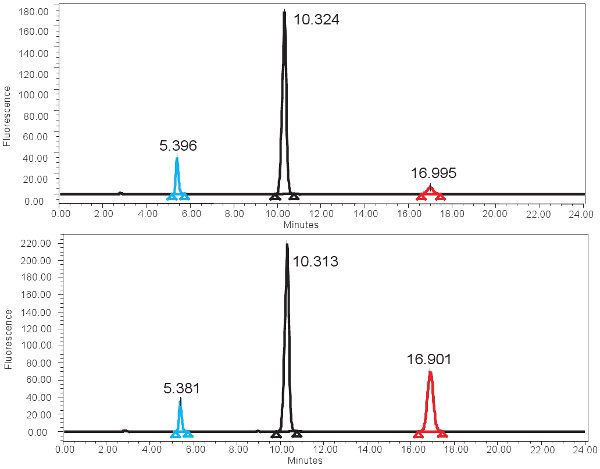
الشكل 4. HPLC الطيف لقياس النشاط XO ألف) النتائج الممثل للمرة دقيقة 0 حضانة والنتائج ممثل B) للفترة حضانة 4 ساعة. لاحظ أعلى ذروة isoxanthopterine (في 17 دقيقة ~) للفترة حضانة 4 ساعة. في الطيف مضان ، 2 - AP elutes الأولى في ~ elutes 5min وpterine المقبل في ~ 10min.
Discussion
وصفت وسائل تسمح هنا تقييم نقص التروية نقص الأكسجة الولدان. هذا البروتوكول يجمع بين قياسات علامات الحرمان (ATP) والطاقة ، والاكسدة ، والضرر التأكسدي ، ونشاط انزيم للحصول على صورة شاملة للوجود البيوكيميائية أو حتى درجة من نقص تروية ميتة. على الرغم من جدوى هذا الأسلوب ، و?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ويتم تمويل هذا العمل من قبل المعاهد الوطنية للصحة NR011209 R01 - 03
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| 6ml K3E أنبوب EDTA K3 | فيشر العلمية | 2204061 | |
| 5702R الطرد المركزي | فيشر العلمية | 05413319 | مع 13 و محول 16MM |
| 1.5ml microcentrifuge أنبوب | الولايات المتحدة الأمريكية والعلم | 1615-5599 | |
| 2 - Aminopurine | سيغما الدريخ | A3509 | |
| فاريان كاري معمل 100 | Agilant تكنولوجيز | 0010071500 | |
| موهوب SpeedVac | الحرارية العلمية | SC210A - 115 | |
| جهاز الطرد المركزي فلتر ميكرون | فيشر العلمية | UFC501596 | |
| Supelcosil LC - 18 - S العمود | سيغما الدريخ | 58931 | |
| Supelcosil LC - 18 - S Supelguard وحامل خرطوشة | سيغما الدريخ | 59629 | |
| HPLC | مياه | ||
| هذه النماذج فيال | فيشر العلمية | 03376607 | |
| DL - آلانتوين C - 5 -13 (1) ؛ -15 N | CDN نظائر | M - 2307 | # الكثير L340P9 |
| MTBSTFA | الحرارية العلمية | 48920 | |
| بيريدين | سيغما الدريخ | 270970 | |
| 5973E GC / MSD | اجيلنت تكنولوجيز | G7021A | جزء # ل5975E GC / MS |
| 3 Ethoxymethacrolein | سيغما الدريخ | 232548 | |
| هيدروكسيد الصوديوم | سيغما الدريخ | S5881 | |
| ثنائي كلورو ميثان | سيغما الدريخ | 270997 | |
| البنزين | سيغما الدريخ | 401765 | |
| Diisopropyl الأثير | سيغما الدريخ | 38270 | |
| BHT | سيغما الدريخ | B1378 | |
| الإيثانول | سيغما الدريخ | 459844 | |
| الفينيل هيدرازين | سيغما الدريخ | P26252 |
References
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved