Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Biochemische Measurement of Neonatal Hypoxie
In diesem Artikel
Zusammenfassung
Eine Methode ist beschrieben, biochemischer Marker des Neugeborenen Hypoxie-Ischämie zu messen. Der Ansatz nutzt Hochdruck-Flüssigchromatographie (HPLC) und Gaschromatographie-Massenspektrometrie (GC / MS).
Zusammenfassung
Neonatal Hypoxie Ischämie durch unzureichende Durchblutung eines Gewebes oder eines systemischen Mangel an Sauerstoff aus. Diese Bedingung gilt als Ursache / verschärfen gut dokumentiert neonatalen Erkrankungen einschließlich neurologische Beeinträchtigung 1-3. Verminderte Adenosintriphosphat Produktion entsteht durch einen Mangel an oxidative Phosphorylierung. Zum Ausgleich für diese Energie entzogen Zustand Molekülen mit hoher Energie Phosphatbindungen abgebaut werden 2. Dies führt zu erhöhten Werten von Adenosin, die später abgebaut zu Inosin, Hypoxanthin, Xanthin ist, und schließlich zu Harnsäure. Die beiden letzten Schritte in diesem Abbauprozess durch Xanthin-Oxidoreduktase durchgeführt. Dieses Enzym existiert in Form von Xanthin-Dehydrogenase unter normoxischen Bedingungen ist aber auf Xanthinoxidase (XO) unter Hypoxie-Reperfusion Umständen 4, 5 umgewandelt. Im Gegensatz zu Xanthin-Dehydrogenase, generiert XO Wasserstoffperoxid als Nebenprodukt der Purin-Abbau 4, 6. Das Wasserstoffperoxid in Kombination mit anderen reaktiven Sauerstoffspezies (ROS) bei Hypoxie produziert, oxidiert Harnsäure zu Allantoin Form und reagiert mit Lipidmembranen zu Malondialdehyd (MDA) 7-9 zu generieren. Die meisten Säugetiere, Menschen befreit, besitzen das Enzym Uricase, die wandelt Harnsäure zu Allantoin. Beim Menschen kann jedoch nur durch Allantoin ROS-vermittelte Oxidation von Harnsäure gebildet werden. Aus diesem Grund ist Allantoin als Marker für oxidativen Stress in den Menschen, aber nicht in der Säugetiere, die Uricase haben.
Wir beschreiben Methoden unter Verwendung von Hochdruck-Flüssigchromatographie (HPLC) und Gaschromatographie-Massenspektrometrie (GCMS) auf biochemischer Marker des Neugeborenen Hypoxie Ischämie zu messen. Menschliches Blut für die meisten Tests verwendet wird. Tierisches Blut, kann auch verwendet werden bei gleichzeitiger Anerkennung des Potenzials für Uricase-generated Allantoin werden. Purin-Metaboliten wurden die Hypoxie so früh wie 1963 und die Zuverlässigkeit von Hypoxanthin, Xanthin verbunden und Harnsäure als biochemische Indikatoren der neonatalen Hypoxie wurde von mehreren Forschern 10-13 validiert. Die HPLC-Methode zur Quantifizierung von Purin-Verbindungen eingesetzt ist schnell, zuverlässig und reproduzierbar. Die GC / MS-Methode zur Quantifizierung von Allantoin, ein relativ neuer Marker für oxidativen Stress verwendet, wurde von Gruber et al 7 angepasst. Diese Methode vermeidet bestimmte Artefakte und erfordert einen geringen Volumina der Probe. Methoden zur Synthese von MMDA verwendet wurden an anderer Stelle 14, beschrieben 15. GC / MS Quantifizierung von MDA wurde von Paroni et al angepasst. und Cighetti et al. 16, 17. Xanthinoxidase-Aktivität wurde durch HPLC durch Quantifizierung der Umwandlung von Pterin zu Isoxanthopterin 18 gemessen. Dieser Ansatz erwies sich als ausreichend empfindlich und reproduzierbar.
Protokoll
1. Probengewinnung und Verarbeitung
- Sammeln Blutprobe in einem 6ml K3E EDTA K3 Rohr, das auf Eis gehalten wird.
- Innerhalb von 2 min für die Sammlung, Zentrifuge die Probe bei 4 ° C bei 1500 g für 10 min.
- Übertragen Sie den Überstand (Plasma), eine 1,5 ml Mikrozentrifugenröhrchen.
- Zentrifuge bei 4 ° C mit 18000 g für 30 min.
- Entfernen Sie den Überstand aliquotiert und übertragen sie in separaten Reaktionsgefäßen für den Purin (200 ul), Allantoin (50 ul), MDA (100 &mgr; l) und XO (120μl) Analyse. Achten Sie darauf, die Proben mit roten Blutkörperchen zu verunreinigen. Möglicherweise müssen Sie das Volumen des Plasmas für MDA, XO und Purinen auf das Gesamtvolumen des Plasmas zur Verfügung Basis einstellen.
2. Vorbereitung interner Standard, 2-Amino (2-AP), für die Purin-und XO-Analyse
- Abwiegen 0.01351g 2-AP und fügen Sie es 8ml Wasser, das mit 2-5 Tropfen HCl angesäuert wurde. Wenn die 2-AP nicht gelöst ist, müssen Sie mehr Säure hinzu. Passen Sie das Endvolumen bis 10ml.
- Verwenden Sie die UV-Vis-Spektralphotometer, die wahre Konzentration von Ihrem Lager 2-AP-Lösung zu bestimmen. (Lmax 315, ε 4000).
- Sobald die Konzentration der Aktie 2-AP-Lösung ermittelt wird, berechnen die benötigten Volumina zu 1x10 -7 mol 2-AP interner Standard für die Purin-Messungen und 1x10 -8 mol 2-AP interner Standard für die XO-Messungen enthalten.
- Aliquot der berechneten Volumina in separaten Reaktionsgefäßen und verdampft zur Trockne in einem SpeedVac.
Gleichung 1: 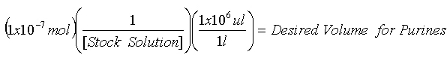
Gleichung 2: 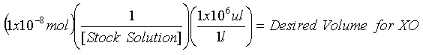
3. HPLC Messung der Purine
- Transfer-Plasma (200 ul), um eine Microcon YM-10 Zentrifugalfilter Gerät und Zentrifuge bei 4 ° C bei 14000 g für 1,5 Stunden.
- Entfernen Sie das Filtrat und in ein Mikrozentrifugenröhrchen mit 1x10 -7 mol 2-AP. Achten Sie darauf, das Volumen der Filtrat hinzugefügt, um die Mikrozentrifugenröhrchen mit der 2-AP aufzunehmen. Vortex die Proben für 10-20 sek.
- Analysieren Sie die Proben mit einer HPLC. Drei 50 ul-Injektionen werden für jede Probe verwendet. Proben auf eine Supelcosil LC-18-S injiziert werden, 15 cm x 4,6 mm, 5 mm-Spalte mit einer Supelguard LC-18-S-Säule guard. Das Gefälle in Tabelle 1 beschrieben werden, sollten verwendet werden, um angemessene Peaktrennung erhalten werden: Lösungsmittel A-Wasser, Lösungsmittel B-Methanol, Lösungsmittel C-50mm Ammoniumformiat-Puffer, pH 5,5.
| Zeit | Flow (ml / min) | % A | % B | % C | |
| 1 | 1,00 | 0,0 | 0,0 | 100,0 | |
| 2 | 16,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 3 | 17,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 4 | 22,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 5 | 27,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 6 | 32,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 7 | 33,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 8 | 38,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 9 | 39,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 10 | 45,00 | 1,00 | 0,0 | 0,0 | 100,0 |
Tabelle 1. Solvent Änderungen für HPLC-Messung von Purin-Verbindungen.
- Bestimmen Sie die Konzentration der Purine in der Probe. Quantify Hypoxanthin, Xanthin und Harnsäure durch den Erwerb Peakflächen bei der Aufbewahrung und Wellenlängen in Tabelle 2 beschrieben. Die Peakfläche von 2-AP. Bestimmen Sie die Flächenverhältnisse von Hypoxanthin, Xanthin und Harnsäure zu 2-AP und wandeln die Verhältnisse zu μmolar Konzentrationen unter Verwendung von Standard-Kurven.
| Retention Time * | Beobachtete λ max * | Berichtet λ max 19 | Berichtet ε max 19 | |
| Harn-Säure | ~ 3,5 min | 288 | 283 [2] | 11.500 [2] |
| Hypoxanthin | ~ 7,0 min | 248 | 248 [1] | 10.800 [1] |
| Xanthine | ~ 9,5 min | 267 | 267 [2] | 10.200 [2] |
| 2-Amino | ~ 12,5 min | 305 | 314 [2] | 4.000 [2] |
Tabelle 2. Typische Retentionszeiten und λ max für Purine und internem Standard. * Basierend auf HPLC unter Verwendung einer isokratischen 50mM Ammoniumformiat-Puffer (pH 5,5) mit einer Flussrate von 1ml/min. pH-Wert in [].
- Analysieren Sie alle Proben in dreifacher Ausfertigung, sondern nur zählen Werte für spätere Analysen, wenn der Variationskoeffizient beträgt weniger als 10%.
4. GC / MS Messung von Allantoin
- Add 50 ul 10 um DL-Allantoin-5 bis 13 C; 1 bis 15 N (interner Standard) auf die 50 ul Plasma der Flächenstilllegung für das Allantoin Test während der Probenahme und-verarbeitung eingestellt.
- 100 l Acetonitril, dieses Plasma-Lösung.
- Vortex die Mischung für 10-20 sec dann bei 4 ° C zentrifugieren bei 20.000 g für 10 min.
- Entfernen Sie den Überstand, legen Sie sie in einem GC / MS Fläschchen und trocken unter N 2.
- Nach dem Trocknen werden 50 ul der Derivatisierungsmittel N-tert-Butyldimethylsilyl-N-methyltrifluoroacetamide (MTBSTFA) in Pyridin (1:1 vol / vol), Verschließen Sie die Fläschchen und inkubieren sie bei 50 ° C für 2 h. Diese Derivatisierung Erträge konsequent quantifizierbare m / z Gipfel 398,0 und 400,0 für Allantoin und DL-Allantoin-5 bis 13 C; 1 bis 15 N bzw. 20.
- Analysieren Sie die Proben auf der Agilent Technologies GC 6890N und MS 5973 mit einem Autosampler ausgestattet. Führen Verbindung Trennung auf einem Agilent 122-5532G-Kapillarsäule (25,7 Länge, 0,25 mm Innendurchmesser). Verwenden Helium als Trägergas mit einer Flussrate von 1,5 ml / min. Inject derivatisierten Produkt (1 ul) im Split-Modus (Split-Verhältnis 20:1, Split-Flow 29,4 ml / min, Volumen 33,8 ml / min). Setzen Sie den ersten Säule Temperatur auf 100 ° C und bei dieser Temperatur halten für 2 min vor Anhebung auf 180 ° C mit einer Rate von 10 ° C / min. Halten Sie die Temperatur für 4 min und dann erhöhen auf 260 ° C mit einer Rate von 20 ° C / min. Halten Sie diese Temperatur bis zum Ende des Laufs. Nach jeder Probe, reinigen Sie die Spalte mit 2 Injektionen von Hexan.
- Quantify Allantoin mit select Ion Monitoring-Modus während der Überwachung des 398,0 m / z-Ionen für Allantoin und 400.0 m / z-Ionen für die DL-Allantoin-5 bis 13 C; 1 bis 15 N. Konvertieren Sie die Ionenhäufigkeit Verhältnisse Allantoin / (schwere Allantoin), um mikromolaren Konzentrationen von Allantoin mit einer vorbereiteten Eichkurve.
- Alle Proben werden in dreifacher Ausfertigung analysiert, sondern nur Werte mit einem Variationskoeffizienten von weniger als 10% sind in weiteren Untersuchungen verwendet.
5. Vorbereitung interner Standard, Methyl Malondialdehyd (MMDA), für die MDA-Analyse
- Fügen Sie 523μl 3-ethoxymethacrolein zu 1477μl 7M NaOH in einem 100 ml Rundkolben. Fügen Sie einem Rührstab.
- Der Kolben wird in ein Wasserbad bei 45 ° C und rühren, bis die Reaktion zu Ende gegangen ist. Dies sollte etwa 140 min. Überwachen Sie den Fortschritt der Reaktion durch Entfernen eines 10 &mgr; l Aliquot der Flüssigkeit in regelmäßigen Abständen bei 10 Minuten-Intervallen. Verdünnen Sie jede Probe um einen Faktor von 10 5 mit 50 mM Kaliumphosphatpuffer (pH 7) und Messung der Absorption mit der UV-Vis gesammelt. Nach der Absorption bei 275nm erreicht etwa 0,658 ist die Reaktion beendet. Da die Reaktion fortschreitet, wird die Lösung gelb dann orange.
- Lassen Sie die Reaktion für weitere 15 min Fortschritt.
- Add 5 ml destilliertem entionisiertem Wasser auf die Rundkolben und die Lösung in einen Scheidetrichter. Verwenden Sie ein zusätzliches 3 ml Wasser, um den Inhalt der Flasche in den Trichter zu waschen. Fügen Sie eine weitere 2ml Wasser in den Trichter.
- Entpacken Sie die Lösung 3 mal mit 5 ml Dichlormethan. Nach jeder Extraktion verwerfen der organischen Schicht.
- Nach der dritten Extraktion, Transfer der wässrigen Schicht auf einem Rundkolben und Rotationsverdampfer bis zur Trockenheit.
- Resuspendieren das Produkt in 3 ml Ethanol und Transfer zu einem vorher gewogenen 15ml konischen Rohr. Spülen Sie die Flasche mit einem zusätzlichen 2ml Ethanol und fügen Sie die zu dem konischen Rohr zu spülen.
- Add 5ml Benzol und inkubieren Sie die Röhre in warmem Wasser, bis das Produkt löst sich dann sofort den Schlauch auf Eis für 10 min. Zentrifuge für 5 min bei 15000 g und entfernen Sie den Überstand.
- Add 5ml Ethanol und 5 ml Isopropylether der Niederschlagitant. Lösen Sie das Fällungsmittel durch Inkubation der Röhrchen in warmem Wasser und in regelmäßigen Abständen Kippen der Röhre sehr sanft. Sobald Niederschlag gelöst ist, wird das Reagenzglas auf Eis für 10 min. Führen Sie diese Rekristallisation 2 weitere Male mit Ethanol und Isopropylether. Einige unlösliche weiße Brocken Produkt gebildet werden kann.
- Nach dem letzten Rekristallisationsschritt so viel Überstand möglichst trocken und das resultierende Produkt in einer Speedvac entfernen. Wiegen Sie die konischen Rohr mit dem synthetisierten Produkt.
- Add 5ml Wasser auf die Tube, Wirbel, und herausfiltern, die verbleibenden Feststoffe.
- Verwenden Sie die UV-VIS Spektralphotometer zur Endkonzentration von MMDA bestimmen. Die lmax für MMDA in 50 mM Kaliumphosphatpuffer (pH 7) liegt zwischen 274 nm mit dem Extinktionskoeffizienten von 29900 M -1 cm -1 14.
6. GC / MS Messung von MDA
- Bereiten Sie eine Lösung von 0,5 mm butyliertes Hydroxy-Toluol (BTH) in Ethanol durch Zugabe von 0,11 g BTH zu 9ml Ethanol und Anpassung der Endvolumen von 10ml. Führen Sie dann eine Verdünnung durch Zugabe von 10 &mgr; l dieser konzentrierten Lösung zu 990μl Ethanol.
- Bereiten Sie eine Lösung von 50mM Phenylhydrazin, indem 4.92μl von Phenylhydrazin auf 995μl Wasser in einem dunklen Mikrozentrifugenröhrchen. Vortex die Lösung.
- Add 5μl 10 um MMDA die 100 &mgr; Plasma der Flächenstilllegung für das MDA-Test während der Probenahme und-verarbeitung eingestellt.
- Dann fügen Sie 10 &mgr; l 0,5 mM BTH die MMDA / Plasma-Mischung durch die Zugabe von 200 ul 1M Natriumcitrat bei pH 4 an. Dieser pH-Wert ist entscheidend für die korrekte Derivatisierung der Probe. Eine höhere oder niedrigere pH-Wert wird in verzerrt MDA Ebenen führen.
- Verdünnen Sie die fertige Mischung durch Zugabe von destilliertem deionisiertem Wasser auf ein Gesamtvolumen von 480μl.
- Derivatisieren die Lösung durch Zugabe von 20 &mgr; l 50 mM Phenylhydrazin, Capping die Fläschchen und Inkubation der Lösung bei 25 ° C für 30 min auf einem Schüttler.
- Add 1 ml Hexan, Wirbel für 1 min, und Zentrifuge bei 3000 rpm für 10 min.
- Übertragen Sie die organische Schicht auf eine GC / MS Fläschchen und konzentriert die Lösung für 100 &mgr; von N 2-Strom.
- Analysieren Sie die Proben auf einem GC / MS mit dem Autosampler. Führen Verbindung Trennung auf einem Agilent 122-5532G-Kapillarsäule (25,7 m Länge, 0,25 mm Innendurchmesser). Verwenden Helium als Trägergas mit einer Flussrate von 0,6-0,8 ml / min. Inject derivatisierten Produkt (2 ul) im Split-Modus (Split-Verhältnis 20:1, Split-Flow 23,0 ml / min, Volumen 27,1 ml / min). Setzen Sie den ersten Säule bei 110 ° C und bei dieser Temperatur halten für 1 min vor Anhebung auf 250 ° C mit einer Rate von 40 ° C / min. Halten Sie diese Temperatur bis zum Ende des Laufs. Nach jeder Probe, reinigen Sie die Spalte mit 2 Injektionen von Hexan.
- Quantify MDA mit select Ion Monitoring Modus unter Verwendung der 144,00 m / z für MDA und die 158,00 m / z für MMDA. Konvertieren Sie die MDA / MMDA Ionenhäufigkeit Verhältnissen mikromolaren Konzentrationen unter Verwendung einer Standardkurve.
- Analysieren Sie die Proben in dreifacher Ausfertigung und nur Werte mit einem Variationskoeffizienten von weniger als 10%.
7. HPLC Messung der Xanthinoxidase
- Der Nachweis der Xanthinoxidase-Funktion ist abhängig von der Fähigkeit, sensibel messen die Werte für ein geeignetes Substrat (Pterin) sowie ihr Produkt (Isoxanthopterin). Plasma ist mit dem Substrat entweder für 0 min (Kontrolle) oder für 4 h inkubiert und die Inkubation-abhängige Substrat zu Produkt Umwandlung bestimmt.
- Fügen Sie 240μl 0,2 M Tris-HCl-Puffer (pH 9,0) und 4.63μl 7.083x10 -3 M Pterin in jedes Röhrchen (0 und 4h) und vorinkubiert sie bei 37 ° C für 5 min.
- Initiieren Sie die Enzymreaktion durch Zugabe von 60μl Plasma in jedes Röhrchen.
- Sofort im 300μl 4% HClO 4 auf das Steuerrohr (0 min), erlauben aber die andere Mischung für 4 Stunden vor dem Abschrecken inkubieren die Reaktion mit 300μl 4% HClO 4.
- Nach der Zugabe von HClO 4, kräftig schütteln die Röhre und dann Zentrifuge bei 4 ° C bei 15000 g für 15 min.
- Entfernen Sie 500μl des Überstandes und zu neutralisieren, indem 20 &mgr; l 5 M K 2 CO 3. Kräftig schütteln, das Rohr und dann Zentrifuge bei 4 ° C bei 15000 g für 15 min.
- Fügen Sie 350μl der neutralisierten Lösung, um ein Mikrozentrifugenröhrchen mit 1x10 -8 mol 2-AP.
- Analysieren Sie die Proben auf einer HPLC mit einer Scan-Fluoreszenz-Detektor ausgestattet. Drei 50 ul-Injektionen werden für jede Probe verwendet. Die Proben werden auf eine Wacosil 5C-18 bis 200 250 mm x 6,0 mm, 5 mm-Spalte mit einer Supelguard LC-18-S-Säule guard injiziert werden. Die folgenden isokratischen Bedingungen sollten zur adäquaten Peak Trennung und Identifizierung zu erhalten: 95% 20 mM KPO 4-Puffer (pH 2,2) und 5% Methanol bei einer Flussrate 1ml/min. Stellen Sie die Anregungswellenlänge für die Fluoreszenz-Detektor bei 345 nm und die EmissionswellenlängeLänge bei 410 nm.
- Bestimmen Sie das Verhältnis von Pterin und isoxanthopterine zu 2-AP durch den Erwerb Peakflächen aus dem Fluoreszenz-Detektor Spektrum. Der erste Peak im Spektrum, ~ 5 Minuten, entspricht 2-AP. Der zweite und größte Peak wird Pterin. Isoxanthopterine Peak eluiert dauern.
- Besorgen Sie sich die Differenz in der isoxanthopterine/2-AP Peakflächenverhältnisse zwischen 0 und die 4 h Inkubationszeit Punkte. Mit diesem Wert wird der XO-Aktivität von Standard-Kurven zu berechnen.
- Analysieren Sie die Proben in dreifacher Ausfertigung, sondern nur Werte mit einem Variationskoeffizienten von weniger als 10%.
8. Repräsentative Ergebnisse:
Ein Beispiel für die HPLC Quantifizierung von Purin-Verbindungen ist in Abbildung 1A dargestellt. Die spezifischen Retentionszeiten und Emissionswellenlängen von Hypoxanthin, Xanthin und Harnsäure erlauben die simultane Quantifizierung von Purin-Verbindungen (Tabelle 2). Wenn der Test korrekt ausgeführt wird, werden die Verbindungen über ausreichende Trennung und Peakform wird scharf und unimodalen. Diese Peaks werden dann in Konzentrationen, reicht in Tabelle 3 dargestellt umgewandelt, durch den Einsatz von Standard-Kurven. Da Probenaufbereitung für diesen Test ist minimal, wäre die einzige Stichprobe Probleme, die entstehen können die Lyse der roten Blutkörperchen werden. Wenn die roten Blutkörperchen zu lysieren, bevor die Proben zentrifugiert werden, wird das Plasma auf eine orange / rote Farbe an und kann nicht zur Beurteilung hypoxische Ischämie eingesetzt werden. Die anderen Fragen, die entstehen, wenn die Messung Purine können beinhaltet das HPLC-System und die Spalte (Abbildung 1B). Wenn sich Luftblasen in das HPLC-System sind die Retentionszeiten verschieben sich und die HPLC Druck wird dramatisch schwanken. Wenn die Vorsäule geändert werden muss, wird den Druck zu erhöhen und die Gipfel wird zu erweitern und zu bi-oder tri-modalen.
| Hypoxanthin (M) | Xanthin (M) | Harnsäure (M) | Xanthinoxidase ((nmol Produkt) / min) | Malondialdehyd (M) | Allantoin (M) | |
| Laufzeit Normoxic | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| Laufzeit Respiratory Distress | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| Laufzeit Hypoxische | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236,44 (9) | 0.95-2.15 (7) | NA |
| Preterm Normoxic | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 - 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Frühgeburt Respiratory Distress | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
Min-Max (n)
Tabelle 3. Representative Bereiche für Purine, Xanthinoxidase, Malondialdehyd und Allantoin.
Ein Beispiel für die GC / MS Quantifizierung von Allantoin wird in Abbildung 2 dargestellt. Da die Masse der derivatisierten Allantoin und derivatisierten schweren Allantoin bekannt ist, wählen Ionen-Modus verwendet werden, um diese Verbindungen auf der Massenspektrometrie zu identifizieren. Wenn der Test korrekt durchgeführt wird, werden zwei Peaks bei der Retentionszeit beobachtet werden. Eine entsprechende Allantoin (398,00 m / z) und der andere schwere Allantoin (400,00 m / z). Diese Peaks werden dann in Konzentrationen, reicht in Tabelle 3 dargestellt umgewandelt, durch den Einsatz einer Standard-Kurve. Wenn der Test ist falsch laufen und die Proben wurden nicht derivatisierten richtig, kann der Gipfel nicht anwesend sein oder auch nicht quantitativ repräsentativ. Noch einmal, wenn die roten Blutzellen lysiert das Plasma kann nicht verwendet werden, um oxidativen Stress in neonatalen hypoxischen Ischämie zu bewerten.
Die Ergebnisse für die Quantifizierung von MDA sind vergleichbar mit denen für Allantoin mit der Ausnahme, dass die beiden Peaks bei unterschiedlichen Retentionszeiten beobachtet. Bei ~ 3,5 Minuten Verweildauer, eine 144,00 m / z Peak für MDA und bei ~ 4 Minuten Verweildauer, eine 158,00 m / z Peak für MMDA beobachtet wird (Abbildung 3). Diese Peaks werden dann in Konzentrationen, reicht in Tabelle 3 dargestellt umgewandelt, durch den Einsatz einer Standard-Kurve. Wenn der Test ist falsch, zu laufen oder Proben nicht derivatisierten richtig, darf kein Gipfel zu beobachten bei der Auswahl für 144.00m / z und 158.00m / z werden Anzumerken ist, dass seinwenn es einen Überschuss an Lipid in das Plasma von Bolus oralen Nahrungsaufnahme oder intravenöse Lipid-Administration, wird das Plasma auf ein milchiges Aussehen zu nehmen und kann nicht verwendet werden, um oxidativen Stress in neonatalen hypoxischen Ischämie zu bewerten.
Ein Beispiel für die HPLC-basierte Quantifizierung der Xanthinoxidase-Funktion ist in Abbildung 4 dargestellt. Wenn der Test korrekt ausgeführt wird, sollten drei Gipfel mit dem fluoreszierenden Detektor beobachtet werden, eine für Pterin, eine für Isoxanthopterin und eine für 2-AP. Diese Peaks werden dann in Konzentrationen, reicht in Tabelle 3 dargestellt umgewandelt, durch den Einsatz einer Standard-Kurve. Es sollte auch eine entsprechende Peak Isoxanthopterin und 2-AP auf das Spektrum von der PDA-Detektor generiert werden. Wenn die Enzymaktivität nicht vorhanden ist, wird der entsprechende Peak Isoxanthopterin nicht gesehen werden. Da dieser Assay misst Enzym-Funktion, wiederholtes Einfrieren und Auftauen der Probe kann ein anderer.
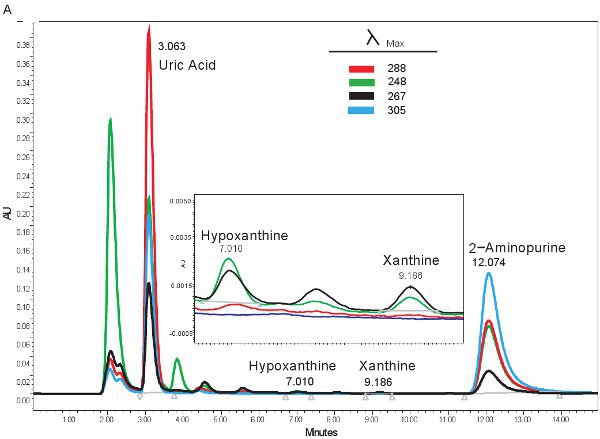
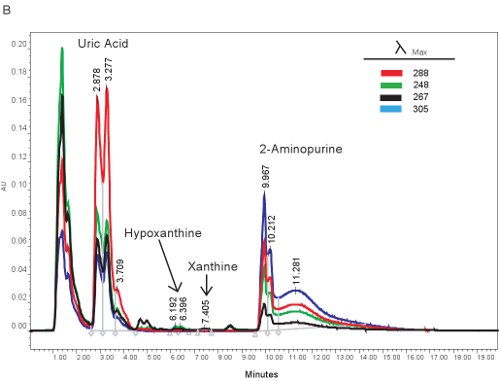
Abbildung 1. HPLC-Spektrum für die Identifizierung von Purin-Verbindungen. A). Repräsentative Ergebnisse, wenn der Test wurde korrekt ausgeführt. B). repräsentative Ergebnisse, wenn es ein Problem mit der HPLC, Spalte oder Vorsäule.
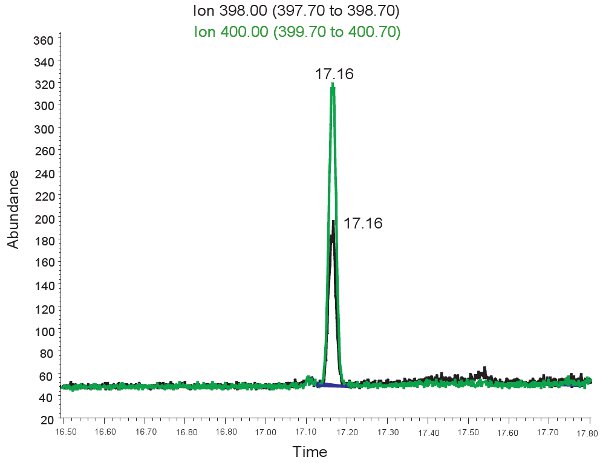
Abbildung 2. GC / MS-Spektrum für die Quantifizierung von Allantoin. Der Peak bei 398,00 Ionen m / z entspricht Allantoin. Der Peak bei 400,00 Ionen m / z entspricht schwere Allantoin.
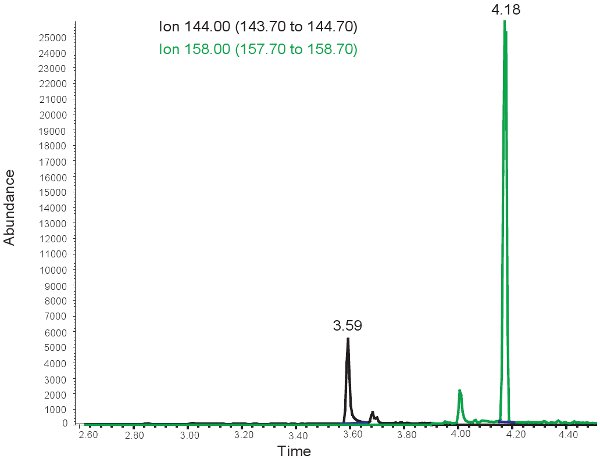
Abbildung 3. GC / MS-Spektrum für die Quantifizierung von MDA. Der Peak bei 144,00 Ionen m / z entspricht MDA. Der Peak bei 158,00 Ionen m / z entspricht MMDA.
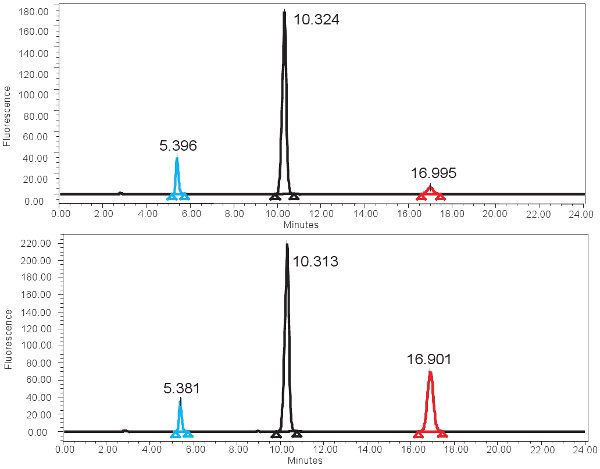
Abbildung 4. HPLC-Spektrum für die Messung der XO-Aktivität. A) Repräsentative Ergebnisse für die 0 min Inkubationszeit und B) repräsentative Ergebnisse für die 4 Stunden Inkubationszeit. Notieren Sie sich die höheren isoxanthopterine peak (bei ~ 17 min) für die 4 Stunden Inkubationszeit. In der Fluoreszenz-Spektrum, eluiert 2-AP zuerst auf ~ 5min und Pterin eluiert nächsten bei ~ 10min.
Diskussion
Die hier beschriebenen Methoden erlauben die Beurteilung des Neugeborenen-Hypoxie Ischämie. Dieses Protokoll verbindet die Messungen von Markern von Energie (ATP) Deprivation, oxidativer Stress, oxidative Schäden und Enzymaktivität zu einer umfassenden biochemischen Bild von der Gegenwart oder auch der Grad der hypoxischen Ischämie zu gewinnen. Trotz der Nützlichkeit dieser Methode gibt es potenzielle Einschränkungen. Erstens dauert es etwa 1-2 ml Blut, um genügend Plasma zu sammeln, um alle Tests auszuführen. D...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wird von den National Institutes of Health R01 NR011209-03 finanziert
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| 6ml K3E EDTA K3 Rohr | Fisher Scientific | 2204061 | |
| 5702R-Zentrifuge | Fisher Scientific | 05413319 | Mit 13 und 16 mm Adapter |
| 1.5ml Mikrozentrifugenröhrchen | USA Scientific | 1615-5599 | |
| 2-Amino | Sigma-Aldrich | A3509 | |
| Varian Cary 100 Spektralphotometer | Agilant Technologies | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micron Zentrifugalfilter Gerät | Fisher Scientific | UFC501596 | |
| Supelcosil LC-18-S Column | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard Patrone und Halter | Sigma-Aldrich | 59629 | |
| HPLC | Waters | ||
| GCMS Vial | Fisher Scientific | 03376607 | |
| DL-Allantoin-5 -13 C; 1 -15 N | EUR Isotopes | M-2307 | Lot # L340P9 |
| MTBSTFA | Thermo Scientific | 48920 | |
| Pyridin | Sigma-Aldrich | 270970 | |
| 5973E GC / MSD | Agilent Technologies | G7021A | Part # für 5975E GC / MS |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Natriumhydroxid | Sigma-Aldrich | S5881 | |
| Dichlormethan | Sigma-Aldrich | 270997 | |
| Benzol | Sigma-Aldrich | 401765 | |
| Diisopropylether | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Ethanol | Sigma-Aldrich | 459844 | |
| Phenylhydrazin | Sigma-Aldrich | P26252 |
Referenzen
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten