È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misure biochimiche di ipossia neonatale
In questo articolo
Riepilogo
Un metodo è descritto per misurare i marcatori biochimici di ischemia-ipossia neonatale. L'approccio utilizza cromatografia liquida ad alta pressione (HPLC) e gas cromatografia spettrometria di massa (GC / MS).
Abstract
Ischemia ipossia neonatale è caratterizzata da inadeguata perfusione sanguigna di un tessuto o una carenza sistemica di ossigeno. Questa condizione è pensato per causare / esacerbare ben documentate patologie neonatali compresi danni neurologici 1-3. Diminuzione della produzione di adenosina trifosfato si verifica a causa della mancanza di fosforilazione ossidativa. Per compensare questo molecole di energia priva di stato contenenti legami fosfato ad alta energia sono 2 degradati. Questo porta ad aumento dei livelli di adenosina, che viene successivamente degradato a inosina, ipoxantina, xantina, e infine ad acido urico. Gli ultimi due passaggi di questo processo di degradazione sono eseguite da xantina ossidoreduttasi. Questo enzima esiste in forma di xantina deidrogenasi in condizioni di normossia ma viene convertito in xantina ossidasi (XO) con ipossia-riperfusione circostanze 4, 5. A differenza di xantina deidrogenasi, XO genera perossido di idrogeno come sottoprodotto della degradazione delle purine 4, 6. Questo perossido di idrogeno in combinazione con altre specie reattive dell'ossigeno (ROS) prodotte durante l'ipossia, ossida l'acido urico ad allantoina forma e reagisce con le membrane lipidiche per generare malondialdeide (MDA) 7-9. Maggior parte dei mammiferi, esseri umani esentati, in possesso dei uricasi enzima, che converte l'acido urico ad allantoina. Negli esseri umani, tuttavia, allantoina può essere formata da ROS-mediate l'ossidazione dell'acido urico. Per questo motivo, allantoina è considerato un marker di stress ossidativo nell'uomo, ma non nei mammiferi che hanno uricasi.
Descriviamo impiegando metodi ad alta pressione (HPLC) e gas cromatografia e spettrometria di massa (GCMS) per misurare i marcatori biochimici di ischemia ipossia neonatale. Il sangue umano è utilizzato per maggior parte dei test. Sangue animale può essere utilizzato anche, pur riconoscendo il potenziale di uricasi generati allantoina. Metaboliti purinici sono stati legati all'ipossia già nel 1963 e l'affidabilità di ipoxantina, xantina, acido urico e come indicatori biochimici di ipossia neonatale è stato validato da vari ricercatori 10-13. Il metodo HPLC utilizzato per la quantificazione dei composti purinici è veloce, affidabile e riproducibile. Il GC / MS metodo utilizzato per la quantificazione del allantoina, un marker relativamente nuovo di stress ossidativo, è stato adattato da Gruber et al 7. Questo metodo evita certi artefatti e richiede bassi volumi di campione. I metodi utilizzati per la sintesi di MMDA sono stati descritti in altri 14, 15. GC / MS quantificazione basato su MDA è stato adattato da Paroni et al. e Cighetti et al. 16, 17. Xantina ossidasi è stata misurata mediante HPLC quantificando la conversione di pterina a isoxanthopterin 18. Questo approccio si è rivelato sufficientemente sensibile e riproducibile.
Protocollo
1. Esempio di raccolta ed elaborazione
- Raccogliere campioni di sangue in una provetta con EDTA K3 K3E 6ml, che è tenuta in ghiaccio.
- Entro 2 min di raccolta, centrifugare il campione a 4 ° C a 1500 g per 10 min.
- Trasferire il surnatante (plasma) in una provetta 1,5 ml.
- Centrifugare a 4 ° C a 18000 g per 30 min.
- Rimuovere il surnatante aliquote e trasferirli in provette da microcentrifuga per purine (200μl), allantoina (50μl), MDA (100μl) e XO (120μl) analisi. Fare attenzione a non contaminare i campioni con globuli rossi. Potrebbe essere necessario regolare il volume di plasma per MDA, XO, e purine in base al volume totale disponibile plasma.
2. Preparazione di standard interno, 2-Aminopurine (2-AP), per Purina e analisi XO
- Pesare 0.01351g 2-AP e aggiungerlo alla 8 ml di acqua che è stato acidificato con 2-5 gocce di HCl. Se il 2-AP non sta dissolvendo è necessario aggiungere più acido. Regolare il volume finale di 10 ml.
- Utilizzare l'UV-Vis spettrofotometro per determinare la concentrazione effettiva delle scorte 2-AP soluzione. (Λmax 315, ε 4000).
- Una volta che la concentrazione dello stock 2-AP è una soluzione determinata, calcolare i volumi richiesti per contenere 1x10 -7 mol 2-AP standard interno per le misure di purine e 1x10 -8 mol 2-AP standard interno per le misure di XO.
- Aliquota del volume calcolato in provette da microcentrifuga ed evaporare in un SpeedVac.
Equazione 1: 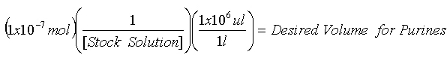
Equazione 2: 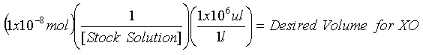
3. HPLC Misurazione delle purine
- Trasferimento plasma (200μl) ad un microcontrollore YM-10 dispositivo centrifugo filtro e centrifugare a 4 ° C a 14000 g per 1,5 ore.
- Rimuovere il filtrato e trasferirli in una provetta contenente 1x10 -7 mol 2-AP. Assicurarsi di registrare il volume di filtrato aggiunto alla provetta contenente il 2-AP. Vortex i campioni per 10-20 secondi.
- Analizzare campioni con un HPLC. Tre da 50 microlitri iniezioni vengono utilizzati per ogni campione. I campioni vengono iniettati in un Supelcosil LC-18-S, 15 cm x 4,6 mm, 5 micron colonna dotato di un LC-18-S Supelguard guardia colonna. Le condizioni di gradiente descritte nella tabella 1 dovrebbe essere utilizzato per ottenere un'adeguata separazione di picco: il solvente A-acqua, solvente B-metanolo, solventi C-tampone formiato di ammonio 50 mM, pH 5.5.
| Tempo | Flusso (ml / min) | % A | % B | % C | |
| 1 | 1,00 | 0,0 | 0,0 | 100,0 | |
| 2 | 16,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 3 | 17,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 4 | 22,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 5 | 27,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 6 | 32,00 | 1,00 | 0,0 | 100,0 | 0,0 |
| 7 | 33,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 8 | 38,00 | 1,00 | 100,0 | 0,0 | 0,0 |
| 9 | 39,00 | 1,00 | 0,0 | 0,0 | 100,0 |
| 10 | 45,00 | 1,00 | 0,0 | 0,0 | 100,0 |
Tabella 1. Cambiamenti solvente per la misurazione HPLC di composti purinici.
- Determinare la concentrazione di purine nel campione. Quantificare ipoxantina, xantina, acido urico e ottenendo aree dei picchi al di ritenzione e lunghezza d'onda descritti nella tabella 2. Determinare l'area del picco di 2-AP. Determinare i rapporti area di ipoxantina, xantina, acido urico e di 2-AP e convertire i rapporti di concentrazioni μmolar usando curve standard.
| Tempo di conservazione * | Osservato λ max * | Riferito λ max 19 | Riferito ε max 19 | |
| UricoAcido | ~ 3.5 min | 288 | 283 [2] | 11.500 [2] |
| Ipoxantina | ~ 7,0 min | 248 | 248 [1] | 10.800 [1] |
| Xantina | ~ 9,5 min | 267 | 267 [2] | 10.200 [2] |
| 2-Aminopurine | ~ 12,5 minuti | 305 | 314 [2] | 4000 [2] |
Tabella 2. Tempi di ritenzione tipici e λ max per purine e standard interno. * Determinato su HPLC isocratica con 50 mM tampone formiato di ammonio (pH 5,5) con una portata di 1mL/min. pH è in [].
- Analizzare tutti i campioni in triplice copia, ma solo includere i valori per le analisi in seguito, se il coefficiente di variazione è inferiore al 10%.
4. GC / MS misura di Allantoina
- Aggiungere 50μl 10μM DL-Allantoina-5-13 C, 1 - 15 N (standard interno) al plasma da 50 microlitri mettere da parte per il saggio allantoina durante la raccolta dei campioni e l'elaborazione.
- Aggiungere 100 microlitri acetonitrile a questa soluzione plasma.
- Vortex l'impasto per 10-20 secondi poi centrifugare a 4 ° C a 20.000 g per 10 min.
- Rimuovere il surnatante, si svolge in un GC / MS flaconcino e secco con il n. 2.
- Dopo l'essiccazione, aggiungere 50 ml di derivatizzazione agente N-terz-Butyldimethylsilyl-N-methyltrifluoroacetamide (MTBSTFA) in piridina (1:1 vol / vol), il cappuccio e incubare le fiale a 50 ° C per 2 ore Questa derivatizzazione rendimenti sempre quantificabili m / z picchi di 398,0 e 400,0 per allantoina e DL-allantoina-5-13 C, 1 - 15 N, rispettivamente, 20.
- Analizzare i campioni sul Agilent Technologies GC 6890N e MS 5973 dotato di un campionatore automatico. Effettuare la separazione composto su un Agilent 122-5532G colonna capillare (25.7m di lunghezza, 0,25 millimetri di diametro interno). Utilizzare l'elio come gas di trasporto ad un flusso di 1,5 ml / min. Iniettare prodotto derivatizzati (1 ml) in modalità split (divisione rapporto di 20:1, Split Flow 29,4 ml / min, il flusso totale di 33,8 ml / min). Impostare la temperatura iniziale della colonna a 100 ° C e mantenere a tale temperatura per 2 minuti prima di aumentare a 180 ° C ad una velocità di 10 ° C / min. Mantenere la temperatura per 4 min e poi aumentare a 260 ° C ad una velocità di 20 ° C / min. Mantenere questa temperatura fino alla fine della corsa. Dopo ogni campione, pulire la colonna con 2 iniezioni di esano.
- Quantificare allantoina utilizzando selezionare la modalità di monitoraggio di ioni, mentre il monitoraggio del 398,0 m / z ioni per allantoina e 400,0 m / z ioni per la DL-allantoina-5-13 C, 1-15 N. Convertire i rapporti di abbondanza di ioni di allantoina / (pesante allantoina) a concentrazioni micromolari di allantoina usando una curva preparato standard.
- Tutti i campioni sono analizzati in triplice copia, ma solo valori con un coefficiente di variazione inferiore al 10% sono utilizzati in ulteriori analisi.
5. Preparazione di standard interno, Metil malondialdeide (MMDA), per l'analisi MDA
- Aggiungere 523μl 3-ethoxymethacrolein a 1477μl 7M NaOH in un pallone da 100 ml a fondo tondo. Aggiungi un stirbar.
- Mettere il pallone nel bagnomaria a 45 ° C e mescolare fino a quando la reazione è andato a compimento. Questo dovrebbe prendere circa 140 min. Monitorare l'andamento della reazione rimuovendo una aliquota 10μl del liquido periodicamente a intervalli di 10 min. Diluire ogni campione raccolto di un fattore 10 5 con 50 mM tampone potassio fosfato (pH 7) e misurare l'assorbanza con l'UV-Vis. Una volta che l'assorbanza a 275nm raggiunge circa 0,658 la reazione è completa. Come la reazione progredisce, la soluzione diventerà giallo poi arancione.
- Lasciare che la reazione al progresso per altri 15 min.
- Aggiungere 5 ml di acqua distillata deionizzata al pallone a fondo tondo e trasferire la soluzione in un imbuto separatore. Utilizzare un ulteriore 3 ml di acqua per lavare il contenuto del pallone nell'imbuto. Aggiungi un ulteriore 2 ml di acqua per l'imbuto.
- Estrarre la soluzione 3 volte con 5 ml di diclorometano. Dopo ogni estrazione scartare lo strato organico.
- Dopo la terza estrazione, trasferire lo strato acquoso in un pallone basso rotondo e rotovap a secco.
- Risospendere il prodotto in 3 ml di etanolo e trasferimento in un pre-pesato tubo 15ml conica. Lavare il pallone con un ulteriore 2 ml di etanolo ed aggiungere il risciacquo al tubo conico.
- Aggiungere 5 ml benzene e incubare il tubo in acqua calda fino a quando il prodotto si scioglie subito posto il tubo in ghiaccio per 10 min. Centrifugare per 5 min a 15000 g e rimuovere il surnatante.
- Aggiungere 5 ml di etanolo e 5 ml di etere isopropilico per il precipitant. Sciogliere il precipitante incubando il tubo in acqua calda e, periodicamente, inclinando il tubo molto dolcemente. Una volta precipitato è disciolto, posizionare il tubo in ghiaccio per 10 min. Eseguire questa ricristallizzazione 2 volte di più con etanolo ed etere isopropilico. Alcuni pezzi insolubile bianco di prodotto possono formarsi.
- Dopo la fase di ricristallizzazione ultimi rimuovere il più possibile sovranatante ed asciugare il prodotto risultante in un Speedvac. Pesare il tubo conico con il prodotto sintetizzato.
- Aggiungere acqua 5 ml al vortice tubo, e filtrare qualsiasi solidi rimanenti.
- Utilizzare l'UV-vis spettrofotometro per determinare la concentrazione finale di MMDA. Il λmax per MMDA in tampone fosfato 50 mM di potassio (pH 7) è 274 nm con il coefficiente di estinzione di 29900 M -1 cm -1 14.
6. GC / MS Misura della MDA
- Preparare una soluzione di 0,5 mm butilato toluene idrossile (BTH) in etanolo con l'aggiunta di 0,11 g di etanolo BTH 9ml e regolando il volume finale di 10 ml. Quindi eseguire una diluizione aggiungendo 10μl di questa soluzione concentrata di 990μl di etanolo.
- Preparare una soluzione di idrazina 50mM fenil aggiungendo 4.92μl di idrazina fenil a 995μl di acqua in una provetta scuro. Vortex la soluzione.
- Aggiungi 5μl 10μM MMDA al plasma 100μl accantonato per il dosaggio della MDA durante la raccolta dei campioni e l'elaborazione.
- Quindi aggiungere 10μl BTH 0,5 mm al MMDA / plasma miscela seguito con l'aggiunta di 200μl citrato di sodio 1M a pH 4. PH Questo è cruciale per derivatizzazione corretta del campione. Un pH maggiore o minore si tradurrà in livelli di MDA distorta.
- Diluire la miscela finale con l'aggiunta di acqua distillata deionizzata per un volume finale di 480μl.
- Derivatize la soluzione con l'aggiunta di 20μl idrazina 50mM fenile, tappatura le fiale e la soluzione di incubazione a 25 ° C per 30 minuti su un agitatore orbitale.
- Aggiungere 1 ml di esano, vortex per 1 min e centrifugare a 3000 rpm per 10 min.
- Trasferire lo strato organico per un GC / MS flaconcino e concentrare la soluzione di 100μl di N 2 torrente.
- Analizzare campioni in GC / MS usando il campionatore automatico. Effettuare la separazione composto su un Agilent 122-5532G colonna capillare (25,7 m di lunghezza, 0,25 mm di diametro interno). Utilizzare l'elio come gas di trasporto ad una portata di 0,6-0,8 ml / min. Iniettare prodotto derivatizzati (2 microlitri) in modalità split (divisione rapporto di 20:1, Split Flow 23,0 ml / min, il flusso totale di 27,1 ml / min). Impostare la temperatura iniziale della colonna a 110 ° C e mantenere a tale temperatura per 1 minuto prima di aumentare a 250 ° C ad una velocità di 40 ° C / min. Mantenere questa temperatura fino alla fine della corsa. Dopo ogni campione, pulire la colonna con 2 iniezioni di esano.
- Quantificare MDA utilizzando selezionare la modalità di monitoraggio di ioni con il 144,00 m / z per la MDA e 158,00 m / z per MMDA. Convertire il MDA / MMDA rapporti di abbondanza di ioni a concentrazioni micromolari usando una curva standard.
- Analizzare campioni in triplice copia ed utilizzare solo i valori con un coefficiente di variazione inferiore al 10%.
7. HPLC Misura della xantina ossidasi
- La rilevazione della xantina ossidasi funzione dipende dalla capacità di misurare sensibilmente i livelli di un substrato idoneo (pterina) così come il suo prodotto (isoxanthopterin). Plasma viene incubato con il substrato sia per 0 min (controllo) o per 4 ore, e l'incubazione del substrato-dipendente per la conversione del prodotto è determinata.
- Aggiungere 240μl 0,2 M Tris-HCl (pH 9,0) e 4.63μl 7.083x10 -3 M pterina ad ogni provetta (0 e 4 ore) e Preincubare loro a 37 ° C per 5 min.
- Avviare la reazione enzimatica con l'aggiunta di 60μl di plasma ad ogni provetta.
- Immediatamente aggiungere 300μl 4% HClO 4 al tubo di controllo (0 min), ma consentono la miscela altri ad incubare per 4 ore prima della tempra la reazione con 300μl 4% HClO 4.
- Dopo l'aggiunta di HClO 4, scuotere con forza il tubo, quindi si centrifuga a 4 ° C a 15000 g per 15 min.
- Rimuovere 500μl di sovranatante e neutralizzare con l'aggiunta di 20μl di 5M K 2 CO 3. Agitare vigorosamente il tubo, quindi si centrifuga a 4 ° C a 15000 g per 15 min.
- Aggiungere 350μl della soluzione neutralizzata ad una provetta contenente 1x10 -8 mol 2-AP.
- Analizzare i campioni in un HPLC dotato di un rilevatore di fluorescenza di scansione. Tre da 50 microlitri iniezioni vengono utilizzati per ogni campione. I campioni verranno iniettate in un Wacosil 5C-18-200 250 mm x 6,0 mm, colonna 5 micron dotato di un LC-18-S guardia colonna Supelguard. Le seguenti condizioni isocratiche dovrebbe essere utilizzato per ottenere un'adeguata separazione e identificazione di picco: 95% 20 mM KPO 4 tampone (pH 2,2) e il 5% di metanolo in un 1ml/min portata. Impostare la lunghezza d'onda di eccitazione per il rivelatore a fluorescenza a 345 nm e l'onda di emissionelunghezza a 410 nm.
- Determinare i rapporti fra pterine e isoxanthopterine di 2-AP ottenendo aree dei picchi dallo spettro rivelatore a fluorescenza. Il primo picco nello spettro, ~ 5 minuti, corrispondente al 2-AP. Il secondo picco e più grande sarà pterine. Isoxanthopterine picco eluisce scorso.
- Ottenere la differenza nei rapporti isoxanthopterine/2-AP area del picco tra lo 0 e il 4 punti h tempo di incubazione. Utilizzare questo valore per calcolare l'attività XO dalle curve standard.
- Analizzare campioni in triplicato, ma utilizzare i valori solo con un coefficiente di variazione inferiore al 10%.
8. Rappresentante dei risultati:
Un esempio di quantificazione HPLC dei composti purinici è mostrata in Figura 1A. I tempi di ritenzione specifica e lunghezze d'onda di emissione di ipoxantina, xantina, acido urico e consentono la quantificazione simultanea di composti purinici (Tabella 2). Quando il saggio è eseguito correttamente, i composti avrà un'adeguata separazione e la forma del picco risulta nitida e unimodale. Questi picchi sono poi trasformate in concentrazioni, limiti riportati nella tabella 3, attraverso l'uso di curve standard. Poiché l'elaborazione del campione per questo dosaggio è minimo, i problemi del campione solo sulla base che possono sorgere sarebbe la lisi dei globuli rossi. Se i globuli rossi lisare prima i campioni vengono centrifugati, il plasma assumerà un colore arancio / rosso e non possono essere utilizzati per valutare l'ischemia ipossica. Le altre questioni che possono sorgere quando si misura purine coinvolge il sistema HPLC e la colonna (Figura 1B). Se ci sono bolle d'aria nel sistema HPLC i tempi di ritenzione si sposterà e la pressione di HPLC fluttuerà in modo drammatico. Se la cartuccia di guardia deve essere cambiato, la pressione aumenterà e le vette si allargherà e diventare bi o tri-modale.
| Ipoxantina (mM) | Xantina (mM) | Acido urico (mM) | Xantina ossidasi ((prodotto nmol) / min) | Malondialdeide (mM) | Allantoina (mM) | |
| Normossia termine | 1.13-19.3 (64) | 0.02-3.69 (61) | 107.20-726.12 (63) | 2.47x10 -6 - 3.92x10 -3 (20) | 0.44-3.76 (53) | NA |
| Termine da distress respiratorio | 1.78-12.59 (27) | 0.07-11.8 (24) | 225.40-653.32 (27) | 0 - 1.03x10 -5 (8) | 0.82-2.73 (24) | NA |
| Ipossico termine | 0.38-31.80 (13) | 0.11-2.88 (13) | 235.65-1348.13 (13) | 1.20x10 -5 -236,44 (9) | 0.95-2.15 (7) | NA |
| Pretermine normossia | 1.54-4.39 (9) | 0.03-1.77 (9) | 178.92-593.49 (9) | 2.46x10 -5 - 5.44x10 -4 (2) | 0.95-2.74 (8) | 2.30-5.26 (67) |
| Pretermine da distress respiratorio | 3.04-8.04 (2) | NA | 327.56-365.11 (2) | NA | 2.40-3.46 (3) | NA |
Min-Max (n)
Tabella 3. Gamme rappresentante per purine, xantina ossidasi, malondialdeide, e allantoina.
Un esempio del GC / MS quantificazione del Allantoina è illustrato nella figura 2. Perché la massa di allantoina derivitized e derivitized allantoina pesante è noto, selezionare la modalità di ioni può essere utilizzato per identificare questi composti sul spettrometro di massa. Se il test è fatto correttamente, due picchi sarà osservato al tempo di ritenzione stesso. Quello corrispondente ad allantoina (398,00 m / z) e l'altra a pesanti allantoina (400.00 m / z). Questi picchi sono poi trasformate in concentrazioni, limiti riportati nella tabella 3, attraverso l'utilizzo di una curva standard. Se il test viene eseguito in modo non corretto, e campioni non sono stati derivitized correttamente, i picchi non possono essere presenti o non possono essere quantitativamente rappresentativi. Ancora una volta, se i globuli rossi lisati il plasma non può essere usato per valutare lo stress ossidativo in ischemia ipossica neonatale.
I risultati per la quantificazione della MDA sono simili a quelli per allantoina con l'eccezione che i due picchi sono osservati a tempi di ritenzione diversi. A ~ 3,5 minuti tempo di ritenzione, un 144,00 m / z picco per MDA e ~ 4 minuti di tempo di ritenzione, un 158,00 m / z di picco per MMDA si osserva (Figura 3). Questi picchi sono poi trasformate in concentrazioni, limiti riportati nella tabella 3, attraverso l'utilizzo di una curva standard. Se il test viene eseguito in modo errato, o campioni non sono derivitized correttamente, senza picchi possono essere osservati al momento della selezione per 144.00m / z e 158.00m / z. Va notato chese c'è un eccesso di lipidi nel plasma da bolo un'alimentazione orale o la somministrazione per via endovenosa di lipidi, il plasma assumerà un aspetto lattiginoso e non può essere usato per valutare lo stress ossidativo in ischemia ipossica neonatale.
Un esempio di HPLC-based quantificazione della xantina ossidasi funzione è mostrata in Figura 4. Se il test viene eseguito correttamente, tre cime devono essere osservati con il rivelatore a fluorescenza, una per pterina, uno per isoxanthopterin, e uno per 2-AP. Questi picchi sono poi trasformate in concentrazioni, limiti riportati nella tabella 3, attraverso l'utilizzo di una curva standard. Ci dovrebbe essere anche un picco corrispondente al isoxanthopterin e 2-AP sullo spettro generato dal rivelatore PDA. Se l'attività enzimatica è assente, il picco corrispondente al isoxanthopterin non si vedrà. Poiché questo saggio misura funzione enzimatica, congelamenti e scongelamenti ripetuti del campione può alterare questo.
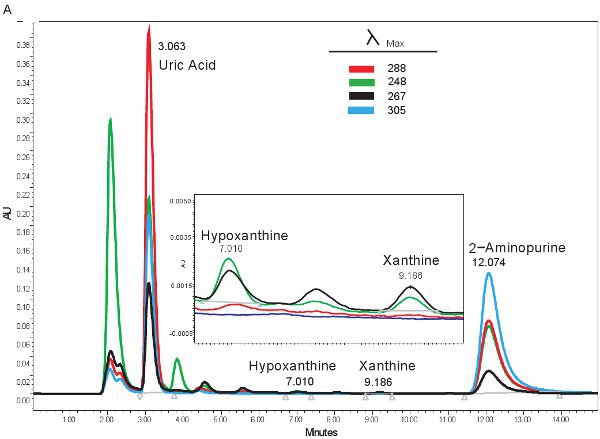
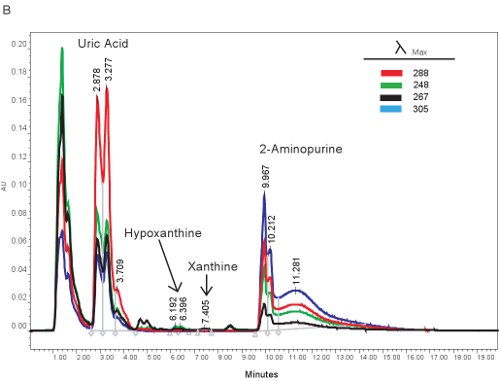
Figura 1. Spettro HPLC per l'identificazione dei composti purinici. A). Rappresentante risultati se il test è stato eseguito correttamente. B). risultati rappresentativi se c'è un problema con l'HPLC, colonna, o guardia cartuccia.
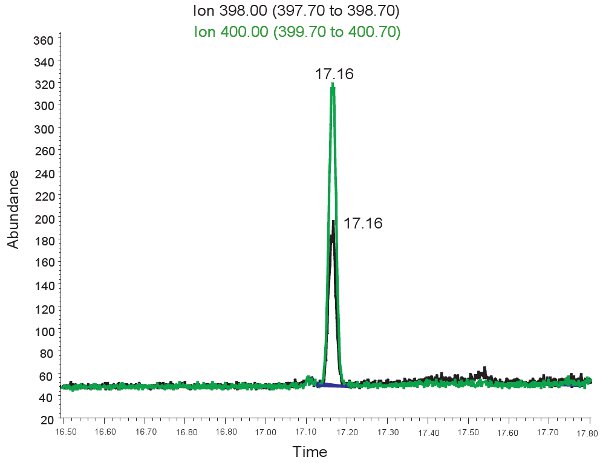
Figura 2. GC / MS spettro per la quantificazione del Allantoina. Il picco a ioni di 398,00 m / z corrisponde ad allantoina. Il picco a ioni di 400,00 m / z corrisponde ad allantoina pesanti.
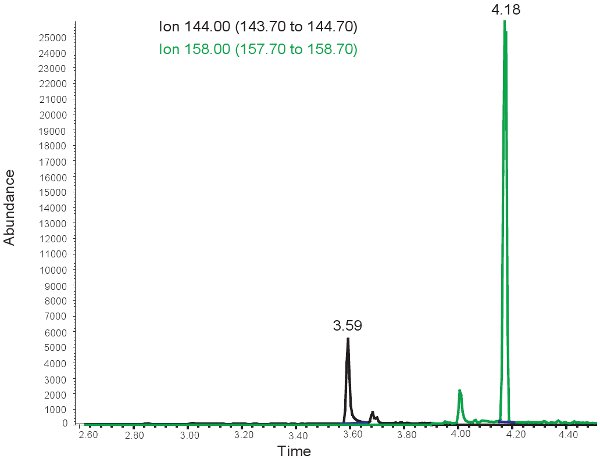
Figura 3. GC / MS spettro per la quantificazione del MDA. Il picco a ioni di 144,00 m / z corrisponde alla MDA. Il picco a ioni di 158,00 m / z corrisponde a MMDA.
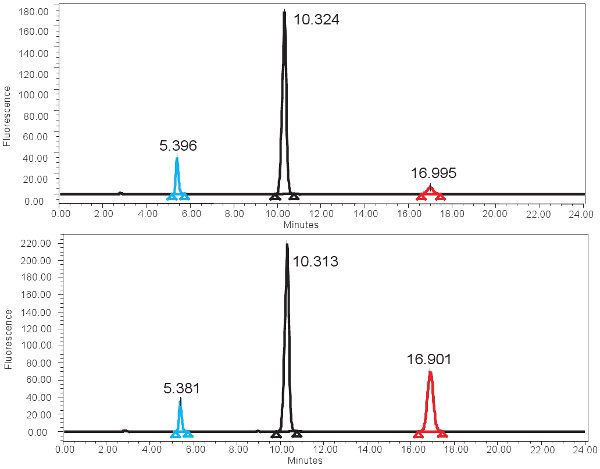
Figura 4. Spettro HPLC per la misurazione dell'attività XO. A) I risultati rappresentativi per il tempo 0 min di incubazione e B) dei risultati rappresentativi per il tempo di incubazione di 4 ore. Si noti il picco più alto isoxanthopterine (a ~ 17 min) per il tempo di incubazione di 4 ore. Nello spettro di fluorescenza, 2-AP eluisce prima ~ eluisce 5min e pterine prossima a ~ 10min.
Discussione
I metodi descritti permettono la valutazione di ischemia ipossia neonatale. Questo protocollo combina la misurazione dei marcatori di energia (ATP) privazione, stress ossidativo, danno ossidativo, l'attività enzimatica e di avere una visione globale biochimiche della presenza o anche il grado di ipossia, ischemia. Nonostante l'utilità di questo metodo, ci sono delle limitazioni potenziale. In primo luogo, ci vogliono circa 1-2 ml di sangue per la raccolta del plasma sufficiente per eseguire tutti i test. Quest...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è finanziato dal National Institutes of Health NR011209 R01-03
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| 6ml K3E EDTA K3 tubo | Fisher Scientific | 2204061 | |
| Centrifuga 5702R | Fisher Scientific | 05413319 | Con 13 e adattatore 16MM |
| Microcentrifuga 1,5 ml tubo | USA scientifico | 1615-5599 | |
| 2-Aminopurine | Sigma-Aldrich | A3509 | |
| Varian Cary 100 spettrofotometro | Agilant Technologies | 0010071500 | |
| Savant SpeedVac | Thermo Scientific | SC210A-115 | |
| Micron dispositivo centrifugo filtro | Fisher Scientific | UFC501596 | |
| Supelcosil LC-18-S Colonna | Sigma-Aldrich | 58931 | |
| Supelcosil LC-18-S Supelguard cartuccia e titolare | Sigma-Aldrich | 59629 | |
| HPLC | Acque | ||
| GCMS Vial | Fisher Scientific | 03376607 | |
| DL-Allantoina -13 C-5, 1 -15 N | CDN Isotopi | M-2307 | Lotto # L340P9 |
| MTBSTFA | Thermo Scientific | 48920 | |
| Piridina | Sigma-Aldrich | 270970 | |
| 5973E GC / MSD | Agilent Technologies | G7021A | Part # 5975E per GC / MS |
| 3-Ethoxymethacrolein | Sigma-Aldrich | 232548 | |
| Di sodio idrossido | Sigma-Aldrich | S5881 | |
| Diclorometano | Sigma-Aldrich | 270997 | |
| Benzene | Sigma-Aldrich | 401765 | |
| Etere diisopropile | Sigma-Aldrich | 38270 | |
| BHT | Sigma-Aldrich | B1378 | |
| Etanolo | Sigma-Aldrich | 459844 | |
| Fenilidrazina | Sigma-Aldrich | P26252 |
Riferimenti
- Harkness, R. A., Whitelaw, A. G., Simmonds, R. J. Intrapartum hypoxia: the association between neurological assessment of damage and abnormal excretion of ATP metabolites. J Clin Pathol. 35, 999-1007 (1982).
- Shalak, L., Perlman, J. M. Hypoxic-ischemic brain injury in the term infant-current concepts. Early Hum Dev. 80, 125-141 (2004).
- Webster, W. S., Abela, D. The effect of hypoxia in development. Birth Defects Res C Embryo Today. 81, 215-228 (2007).
- Engerson, T. D., McKelvey, T. G., Rhyne, D. B., Boggio, E. B., Snyder, S. J., Jones, H. P. Conversion of xanthine dehydrogenase to oxidase in ischemic rat tissues. J Clin Invest. 79, 1564-1570 (1987).
- Choi, E. Y., Stockert, A. L., Leimkuhler, S., Hille, R. Studies on the mechanism of action of xanthine oxidase. J Inorg Biochem. 98, 841-848 (2004).
- Godber, B. L., Schwarz, G., Mendel, R. R., Lowe, D. J., Bray, R. C., Eisenthal, R. Molecular characterization of human xanthine oxidoreductase: the enzyme is grossly deficient in molybdenum and substantially deficient in iron-sulphur centres. Biochem J. 388, 501-508 (2005).
- Gruber, J., Tang, S. Y., Jenner, A. M., Mudway, I., Blomberg, A., Behndig, A. Allantoin in human plasma, serum, and nasal-lining fluids as a biomarker of oxidative stress: avoiding artifacts and establishing real in vivo concentrations. Antioxid Redox Signal. 11, 1767-1776 (2009).
- Zitnanova, I., Korytar, P., Aruoma, O. I., Sustrova, M., Garaiova, I., Muchova, J. Uric acid and allantoin levels in Down syndrome: antioxidant and oxidative stress mechanisms?. Clin Chim Acta. 341, 139-146 (2004).
- Siciarz, A., Weinberger, B., Witz, G., Hiatt, M., Hegyi, T. Urinary thiobarbituric acid-reacting substances as potential biomarkers of intrauterine hypoxia. Arch Pediatr Adolesc Med. 155, 718-722 (2001).
- Buonocore, G., Perrone, S., Longini, M., Terzuoli, L., Bracci, R. Total hydroperoxide and advanced oxidation protein products in preterm hypoxic babies. Pediatr Res. 47, 221-224 (2000).
- Berne, R. M. Cardiac nucleotides in hypoxia: possible role in regulation of coronary blood flow. Am J Physiol. 204, 317-322 (1963).
- Harkness, R. A., Lund, R. J. Cerebrospinal fluid concentrations of hypoxanthine, xanthine, uridine and inosine: high concentrations of the ATP metabolite, hypoxanthine, after hypoxia. J Clin Pathol. 36, 1-8 (1983).
- Plank, M. S., Boskovic, D. S., Sowers, L. C., Angeles, D. M. Biochemical markers of neonatal hypoxia. Pediatric Health. 2, 485-501 (2008).
- Cighetti, G., Allevi, P., Anastasia, L., Bortone, L., Paroni, R. Use of methyl malondialdehyde as an internal standard for malondialdehyde detection: validation by isotope-dilution gas chromatography-mass spectrometry. Clin Chem. 48, 2266-2269 (2002).
- Paroni, R., Fermo, I., Cighetti, G. Validation of methyl malondialdehyde as internal standard for malondialdehyde detection by capillary electrophoresis. Anal Biochem. 307, 92-98 (2002).
- Cighetti, G., Debiasi, S., Ciuffreda, P., Allevi, P. Beta-ethoxyacrolein contamination increases malondialdehyde inhibition of milk xanthine oxidase activity. Free Radic Biol Med. 25, 818-825 (1998).
- Cighetti, G., Debiasi, S., Paroni, R., Allevi, P. Free and total malondialdehyde assessment in biological matrices by gas chromatography-mass spectrometry: what is needed for an accurate detection. Anal Biochem. 266, 222-229 (1999).
- Yamamoto, T., Moriwaki, Y., Takahashi, S., Tsutsumi, Z., Yamakita, J., Nasako, Y. Determination of human plasma xanthine oxidase activity by high-performance liquid chromatography. J Chromatogr B Biomed Appl. 681, 395-400 (1996).
- Fasman, G. . Handbook of Biochemistry and Molecular Biology. , (1988).
- Chen, X. B., Calder, A. G., Prasitkusol, P., Kyle, D. J., Jayasuriya, M. C. Determination of 15N isotopic enrichment and concentrations of allantoin and uric acid in urine by gas chromatography/mass spectrometry. J Mass Spectrom. 33, 130-137 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon