Method Article
بعد الخلوي في مصير
In This Article
Summary
توضح هذه المقالة الإجراء لإعداد الإصدار fluorescently التي تحمل علامات لامدا عاثية، والعدوى من E. القولونية البكتيريا والعدوى بعد ظهور نتائج تحت المجهر، وتحليل النتائج العدوى.
Abstract
نظام يتألف من الجراثيم (بالعاثية) امدا والبكتيريا E. وقد خدم القولونية طويلة كنموذج ل1،2 تقرير مصير الخلية. بعد العدوى المتزامنة للخلية بها عدد من فاجات، يتم اختيار واحد من مسارين: التحللي (ضراوة) أو مستذيب (نائمة) 3،4. ونحن وضعت مؤخرا طريقة لوصفها fluorescently فاجات الفردية، وكانوا قادرين على دراسة قرار ما بعد الإصابة في الوقت الحقيقي تحت المجهر، على مستوى الفرد وفاجات الخلايا 5. هنا، نحن تصف الإجراء الكامل لأداء التجارب العدوى الوارد وصفها في وقت سابق عملنا 5. وهذا يشمل إنشاء فاجات الفلورسنت، والعدوى من الخلايا، والتصوير تحت المجهر وتحليل البيانات. فإن الفيروس هو الفلورسنت قوة "مختلطة"، وشارك في التعبير عن الإصدارات من النوع البري وYFP الانصهار من البروتين قفيصة GPD. يتم الحصول أولا المحللة بالعاثية الخام عن طريق حفز على مستذيب من (GPD-EYFP ENHanced صفراء نيون البروتين) بالعاثية، معربا عن إيواء والبرية البلازميد نوع GPD. ثم يتم تنفيذ سلسلة من الخطوات لتنقية، تليها دابي وضع العلامات والتصوير تحت المجهر. يتم ذلك من أجل التحقق من التوحيد، DNA الكفاءة التعبئة والتغليف، إشارة مضان والاستقرار الهيكلي للسهم بالعاثية. يتم تنفيذ الأولي لامتصاص فاجات للبكتيريا على الجليد، ثم تليها على حضانة قصيرة في 35 ° C لتحريك الفيروسية حقن DNA 6. ثم يتم نقل فإن الفيروس / خليط البكتيريا على سطح لوح المغذيات آجار رقيقة، مع تغطية ساترة وتصوير تحت المجهر epifluorescence. ويتبع عملية ما بعد الإصابة لمدة 4 ساعة، 10 دقيقة على فترات. يتم تعقب مرحلة مواقف متعددة مثل التي يمكن أن تعزى ~ التهابات الخلايا 100 في تجربة واحدة. في كل نقطة موقف والوقت، يتم الحصول على الصور في المقابل مراحل وقنوات الفلورسنت الأحمر والأخضر. يتم استخدام الصور على النقيض من المرحلة في وقت لاحق لسل الآليالاعتراف لتر في حين يتم استخدام القنوات الفلورسنت لوصف نتائج العدوى: إنتاج فاجات الفلورسنت الجديدة (الخضراء)، يليه تحلل الخلايا، أو التعبير عن العوامل استذابة (أحمر)، يليه نمو الخلايا المستأنفة والانقسام. تتم معالجة المكتسبة الوقت الفاصل بين الأفلام باستخدام مزيج من الأساليب اليدوية والآلية. نتائج تحليل البيانات في تحديد مؤشرات الإصابة لكل حدث العدوى (مثل عدد ومواقف اصابة فاجات)، وكذلك نتيجة العدوى (تحلل / استذابة). ويمكن استخراج معلمات إضافية إذا لزم الأمر.
Protocol
1. إنشاء المحللة بالعاثية الخام (الشكل 1)
- في قارورة 50 مل، تطعيم مستعمرة جديدة من LE392 (λ LZ1) [pPLate * D] (انظر الجدول 1 للتفاصيل) إلى 6 مل من المتوسط LB 7 تستكمل مع 10 ميكروغرام / مل و 100 كاناميسين ميكروغرام / مل أمبيسيلين. تنمو بين عشية وضحاها في 30 درجة مئوية مع الهز الخفيف (180 دورة في الدقيقة).
- تمييع 1:100 الثقافة في LBM (LB تستكمل مع 10 ملي MgSO 4) وينمو بمعدل 30 ° C مع اهتزاز خفيف (180 دورة في الدقيقة). من أجل تحسين العائد بالعاثية، تأكد من أن حجم الثقافة ليست أكثر من واحد على عشرة من قارورة سعة وحدة التخزين. نحن نستعد العادة مرتين قوارير من سعة 2 ليتر أو 2.5 ليتر، وإضافة 2.5 مل الثقافة بين عشية وضحاها إلى 250 مل LBM المتوسطة في كل قارورة.
- عندما تصل كثافة الخلية OD 600 ≈ 0.6 (~ 2،5 حتي 3 ساعة)، حمل مستذيب عن طريق تحريك الثقافة إلى 42 ° C شاكر حمام الماء لمدة 18 دقيقة مع اهتزاز خفيف (180 دورة في الدقيقة)، ثم incubatه في 37 ° C مع اهتزاز خفيف (180 دورة في الدقيقة) حتى تحلل مرئيا (الثقافة يصبح واضحا، في ~ 60 حتي 90 دقيقة).
- إضافة 2٪ كلوروفورم للثقافة، ويهز باليد لخلط، ثم احتضان لمدة 15 دقيقة في درجة حرارة الغرفة. تنبيه: ارتداء قفازات للتعامل مع الكلوروفورم، وتجنب التنفس عليه.
- نقل الثقافة إلى قسمين 250 مل الزجاجات الطرد المركزي، أجهزة الطرد المركزي الثقافة في الدوار GSA الكتب التي في 10،000 دورة في الدقيقة لمدة 15 دقيقة في C. ° 4 استرداد طاف يحتوي على جزيئات بالعاثية، وتجاهل بيليه من الحطام. إجراء الطرد المركزي الثاني لتأكد من التخلص من الحطام مرئية.
- استخدام المعايرة القياسية بروتوكول بالعاثية 8 إلى قياس تركيز بالعاثية. يجب أن يكون عيار بالعاثية ~ 5-10 X 10 9 PFU / مل. استخدام سلالة supF مثل LE392 كما سلالة المؤشر بسبب الطفرة Sam7 في التركيب الوراثي للبالعاثية الفلورسنت، واستخدام لوحات أجار أجار أعلى والمصنوعة من NZYM الغنية للحصول على أكبر ويحات (FIجوري 2).
2. تنقية بالعاثية (الشكل 1)
- صب المحللة في قارورة (على سبيل المثال 2 ليتر) كبيرة، إضافة الدناز I وريبونوكلياز (1 ميكروغرام / مل لكل منهما) إلى المحللة من أجل هضم الأحماض النووية المحررة من البكتيريا هي lysed، واحتضان 1 ساعة في درجة حرارة الغرفة.
- إضافة كلوريد الصوديوم 1M إلى المحللة، نقل المحللة إلى 250 مل الزجاجات أجهزة الطرد المركزي، واحتضان 3 ساعة على الجليد. أجهزة الطرد المركزي لالمحللة في الكتب التي GSA في 10،000 دورة في الدقيقة لمدة 15 دقيقة في 4 درجات مئوية. استرداد طاف. يجب أن يكون عيار بالعاثية مماثلة لتلك التي من النفط الخام المحللة، وهو ~ 5-10 X 10 9 PFU / مل. إضافة كلوريد الصوديوم يعزز تفكك جزيئات بالعاثية من الحطام البكتيرية ومطلوب من أجل هطول الأمطار كفاءة من الجسيمات بالعاثية من PEG 8.
- صب المحللة في قارورة كبيرة، على سبيل المثال 2-قارورة لتر، إضافة 10٪ (W / V) PEG8000 في المحللة، وإثارة ببطء أو تهزه حل PEG8000 في درجة حرارة الغرفة. نقل المحللة في المائة 250 ملزجاجات rifuge واحتضان بين عشية وضحاها ثم (~ 16 ساعة) في C. ° 4 أجهزة الطرد المركزي لالمحللة في الدوار GSA الكتب التي في 10،000 دورة في الدقيقة لمدة 15 دقيقة في 4 درجات مئوية. تجاهل طاف.
- نقع بيليه (جسيمات بالعاثية عجل مع PEG8000) مع بالعاثية SM العازلة (4 عازلة SM مل لكل 250 مل من المحللة بالعاثية الأولي). احتضان مع اهتزاز خفيف جدا أو معدومة لمدة 16 ساعة تهز في C. ° 4
- بلطف من اتخاذ المحللة (SM العازلة مع جزيئات بالعاثية) في أنبوب الطرد المركزي 50 مل إيبندورف، ثم غسل بيليه المتبقية مع 0،5 حتي 1 مل من العازلة SM.
- إضافة حجم مساو من كلوروفورم إلى المحللة. مزيج بلطف المحللة مع الكلوروفورم بنسبة تصل قلب وهبوطا لعدة مرات. أجهزة الطرد المركزي في 4،000 دورة في الدقيقة لمدة 15 دقيقة في C ° 4 في 5804R إيبندورف أو مماثلة الطرد المركزي مقعد بين كبار.
- كرر الخطوة 2.6 إلى الحصول على أكثر وضوحا المحللة. يجب أن يكون عيار بالعاثية ~ 1-2 X 10 11 PFU / مل.
- إعداد SM / CSCL حلول مع ثلاثة كثافات مختلفة (ρ) إلى 1.3 جم / مل، 10.5 جم / مل و 1.7 جم / مل. قياس معامل الانكسار (η) للحصول على قراءة كثافة أكثر دقة. تحويل الكثافة ρ = 9 هو 10،8601 η - 13،4974 عند 25 ° C. أنظر الجدول 3 لمزيد من التفاصيل.
- استخدام المحاقن مع إبرة طويلة لتحميل الحل في أنبوب مل في 14 بيكمان فائقة الوضوح نابذة فائقة السرعة 40Ti. لتجنب الخلط وتشكيل التدرج أفضل الكثافة، تحتها الحل (الحلول طبقات أي زيادة الكثافة تحت بعضها البعض) وينبغي أن تستخدم، أي تحميل بلطف 2 مل من SM / CSCL الحلول في النظام قدرها 1.3 جم / مل، 1.5 ز / مل و 1.7 جم / مل قبل إدخال الإبرة مع حقنة مل 3 إلى الجزء السفلي من الأنبوب.
- تحميل بلطف 8 مل من بالعاثية المحللة عن طريق تغطية من الجزء العلوي من أنبوب نابذة فائقة السرعة 14 مل. إعداد أنبوب التوازن. أجهزة الطرد المركزي في الدوار SW40Ti بيكمان في 24000 دورة في الدقيقة لمدة 4 ساعة في 4 درجات مئوية.
- اتخاذ بلطف من الأنبوب في غرفة مظلمة وتسليط الضوء من الجزء العلوي من الأنبوب على خلفية سوداء باستخدام AFlashlight. ينبغي أن الفرقة بالعاثية تكون واضحة للعيان في موقع واجهة بين 1.3 جم / مل و 1.5 جم / مل SM / CSCL طبقات (الشكل 3A). ثقب من خلال الجانب من الأنبوب أقل قليلا من الفرقة مع إبرة قياس 21.5 مع حقنة مل 3. جمع بلطف ~ 500 ميكرولتر من التعليق بالعاثية. يجب أن يكون عيار بالعاثية ~ 5-10 X 10 11 PFU / مل.
- ضع تعليق بالعاثية إلى 4 مل أنبوب بيكمان فائقة الوضوح SW60Ti نابذة فائقة السرعة الدوار. ملء الأنبوب مع SM ز / 1.5 مل / حل CSCL. إعداد أنبوب التوازن. أجهزة الطرد المركزي في الدوار SW60Ti بيكمان في 35000 دورة في الدقيقة لمدة 24 ساعة في 4 درجات مئوية.
- كرر نفس الإجراء كما في الخطوة 2،11 لجمع بالعاثية من الفرقة مرئية. ينبغي أن تكون واضحة الفرقة كما هو موضح في الشكل 3B.
- تحميل التعليق بالعاثية إلى غسيل الكلى كاسيت غشاء (الجدول 2) وdialyze ثلاث مرات ضد وحدة تخزين 1000-SM حظيرة العازلة عند 4 درجة مئوية لمدة ساعة من 3 فترات ساعة 3، وovernigحزب التحرير (~ 16 ساعة). والغرض من هذا هو غسيل الكلى للتخلص من الحاضر CSCL في التعليق بالعاثية. يجب أن يكون عيار بالعاثية النهائي ~ 5-10 X 10 11 PFU / مل.
3. تعد واحدة بلاطة هلام الاغاروز (الشكل 4)
- تنظيف الشرائح المجهر 6 (75 × 50 مم، 1 مم) مع الايثانول 70٪.
- 5 ترتيب الشرائح وتأمين الشريط مع كما هو موضح في الشكل 4.
- مزيج 0،09 ز الاغاروز في المتوسط مل 6 في كوب صغير مغطاة تتشبث التفاف (الرضوخ الاغاروز 1.5٪). الحرارة على لوحة الساخن حتى يتحول الحل واضح.
- من أجل حل الاغاروز على الشرائح المضمون.
- ضع الشريحة الأخيرة على القمة، وتجنب فقاعات الهواء بعناية. مكان الوزن على رأس والسماح لتبرد لمدة 30 دقيقة ~.
- إزالة الشرائح 4 على الجانب، والتفاف لوح جنبا إلى جنب مع شرائح أعلى وأسفل مع تتشبث التفاف. يمكن تخزين بلاطة في C ° 4 لمدة تصل إلى 3 أيام.
4. اختبار الأسهم النقية بالعاثية
- إعدادلوح هلام PBS-الاغاروز كما هو موضح أعلاه (القسم 3).
- وصمة عار على تنقية بالعاثية مع دابي. 10 ميكرولتر من مزيج بالعاثية (~ 1 × 10 10 PFU / مل) مع 10 ميكرولتر من 10 ميكروغرام / مل دابي (دابي تركيز النهائي من 5 ميكروغرام / مل)، احتضان لمدة 30 دقيقة في 4 درجات مئوية أو 10 دقيقة في درجة حرارة الغرفة.
- المكان 1 ميكرولتر من خليط بالعاثية / دابي في وسط NO.1 24 × 50 مم ساترة، تراكب قطعة صغيرة (~ 10 × 10 مم) من بلاطة PBS-الاغاروز معدة سلفا. يتم قطع قطعة صغيرة من لوح الاغاروز بشفرة حلاقة بعد الشريحة الأولى على إزالة هلام شطيرة. صورة العينة تحت المجهر epifluorescence من خلال القنوات YFP ودابي. يجب أن تكون واضحة فاجات الفردية وحيود محدودة "النقاط" الفلورسنت في كل من قنوات (الشكل 5). استخدام المجهر والاجهزة نفس الكاميرا كما في الخطوة 6.2 أدناه.
5. عدوى (الشكل 6)
- في أنبوب فالكون 14 مل، تطعيم مستعمرة جديدة من LE392 [PP-RE صحة الأم والطفلerry] (انظر الجدول 1 للحصول على التفاصيل) إلى 2 مل من المتوسط LB تستكمل مع 100 ميكروغرام / مل أمبيسيلين، 10 ملم MgSO 4 و مالتوز 0.2٪. تنمو بين عشية وضحاها في C ° 37 مع اهتزاز معتدلة (265 دورة في الدقيقة).
- تمييع 1:1000 الثقافة في LBMM (LB تستكمل مع 10 ملي MgSO 4 و مالتوز 0.2٪)، أي إضافة 5 ميكرولتر الثقافة بين عشية وضحاها في المتوسط 5 مل LBMM في قارورة 50 مل. تنمو إلى 0،4 ≈ OD 600 في 37 ° C مع اهتزاز معتدلة (265 دورة في الدقيقة).
- استخدام LBM المتوسطة لإعداد لوح جل LBM-الاغاروز كما هو موضح في القسم 3 أعلاه.
- 1 مل من أجهزة الطرد المركزي الخلايا في 2000 ز في ميكروسنتريفوج مقعد بين كبار لمدة 2 دقيقة في درجة حرارة الغرفة. إزالة طاف، و resuspend الخلايا برفق إلى 20 LBMM الجليد الباردة ميكرولتر لتصل إلى 600 & OD 20.
- عند التعامل مع المخزون بالعاثية تنقيته، استخدم تلميح ماصة واسعة أو قطع الطرف ماصة العادية لجعل تلميح فتح أوسع، لتجنب قص الجزيئات بالعاثية 3. M بلطفتاسعا 20 ميكرولتر من الخلايا مع 20 ميكرولتر من تنقية بالعاثية لتصل إلى متوسط فاجات الى خلية في نسبة تراوح من 0.1 - 5. احتضان على الجليد لمدة 30 دقيقة للسماح بالعاثية الامتزاز، ثم في احتضان 35 درجة مئوية حمام الماء لمدة 5 دقائق لتحريك بالعاثية حقن DNA 6.
- ماصة صعودا وهبوطا عدة مرات لفصل أي المجاميع الخلية. استخدام مرة أخرى تلميح ماصة واسعة لتجنب قص وفاجات. تخفيف الخليط في 1:10 LBMM، مثلا 5 ميكرولتر مزيج إلى 45 ميكرولتر LBMM.
- ضع قطعة من لوح LBM-الاغاروز (~ 10 × 10 ملم) على ساترة NO.1 × 22 مم 22. يجب وضع معدة سلفا LBM-الاغاروز بلاطة في درجة حرارة الغرفة لمدة لا تقل عن 1 ساعة قبل استخدامها لضمان أن لوح الاغاروز تصل درجة حرارة الغرفة. المكان 1 ميكرولتر من خليط بالعاثية / خلية على لوح الاغاروز وانتظر 1 دقيقة للسماح لاستيعاب الخليط في لوح الاغاروز. وضع بلطف NO.1 24 × 50 مم ساترة على الجزء العلوي من لوح الاغاروز. ويهدف هذا الإجراء إلى تجنب القص وفاجات من الوقود النووي المشعected الخلية (الشكل 6).
6. بعد مصير الخلايا تحت المجهر
- تحميل بعناية ساترة على مسرح المجهر. التصوير، واستخدام الهدف عالية التكبير (مثل 100X) (انظر النظام المجهر في المناقشة الواردة أدناه).
- الحصول على صورة عن وضع الإطار الزمني الأولي. وسوف تستخدم هذه المجموعة صورة لوصف الأرقام الأولية ومواقف جميع فاجات اصابة. اتخاذ سلسلة من 15 صورة في 200 نانومتر Z-المحور (الرأسي) فترات. الصورة من خلال قناة YFP. وبالإضافة إلى ذلك، واتخاذ واحد في التركيز على الصورة من خلال التباين وقنوات mCherry المرحلة. تحسين شدة الضوء وزمن التعرض للحصول على إشارة كافية مع تقليل تلف الخلايا وتبيض (انظر الحصول على صورة في المناقشة الواردة أدناه).
- الحصول على الفيلم مرور الزمن من مصير الخلية بعد الإصابة. صورة العينة في YFP، وعلى النقيض من المرحلة mCherryالقنوات على فترات زمنية من 10 دقيقة لنحو 4 ساعات. خلال الوقت الفاصل بين الفيلم، واستخدام واحدة Z-موقف صورة لكل قناة في نقطة زمنية، لتجنب التعرض غير الضروري للعينة، والتي يمكن أن تؤدي إلى تبيض والضيائية.
7. تحليل الصور
- العد يدويا عدد فاجات وسجل موقع بالعاثية وطول الخلية في الإطار الزمني الأولي. ويمكن أن يتم ذلك باستخدام البرمجيات مثل MetaMorph أو يماغيج. تسجيل مصائر خلية (التحللي، أو غير مصاب مستذيب)، والوقت تحلل، وأية معلومات أخرى عن طريق اللعب المطلوب الفيلم مرور الزمن. لتحديد مصير مختلفة من الخلايا، راجع الزمن الفاصل بين الفيلم الممثل في قسم النتائج أدناه.
- بالإضافة إلى تحليل الخط أعلاه، يمكن استخراج المزيد من المعلومات الكمية (مثل مستوى مضان على مر الزمن في الخلايا الفردية) باستخدام خلية الآلي والتعرف على نسب خوارزميات البحث عن المفقودين. نستخدم برنامج ماتلاب الرئيسية لبناء TRالتفوق نسب الخلايا ومستويات مضان، جنبا إلى جنب مع رمز لمطلب Schnitzcell تجزئة الخلية (الذي كتبه مجموعة Elowitz في معهد كاليفورنيا للتكنولوجيا).
8. ممثل النتائج:
بالعاثية تصفيح:
لويحات من فاجات fluorescently المسمى (في 1.6 الخطوة والقسم 2) هي أصغر بكثير من تلك التي من نوع البرية (الشكل 2). ونحن بالتالي احتضان لوحات لا يقل عن 12 ساعة في 37 ° C حاضنة لويحات أن تكون مرئية.
بالعاثية تنبيذ فائق:
بعد تنبيذ فائق من العينة بالعاثية مع التدرج خطوة CSCL (الخطوة 2.10)، وينبغي أن تكون واضحة شريطين (الشكل 3A). الفرقة الأعلى، في واجهة بين التعليق وبالعاثية SM / CSCL 1،3 طبقة ز / لتر، يحتوي على الحطام الخلية وcapsids بالعاثية فارغة. الفرقة القاع، في مجال التفاعل بين 1،3 G SM / CSCL / مل و 1.5 طبقات ز / مل، هو الفرقة بالعاثية. ثيق الفرقة يظهر الأخضر لLZ2 بالعاثية λ الفلورسنت. الفرقة البرية لنوع بالعاثية λ IG2903 يبدو مزرق 5. بعد تنبيذ فائق التدرج من التوازن في الخطوة CSCL 2.12، ينبغي للمرء أن الفرقة بالعاثية تكون مرئية في الجزء الأوسط من الأنبوب (الشكل 3B). منذ الفلورسنت بالعاثية λ LZ2 يحتوي على خليط من GPD-EYFP وGPD capsids، نسبة البروتين DNA لهو أعلى من النوع البري. ولذلك، فإن الفرقة من LZ2 بالعاثية λ الفلورسنت هو أخف قليلا (يبدو أن في أعلى موقع في أنبوب) من ذلك النوع من البرية λ IG290310.
تلوين دابي:
ويبين الشكل 5 صور نموذجية تم الحصول عليها بعد وصفها بالعاثية مع دابي (القسم 4). ينبغي أن إشارات YFP ودابي من بالعاثية تنقية بنجاح ديهم ما يقرب من 100٪ المراسلات. نلاحظ عادة أن أقل من 1٪ من بقعة YFPق لا تحتوي على دابي (تمثل capsids دون الجينوم الفيروسي). أقل من 1٪ من البقع دابي لا تحتوي على YFP (الموافق غير الفلورسنت فاجات) 5.
الوقت الفاصل بين الفيلم:
يتم التعرف على الخلايا التحللي عن تراكم مضان YFP (الأخضر قناة) داخل الخلية، تليها تحلل الخلية. يتم التعرف على الخلايا مستذيب عن تراكم موحدة mCherry مضان (الأحمر) داخل الخلية، واستئناف النمو وانقسام الخلايا. والخلايا غير المصابة (أو الخلايا التي لا تحدث فشلت) لا يتم عرض أي من الظواهر المذكورة أعلاه، وسوف تنمو وتنقسم بشكل طبيعي. يبين الشكل 7 عدد قليل من الصور، مجموعات من التباين المرحلة، وقنوات mCherry YFP، والصور المقابلة من هذه مضافين ثلاث قنوات، من فيلم الوقت الفاصل بين نموذجي (القسم 6). وفاجات الفردية (البقع الخضراء) واضحة للعيان في الإطار الزمني الأولي (7A الشكل). عادة، عدداوينظر للفاجات على سطح الخلية (اصابة يفترض تلك الخلايا) بينما unadsorbed فاجات أخرى، كما هو مبين في الشكل 7B (اللوحة اليمنى). نتائج مميزة العدوى يصبح مع مرور الوقت. يشار دورة التحللي من إنتاج الخلايا الجديدة من فاجات (أخضر، الشكل 7C)، يليه تحلل الخلايا (خلايا انفجرت مع فاجات الأخضر المفرج عنهم، الشكل 7D). يشار استذابة من إنتاج mCherry من المروج RE P (الأحمر، الشكل 7C) واستئناف نمو الخلية والانقسام (الأحمر والشكل 7D).
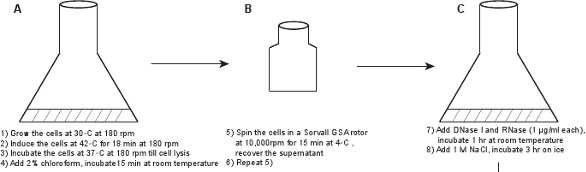
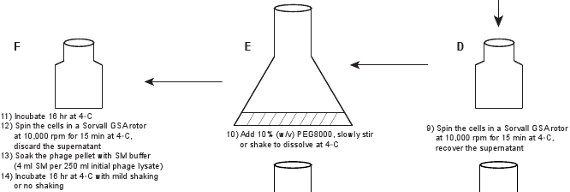
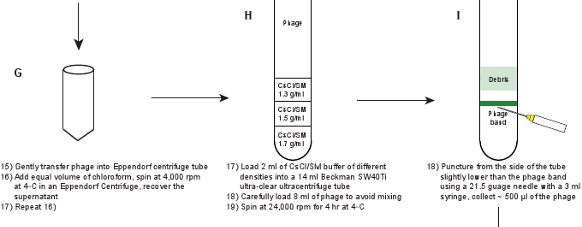
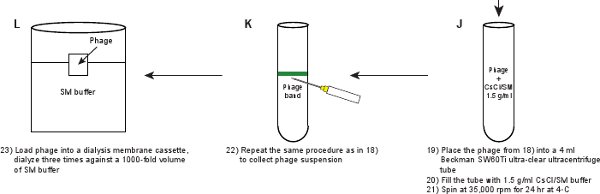
الشكل 1. مخطط التدفق واصفا إنشاء فاجات الفلورسنت. يتم الحصول أولا المحللة بالعاثية الخام عن طريق حفز على مستذيب من بالعاثية GPD-EYFP، معربا عن إيواء والبرية البلازميد نوع GPD البروتين (لوحات AB). يتم تنقيته من خلال بالعاثية سلسلة من الخطوات (لوحات CL).
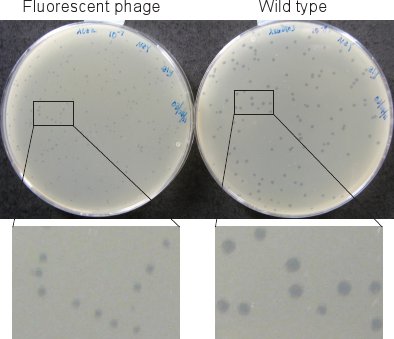
الشكل 2. ويحات بالعاثية. لويحات من بالعاثية الفلورسنت (من اليسار) هي أصغر من تلك التي من نوع البرية (يمين) بعد احتضان لمدة 12 ساعة لوحات في 37 ° C.
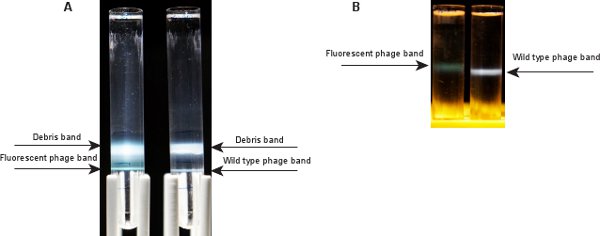
الشكل 3. العصابات بالعاثية بعد تنبيذ فائق. A) اثنين من عصابات واضحة بعد تنبيذ فائق التدرج في خطوة CSCL. رأس واحد يتوافق مع الحطام الخلية وcapsids بالعاثية فارغة، والفرقة أسفل يحتوي على بالعاثية المطلوب. اليسار: بالعاثية الفلورسنت، والحق: نوع B البرية ) A الفرقة بالعاثية واحد مرئيا بعد تنبيذ فائق التدرج في التوازن CSCL. الفرقة بالعاثية الفلورسنت (من اليسار) هو مخضر، مقارنة الفرقة مزرق للبالعاثية نوع البرية (يمين).
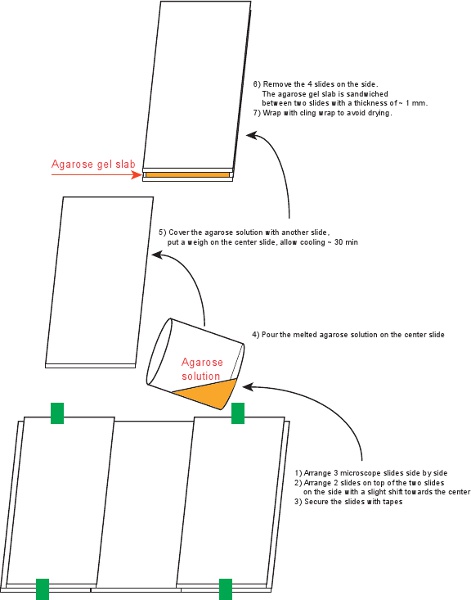
الشكل 4. الإجراء إعداد ألواح هلام الاغاروز.
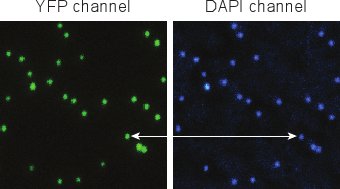
الشكل 5. الصور نيون من فاجات بعد تلطيخ دابي. فاجات الفردية يمكن تمييزها بسهولة، وYFP ودابي يشير شارك في توطين بشكل جيد للغاية.
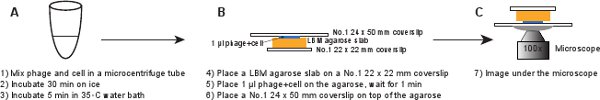
الشكل 6. وصف تخطيطي للعدوى بالعاثية والإعداد التصوير. انقر هنا لعرض النسخة الكاملة الحجم من هذه الصورة.
جوري 7 "SRC =" / files/ftp_upload/3363/3363fig7.jpg "/>
الشكل 7. الصور النمطية من فيلم الوقت الفاصل بين الإصابة بالعاثية. المعروضة هي التخلص النقيض من ذلك، YFP وقنوات mCherry، وكذلك تراكب من القنوات الثلاث. (A) YFP قناة الصور من الإطار الزمني الأولي. اليسار، ومجموع الصور في مختلف YFP Z-المواقف. الصور الثلاث الحق عبارة عن صور مختلفة في عينة YFP Z-المواقف، الموافق مناطق مختلفة من سطح الخلية. (B)، (C) و (D). الصور مضافين (يسار) من التباين المرحلة (المتوسطة اليسار)، YFP (وسط يمين) وmCherry (يمين) في قنوات اطر زمنية مختلفة (B) في ر وينظر = 0، خليتين، كل مصاب إصابة قبل بالعاثية واحد (البقع الخضراء)، وخلية واحدة بنسبة 3 فاجات. وكما لاحظ بعض فاجات unadsorbed. (C) في دقيقة ر 80 =، الخليتين المصابين فاجات واحد قد ذهب كل في المسار التحللي، كما تشيرد من إنتاج الخلايا الجديدة من فاجات (الخضراء). وقد ذهب الخلية المصابة بنسبة 3 فاجات في المسار مستذيب، كما يتبين من إنتاج mCherry من المروج PRE (الحمراء). (د) في 2 T = ساعة، وقد أدى مسار التحللي في تحلل الخلايا (خلية انفجرت)، في حين أن الخلية مستذيب وقد قسمت §.
§ لوحات من الزمن من الشكل 7 (C) و (D) وأعيد طبعه من الخلية، 141، Lanying تسنغ، صموئيل سكينر O.، تسونغ Chenghang، سيبي جان مايكل فايس، وايدو غولدنغ، اتخاذ القرار في المستوى التحت خلوية يحدد النتيجة من الجراثيم العدوى، 682-691، حقوق الطبع والنشر (2010)، بإذن من السيفير.
| توتر اسم | ذات الصلة الوراثي | المصدر / المرجع |
| سلالات بكتيرية | ||
| LE392 | تعشىF | جون هودكنسون وجامعة إلينوي |
| بالعاثية سلالات | ||
| λ LZ1 | GPD-EYFP، cI857 Sam7 D-eyfp ب :: kanR | تسنغ وآخرون .. 5 |
| λ LZ2 | GPD-الفسيفساء، نفس النمط الجيني LZ1 λ | تسنغ وآخرون .. 5 |
| البلازميدات | ||
| RE PP - mCherry | mCherry تحت سيطرة RE P، R أمبير | تسنغ وآخرون .. 5 |
| pPLate * D | GPD تحت سيطرة المروج λ أواخر أمبير R | تسنغ وآخرون .. 5 |
الجدول 1. سلالات بكتيرية،وفاجات البلازميدات المستخدمة في هذا العمل.
| ρ الكثافة (جم / مل) | CSCL (ز) | SM (ML) | معامل الإنكسار η |
| 1.30 | 39 | 86 | 1،3625 |
| 1.50 | 67 | 82 | 1،3815 |
| 1.70 | 95 | 75 | 1،3990 |
الجدول 3. حلول CSCL أعد العازلة SM (100 مل) لالتدرجات الخطوة.
Discussion
سلالات بكتيرية، وبالعاثية البلازميدات:
سلالة LE392 هو supF. تم اختيارها لقمع طفرة في الجينوم Sam7 بالعاثية (انظر الجدول 1 للاطلاع على التفاصيل). وهكذا، سوف يتسبب lysogens ليز والافراج عن الجسيمات في نهاية المطاف بالعاثية، وكذلك الخلايا المصابة التي اختارت المسار التحللي. تزرع الخلايا مستذيب في 30 ° C بسبب وجود درجة حرارة 857 CI الحساسة أليل في الجينوم بالعاثية. بعد تحريض الحرارة، وGPD-EYFP والبرية GPD نوع من شارك في أعربت جينوم LZ1 λ وpPlate البلازميد * D على التوالي. ونتيجة لذلك، قفيصة من LZ2 تم إنشاؤه حديثا λ بالعاثية يحتوي على خليط من GPD-EYFP والبروتينات GPD. هذه الفسيفساء بالعاثية مستقرة هيكليا والفلورسنت بما فيه الكفاية للسماح الكشف عن فاجات الفردية 5. RE PP - mCherry هو مراسل البلازميد المستخدمة للكشف عن اختيار pathwa مستذيبذ. يتم تنشيط RE P المروج من خلال CII إنشاء استذابة 1،11. وقد اشتق mCherry 5 من PE-GFP 11 من استبدال GFP مع mCherry 12 - PP RE. لمزيد من التفاصيل انظر عملنا في وقت سابق 5.
معلمات نمو الحالة:
خلال الحث مستذيب (القسم 1)، الهز الخفيف عند 180 دورة في الدقيقة يعطي غلة جيدة الفيروس 13. استخدام الجلوكوز في المتوسط النمو كما يجب تجنب المنتجات يولد ايض الجلوكوز الأيض الحمضية، والجزيئات غير مستقرة ناضجة لامدا في الرقم الهيدروجيني الحمضية 13. وتهدف إضافة MgSO 4 في استقرار بالعاثية قفيصة 3. لفاجات تحمل البرية اخ نوع (بي بدلا من 857)، ويمكن أن يتسبب في مستذيب باستخدام C DNA المضرة ميتوميسين كيل 3. في الخطوة 1.3، والحضانة عند 37 ° C ينبغي عادة لا تتجاوز 90 دقيقة. فمن usef UL للتحقق من كثافة الخلايا بواسطة OD 600 كل 30 دقيقة. لالمحللة جيدة، OD 600 ينخفض إلى نحو 0.2 أو أقل، وOD المتبقية 600 هو نتيجة للحطام الخلايا. قد تفرخ طويل جدا يؤدي إلى انخفاض العائد بالعاثية منذ بالعاثية تم إنشاؤه حديثا قد تبدأ في ضخ عينات من الحمض النووي في الخلية الحطام. للحصول على الفرقة بالعاثية مرئية (على الأقل 1 × 10 الجسيمات بالعاثية 11) في خطوات 2.11 و 2.13، وتنمو على الأقل 500 مل الثقافة في الخطوة 1.2. وتهدف إضافة مالتوس 0.2٪ في المتوسط في خطوات النمو 5.1 و 5.2 في التعبير حمل من لحم الضأن، ومستقبلات لامدا بالعاثية الامتزاز 3،14. ويهدف التخفيف 1000-أضعاف أضعاف بدلا من-100 في الخطوة 5.2 في خفض مستوى الخلفية mCherry من RE مراسل بي بي البلازميد - mCherry. في الخطوة 5.5 لحقن الحمض النووي مما اثار بالعاثية، 35 ° C يتم اختيار لتجنب تحريض على أليل حساسة للحرارة cI857.
بالعاثية تنقية:
jove_content "> يمكن استبدال الخطوات تنقية بالعاثية (2،1 خطوات من خلال 2.11) مع بروتوكولات أخرى تنقية 5، ولكن من خلال التدرج تنبيذ فائق النهائي التوازن CSCL (2.12 و خطوات 2.13) أمر لا مفر منه. دوارات الدلو المتأرجح هناك حاجة في خطوات 2.10 و 2.12 ل ضمان حادة العصابات بالعاثية مرئية. الحصول على الأسهم النقية بالعاثية يمكن أن تتخذ بسهولة تصل إلى أسبوع، ولذلك فمن الضروري التحقق من عيار بالعاثية على طول الطريق لتأكد من أي شيء يذهب على نحو خاطئ خلال خطوات وسيطة.بالعاثية يعالج:
خلال جميع الإجراءات تنقية في القسم 2، من المهم جدا للتعامل مع بالعاثية حلالة بلطف لتجنب قص ذيول بالعاثية من رؤساء بالعاثية. خلال العدوى خلية في القسم 5 (على سبيل المثال، من خلال خطوات 5،5 5.7)، كما أنها ضرورية لتجنب القص من الجسيمات بالعاثية من الخلية المصابة. ملاحظة أنه إذا تم المنفصمة فإن الفيروس من الخلية المصابة بعد حقن الحمض النووي، والنتيجة هي "الظلام" عدوى، أي فيوسيراعى في نتائج التجربة في fection لكن بالعاثية اصابة لن. للحد من هذه المشاكل، ونحن نستخدم تلميح ماصة واسعة كلما التعامل مع فاجات أو الخليط بالعاثية / خلية.
دابي الاختبار:
تلطيخ السهم بالعاثية مع دابي (القسم 4) هو وسيلة سريعة وفعالة للتحقق من نقاء الأسهم بالعاثية. ويمكن أيضا أن تستخدم لاختبار إمكانية تدهور مخزون بالعاثية القائمة مع مرور الوقت. لسهم نقي، ينبغي أن يشترك في توطين إشارات YFP ودابي تحت المجهر مضان تكون قريبة من 100٪. نلاحظ عادة أن أقل من 1٪ من البقع YFP لا تحتوي على دابي (تمثل capsids دون الجينوم الفيروسي)، مما يدل على أن هذه الجسيمات لم حزم بنجاح الحمض النووي الفيروسي أو قد حقن الحمض النووي بالفعل في أماكن أخرى. أقل من 1٪ من البقع دابي لا تحتوي على YFP (الموافق غير الفلورسنت فاجات). إذا لم تكن هذه هي الحالة، من خلال خطوات 2،12 2،14 حاجة للتكرار في سrder لتنقية مرة أخرى. فيما يتعلق المعلمات والتصوير، والإعداد المجهر في الخطوة 4.3 ليست حرجة كما هو الحال في المادة 5 لأنه لا يلزم على المدى الطويل الخلية الحية التصوير هنا. ومع ذلك، والحفاظ على إعدادات الفحص المجهري نفسه كما في القسم 5 من المفيد إذا كان أحد يرغب لمعايرة كثافة مضان من الجسيمات بالعاثية واحد. إذا كان لوح PBS-الاغاروز ليست نظيفة جدا، أو الكثير من يستخدم صبغة دابي، قد يكون محاطا بعض المواقع دابي الموافق DNA بالعاثية مع "هالة". إذا تم استخدام القليل جدا دابي صبغة، قد الإشارة من قناة دابي تكون ضعيفة جدا.
المجهر النظام:
للتصوير في القسم 6، ونحن نستخدم المجهر تجاري epifluorescence مقلوب (الكسوف TE2000-E، نيكون) مع هدف 100X (خطة فلوو، والفتحة العددية 1.40 في الغمر النفط) ومجموعات التصفية القياسية (نيكون). مصدر الضوء مضان هو مصباح القوس مع السيطرة على شدة الضوء. الميزات التالية يتم التحكم الكمبيوتر: X، Y Z وبوsition؛ حقل مشرق ومصاريع مضان، واختيار مرشح مضان. مطلوب ميزة التركيز التلقائي. وإلا، قد تنجرف بسهولة التركيز بعيدا خلال الوقت الفاصل بين الفيلم (عادة 4 ساعات طويلة). القدرة على الحصول على وظائف متعددة (س، ص) في كل نقطة زمنية مفيد، لأنه يتيح لمتابعة الأحداث العدوى متعددة في نفس الوقت. نكتسب عادة مناصب المرحلة 8 في كل فيلم، ومتابعة للأحداث العدوى 100. الكاميرا التي نستخدمها هي 512x512 تبريد CCD مع 16X16 بيكسل ميكرومتر مع مجموعة ديناميكية من 16 بت (Cascade512، Photometrics). يتم تنفيذ برامج اقتناء باستخدام MetaMorph (الأجهزة الجزيئية). يجب وضع المجهر في غرفة التحكم في درجة حرارته؛ بدلا من ذلك، ينبغي أن تكون محاطة المرحلة المجهر من قبل غرفة التحكم في درجة حرارته.
الصورة اكتساب:
لحية خلايا التصوير، فمن الأهمية بمكان لتجنب التعرض غير الضروري للعينة، والتي يمكن أن تؤدي إلى تبيض وبوtotoxicity. ولذلك، فمن الأفضل لوصف أول نظام لإيجاد التعرض للضوء الأمثل الذي يسمح للكشف مضان في حين لا تؤدي إلى نمو الخلايا المفرط أو تبيض معرقلة. للحصول على صورة جيدة مضان، ولعب مع شدة الضوء مثيرة، وزيادة زمن التعرض الكاميرا. في خطوات 6،2-6،3، يتم اختيار الإطار الزمني 10 دقيقة لغرض التقليل من التعرض للضوء. في كل إطار، لا بد من واحد فقط في التركيز على عكس صورة المرحلة (للاعتراف الخلية) وقنوات الفلورسنت (لتحديد مصير الخلية). في نقطة أول مرة، يطلب ومع ذلك، متعددة Z-موقف الصور من خلال برنامج قناة YFP لالتقاط جميع فاجات اصابة على سطح الخلية. قد زمن التعرض YFP في الإطار الأولي بحاجة أيضا إلى أن تكون أعلى من تلك المستخدمة للفيلم في الوقت الفاصل بين الأطر وقت لاحق.
تحليل الصور:
بعناية شديدة الاعتماد الجسيمات بالعاثية حول سطح الخلية في الخطوة 7.1. كماالمشار إليها أعلاه، ونحن نأخذ سلسلة من المداخن Z-من خلال قناة YFP في الخطوة 6.2. ولكن هذا قد لا تزال تترك بعض الجزيئات بالعاثية الفلورسنت خارج التركيز، التي تتحدى العد. يتم قياس طول الخلية في الإطار الزمني الأولي باستخدام برنامج Metamorph. ويمكن أيضا طول الخلية تقاس يماغيج أو أدوات البرمجيات الأخرى. بالإضافة إلى ذلك، يمكن للبرنامج الآلي المنزل مطلب بني أن تكون مفيدة جدا في الحصول على معلومات مثل تغير مضان مع مرور الوقت على طول الأنساب الخلية.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ونحن ممتنون لمايكل فايس وجان سيبي لتوجيهات بشأن إنشاء بالعاثية وتنقيتها. نشكر مايكل Elowitz لتوفير برنامج التعرف على الخلية، Schnitzcell. ويدعم عمل في المختبر غولدنغ من المنح المقدمة من المعاهد الوطنية للصحة (R01GM082837)، المؤسسة الوطنية للعلوم (082265، PFC: مركز للفيزياء الخلايا الحية)، ومؤسسة ولش (المنح Q-1759) وعلوم الإنسان الحدودي برنامج (RGY 70/2008).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | |
| الكلوروفورم | فيشر العلمية | C298-500 | |
| كلوريد الصوديوم | فيشر العلمية | S271-3 | |
| الدناز I | سيجما | D4527-10KU | |
| ريبونوكلياز | سيجما | R4642-10MG | |
| PEG8000 | فيشر العلمية | BP233-1 | |
| SM العازلة | Teknova | S0249 | |
| NZYM | Teknova | N2062 | |
| CSCL | سيجما | C3011-250G | |
| محقنة | بيكتون ديكنسون | 309585 | |
| إبرة | بيكتون ديكنسون | 305176 | |
| غسيل الكلى كاسيت | الحرارية العلمية | 66333 | |
| المجهر الشريحة | كورنينج | 2947-75x50 | |
| الاغاروز | فيشر العلمية | BP160-100 | |
| SW40Ti فائقة الوضوح أنبوب | بيكمان كولتر | 344060 | |
| SW60Ti فائقة الوضوح أنبوب | بيكمان كولتر | 344062 | |
| SW40Ti الدوار | بيكمان كولتر | 331302 | |
| SW60Ti الدوار | بيكمان كولتر | 335649 | |
| إنكسار | فيشر العلمية | 13-947 | |
| Epifluorescence المجهر | نيكون | الكسوف TE2000-E |
الجدول 2. الكواشف والمعدات.
References
- Oppenheim, A. B., Kobiler, O., Stavans, J., Court, D. L., Adhya, S. Switches in bacteriophage lambda development. Annu. Rev. Genet. 39, 409-429 (2005).
- Ptashne, M. . A genetic switch : phage lambda revisited. , (2004).
- Hendrix, R. W. . Lambda II. , (1983).
- Hershey, A. D. . The Bacteriophage lambda. , (1971).
- Zeng, L. Decision making at a subcellular level determines the outcome of bacteriophage infection. Cell. 141, 682-691 (2010).
- Edgar, R. Bacteriophage infection is targeted to cellular poles. Mol. Microbiol. , (2008).
- Ausubel, F. M. . Current protocols in molecular biology. , (1994).
- Sambrook, J., Russell, D. W. . Molecular cloning : a laboratory manual. , (2001).
- Fasman, G. D. . Practical handbook of biochemistry and molecular biology. , (1989).
- Kaiser, A. D. On the internal structure of bacteriophage lambda. J. Gen. Physiol. 49, 171-178 (1966).
- Kobiler, O. Quantitative kinetic analysis of the bacteriophage lambda genetic network. Proc Natl Acad Sci. 102, 4470-4475 (2005).
- Shaner, N. C. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22, 1567-1572 (2004).
- Zeng, L. . Personal communication with M. Feiss. , .
- Schwartz, M. The adsorption of coliphage lambda to its host: effect of variations in the surface density of receptor and in phage-receptor affinity. J. Mol. Biol. 103, 521-536 (1976).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved