Method Article
Hücre-kaderi ardından
Bu Makalede
Özet
Bu makale bakteriyofaj lambda, enfeksiyon bir floresan etiketli versiyonu hazırlamak için prosedürü açıklar E. coli Bakteriler, mikroskop altında enfeksiyon sonuçlanması sonrasında ve enfeksiyon sonuçlarının analizi.
Özet
Bakteriyofaj (faj) lambda ve bakteri E. oluşan sistemi coli uzun hücre-kader tayin 1,2 için bir paradigma olarak hizmet vermiştir. Faj bir dizi hücrenin eşzamanlı enfeksiyondan sonra iki yoldan biri seçilmiştir: litik (öldürücü) veya lizogenik (hareketsiz) 3,4. Yakın zamanda floresan bireysel fajlar etiketlenmesine yönelik bir yöntem geliştirilmiştir ve bireysel fajlar ve hücreler 5 seviyesinde, mikroskop altında gerçek-zamanlı olarak sonrası enfeksiyon karar incelemek için mümkün. Burada, bizim daha önceki çalışmalar 5 de tarif enfeksiyon deneyleri yapmak için tam bir prosedür açıklanmaktadır. Bu, floresan faj oluşturulması, hücrelerin enfeksiyonu, mikroskop altında görüntü ve veri analizi içerir. Floresan faj kapsid GPD protein "melez", eş-ifade yabani tip ve YFP-füzyon versiyonları olduğunu. Ham bir faj lisatı birinci GPD-EYFP (ENH bir lysogen indüklenmesi ile elde edilirBir plazmid ifade vahşi tip GPD barındıran, Sarı floresan proteini) faj anced. Saflaştırma aşamaları uygulanarak, bir dizi daha sonra mikroskop altında DAPI-etiketleme ve görüntüleme takip edilerek yapılır. Bu tekdüzelik, DNA'nın paketleme verimliliği, floresans sinyali ve faj stokunun yapısal stabilite doğrulamak amacıyla yapılır. Bakteriler için faj ilk adsorpsiyon ° C viral DNA enjeksiyon 6 tetiklemek için 35 kısa bir inkübasyon sonra, ardından buz üzerinde gerçekleştirilir. Faj / bakteri karışımı daha sonra, ince bir besleyici agar plaka, bir lamel ile kaplanmış ve bir mikroskop altında Epifloresans görüntülü yüzeyine taşınır. Enfeksiyon sonrası işlem 10 dakika aralıklarla, 4 saat boyunca takip edilir. Multiple stage pozisyonları ~ 100 hücre enfeksiyonları tek bir denemede izlenebilmektedir böyle izlenir. Her pozisyon ve zaman noktada, görüntüleri faz-kontrast kırmızı ve yeşil floresan kanalları elde edilir. Faz-kontrast görüntünün otomatik cel daha sonra kullanılırfloresan kanal enfeksiyonu sonucu karakterize etmek için kullanılan iken l tanıma: yeniden hücre büyümesi ve bölünmesi takip lysogeny faktörlerin hücre parçalama veya ifade (kırmızı), ardından yeni floresan fajlar (yeşil) üretimi. Edinilen time-lapse film manuel ve otomatik yöntemleri bir arada kullanarak işlenir. Her enfeksiyon olayı (fajlar bulaştırmaktan örneğin sayısı ve konumları) yanı sıra enfeksiyon sonucu (lizis / lysogeny) için enfeksiyon parametrelerinin belirlenmesinde Veri analizi sonuçları. İstenirse, ek parametrelerin elde edilebilir.
Protokol
1. Bir ham faj lizat Yaratılış (Şekil 1)
- 50 ml'lik bir şişe içinde, bir yeni LE392 koloni (λ LZ1) [pPLate * D] (ayrıntılar için bakınız Tablo 1) 10 ug / ml Kanamisin ve 100 ug / ml ampisilin ile desteklenmiş LB ortamı 7, 6 ml içine inoküle. ° C hafif titreme (180 rpm) 30 gecede büyümek.
- LBM (LB 10 mM MgSO4 ile takviye) içine kültür 1:100 seyreltin ve hafif titreme (180 rpm) ile 30 ° C'de büyür. Faj verim optimize etmek için, kültür hacmi artık şişenin hacim kapasitesi onda birine göre olduğundan emin olun. Biz genellikle 2 litre veya 2.5 litre kapasiteli iki matara hazırlamak ve her şişede 250 ml LBM ortama 2.5 ml gecede kültürü ekleyin.
- Hücre yoğunluğu 600 OD ulaşırsa ≈ 0.6 (~ 2,5-3 saat), sonra incubat hafif sallama (180 rpm) ile 18 dakika için bir 42 ° C su banyosu çalkalayıcı ile kültür hareket ettirerek lysogen indükler ve37 E ° C lizis kadar hafif titreme (180 rpm) ile görülebilir (kültür ~ 60, netleşir - 90 dakika).
- Kültürü% 2 kloroform ekleme, oda sıcaklığında 15 dakika inkübe edilir ve daha sonra karıştırmak için elle sallayın, ve. Dikkat: kloroform işlemek için eldiven giyin ve solumayınız.
- Iki adet 250 ml'lik bir santrifüj şişesi içine aktarın kültür, 4 ° C'de 15 dakika boyunca 10,000 rpm'de bir Sorvall GSA rotoru içinde kültür santrifüj Faj parçacıkları içeren süpernatant Kurtar ve enkaz pelet atın. Görünür enkaz kurtulmak için emin olmak için ikinci bir santrifüj uygulayın.
- Faj konsantrasyonunu ölçmek için bir standart faj titrasyon protokolü 8 kullanın. Faj titresi olmalıdır ~ 5-10 x 10 9 pfu / ml. Böyle çünkü floresan faj genotipinde SAM7 mutasyon göstergesi suşu olarak LE392 olarak supF suşu kullanın ve (Fi büyük plaklar elde etmek zengin NZYM ile yapılan top agar ve agar plakları kullanmayınŞayet 2).
2. Faj arıtma (Şekil 1)
- Parçalanan bakteriler kurtulmuş nükleik asitleri sindirimi için lizat için DNaz I ve RNaz (1 ug / ml her biri) eklenir, büyük (örneğin 2-litre) bir şişeye lizat dökün ve oda sıcaklığında 1 saat inkübe edilir.
- Lizat 1M NaCl ekle, 250 ml santrifüj şişelere lizat aktarın ve buz üzerinde 3 saat inkübe edin. 4 'de 15 dakika için 10,000 rpm'de bir Sorvall GSA içinde lizat Santrifüj ° C. Süpernatant kurtarın. Faj titresi olan ham lizat, bu benzer olmalıdır ~ 5-10 x 10 9 pfu / ml. NaCl ilave bakteri artıklardan faj partiküllerinin ayrışma teşvik eder ve PEG 8 tarafından faj partiküllerinin etkili çökeltme için gereklidir.
- , 2-litrelik şişeye, örneğin bir geniş şişenin içine dökün lizat lizat 10% (w / v) PEG8000 eklemek, yavaş yavaş karıştırmak ya da oda sıcaklığında PEG8000 çözünmesi için sallayın. 250 ml yüzde içine aktarın lizatrifuge şişeler ve sonra 4 ° C de (~ 16 saat) bir gece inkübe 4 'de 15 dakika için 10,000 rpm'de bir Sorvall GSA rotoru içinde lizat Santrifüj ° C. Süpernatantı atın.
- Faj SM tamponu (başlangıç faj lizat 250 ml başına 4 ml SM tamponu) pelet (faj parçacıkları PEG8000 ile çöktürülerek) bekletin. Çok hafif sallama veya 4 ° C'de 16 saat süreyle çalkalanarak inkübe
- Yavaşça 50 ml Eppendorf santrifüj tüpüne lizat (faj parçacıkları ile SM tampon) çıkarıp, sonra 0.5 ile geriye kalan pelet yıkayın - SM tampon 1 ml.
- Lizat üzere kloroform eşit hacmi ekleyin. Hafifçe birkaç kez eviren yukarı ve aşağı tarafından kloroform ile lizat karıştırın. 15, bir Eppendorf 5804R içinde 4 ° C'de bir dakika ya da benzer bir masaüstü santrifüj için 4000 rpm'de santrifüj yapılır.
- Net bir lizat almak için Adım 2.6 tekrarlayın. Faj titresi ~ 1-2 olmalıdır x 10 11 pfu / ml.
- 1.3 g / ml, 1 üç farklı yoğunluklardaki (ρ) ile SM / CsCl çözümleri hazırlayın.5 G / ml ve 1.7 g / ml. Daha doğru bir yoğunluk okuma almak için kırılma indisi (η) ölçün. Yoğunluk dönüştürme 9 ρ olup = 10,8601 η - 25 ° C 'de 13,4974 Ayrıntılar için Tablo 3'e bakınız.
- 14 ml ultra net Beckman 40Ti ultrasantrifüjdeki tüpüne çözümü yüklemek için uzun bir iğne ile bir şırınga kullanın. Karıştırma önlemek için, daha iyi bir yoğunluk gradyan oluşturmak üzere çözelti kullanılması gerekir (başka bir altında artan yoğunluk yani katman çözeltileri), yani, yavaşça 1.3 g / ml, 1.5 mertebesinde SM / CsCl çözeltilerin 2 ml yük underlaying g / ml ve 1.7 g / tüpün altına bir 3 ml'lik şırınga ile iğne sokarak ml.
- Yavaşça 14 ml ultrasantrifüjdeki tüpün üst kısmından ile kaplanacağı faj lisatı 8 ml yük. Bir denge tüpü hazırlayın. 4 de, 4 saat boyunca 24,000 rpm'de bir Beckman SW40Ti rotor içinde Santrifüj ° C.
- Yavaşça af kullanarak bir karanlık oda içinde tüp dışarı çekmek ve bir siyah bir arka plana karşı tüpün üst kısmından aydınlatmaklashlight. Faj bant 1.3 g / ml ve 1.5 g / ml SM / CsCl katmanları (Şekil 3A) arasındaki arabirim yerde açıkça görünür olmalıdır. Hafif bir 3 ml'lik şırınga ile bir 21.5 gauge iğne ile bant altında tüpün yan yoluyla delinme. Yavaşça faj süspansiyonunun ~ 500 ul toplamak. Faj titresi ~ 5-10 x 10 11 pfu / ml olmalıdır.
- 4 ml ultra net Beckman ultrasantrifüjdeki SW60Ti rotor tüp içine faj süspansiyonunun yerleştirin. 1.5 g / ml SM / CsCl çözeltisi ile tüp doldurun. Bir denge tüpü hazırlayın. 4 de 24 saat boyunca 35,000 rpm'de bir Beckman SW60Ti rotor içinde Santrifüj ° C.
- Görünür bant itibaren faj toplamak için Adım 2.11 aynı işlemi tekrarlayın. Şekil 3B 'de gösterildiği gibi grup olarak görülmelidir.
- Bir diyaliz membran kaset (Tablo 2) içine faj süspansiyonunun yükleyin ve 3 saat, 3 saat ve overnig süreleri için 4 de SM tampon bir 1000 kat hacim ° C'ye karşı üç kez dialyzeht (~ 16 saat). Diyaliz amacı faj süspansiyon CsCl mevcut kurtulmak için. Nihai faj titresi 5-10 x 10 ~ 11 pfu / ml olmalıdır.
3. Biri agaroz jel levha (Şekil 4) hazırlayın
- % 70 etanol ile 6 mikroskop slaytlar (75 x 50 mm, 1 mm kalınlığında) temizleyin.
- 5 slaytlar Düzenleme ve Şekil 4'te gösterildiği gibi şerit ile sabitleyin.
- Sarılmak sarma (% 1.5 agaroz veren) ile kaplı küçük bir behere 6 ml ortama 0,09 gr agaroz karıştırın. Çözüm açık olana kadar sıcak bir plaka üzerinde ısıtın.
- Güvenli Slaytlarınıza agaroz çözeltisi dökün.
- Dikkatle hava kabarcıkları kaçınarak, üstüne son slayt yerleştirin. Yer üstünde ağırlık ve ~ 30 dakika için soğumaya bırakın.
- Tarafta 4 slaytlar çıkarın ve sarılmak sargı ile üst ve alt slaytlar ile birlikte levha sarılır. Levha 3 güne kadar 4 ° C 'de muhafaza edilebilir.
4. Saflaştırılmış faj stok Test
- Hazırlamakyukarıda tarif edildiği gibi PBS-agaroz jel levha (Bölüm 3).
- DAPI ile saflaştınldı faj Leke. 10 faj ul (1 x 10 ~ 10 pfu / ml) 10 ug / 4 'de 30 dakika inkübe edilir ml DAPI (5 ug / ml' lik nihai konsantrasyon DAPI), 10 ul ° C'de ya da oda sıcaklığında 10 dak. Karıştırılır
- Bir No.1 24 önceden hazırlanmış PBS-agaroz kütüğün x 50 mm lamel, kaplama küçük bir parça (yaklaşık 10 x 10 mm) ortasına faj / DAPI karışım il 1 ul. Agaroz slab küçük bir parça sandviç jel kaldırılır üzerine üst slayttan sonra bir jilet ile kesilir. YFP ve DAPI kanallardan Epifloresans mikroskop altında Görüntü örnek. Bireysel fajlar iki kanal içinde kırınım-sınırlı floresan "noktalar" (Şekil 5) olarak görünür olmalıdır. Adım aşağıda 6.2 'de anlatılanla aynı mikroskop ve kamera kurulumları kullanın.
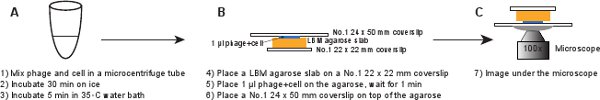
5. Enfeksiyon (Şekil 6)
- 14 ml Falcon tüp, LE392 taze bir kolonisi inoküle [pP RE-MCHerry] (ayrıntılar için bkz Tablo 1) 100 ug / ml ampisilin, 10 mM MgSO4 ve% 0.2 maltoz ile desteklenmiş LB ortamı içine 2 ml. Orta derecede sarsıntı (265 rpm) ile 37 ° C 'de gece boyunca büyütün.
- LBMM (LB 10 mM MgSO4 ve% 0.2 maltoz ile desteklenmiş) içine kültür 1:1000 ile seyreltilir, yani, 50 ml'lik bir balon içinde 5 ml LBMM ortam içine 5 ul bir gecelik kültürü ekleyin. ° C orta sallama (265 rpm) ile 37 OD 600 ≈ 0,4 büyütün.
- Bölüm 3'te yukarıda tarif edildiği gibi bir LBM-agaroz jel levha hazırlamak için LBM ortamı kullanın.
- Oda sıcaklığında 2 dakika için bir tezgah üstü mikrosantrifüj içinde 2,000 g hücrelere 1 ml santrifüjleyin. Süpernatantı ve yavaşça OD 600 ve 20 ulaşmak için 20 ul buz LBMM içine hücreleri tekrar süspansiyon haline getirin.
- Saflaştırılmış faj stok işlem yaparken, geniş bir pipet kullanın veya ucu faj partiküllerinin 3 kesme önlemek için, daha geniş açılması için düzenli pipet ucu kesilir. Yavaşça Mix 0.1 arasında değişen bir ortalama faj-hücre oranına ulaşmak için faj saflaştırılmış 20 ul ile hücreler 20 ul - 5. Faj adsorpsiyon izin vermek için 30 dakika süreyle buz üzerinde inkübe ve daha sonra faj DNA enjeksiyon 6 tetiklemek için 5 dakika için bir 35 ° C su banyosu içinde inkübe edilir.
- Herhangi bir hücre agrega ayırmak için birkaç kez aşağı yukarı pipet ve. Yine fajlar kesme önlemek için geniş bir pipet kullanın. LBMM, 45 ul LBMM içine örneğin, 5 ul karışım içine karışım 1:10 seyreltin.
- Bir No.1 22 x 22 mm lamel LBM-agaroz döşeme (~ 10 x 10 mm) bir parça yerleştirin. Agaroz levha oda sıcaklığına ulaşmasını sağlamak için kullanımdan önce önceden hazırlanmış LBM-agaroz levha, en az 1 saat boyunca oda sıcaklığında yerleştirilmelidir. Sıra 1 agaroz levha üzerinde faj / ul hücre karışımı ile karışım agaroz levha içine absorbe etmek için izin vermek üzere, 1 dakika boyunca bekleyin. Yavaşça agaroz kütüğün üstünde No.1 24 x 50 mm lamel yerleştirin. Bu işlem, INF fajlar kesme önlemek içindirected hücre (Şekil 6).
6. Mikroskop altında hücre kaderinin ardından
- Mikroskop sahnede lamel dikkatlice monte edin. Görüntüleme için yüksek büyütmeli (örneğin 100x) nesnel (aşağıda Tartışma Mikroskop Sistemi bakın) kullanın.
- İlk zaman çerçevesi için ayarladığınız bir görüntü elde edin. Bu görüntü seti her enfekte faj ilk pozisyon numaraları ve karakterize etmek için kullanılır. 200 nm z-ekseni (dikey) aralıklarla bir dizi 15 görüntü al. YFP kanalıyla resmi. Buna ek olarak, faz-kontrast ve mCherry kanallar aracılığıyla, tek bir odak görüntü alır. (Aşağıda Tartışma Image Acquisition bakın) ağartma ve hücre hasarı en aza yeterli sinyal elde etmek için ışık şiddeti ve maruz kalma süresi optimize edin.
- Enfeksiyon sonrası hücre kaderinin bir time-lapse film edinin. Faz-kontrast, YFP ve mCherry Image örnekYaklaşık 4 saat süreyle 10 dk aralıklarla kanalları. Time-lapse film sırasında, ağartma ve fototoksisite yol açabilecek örnek gereksiz maruziyeti önlemek için, zaman noktasında kanal başına tek bir z-pozisyonu görüntü kullanabilirsiniz.
7. Görüntü analizi
- El fajlar ve ilk zaman dilimi içinde rekor faj konumu ve hücre uzunluğu sayısını saymak. Bu MetaMorph veya ImageJ gibi yazılımlar kullanılarak yapılabilir. Hücre kaderi (litik lysogenic veya bulaşmamış), lizis zamanı ve time-lapse film oynayarak istediğiniz diğer bilgileri kaydedin. Farklı hücre kaderi belirlemek için, aşağıdaki Temsilcisi Sonuçlar bölümünde Time-lapse film bkz.
- Yukarda anlatılan analizine ek olarak, daha nicel bilgiler (bireysel hücrelerin zamanla örneğin seviye fluoresans) otomatik bir hücre tanıma ve soy izleme algoritmaları kullanılarak elde edilebilir. Biz tr için bir ev inşa Matlab programını kullanınhücre bölümleme Schnitzcell Matlab kodu (Caltech'te Elowitz grubu tarafından yazılan) ile birlikte, hücre soyu ve floresans seviyelerini acing.
8. Temsilcisi sonuçları:
Faj Kaplama:
Floresan etiketli fajlar (Adım 1.6 ve Bölüm 2 olarak) plaklar wild tip (Şekil 2) göre anlamlı küçüktür. Bu nedenle plakalar için ° C inkübatör görünür olması için 37 yer alan plakaların en az 12 saat inkübe edilir.
Faj Ultrasantrifüj:
CsCl adım gradyanı (Adım 2.10) ile faj örnek Ultrasantrifügasyon sonra, iki grup (Şekil 3A) görünür olmalıdır. Üst bant, faj süspansiyonunun ve SM / CsCl 1.3 g / ml katmanı arasındaki arayüzde, hücre artıkları ve boş faj capsids içerir. Alt grup, SM / CsCl 1.3 g / ml ve 1.5 g / ml tabakaları arasındaki ara yüzeyde, faj grubudur. This band floresan faj λ LZ2 için yeşilimsi görünüyor. Vahşi tip faj λ IG2903 için bant 5 mavimsi görünür. Adım 2.12 CsCl denge degrade Ultrasantrifügasyon sonra, bir faj bant tüpü (Şekil 3B) orta kısmında görünür olmalıdır. Floresan faj λ LZ2 GPD-EYFP ve GPD capsids, protein-DNA ile oranının bir karışımı içerdiğinden yabani tip göre daha yüksektir. Bu nedenle, floresan faj λ LZ2 bir grup vahşi tip λ IG290310 göre (tüp içinde daha yüksek bir konumda olduğu görülmektedir) biraz daha hafiftir.
DAPI Boyama:
Şekil 5 DAPI (Bölüm 4) ile faj etiketleme sonrası elde edilen tipik görüntüleri gösterir. Başarılı bir şekilde saflaştırılmış faj YFP ve DAPI sinyalleri% 100'e yakın yazışma olmalıdır. Biz genellikle gözlemlemek YFP nokta% 1'den daha azs DAPI (viral genom olmadan capsids temsil eder) içermez. DAPI lekelerin% 1'den azı YFP (floresan olmayan faj karşılık gelen) 5 içermez.
Time-lapse film:
Litik hücreleri hücre lizis ardından hücre içinde YFP floresans (yeşil kanal), birikimi ile tanınır. Lysogenic hücreleri hücre ve normal hücre büyümesi ve bölünmesi sürdürülmesi içerisinde düzgün mCherry floresans (kırmızı) birikimi ile tanınır. Bulaşmamış hücreleri (veya enfeksiyon başarısız hücreleri) Yukarıdaki fenotipleri herhangi görüntülemez ve büyümek ve normalde böleceğiz. Şekil 7 faz-kontrast birkaç görüntü setleri gösterir, YFP ve mCherry kanalları ve bunların karşılık gelen overlaid görüntüleri Tipik bir time-lapse film (Bölüm 6) üç kanal,. Bireysel fajlar (yeşil noktalar) başlangıç zaman çerçevesi (Şekil 7A) de açıkça görülebilir. Tipik olarak, bir numaradiğer faj unadsorbed ise bir faj olarak Şekil 7B (sol panel) de gösterildiği gibi, hücre yüzeyi (muhtemelen bu hücreleri enfekte) görülür. Enfeksiyon sonucu zamanla ayırt olur. Litik döngü hücre parçalama (serbest yeşil fajlarla patladı hücreler, Şekil 7D) ardından yeni faj intrasellüler üretimi (yeşil, Şekil 7C) ile gösterilir. Lysogeny P RE organizatörü (kırmızı, Şekil 7C) ve hücre büyümesi ve bölünmesi (kırmızı, Şekil 7D) sürdürülmesi gelen mCherry üretimi ile gösterilir.
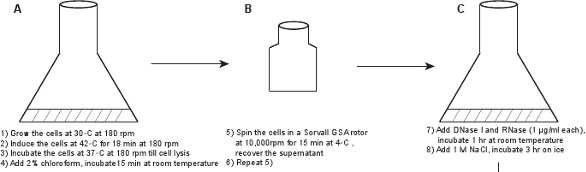
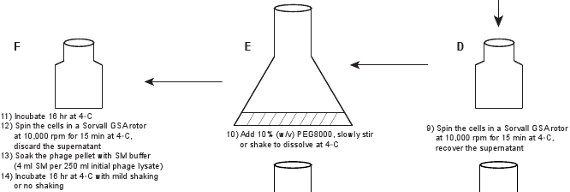
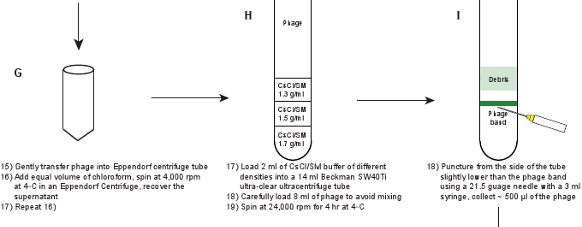
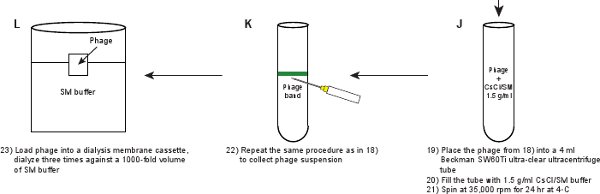
Şekil 1. Akış şeması. Ham bir faj lisatı önce ifade eden bir plasmidin yabani tip protein GPD (paneller AB) barındıran, GPD-EYFP faj bir lysogen indüklenmesi ile elde edilir. Faj adımlar (paneller CL) bir dizi saflaştırılır.
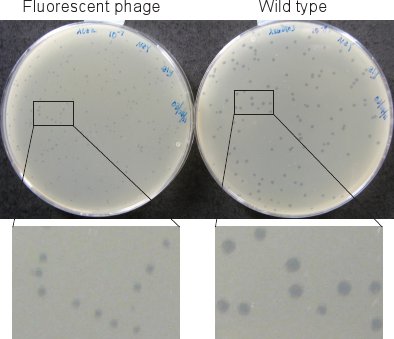
Şekil 2. Faj plaklar. Floresan faj Plaketler (sol) 37 az 12 saat boyunca plakalar inkübe sonra vahşi tip (sağda) daha küçüktür ° C.
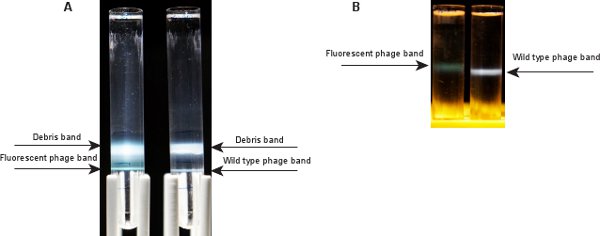
Şekil 3. Faj bantları Ultrasantrifügasyon sonra. A) İki bantları CsCl adım degrade Ultrasantrifügasyon sonra görülebilir. Üst bir hücre artıkları ve boş faj capsids karşılık; alt bandı istenilen faj içerir. Sol: floresan faj, sağ:. Vahşi tip B ) Tek bir faj bant CsCl denge degrade Ultrasantrifügasyon sonra görünür. Floresan faj bandı (solda) vahşi tip faj (sağda) için bir mavimsi grup karşılaştırıldığında, yeşilimsi.
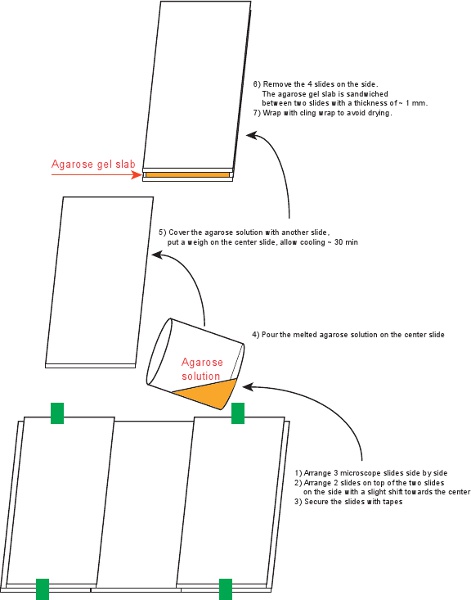
Şekil 4,. Agaroz jel plaka hazırlama işlemi.
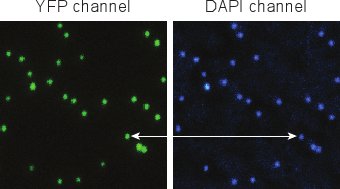
Şekil 5. DAPI boyama sonrası faj Floresan görüntüleri. Bireysel fajlar kolayca ayırt, ve YFP ve DAPI çok iyi ko-yerelleştirilmesine sinyalleri.
Şekil 6. Faj enfeksiyonu ve görüntüleme düzeneğinin açıklaması. Bu görüntünün tam boyutlu sürümünü görmek için buraya tıklayın.
Güre 7 "src =" / files/ftp_upload/3363/3363fig7.jpg "/>
Şekil 7. Faj enfeksiyonu time-lapse film tipik görüntüler. Gösterilen faz-kontrast olup, YFP ve mCherry kanalı, aynı zamanda, üç kanallı bir kaplaması. İlk zaman çerçevesi (A) YFP-kanal görüntü. Sol, farklı z-pozisyonlarında YFP görüntü toplamıdır. Üç sağ görüntüler farklı z pozisyonları, hücre yüzeyinde farklı alanlarda karşılık az örnek YFP görüntülerdir. (B), (C) ve (D) faz kontrast (orta-sol), farklı zaman dilimlerinde de YFP (orta sağda) ve mCherry (sağda) kanalları Overlaid görüntüleri (solda). (B) t = 0, iki hücre görülen, tek bir faj (yeşil noktalar), ve bir hücre tarafından enfekte her 3 faj tarafından enfekte. Ayrıca bazı unadsorbed fajlar gözlemlemekteyiz. (C) t = 80 dk anda, tek bir faj tarafından enfekte her iki hücre litik yolun içine gitmiş gibi göstermekYeni bir faj hücre içi üretimi (yeşil) tarafından d. 3 faj ile enfekte hücreler gibi PRE promotör (kırmızı) mCherry üretimi ile gösterilen lizogenik yolun, girmiştir. Lysogenic hücre § bölünmüş ederken (D) t = 2 saat anda, litik yolağı, hücre parçalama (hücre patladı) sonuçlandı.
Bir Subselüler Düzeyde Yapımı Şekil 7 § Sol panelleri (C) ve (D) Zeng, Samuel O. Skinner, chenghang Zong, Jean Sippy, Michael Feiss ve İdo Golding Lanying, Hücre, 141 yeniden basıldı vardır, Karar Sonuç belirler Bakteriyofaj Enfeksiyon, 682-691, Elsevier izni ile Copyright (2010),.
| Adı Gerinim | İlgili genotip | Kaynak / Referans |
| Bakteriyel suşlar | ||
| LE392 | yudumlamakF | John Cronan, University of Illinois |
| Faj suşları | ||
| λ LZ1 | GPD-EYFP, cI857 SAM7 D-eyfp b :: kanR | Ve ark. 5 Zeng |
| λ LZ2 | λ LZ1 olarak GPD-mozaik, aynı genotip | Ve ark. 5 Zeng |
| Plazmidler | ||
| pP RE - mCherry | P RE kontrolü altında mCherry, amp R | Ve ark. 5 Zeng |
| pPLate * D | λ geç promotör kontrolü altında GPD, amp R | Ve ark. 5 Zeng |
Tablo 1. Bakteriyel suşlar,Bu çalışmada kullanılan faj ve plazmid.
| Yoğunluk ρ (g / ml) | CsCl (g) | SM (ml) | Kırılma İndisi η |
| 1.30 | 39 | 86 | 1.3625 |
| 1.50 | 67 | 82 | 1.3815 |
| 1.70 | 95 | 75 | 1.3990 |
Tablo 3. CsCl çözüm adım gradyanları için SM tampon maddesi (100 mi) içinde hazırlanmıştır.
Tartışmalar
Bakteriyel Suşlarının, Faj ve Plazmid:
Gerinim LE392 supF olduğunu. O (ayrıntılar için bakınız Tablo 1) faj genomunda SAM7 mutasyon bastırmak için seçildi. Böylece indüklenmiş lysogens sonunda lyse ve faj parçacıkları serbest, litik yolu seçmiş gibi olacak infekte hücreleri olacak. Lizogenik hücreler 30 ° C'de yetiştirilen faj genomu içinde 857 aleli CI hassas sıcaklık varlığı nedeniyle. Isı indüksiyonu sonrasında, GPD-EYFP ve yabani tip GPD λ LZ1 genomunun ve plazmid pPlate * D sırasıyla ikinci eş olarak ifade edilmiştir. Sonuç olarak, yeni oluşturulan faj λ LZ2 bir kapsid GPD-EYFP ve GPD proteinlerin bir karışımını içerir. Bu mozaik faj bireysel fajlar 5 algılanmasına izin vermek için yapısal istikrarlı ve yeterli floresan olduğunu. pP RE - mCherry lysogenic pathwa seçimi algılamak için kullanılan plazmid bir muhabiry. Promotor P RE lysogeny 1,11 kurulması sırasında CII tarafından aktive edilir. pP RE - mCherry 5 mCherry 12 gfp değiştirerek pE-gfp 11 türetilmiştir. Daha fazla ayrıntı için bizim daha önceki çalışmaları 5'e bakınız.
Büyüme Durum Parametreleri:
Lysogen indüksiyonu sırasında (Bölüm 1), 180 rpm'de hafif sallayarak iyi bir virüs verim 13 verir. Glukoz metabolizması kaçınılmalıdır büyüme ortamında glukoz kullanımı asidik metabolik ürünler üretir, ve olgun lambda parçacıklar asidik pH 13 de kararsız. MgSO4 ilavesi faj kapsid 3 stabilize hedefleniyor. Vahşi tip CI (yerine CI 857) taşıyan faj için lysogen DNA'ya zarar veren ajan Mitomisin C 3 ile indüklenen olabilir. Adım 1.3 olarak, 37 inkübasyon ° C normal olarak 90 dakikayı geçmemelidir. Bu usef olduğunu her 30 dakikada bir OD 600 ile hücre yoğunluğu kontrol etmek ul. İyi bir lizat için OD 600 0.2 veya daha az düşer ve kalan OD 600 hücre artıkları bir sonucudur. Yeni oluşturulan faj hücre enkaz içine DNA enjekte etmeye başlayabilir yana çok uzun kuluçka düşük bir faj verim neden olabilir. Adımlar 2.11 ve 2.13 'de görünür bir faj bandı (en az 1 x 10 11 faj parçacıkları) elde etmek için, Adım 1.2' de en az 500 ml kültür büyür. Adımları 5.1 ve 5.2 büyüme ortamının içine% 0.2 maltoz ilavesi kuzu, faj lambda adsorpsiyon 3,14 için reseptör ekspresyonu inducing hedefleniyor. MCherry - yerine Adım 5.2 'de 100 kat 1000 kat seyreltme muhabiri plazmid pP RE mCherry plan düzeyinde azaltılması hedefleniyor. , 35 tetikleme faj DNA enjeksiyon için Basamak 5.5 'te ° C sıcaklığa duyarlı allel cI857 indüksiyon önlemek için tercih edilir.
Faj Arıtma:
jove_content "> faj saflaştırma adımları (2.11 aracılığıyla adımlar 2.1) diğer arıtma protokolü 5 ile değiştirilir, ama CsCl denge degrade (Adımlar 2.12 ve 2.13) vasıtasıyla nihai Ultrasantrifügasyon kaçınılmaz olabilir. Sallanan kova rotor Adımlar 2.10 ve 2.12 için gerekli saf faj stok elde kolayca bir hafta kadar sürebilir. keskin görünür faj bantları sağlamak, bu yüzden emin bir şey ara adımları sırasında yanlış gittiğinde yapmak için yol boyunca faj titresi kontrol edilmesi gereklidir.Faj Elleçleme:
Bölüm 2'de tüm saflaştırma işlemleri sırasında, faj faj kafaları faj kuyrukları kesme önlemek için nazikçe lizat işlemek için kritik öneme sahiptir. Bölüm 5 (örn., 5.7 ile 5.5 adım) olarak hücre enfeksiyonu esnasında, bu da enfekte olmuş hücreden faj partiküllerinin makaslama önlemek için önemlidir. Faj DNA'sını enjekte edildikten sonra enfekte olmuş hücreden makaslanmış ise, sonuç bir "karanlık" enfeksiyon olduğunu unutmayın, içinde yaniInfeksiyon sonuç deneyinde gözlenen ancak bulaşmasını faj olmaz edilecektir. Faj veya faj / hücre karışımı işleme her tür sorunları en aza indirmek için, geniş bir pipet kullanın.
DAPI Test:
DAPI (Bölüm 4) ile faj stok Boyama faj stok saflığını kontrol etmek için hızlı ve etkili bir yöntemdir. Aynı zamanda, zaman içinde mevcut bir faj stokunun olası bozulması için test etmek için de kullanılabilir. Saf bir stok için, flöresanlı bir mikroskop altında YFP ve DAPI sinyallerinin eş-yerelleştirme% 100'e yakın olması gerekir. Biz genellikle YFP lekelerin% 1'den az bu parçacıkların başarılı viral DNA paketlemek olmadığını gösterir ya da başka bir yerde zaten onların DNA enjekte ettiği DAPI (viral genom olmadan capsids temsilen), içermez gözlemliyoruz. DAPI lekelerin% 1'den azı YFP (floresan olmayan faj karşılık) içermez. Bu durumda değilse, o da tekrar edilmesi 2.14 gerek yoluyla 2.12 StepsTekrar arındırmak için order. Hiçbir uzun vadeli yaşamak-hücre görüntüleme burada gerekli olduğundan görüntüleme parametreleri ile ilgili olarak, Adım 4.3 mikroskop kurulumu Bölüm 5 olarak önemli değildir. Istediği bir tek faj partikülünün floresans yoğunluğunu ayarlamak için Ancak, Bölüm 5 'de anlatılanla aynı mikroskopi ayarları tutma yararlıdır. PBS-agaroz levha çok temiz, veya DAPI boya kullanılan çok fazla değilse, faj DNA ile ilgili olarak bazı DAPI lekeler "halo" terimi ile çevrelenmiş olabilir. Çok az DAPI boya kullanılması durumunda, DAPI kanal sinyali çok zayıf olabilir.
Mikroskop Sistemi:
Bölüm 6'da görüntüleme için, biz bir 100x objektif (Plan Fluo, sayısal açıklık 1.40, immersiyon yağı) ve standart filtre setleri (Nikon) ile ticari bir ters Epifloresans mikroskobu (Eclipse TE2000-E, Nikon) kullanın. Floresan ışık kaynağının ışık yoğunluğunun kontrolü ile Arc lambadır. X, y ve z po: Aşağıdaki özellikler bilgisayar kontrollü olaraknoktası pozisyonu; parlak alan ve floresans panjurlar ve floresan filtre seçimi. Bir otomatik odaklama özelliği gereklidir. Aksi takdirde, odak kolayca time-lapse film (normalde 4 saat uzunluğunda) boyunca sürüklenip olabilir. Paralel birden fazla enfeksiyon etkinlikleri takip sağlar her zaman noktasında (x, y) birden fazla pozisyon alma yeteneği, yararlıdır. Biz genellikle 100 enfeksiyonu olayları takip etmek, her filmde 8 aşamalı pozisyonları kazanır. Kullandığımız kamera 16 bit (Cascade512, Fotometrik) bir dinamik aralık ile 16x16 mikron piksel kamera ile bir soğutmalı 512x512 CCD olduğunu. Toplama MetaMorph yazılımı (Molecular Devices) kullanılarak gerçekleştirilir. Mikroskop sıcaklık kontrollü bir odaya yerleştirildi olmalıdır; alternatif olarak, mikroskop aşama bir ısı kontrollü bir boşluk ile çevrili olmalıdır.
Image Acquisition:
Canlı hücre görüntüleme için, ağartma ve pho yol açabilecek örnek gereksiz maruziyeti önlemek için kritik öneme sahiptirtotoxicity. Bu nedenle, ilk ağartma aşırı veya hücre büyümesini engelleyen neden olmasa da floresan tespiti için izin verir, optimum ışık pozlama bulmak için sisteminizi karakterize etmek en iyisidir. İyi bir floresan görüntü elde etmek için, heyecan verici ışık şiddeti, maruz kalma süresi ve kamera kazanç ile oynamak. Adımlar 6.2-6.3 olarak, çerçeve 10 dakika süre ışığa maruz kalma en aza indirmek amacıyla seçilir. Her çerçeve, yalnızca tek bir odak görüntü faz-kontrast (hücre tanıması için) ve floresan kanalları (hücre kaderinin belirlenmesi için) gereklidir. Ilk zaman noktası olarak, YFP kanalı ile Bununla birlikte, çoklu z-pozisyon görüntü hücre yüzeyi üzerindeki tüm enfekte fajlar yakalamak için gereklidir. İlk çerçeve içinde YFP maruz kalma süresi de daha sonra zaman dilimlerinde hızlandırılmış film için kullanılan daha yüksek olması gerekir.
Görüntü Analizi:
Çok dikkatli Adım 7.1 hücre yüzeyi etrafında faj parçacıkları saymak. GibiYukarıda belirtildiği üzere, Adım 6.2 YFP kanalıyla z yığınlarının bir dizi çekmek. Ancak, bu hala sayma zorlukları bazı floresan faj partiküllerinin out-of-odak bırakabilir. Ilk bir zaman dilimi içinde hücre boyu Metamorph yazılımı kullanılarak ölçülür. Hücre uzunluğu da ImageJ ya da başka yazılım araçları ile ölçülebilir. Ayrıca, otomatik bir ev inşa Matlab programı, hücre soylarının birlikte zamanla floresans değişim olarak bilgi almak çok yararlı olabilir.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Biz Michael Feiss ve faj oluşturma ve arıtma ile ilgili rehberlik için Jean Sippy minnettarız. Biz hücre tanıma yazılımı, Schnitzcell sağlamak için Michael Elowitz ederim. , Welch Vakfı (Hibe Q-1759) ve İnsan Frontier Bilim: Golding laboratuarda çalışma, Ulusal Sağlık Enstitüleri (R01GM082837), Ulusal Bilim Vakfı (Yaşam Hücreleri Fizik Merkezi 082265, PFC) hibe tarafından desteklenmektedir Programı (RGY 70/2008).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Kloroform | Fisher Scientific | C298-500 | |
| NaCl | Fisher Scientific | S271-3 | |
| DNaz I | Sigma | D4527-10KU | |
| RNaz | Sigma | R4642-10MG | |
| PEG8000 | Fisher Scientific | BP233-1 | |
| SM tampon | Teknova | S0249 | |
| NZYM | Teknova | N2062 | |
| CsCl | Sigma | C3011-250G | |
| Şırınga | Becton Dickinson | 309585 | |
| Iğne | Becton Dickinson | 305176 | |
| Diyaliz kaset | Thermo Scientific | 66333 | |
| Mikroskop slayt | Corning | 2947-75x50 | |
| Agaroz | Fisher Scientific | BP160-100 | |
| SW40Ti ultra net tüpü | Beckman Coulter | 344060 | |
| SW60Ti ultra net tüpü | Beckman Coulter | 344062 | |
| SW40Ti rotor | Beckman Coulter | 331302 | |
| SW60Ti rotor | Beckman Coulter | 335649 | |
| Refraktometre | Fisher Scientific | 13-947 | |
| Epifloresans mikroskop | Nikon | Tutulma TE2000-E |
Tablo 2. Reaktifler ve cihazlar.
Referanslar
- Oppenheim, A. B., Kobiler, O., Stavans, J., Court, D. L., Adhya, S. Switches in bacteriophage lambda development. Annu. Rev. Genet. 39, 409-429 (2005).
- Ptashne, M. A genetic switch : phage lambda revisited. , 3rd edn, Cold Spring Harbor Laboratory Press. (2004).
- Hendrix, R. W. Lambda II. , Cold Spring Harbor Laboratory. (1983).
- Hershey, A. D. The Bacteriophage lambda. , Cold Spring Harbor Laboratory. (1971).
- Zeng, L. Decision making at a subcellular level determines the outcome of bacteriophage infection. Cell. 141, 682-691 (2010).
- Edgar, R. Bacteriophage infection is targeted to cellular poles. Mol. Microbiol. , (2008).
- Ausubel, F. M. Current protocols in molecular biology. , John Wiley & Sons. (1994).
- Sambrook, J., Russell, D. W. Molecular cloning : a laboratory manual. , 3rd edn, Cold Spring Harbor Laboratory Press. (2001).
- Fasman, G. D. Practical handbook of biochemistry and molecular biology. , CRC press. (1989).
- Kaiser, A. D. On the internal structure of bacteriophage lambda. J. Gen. Physiol. 49, 171-178 (1966).
- Kobiler, O. Quantitative kinetic analysis of the bacteriophage lambda genetic network. Proc Natl Acad Sci. 102, 4470-4475 (2005).
- Shaner, N. C. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22, 1567-1572 (2004).
- Personal communication with M. Feiss. , Forthcoming.
- Schwartz, M. The adsorption of coliphage lambda to its host: effect of variations in the surface density of receptor and in phage-receptor affinity. J. Mol. Biol. 103, 521-536 (1976).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır