A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
[رني الفرز لتحديد الظواهر تال للمرحلة الجنينية في C. ايليجانس
In This Article
Summary
نحن وصفا لطريقة توعية لتعريف المنظمين تال للمرحلة الجنينية من بروتين تعبير والتوطين في C. ايليجانس باستخدام شاشة الجينومية رني المستندة إلى والتحوير المتكاملة التي تعبر عن وظيفية، والبروتين الموسومة fluorescently.
Abstract
وقد ثبت جيم ايليجانس أن يكون نظام نموذجا قيما للاكتشاف وتوصيف وظيفي للجينات كثيرة ومسارات الجينات 1. أدوات أكثر تطورا وموارد لإجراء دراسات في هذا النظام وتسهيل اكتشاف الجينات مع استمرار الظواهر أكثر دهاء أو الأدوار.
هنا نقدم لبروتوكول المعمم نحن تكييفها لتحديد C. ايليجانس الجينات مع الظواهر تال للمرحلة الجنينية من الاهتمام باستخدام رني 2. يتم تعديل بسهولة هذا الإجراء لفحص النمط الظاهري في الاختيار، سواء من قبل بصريات ضوء أو مضان على مجهر تشريح أو مركب. هذا البروتوكول فحص تستفيد من الأصول المادية للكائن الحي والأدوات الجزيئية وجيم وقد أنتجت الأبحاث ايليجانس المجتمع. كمثال على ذلك، ونحن لشرح استخدام من التحوير المتكاملة التي تعبر عن منتج فلوري في شاشة رني لتحديد الجينات اللازمة لتوطين طبيعية من هذامنتج في مرحلة متأخرة اليرقات والكبار. أولا، استخدمنا المتاحة تجاريا مكتبة رني الجينومية مع كامل طول إدراج [كدنا]. هذه المكتبة يسهل التعرف السريع على تعدد المرشحين من قبل تخفيض رني المرشح منتج الجين. الثانية، ولدت لدينا خبير التحوير المتكاملة التي تعبر عن البروتين لدينا الموسومة fluorecently من اهتمام في خلفية رني حساسة. الثالثة، من خلال تعريض الحيوانات التي تحاك لرني، هذه الشاشة يسمح تحديد المنتجات الجينات التي لها دور حيوي الجنينية التي من شأنها أن تخفي ذلك دورا في مرحلة ما بعد الجنينية في تنظيم بروتين من الفائدة. أخيرا، هذه الشاشة يستخدم مجهر مركب مجهزة لقرار خلية واحدة.
Protocol
1. فحص سلالة البناء
تصميم دقيق للسلالة الفرز هو أمر حاسم لنجاح الشاشة ولقد وصفت في مكان آخر 3. بالنسبة لبعض الباحثين، وذلك باستخدام السلالة التي تعبر عن منتج مرئي من التحوير وهناك حاجة للتجربة. العديد من السلالات ايواء الجينات المحورة المتكاملة المتوفرة من الباحثين CGC أو الفردية. إذا كان المطلوب سلالة معدلة وراثيا للعرض على الشاشة ولكن غير متوفرة، يمكن بعد ذلك أنها ولدت باستخدام أسلوب نشر مثل قصف 4، والأشعة فوق البنفسجية / TMP 5، أو موس ينقول الإدراج 6. إدراج نحن من أجل تصور بروتين لدينا من الفائدة، وتسلسل GFP الترميز في إطار مع تسلسل [كدنا] ناضجة (كنا DBL-1 تسلسل). لأن هذا انصهار بروتين GFP غير مرئية من قبل تشريح نطاق، استخدمنا علامة coinjection التي كانت واضحة ولم يؤثر على عرض من البروتين لدينا اهتمام (TTX-3P :: طلب تقديم العروض ، لمراجعة علامات عدة القياسية الأخرى، انظر 7). أنشأنا بعد ذلك التحوير متكاملة من المصفوفة خارج الصبغي. وجدنا أن القصف من التحوير أسفرت عن انخفاض عدد النسخ خط متكامل لانقاذ أيا من النمط الظاهري مجهر تشريح ولا تنتج مستويات واضحة من الناتج GFP الموسومة (Beifuss وGumienny، غير منشورة). أسفرت عن الأشعة فوق البنفسجية / TMP التكامل من مجموعة نسخ متعددة خارج الصبغي في الأصل عن طريق الحقن 8،9 مرئية، انقاذ مستويات الناتج التحوير (الشكل 3A). لطخة غربية معادية للGFP الأضداد وأكد أن يعبر عن التحوير (اسم أليل texIs100) ومعالجتها بشكل صحيح (Beifuss وGumienny، غير منشورة). وينبغي outcrossed الجينات المحورة المتكاملة خمس مرات لإزالة الطفرات خلفية غريبة بغض النظر عن المصدر.
لدينا شاشة، أردنا أن البروتين فقط من مصلحة ليكون وراثيا، شكل المفتاحية. ولذلك، قمنا بإزالة مجموعة وظيفية الذاتيةين عن طريق إدخال الخسارة من وظيفة متحولة DBL-1 أليل.
وأخيرا، فإننا توعية سلالة لآثار رني. سوف رني من المكتبة، عن العديد من الجينات، وانتاج انخفاضا أكثر حدة في منتج الجين إذا الحيوانات تحتوي على الطفرة التي محسس الحيوانات إلى آثار رني 10،11 وينبغي النظر في الأنسجة (ق) من الفائدة عند اختيار المناسب [رني توعية خلفية 11. استخدمنا أليل قوة الرد السريع-3 (pk1426) الكنسي لجعل سلالة لدينا الفرز. قوة الرد السريع-3 هو بوليميريز الحمض النووي الريبي RNA الموجه (RdRP) homolog الذي يمنع عادة جسدية رني 10. ويمكن استخدام الطفرات في جينات أخرى رني hypersensitizing مثل ERI-1 أو ERI 1-15B-لين بدلا من ذلك لزيادة فعالية رني 11-13.
سلالة الفرز التي قطعناها على أنفسنا لديه التركيب الوراثي قوة الرد السريع-3 (pk1426)؛ texIs100؛ DBL-1 (nk3).
2. اختيار وإعدادمكتبة رني
المتاحة تجاريا C. المكتبات ايليجانس [كدنا] وتمثل نحو 55 في المئة أو 87٪ من الجينات وتوقع في C. ايليجانس فردي (فيدال مختبر أو المكتبات Ahringer مختبر، على التوالي). استنساخ فرد متاحة للشراء (فتح النظم البيولوجية، Geneservice المحدودة). اخترنا مكتبة ORF-رني شيدت من قبل مختبر فيدال (فتح النظم البيولوجية) لان الحيوانات المستنسخة لها هي في معظمها كامل طول cDNAs بوابة المستنسخة وعلى استعداد لتقديم الطلبات المصب (إينفيتروجن شركة، كارلسباد، كاليفورنيا). الأصل الجيني مختبر Ahringer مكتبة تحتوي على شظايا [كدنا] [كدنا] التي ليست مفيدة على نطاق واسع لإجراء التجارب توصيف المصب 14،15. كلا مكتبات استخدام ناقلات أن يحتوي على اثنين من المروجين T7 المرافقة إدراج (الشكل 1). وتزرع في بنيات في السلالة البكتيرية HT115، الذي يعبر عن T7 بوليميريز على تحريض من قبل الآيزوبروبيل-β-D-thiogalactopyranoside (IPTG). وبفعل البكتيريا التي تحتوي على الحيوانات المستنسخة مع مكتبة IPTG إلىإنتاج الرنا المزدوج الجديلة (انظر الخطوة 3.4).
تكرار مكتبة بأكملها عند استلام واستخدام مكررة لجميع التجارب. يجب أن يتم تخزينها في المكتبات الأصلي ومكررة في مختلف -80 درجة مئوية المجمدات التي ترتبط في فصل خطوط الكهرباء.
3. إعداد البكتيريا مع الحيوانات المستنسخة مكتبة
- (في غضون شهرين من التجربة) بكتيريا الإنتصارات من الحيوانات المستنسخة مختارة مكتبة التغذية، فضلا عن الضوابط الإيجابية والسلبية، على لوحات LB-كربنيسيلين / التتراسيكلين المسمى (نحن ينمو بنسبة 8 الثقافات لكل لوحة 100 ملم)، واحتضان عند 37 درجة مئوية خلال الليل ( > 16 ساعة) (الشكل 1). من أجل كل لوحة 24 جيد، ونحن نستخدم اثنين من عناصر التحكم. السيطرة الإيجابية، BLI-4 (K04F10.4)، وتنتج تعتمد على الجرعة بعد الجنينية pheontype 16،17. سيطرة سلبية، C06C3.5، هو جين كاذب وتوقع ( WormBase.org ) أن لا يسبب الظواهر المرصودة (Beifuss وGumienny، غير منشورة).
- (في غضون شهرين من التجربة، ويفضل أن يكون ذلك عاجلا) إعداد 24 جيد متوسط النمو النيماتودا (NGM) لوحات تحتوي على 25 حتي 50 ميكروغرام / مل كربنيسيلين وIPTG 1MM. تخزن في درجة مئوية 4
- (يوم 1) للحصول على كل استنساخ، تطعيم 2 مل تحتوي على وسائل الاعلام LB 50 ميكروغرام / مل كربنيسيلين مع مستعمرة واحدة من لوحة يشوبه (ق) (في الخطوة 3.1) باستخدام تقنية معقمة القياسية. احتضان عند 37 درجة مئوية بين عشية وضحاها (> 16 ساعة) في مجموعة شاكر إلى 220-240 دورة في الدقيقة (الشكل 1). وينبغي أن يكون الحل غائم بعد 16 ساعة.
- (يوم 2) في صباح اليوم التالي، حمل مضاعفة الذين تقطعت بهم السبل الحمض النووي الريبي (الرنا المزدوج الجديلة) الإنتاج من خلال إضافة IPTG على ثقافات إلى تركيز النهائي من 1MM. احتضان الثقافات في 37 درجة مئوية، 220 - 240 دورة في الدقيقة، للحصول على 4 إضافية - 5 ساعات. هذه الخطوة تضمن أكثر متماسك وقوي رني الناجم عن ضربة قاضية للمنتج الجين من الاعتماد فقط على IPTG في أغار من لوحة NGM (في الخطوة 3.5).
- بقعة 30 ميكرولتر من مكعب كل البكتيرية التي يسببهاlture في آبار منفصلة من لوحة 24-جيدا رني NGM التي تحتوي على 25 حتي 50 ميكروغرام / مل كربنيسيلين و1MM IPTG (الشكل رقم 1، انظر الشكل 4 لقالب المستخدمة لتتبع التجارب رني). وضع لوحات، وكشف، في غطاء تدفق معقم لمدة 20 دقيقة أو حتى البقع البكتيرية جافة. لا overdry. Overdrying يسبب حواف أجار لسحب بعيدا عن لوحة والحيوانات سيكون غير قابل للاسترجاع إذا كانوا يزحفون في الشقوق الناتجة عن ذلك.
4. إعداد النيماتودا
تبدأ مع عدد السكان ونظم من الديدان الخيطية. انطلاق الحيوانات يقلل من فرصة أن الفروق الملحوظة بين الرقابة والتجريبية التجارب رني هي ببساطة بسبب وجود خلافات في مرحلة النمو من الحيوانات (ولكن، إذا كان رني يؤدي إلى تأخر في النمو، وتجدر الإشارة إلى هذا من قبل فرز (الشكل 2)) . وعلاوة على ذلك، بدءا من تجربة رني مع يرقات L1 يغني الآثار المحتملة للالتباس الفتك الجنينية بواسطة رني من الجنرالوفاق يمكن أن تلعب أيضا دورا تال للمرحلة الجنينية من الفائدة.
ويتم إنجاز التدريج التي تبيض لأول مرة سكان مختلط مرحلة من سلالة الفرز، والتي فقط قشر البيض المحمية الأجنة البقاء على قيد الحياة. هذه الحيوانات على مراحل في غضون 12 ساعة على 20 درجة مئوية أو حوالي 18 ساعة على 16 درجة مئوية 18. إلى مرحلة أكثر إحكاما الحيوانات، الحيوانات الاعتقال في مرحلة اليرقات الأول (L1) عن طريق السماح للأجنة فتحة في وسط M9 دون طعام. الحيوانات L1 المتعطشة المفروضة على النمو استئناف الطعام من نفس الفئة العمرية بدءا 19.
- (يوم 1) استخدام ثلاث لوحات 100 ملم من بنك الاحتياطي الفيدرالي ونظيفة والحيوانات التي تحتوي على السلالة فحص البالغين حامل والأجنة. غسل الحيوانات من لوحات باستخدام M9 معقم بواسطة pipeting السائل على سطح لوحة بلطف لتخفيف الحيوانات والأجنة. نقل غسيل في أنبوب معقم 15 مل مع سدادة ملولبة.
- إذا كان غسل أكبر من 3.5 مل، وتدور باستمرار على الحيوانات (~ 3000 دورة في الدقيقة لمدة 30 ثانية) وإزالة السائل إلى 3.5 مل. إذا كان يغسل هو Lوفاق سطيف من 3.5 مل، إضافة H 2 0 أو M9 إلى أنبوب ليبلغ 3.5 مل.
- ارتداء ملابس واقية مناسبة (معطف المختبر، والقفازات، ونظارات واقية) أثناء التعامل مع المواد الكيميائية. خلط 0.5 مل 5 N هيدروكسيد الصوديوم مع التبييض 1 مل الطازجة (5٪ هيبوكلوريت الصوديوم، وأقل من 1 سنة). إضافة إلى هذا الخليط لغسل 3.5 مل الخيطية. بدء العد حتى الموقت. يجب أن هذه العملية لا تستغرق أكثر من 10 دقائق. إذا فعلت ذلك، ثم سيتم خطر الأجنة وربما يتم تخفيض الإنتاج، أو التبييض هو قديم ويجب استبداله.
- دوامة الأنبوب لمدة 10 ثوان. كرر vortexing كل دقيقتين لمدة 4 إلى 10 دقائق. بعد كل vortexing، تحت مراقبة حل نطاق تشريح لجثث الحيوانات.
- عندما يتم الإفراج الأجنة ومجزأة البالغين (6 - 8 دقائق)، بيليه الأجنة عن طريق الغزل أنبوب الطرد المركزي في جدول أعلى (~ 3000 دورة في الدقيقة، 30 ثانية).
- نضح أكبر قدر من طاف وقت ممكن من دون إزعاج بيليه. كن حذرا، لاالجشع.
- إضافة إلى M9 معقم 10ML ~. لفترة وجيزة دوامة أو تهزه جيدا لresuspend لبيليه.
- تدور وإزالة طاف مرة أخرى. إذا يمكن الكشف عن رائحة مبيض في الأنبوب، وتكرار شطف الضرورة.
- Resuspend الأجنة في 10 - 15 مل العقيمة M9 ونقل إلى قارورة صغيرة مخروطي (25 مل) (للتهوية). هزة في درجة الحرارة المناسبة لسلالة والتجربة (15 - 25 درجة مئوية) بين عشية وضحاها (> 16 ساعة على 20 درجة مئوية). في هذا الوقت، فإن كل الحيوانات يفقس والاعتقال في فترة البيات L1.
- (يوم 2) تدور باستمرار الحيوانات مرحلة L1 في أنبوب 15 مل و resuspend في 0،5-1 مل M9 (~ 3000 دورة في الدقيقة، 30 ثانية). 5 وضع حل ميكرولتر على لوحة منفصلة وحساب عدد من الحيوانات. إجراء تعديلات على وحدة التخزين، إذا لزم الأمر، لانتاج 30 الديدان / 3-10 حل ميكرولتر.
- اكتشاف ما يقرب من 30 هيبوكلوريت مرحلة L1 متزامنة الحيوانات على البكتيريا في كل بئر من لوحة 24 معد إعدادا جيدا. الكثير من موقد أعيد من 30 الحيوانات لكل بئر يؤدي إلى تجويع السكان قبل أن تصل إلى مرحلة النضج. السماح لوحة جاف مع منحرف الأغطية. استبدال غطاء وضمان الحصول عليها مع الشريط المطاطي. عكس لوحة ووضعها في درجة حرارة مناسبة للوقت اللازم ليسجل في المرحلة المطلوبة. بسبب قوة الرد السريع-3 (pk1426) هو الأليل درجة الحرارة الحساسة، وقد نمت حيواناتنا سلالة فحص بسرعة 15 - 17 درجة مئوية لمدة ثلاثة أو أربعة أيام لمراقبة L4 للحيوانات مرحلة الكبار (الشكل 1).
5. ملاحظة من الديدان الخيطية
(اليوم 5) وبمجرد أن الديدان الخيطية قد نمت إلى مرحلة المطلوب (الشكل 2A)، يؤكد أن الضوابط الإيجابية والسلبية انتاج الظواهر المتوقعة باستخدام مجهر تشريح. نحن نستخدم BLI-4 كعنصر تحكم عن فعالية رني، لأنها تنتج تعتمد على الجرعة بعد الجنينية العيوب التي تتراوح بين البالغين تقرح (معتدل رني النمط الظاهري، لا تظهر) على اليرقات، اعتقلت تنمويا صغيرة (قوي، والبريدxpected رني النمط الظاهري) (الشكل 2B). ثم مراقبة الحيوانات في كل التجريبية جيدا باستخدام مجهر تشريح والظواهر الشاذة واضح علما الناجمة عن رني (الشكل 2C). بعد تأكيد الضوابط وأشار إلى الظواهر الإجمالي، وشاشة التجارب رني عن الظواهر ذات الاهتمام. نستخدم المجهر المركب مجهز مضان وهدف 63x لمراقبة ما لا يقل عن خمسة حيوانات من كل تجربة رني، بدءا من الضوابط (الشكل 3).
- إعداد شريحة (معيار 75 × 25 ملم) من خلال جعل لوحة أجار 4٪ (أجار 4٪ في H 2 O). لضمان وجود سمك موحد من وسادة أجار، ووضع شريحة زجاجية نظيفة بين اثنين من الفواصل (يرصد كل هل شريحة المجهر مع طبقتين من الشريط مختبر على ذلك). ماصة حوالي 100 ميكروليتر (من سنتين إلى ثلاث قطرات من الماصة باستور الزجاج) من مصهور أجار 4٪ على وسط شريحة زجاجية نظيفة. تشكل وسادة آغار من خلال تغطية أجار المنصهر باستخدام شريحة إضافية توضع بسرعة ولكن بلطف على الجزء العلوي من الفواصل 1الثانية للأجار المنصهر. فضح لوحة أجار عن طريق تحريك بلطف الشرائح الزجاجية بعيدا، وترك وسادة التمسك شريحة واحدة.
- وضع قطرة ~ 5 ميكرولتر من مخدر (ليفاميزول أو أزيد الصوديوم، على سبيل المثال) على لوحة أجار. جبل 8-12 الحيوانات في مخدر. تغطية مع 22 ملم 22 × 1،5 # ساترة (أو سمك ساترة الانسب لمجهر مركب) ومراقبة الحيوانات باستخدام مجهر مركب.
- سجل الجينات، لاحظ عدد من الحيوانات، والنمط الظاهري نتائج كل تجربة رني. للحصول على الشاشة، وجعل استخدام قالب قياسي (انظر المثال، الشكل 5).
- التحقق من النمط الظاهري رني، التي تنتجها آخر النمط الظاهري، ثانوي، إذا كان ذلك ممكنا، وتكرار التجربة. (على سبيل المثال، كما هو موضح استخدام شاشة سبيل المثال تغيير توطين DBL-1-GFP الموسومة كشاشة الأولية وحجم الجسم كشاشة ثانوية 20). البكتيريا يمكن استخدامها من خط واحد (المخزنة في درجة مئوية 4) لمدة تصل إلى شهرين. يمكن أن يقيم الشرائط صوينبغي restreaked esult في ضعف النمو في الثقافات بين عشية وضحاها السائل والعشرين.
- تسلسل على الأقل واحدة من نهاية إدراج [كدنا] للتأكد من أن إدراج يطابق تسمية مكتبة (مكتبة Ahringer كان له تحليل الموثوقية يؤديها، وانظر http://biocompute.bmi.ac.cn/CelRNAi/ ) 21. الاشعال موصى بها (لإدراج إما من المكتبة) يصلب على مواقع في موقع النواقل والجناح L4440 المستمدة من الإدراج في: 5'-AGCGAGTCAGTGAGCGAG-3 "و 5'-3-GTAAAACGACGGCCAGT '(M13f20 التمهيدي).
باستخدام هذه الطريقة، يمكن لشخص واحد معقول تنظيم ومراقبة 2-4 مجموعات من التجارب في كل أسبوع. على سبيل المثال، قام الحيوانات يوم الاثنين ويمكن ملاحظة الثلاثاء الخميس والجمعة، على التوالي، ويمكن مرة أخرى ستقام يومي الجمعة والسبت ليوم الاثنين والمراقبة الثلاثاء. اعتمادا على النمط الظاهري (ق) فحص كل يوم، قد مجموعة تتكون من واحد 24 لوحة من قبل بشكل جيد الدقيقة مركبالتنظير أو أكثر إذا تم التعرف بسرعة على النمط الظاهري. وبالتالي، يمكن ملاحظة ما لا يقل عن 88 تجارب مختلفة رني في أسبوع واحد، مع الأخذ في الاعتبار الضوابط الإيجابية والسلبية ومعدل الفرز. ويمكن أن يؤديها شاشة نطاق تشريح أسرع بكثير، من دون الحاجة لتركيب الحيوانات على شرائح للعرض. ويمكن لعدة أشخاص أيضا زيادة الإنتاجية من خلال مختبر جداول مذهل و / أو باستخدام المجاهر متعددة. قد طريقة بديلة لزراعة الحيوانات على شريحة رقيقة من أجار ونقل شريحة من أجار التي تحتوي على الحيوانات مباشرة إلى شريحة للعرض توفيرا للوقت. وقد استخدم بنجاح هذا التباين لفحص العيوب في ذيل ذكر التكبير 400X 22.
6. ممثل النتائج
وترد أمثلة على الترجمة العادية والمعدلة من GFP الموسومة DBL-1 في الشكل 3. التعبير العادي للGFP الموسومة DBL-1 ويشمل بطني أجسام الخلايا العصبية والحبل على التوالي من punctae (الشكل 3A). DBL-1 أناق الموهن بشدة عندما يتم تغذية الحيوانات الحمض النووي الريبي الذي يمنع ترجمة DBL-1 مرنا (الشكل 3B). DBL-1 ([رني) كما تنتج الحيوانات الصغيرة، وشاشة ثانوية في هذا المثال (لا تظهر البيانات). ويتم تحديد الجينات التي تؤثر بسهولة DBL-1 التعريب بواسطة رني باستخدام سلالة المصممة لهذه الشاشة (الشكل 3C).

الشكل 1. مخطط الشاشة لتحديد المنظمين خارج الخلية من DBL-1 الإشارات. تزرع البكتيريا من مكتبة التغذية بين عشية وضحاها، بفعل مع IPTG، وحضنت على 37 درجة مئوية للحصول على 4 ساعات اضافية للسماح للبكتيريا لإنتاج الحمض النووي الريبي مزدوج تقطعت بهم السبل (الرنا المزدوج الجديلة). ورصدت 30 ميكرولتر من ثقافة البكتيرية التي يسببها لكل بئر على طبق من ذهب 24-جيدا (الخيطية متوسط النمو) NGM التي تحتوي على 25 ميكروغرام / مل كربنيسيلين وIPTG 1MM وسمح لتجف في غطاء تدفق العقيمة. نحن المرحلة الاولى من مرحلة اليرقات (L1) يرقات عن طريق السماح هيبوكلوريت المعالجة embrيوس يفقس في وسائل الاعلام من دون طعام، والتي يدفع 1 فترة البيات L1 (تطوير القبض). ومطلي ما يقرب من 30 مرحلة L1 متزامنة على كل الحيوانات التي تحتوي على البكتيريا بشكل جيد من المكتبة رني، والذي يسمح نظموا الحيوانات لاستئناف النمو وتستهلك الرنا المزدوج الجديلة الناجمة عن البكتيريا 23. بعد 72 ساعة على 15 درجة مئوية، ويتم فحص الديدان البالغة الشباب للحصول على النمط الظاهري مرئية. في هذا العصر، وعيوب حجم الجسم واضحة للعيان والاستشعاع مشرق من التعبير التحوير texIs100.
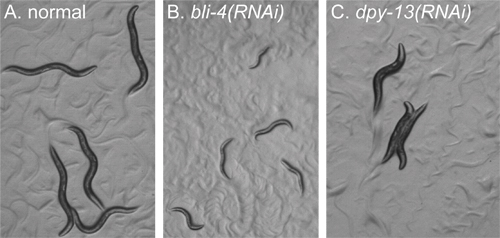
الشكل 2. أمثلة من الظواهر لتحديد قبل الفرز. جميع صور للحيوانات في لوحة جيدا أخذت في التكبير نفسه باستخدام مجهر تشريح. تم تصوير جميع الحيوانات عن 72 ساعة بعد الطلاء واليرقات L1 المتعطشة. تم علاج جميع الصور مماثل. A) [رني من الجين الذي لا يعطي أي خلل الجسيم الصرفي. الحيوانات البرية تظهر نوع. B) RNمنظمة العفو الدولية من BLI-4. عرض الحيوانات تطوير القبض عليه، وتكون صغيرة جدا مقارنة مع الحيوانات في لوحة A. C) [رني من dpy-13. الحيوانات هي في نفس المرحلة من التنمية والحيوانات في لوحة A، ولكن عرض "بدين وقصير" مورفولوجيا الجسم.
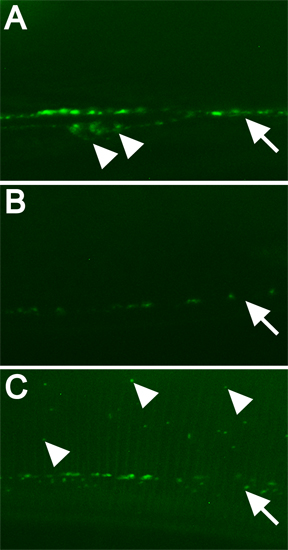
الشكل 3. أمثلة من البروتين الموسومة fluorescently وكيف رني من جينات معينة يغير نمط التوطين. وقد اتخذت جميع الصور في التكبير 630x مع المجهري القرص الغزل مبائر، 5 ثانية. التعرض. شريط النطاق = 10 ميكرون. تم علاج جميع الصور مماثل. النصال مفتوحة تشير إلى أجسام الخلايا. سهام بمناسبة خط punctae. رؤوس سهام مليئة تشير بعض GFP الموسومة المترجمة aberrantly DBL-1. A) رني التي تغذيها جين كاذب C06C3.5 ("من النوع البري"). B) DBL-1 ([رني) السيطرة. C) [رني من الجينات اللازمة لتوطين العادي GFP الموسومة DBL-1.
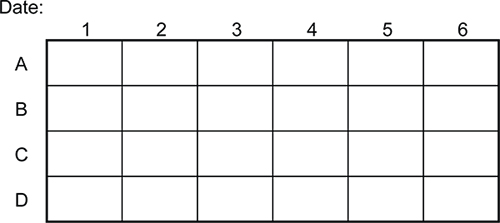
الشكل 4. مثال قالب لتتبع التجارب رني (استنساخ المكتبة) في 24 وحات جيدة. ويمكن استخدام هذا القالب لإنشاء سجل دائم من التجارب، على عكس وصفها مباشرة لوحات.
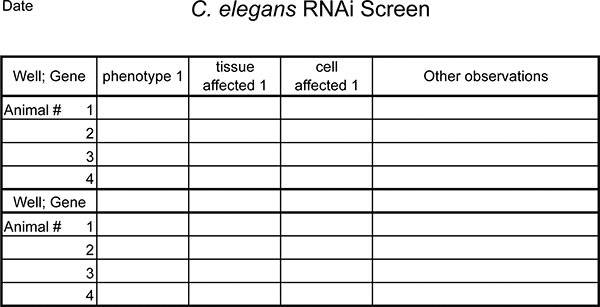
الشكل 5. مثال نموذج لتسجيل الظواهر رني. توسيع حسب الحاجة.
Discussion
طريقة فحص رني المقدمة هنا يمكن تحليل حساسة وسريعة من المنتجات الجينات المطلوبة لالنمط الظاهري (أو المعدلة وراثيا) طبيعي تال للمرحلة الجنينية. المثال المعروض هو الشاشة عن الجينات المسؤولة عن توطين التحت خلوية من البروتين الموسومة fluorescently. ومع ذلك، يمكن تعديل هذا البر...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
فإن الكتاب أود أن أشكر الدكتور ريك بادجيت (اكسمان معهد، جامعة روتجرز بولاية نيو جيرسي) لهدية من [كدنا] DBL-1، والدكتور كريستوفر Rongo (اكسمان معهد، جامعة روتجرز بولاية نيو جيرسي) للحصول على علامة حقن. يقوم مختبر الدكتور بارث غرانت قصف مدفع الجينات لانخفاض نسخة دمج عدد من التركيبة GFP الموسومة-1 DBL. قدمت رينيه غارسيا مختبر المساعدة التقنية أثناء إنشاء texIs100. قدمت رينيه غارسيا، Lints روبين، وHongmin المختبرات تشين نصيحة الإنتاجية. وقد تم تمويل هذا العمل من قبل بدء أموال من وزارة TAMHSC الطب الجزيئي والخلوي. تم شراؤها في نطاق المجمع والغزل مبائر القرص مع الأموال التي تقدمها الإدارة، وكلية الطب TAMHSC من مكتب عميد.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| NGM آجار | الديدان الخيطية النمو المتوسطة | المكافحة المتكاملة للآفات والعلم، وشركة | ويمكن أن تكون مستعدة بعد بروتوكول أجار NGM 25 |
| M9 متوسطة | 22mm و KH 2 PO 4، 42mM نا 2 هبو 4، 86mM كلوريد الصوديوم، 1 مم MgSO 4 | 26 | |
| أجار أجار | EMD شركة الكيماويات | 1.01614.1000 | 2٪ في الماء لوحات NGM. 4٪ في الماء لمنصات شريحة المجهر (الأوتوكلاف في البداية، والميكروويف لتذوب بعد ذلك). |
| Bacto البيبتون | بيكتون ديكنسون - Difco CP | 211677 | 0.25٪ |
| IPTG | بحث منتجات شركة الدولية | I56000-5.0 | 1 تركيز نهائي ملي |
| كربنيسيلين | بحث منتجات شركة الدولية | C46000-5.0 | 50 ميكروغرام / مل تخفيف العمل |
| LB حساء لينوكس | بيكتون ديكنسون - Difco CP | 240230 | 20 جم / لتر |
| التتراسيكلين | سيغما | 268054 | 12.5 ميكروغرام / مل تخفيف العمل |
| هيبوكلوريت الصوديوم | أي علامة تجارية | 5٪ التبييض المنزلي | استخدام التبييض الطازجة. |
| هيدروكسيد الصوديوم | أي علامة تجارية | CAS 1310-73-2 | 5 N الأوراق المالية |
| M9 المتوسطة | Wormlab وصفة كتاب | http://130.15.90.245/wormlab_recipe_book.htm # Commonlab | 26 |
| levamisol | سيغما | 31742 | 100 ميكرون - 1 ملم تخفيف العمل |
| أزيد الصوديوم | فيشر العلمية | S227 | 10 مليمتر في تخفيف العمل M9 |
| 24 لوحة جيد | غرينر بيو واحد | 662160 | VWR موزع |
| مجهر الشرائح | أي علامة تجارية | 75 × 25 × 1 ملم | |
| زلات مجهر الغطاء | أي علامة تجارية | 22 × 22 مم No.1.5 | استخدام سماكة موصى بها من قبل الشركة المصنعة للمجهر. |
| مجمع المجهر | كارل زايس، وشركة | A1m | استخدام الأهداف والمرشحات لتلبية احتياجات التجربة. |
| وسائل الاعلام مضخة | Manostat Varistaltic مضخة | كيت نموذج # 72-620-000 | استخدام أنابيب والضبط المناسب للجهاز |
References
- Giacomotto, J., Segalat, L. High-throughput screening and small animal models, where are we. Br. J. Pharmacol. 160, 204-216 (2010).
- Lamitina, T. Functional genomic approaches in C. elegans. Methods in Molecular Biology. 351, 127-138 (2006).
- Boutros, M., Ahringer, J. The art and design of genetic screens: RNA interference. Nat. Rev. Genet. 9, 554-566 (2008).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157, 1217-1226 (2001).
- Yandell, M. D., Edgar, L. G., Wood, W. B. Trimethylpsoralen induces small deletion mutations in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 91, 1381-1385 (1994).
- Frokjaer-Jensen, C. Single-copy insertion of transgenes in Caenorhabditis elegans. Nature Genetics. 40, 1375-1383 (2008).
- Giordano-Santini, R., Dupuy, D. Selectable genetic markers for nematode transgenesis. Cell. Mol. Life. Sci. , (2011).
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833 (2008).
- Mello, C., Fire, A. DNA transformation. Methods in Cell Biology. 48, 451-482 (1995).
- Simmer, F. Loss of the putative RNA-directed RNA polymerase RRF-3 makes C. elegans hypersensitive to RNAi. Curr. Biol. 12, 1317-1319 (2002).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans enhanced RNAi mutants. Genetics. , (2011).
- Samuelson, A. V., Klimczak, R. R., Thompson, D. B., Carr, C. E., Ruvkun, G. Identification of Caenorhabditis elegans genes regulating longevity using enhanced RNAi-sensitive strains. Cold Spring Harbor Symposia on Quantitative Biology. 72, 489-497 (2007).
- Wang, D. Somatic misexpression of germline P granules and enhanced RNA interference in retinoblastoma pathway mutants. Nature. 436, 593-597 (2005).
- Fraser, A. G. Functional genomic analysis of C. elegans chromosome I by systematic RNA interference. Nature. 408, 325-330 (2000).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Peters, K., McDowall, J., Rose, A. M. Mutations in the bli-4 (I) locus of Caenorhabditis elegans disrupt both adult cuticle and early larval development. Genetics. , 129-195 (1991).
- Thacker, C., Peters, K., Srayko, M., Rose, A. M. The bli-4 locus of Caenorhabditis elegans encodes structurally distinct kex2/subtilisin-like endoproteases essential for early development and adult morphology. Genes & Development. 9, 956-971 (1995).
- Byerly, L., Cassada, R. C., Russell, R. L. The life cycle of the nematode Caenorhabditis elegans. I. Wild-type growth and reproduction. Dev. Biol. 51, 23-33 (1976).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Savage-Dunn, C. Genetic screen for small body size mutants in C. elegans reveals many TGFbeta pathway components. Genesis. 35, 239-247 (2003).
- Qu, W. Reliability analysis of the Ahringer Caenorhabditis elegans RNAi feeding library: a guide for genome-wide screens. BMC Genomics. 12, 1471-2164 (2011).
- Nelson, M. D. A Bow-Tie Genetic Architecture for Morphogenesis Suggested by a Genome-Wide RNAi Screen in Caenorhabditis elegans. PLoS Genetics. 7, e1002010 (2011).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854 (1998).
- Sarin, S., Prabhu, S., O'Meara, M. M., Pe'er, I., Hobert, O. Caenorhabditis elegans mutant allele identification by whole-genome sequencing. Nature Methods. 5, 865-867 (2008).
- Lewis, J. A., Fleming, J. T. Basic culture methods. Methods in Cell Biology. 48, 3-29 (1995).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved