A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جراحة القوارض التجسيمي والتحسينات نتائج الخيرية لرعاية الحيوان العلوم العصبية السلوكية
In This Article
Summary
جراحة التجسيمي على القوارض يسمح للادارة تستهدف المخدرات أو التحفيز الكهربائي والتسجيلات في اليقظة ، تتصرف الحيوانات. في هذا العرض الفيديو سوف نظهر التحسينات الإجرائية الأخيرة لهذا الإجراء منذ وقت طويل أن معدل البقاء على قيد الحياة وتحسين بنجاح وانخفاض فقدان الوزن بعد الجراحة.
Abstract
التجسيمي جراحة لزرع حقنة عادية في مناطق محددة في الدماغ منذ عقود عديدة تقنية تجريبية ناجحة جدا للتحقيق في آثار العصبي التلاعب محليا ومسارات إشارات في الحيوانات ، ويتصرف مستيقظا. وعلاوة على ذلك ، تم غرس التجسيمي من الأقطاب الكهربائية لتحفيز الكهربية ودراسات مفيدة تسجيل في فهمنا الحالي للشبكات والمرونة العصبية في المخ في الحيوانات تتصرف. ودفع المعرفة المتزايدة حول تحسين التقنيات الجراحية في القوارض 1-4 ، والتوعية العامة بشأن قضايا الرفق بالحيوان والتشريعات الصارمة (على سبيل المثال ، عام 2010 توجيه الاتحاد الأوروبي بشأن استخدام الحيوانات المختبرية 5) لنا لصقل هذه الإجراءات الجراحية ، وخاصة فيما يتعلق لتنفيذ إجراءات جديدة لمكملات الأوكسجين والرصد المستمر للالأوكسجين في الدم ومستويات معدل ضربات القلب أثناء الجراحة ، فضلا عناستحداث بروتوكول موحد لرعاية ما بعد الجراحة. ملاحظاتنا تشير إلى أن هذه التعديلات أدت إلى زيادة معدل البقاء على قيد الحياة وحدوث تحسن في الحالة العامة للحيوانات بعد الجراحة (أقل مثل فقدان الوزن والحيوان أكثر نشاطا). وهذا عرض فيديو تظهر الإجراءات العامة التي تشارك في هذا النوع من الجراحة التجسيمي مع إيلاء اهتمام خاص لدينا العديد من التعديلات. وسوف نوضح هذه العمليات الجراحية في الفئران ، ولكن من الممكن أيضا لتنفيذ هذا النوع من الجراحة في الفئران أو غيرها من الحيوانات المختبرية باستخدام محولات صغيرة خاصة للجهاز التجسيمي 6.
Protocol
ملاحظة : ينبغي استخدام تقنيات مطهر أثناء العملية بأكملها. ويجب تعقيم جميع الأدوات والمواد (القطن ذات الرؤوس مسحات والشاش ، وغيرها) التي سيتم استخدامها أثناء الجراحة بواسطة التعقيم. وينبغي ارتداء قناع جراحي ، بونيه الشعر وقفازات معقمة. يجب تنظيف منطقة العمل وأجهزة التجسيمي جيدا ، وتطهيرها بمحلول الإيثانول 70 ٪.
1. قبل الإجراءات الجراحية
- إعداد جهاز التجسيمي وجميع المواد اللازمة. قبل حرارة التدفئة وسادة.
- وضع قنية في دعمها ومعرفة ما اذا كان هو على التوالي.
- بدوره على نظام الغاز -- خليط من الهواء المحيط والاوكسجين (30-35 ٪ من مجموع تدفقات ينبغي الأكسجين).
- وزن الفئران وإدارة مخدر. نحن باستخدام مزيج من الكيتامين (37.5 ملغ / كلغ) وdexmedetomidine (0.25 ملغ / كلغ) حقن تحت الجلد. لبروتوكولات مختلفة التخدير ، انظر Flecknell 4 و Hellebrekerق وآخرون. 7.
- بعد الفئران فقدت الوعي ، وحلق الرأس الانتقال من منطقة الأذنين للتو في ما بين العينين مع الحلاقة الكهربائية.
- وضع فأر على لوحة التدفئة ، مع أنفها امام أنابيب الهواء. استخدام مقياس التأكسج للتأكد من أن الفئران لديها مستوى الأوكسجين في الدم الكافي (يجب أن لا تسقط <90 ٪). يرجى اتباع إرشادات الشركة المصنعة للاستخدام السليم للمعدات.
- تطبيق كريم العين (Duratears Z ، ألكون) على كل من القرنيات لتجنب الجفاف.
- ردود الفعل على الاختيار الجرذ (الذيل المنعكس أو منعكس إصبع القدم قرصة ، كما هو موضح في Walantus آخرون 8) لضمان أن يتم تخدير كاف. إذا كانت الفئران لا تزال تظهر ردود الفعل قوية ، قد تكون هناك حاجة إلى مكملات من التخدير.
- إذا لم يظهر رد الفعل إصبع القدم قرصة ، وضع الجرذان في الجهاز التجسيمي ، وضبط أشرطة الأذن بحيث تظهر القراءة على قدم المساواة على كلا الجانبين ، ووضع أنابيب الهواء مرة أخرى أمام هذا الحيوانعن طريق تحديد ذلك مع شريط الأنف. الاختيار مرة أخرى إذا كان الفأر يظهر مستوى الأوكسجين في الدم بنسبة 90 ٪ أو أعلى. إذا لم يكن كذلك ، إما ضبط الأنبوب ، مما جعلها أقرب إلى الأنف ، أو زيادة تدفق الأوكسجين. مراقبة مستوى الأوكسجين في الدم ومعدل ضربات القلب خلال عملية جراحية.
- رصد درجات الحرارة بشكل مستمر الفأر مع ميزان حرارة المستقيم (متصلا بشكل تفضيلي لوحة التدفئة) وسجل القيم في بداية ونهاية لعملية جراحية. ضبط لوحة التسخين أو استخدام غطاء للحفاظ على درجة حرارة الجسم من 37،5-38،5 درجة مئوية.
2. عملية جراحية
- حقن المسكنات. نحن نستخدم واحد شبه المنطوق إدارة كاربروفين (4،0-5،0 ملغم / كغم ، تحت الجلد). مسكن لبروتوكولات مختلفة ، راجع Hellebrekers 7 آخرون.
- تنظيف المنطقة من حلق ركان الجلد من المركز إلى المحيط الشعر ثلاث مرات مع مطهر (مثل الكلورهيكسيدين 0.5 ٪) محليا وحقن خليط من يدوكائين (20 ملغ / مل) والأدرينالين (5 ملغ / مل) لتخدير موضعي ، وتضيق الأوعية (لمنع النزيف).
- إجراء شق الأمامي الخلفي من حوالي 2.5 سم على خط الوسط من فروة الرأس ، والانتقال من بين عينيه حتى الجزء الخلفي من الأذن. استخدام المشابك البلدغ 4-6 لقرصة قبالة الجلد والحفاظ على شق مفتوحة. إزالة أي نسيج الموصول مع و / أو ملعقة والقطن مسحات تنظيف المنطقة للكشف عن سطح الجمجمة.
- معرفة ما اذا كان رئيس هو مستوى : أولا ، إيجاد امدا ووضع قنية دليل على هذا الموقع بالضبط ، ولمس الجمجمة. سجل تنسيق ظهراني البطني. المقبل ، وضع قنية دليل على Bregma بالضبط ، ولمس الجمجمة ، وسجلها في بطني ظهراني تنسيق. ينبغي أن تكون هذه الإحداثيات الاثنين سيكون متطابقة. إذا كان الفرق هو> 0.3 مم ، وضبط شريط الأنف لتصحيح ذلك.
- Mأك اثنين من الثقوب الصغيرة لتثبيت المسامير الجمجمة باستخدام الحفر ناحية تعقيم (واحد ما يقرب من 5 مم إلى الموقع الأمامي للقنية في أحد نصفي الكرة الأرضية وغيرها من 5 ملم الخلفي إلى الموقع قنية في نصف الكرة الأرضية المقابل). مكان اثنين من البراغي العقيمة في هذه الثقوب حتى يتم بإحكام الراسية فيه ، دون أن تدرج بالكامل في الجمجمة.
- مع وضع قنية دليل بالضبط عند Bregma وتسجيل إحداثيات الأمامي الخلفي والجانبي. ويمكن حساب الموقع الصحيح لوضع دليل للقنية كل منطقة في الدماغ عن طريق إضافة أو طرح من Bregma ، مع المعونة من الأطلس التجسيمي 9-11.
- موقف قنية الدليل في موقعها الصحيح ، ولمس قليلا الجمجمة. سجل تنسيق ظهراني البطني. التنسيب للقنية الثنائية ، والعثور على الموقع التالي قنية في نصف الكرة الآخر ، وسجل مرة أخرى تنسيق ظهراني البطني. وينبغي أن تكون متطابقة كلا إحداثيات (أو تختلف <0.3 مم).
- بمناسبة المواقع قنية على الجمجمة مع قلم رصاص ومعقمة ، مع الحفار ناحية ، وجعل الثقوب لدغ ، والتحقق من حجم والموقع الصحيح مع المعونة من قنية الدليل. مرة واحدة مصنوعة من الثقوب ، واستخدام إبرة معقمة لكمة بلطف السحايا للسماح الإدراج دون عائق للقنية.
- وضع قنية في الحفرة الأولى وأقل بعناية حتى يصل إلى تنسيق النهائي البطني. تحضير الاسمنت الأسنان وتطبيق ذلك في جميع أنحاء بسخاء قنية واحد أو مسامير على حد سواء من أجل إصلاح قنية. انتظر حتى الاسمنت قد جفت تماما. بعد ذلك ، إزالة بعناية من خلال تحويل الدعم قنية صعودا شريط ظهراني البطني.
- وضع قنية الثاني في دعم وانتقل إلى موقع قنية في نصف الكرة الأرضية الآخر. وضع قنية في حفرة وكرر الخطوة السابقة. مسامير وتغطية سطح كبير من cannulas مع الاسمنت ، وقبل أن يجف الأسمنت ، وإزالة أي فائض من الجلد.
- حقن دافئة (~ 37 درجة مئوية) ملحي معقم (~ 10 مل / كجم ، SC) لضمان معالجة الجفاف.
- بعد الاسمنت قد جفت تماما ، وإزالة الدعم قنية ووضع دبوس معقم في كل قنية لمنع العرقلة.
- تنظيف منطقة الجرح بمحلول ملحي معقم وخياطة الأمامي والجزء الخلفي من الجرح.
- إزالة الحيوان من جهاز التجسيمي ، لتحل محل أنابيب الغاز أمام أنفها. مواصلة رصد مستوى تشبع الأوكسجين ودرجة حرارة الجسم.
- إذا تم استخدام حقن مخدر مع dexmedetomidine ، وضخ atipamezole لها خصم (0.25 ملغم / كغم ، SC) ، وانتظر حتى يستيقظ الحيوان (حوالي 5 دقائق).
- وضع الفئران في قفص الانتعاش. لتجنب انخفاض حرارة الجسم ، ومكان القفص في حاضنة عند 28 درجة مئوية أو على وسادة التدفئة في المكان الذي يمكنك مراقبة الحيوانات لمدة ساعة على الأقل ، قبل إعادته إلى غرفة الحظيرة.
3. الرعاية بعد الجراحة
- خلال أول 4 أيام بعد الجراحة ، ورصد الانتعاش الفئران عن طريق حفظ السجلات اليومية من وزنه والملاحظات الأخرى المتعلقة شرط من الحيوانات في المختبر أو في دفاترها "يوميات الرفق بالحيوان".
- الحيوانات التي تظهر علامات صريحة للعدوى والمرض من الخسارة ، الجرح من وزن الجسم أو علامات أخرى لرعاية خاصة تقلص الرفاه ، يجب أن تخضع مثلا : جرعة زائدة من المسكنات لتخفيف آلام ما بعد الجراحة ، وهي مزيج من المواد الغذائية والمياه ومسحوق بالإضافة إلى طعام القياسية لتحفيز شهية الفئران ، و / أو الحقن تحت الجلد من المياه المالحة لدعم الإماهة.
- إذا كانت الفئران لا تظهر أي تحسن بعد هذه التدخلات ، أو فقدان وزن الجسم هو> 15 ٪ (مقارنة مع ما قبل الجراحة الوزن) ، التضحية الحيوانية مع جرعة زائدة من مخدر (إنسانية نقطة النهاية).
- الجرذان تحتاج عادة لاسترداد ما لا يقل عن 7 أيام قبل بدء التجارب السلوكية.
4. ممثل النتائج
jove_content "> لتحديد ما إذا كانت تعديلات مختلفة لإجراءاتنا الجراحية ، وخاصة فيما يتعلق مكملات الأوكسجين والرصد المستمر لمستويات الأوكسجين في الدم ومعدل ضربات القلب وحرارة الجسم ، وتعزيز بقاء الحيوان وتحسين حالته العامة بعد الجراحة ، وقارنا غير البقاء على قيد الحياة بنسبة 20 أفواج من الحيوانات (الفئران التي تتكون من 20 لكل منهما) الذي خضع لعملية جراحية بعد أن نفذت هذه التعديلات مع معدل البقاء على قيد الحياة غير الأفواج من 24 (20 فئران لكل منهما) تعمل مع بروتوكول قياسي. وكما هو مبين في الشكل 1A ، خفض ملحوظ في معدل البقاء على قيد الحياة غير في عينة من الأفواج التي كانت تعمل مع بروتوكول تعديل (P <0.05 ؛ مان ويتني U اختبار ، واثنين من الذيل). علاوة على ذلك ، كما هو مبين في الشكل 1B ، وفقدان الوزن بعد الجراحة من الفئران يعمل مع بروتوكول تعديل كان أيضا انخفاضا ملحوظا بالمقارنة مع الفئران التي لتعمل مع الإجراء العادي (ما بعد الجراحة يوم 1 : P <0.05 ؛ بعد الجراحة يوم 2 : P <0.01 ، بعد العملية الجراحية يوم 3 : P = 0.17 ، t للطلاب الاختبارات).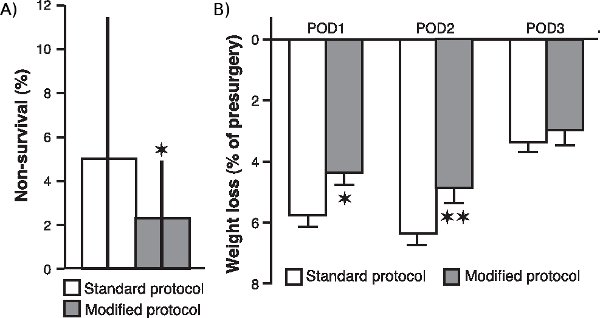
الشكل 1. تأثير التعديلات الجراحية على غير معدل البقاء في مرحلة ما بعد العمليات الجراحية وفقدان الوزن. (أ) عدم بقاء معدل الفئران يعمل مع بروتوكول تعديل بالمقارنة مع الفئران التي لتعمل مع بروتوكول قياسي. تم احتساب معدل البقاء على قيد الحياة غير (الوسيط ± الشرائح الربعية يتراوح) كنسبة مئوية من الفئران ، في الفوج 20 من الفئران ، التي لم تنج الجراحة. * ع <0.05 ، مان ويتني U اختبار اثنين الذيل (ن = 20 أفواج من أجل بروتوكول تعديل والأفواج 24 لبروتوكول قياسي). (ب) فقدان الوزن (يعني ± SEM كنسبة مئوية من الوزن قبل الجراحة) خلال الثانية الأولى ، (POD1) (POD2) والثالثة (POD3) في اليوم ما بعد الجراحة. * P <0.05 ** ، ف <0.01 ، طالبة اختبار t (ن = 60 في كل مجموعة).
Discussion
الغرض الرئيسي من هذا العرض الفيديو هو تعريف علماء الأعصاب السلوكي مع المبادئ الأساسية لعملية جراحية التجسيمي. قد الباحثين الذين يؤدون بالفعل جراحة التجسيمي أيضا الاستفادة من هذا الفيديو والنظر في بعض التحسينات الإجرائية للاستخدام في المختبرات الخاصة. المعرفة المت...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
الكتاب نشكر الدكتور بيتر Gerrits عن الرسوم التي استخدمت في الفيديو.
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | ||
| 70 ٪ كحول | VWR | ||
| Antisedan (atipamezole) | اوريون | ||
| سلفات الأتروبين 0،5 | Pharmachemie BV | ||
| البلدغ المشبك تخثر الدم | Aesculap | ||
| Cannulas | المكون شركة التموين | ||
| الكلورهيكسيدين 0.5 ٪ | AppepPharma | ||
| مسحوق التنظيف | Alconox | ||
| القطن العصي | هارتمان BV | ||
| Dexdomitor (dexmedetomidine) | اوريون | ||
| حفر | DREMEL 8000 | ||
| Duratears Z | ألكون | ||
| Durogrip Naaldvoerder العكس 130mm | Aesculap | ||
| Durotip Fijne schaar ret.sp / ش 110 ملم | Aesculap | ||
| الشاش | Medicomp (5x5) | ||
| تدفئة وسادة | جهاز هارفارد | ||
| الحشرات دبابيس (stylets) | Entosphinx (Republik التشيكية) | ||
| الكيتامين 10 ٪ (الكيتامين) | Alfasan | ||
| الدقيقة هالستيد طرف مستقيم | Aesculap ، طبيب بيطري | ||
| Molinea | هارتمان BV | ||
| كلوريد الصوديوم 0،9 ٪ | باكستر | ||
| الإبر (25G) | Terumo | ||
| مقياس التأكسج | عيدان الآلات ، وشركة | ||
| بنتوباربيتال | صيدلية للUMCG | ||
| Rimadyl | شركة فايزر | ||
| شفرة مشرط رقم 23 | سوان مورتون | ||
| Scalpelholder NR. 4 133 ملم | Aesculap | ||
| برغي سائق | الأجهزة التقليدية مخزن | ||
| رابيد البسيط (الاسمنت الأسنان) | Kemdent | ||
| الجمجمة مسامير | المكون شركة التموين | ||
| ملعقة الصيدلي | VWR | ||
| Spongestan الخاصة | جونسون آند جونسون | ||
| Stereotacts | Kopf الآلات | ||
| ملقط جراحي 100mm | Aesculap | ||
| الدرز Safil المادة 5 / 0 | Aesculap | ||
| محقنة 10 مل | Omnifix | ||
| المحاقن 1ml | Terumo | ||
| حقنة 5ml | Omnifix | ||
| Xylocaine (يدوكائين / الأدرينالين) | استرا زينيكا |
References
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved