Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Chirurgie stéréotaxique rongeurs et des améliorations pour la protection des animaux Résultat Behavioral Neuroscience
Dans cet article
Résumé
Chirurgie stéréotaxique sur des rongeurs permet l'administration ciblée de médicaments ou la stimulation électrique et les enregistrements dans Réveillez-vous, de se comporter des animaux. Dans cette présentation vidéo, nous allons montrer des dernières améliorations procédurales à cette procédure depuis longtemps que le taux de survie et réduit réussi à améliorer la perte de poids post-chirurgicale.
Résumé
Chirurgie stéréotaxique pour l'implantation de canules dans les régions spécifiques du cerveau a été pendant de nombreuses décennies une technique très réussie expérimentale pour étudier les effets des neurotransmetteurs au niveau local manipulé et voies de signalisation dans éveillés, les animaux se comportent. Par ailleurs, l'implantation stéréotaxique d'électrodes de stimulation et des études électrophysiologiques d'enregistrement a été déterminant pour notre compréhension actuelle de la neuroplasticité du cerveau et des réseaux dans le comportement des animaux. Connaissances sans cesse croissantes sur l'optimisation des techniques chirurgicales chez les rongeurs 1-4, sensibilisation du public concernant les questions de bien-être animal et de la législation stricte (par exemple, la directive 2010 de l'Union européenne sur l'utilisation des animaux de laboratoire 5) nous a incité à affiner ces procédures chirurgicales, en particulier en ce qui concerne la mise en œuvre de nouvelles procédures pour la supplémentation en oxygène et la surveillance continue de l'oxygénation du sang et des niveaux de fréquence cardiaque pendant l'intervention chirurgicale ainsi quel'introduction d'un protocole normalisé pour soins post-chirurgicaux. Nos observations indiquent que ces modifications conduit à un taux de survie accru et une amélioration de l'état général des animaux après la chirurgie (par exemple moins de perte de poids et un animal plus active). Cette présentation vidéo montrera les procédures générales impliquées dans ce type de chirurgie stéréotaxique avec une attention particulière à notre plusieurs modifications. Nous allons illustrer ces procédures chirurgicales chez les rats, mais il est également possible d'effectuer ce type de chirurgie chez la souris ou d'autres petits animaux de laboratoire en utilisant des adaptateurs spéciaux pour l'appareil de stéréotaxie 6.
Protocole
Note: Les techniques antiseptiques doivent être utilisés durant toute la procédure. Tous les instruments et les matériaux (coton-tige tampons de gaze, etc) qui sera utilisé pendant la chirurgie doivent être stérilisées à l'autoclave. Un masque chirurgical, bonnet de cheveux et gants stériles devraient être portés. La zone de travail et de l'appareil de stéréotaxie devraient être entièrement nettoyés et désinfectés avec une solution d'éthanol à 70%.
1. Pré-chirurgicales
- Mettre en place l'appareil de stéréotaxie et tous les matériaux nécessaires. Pré-chauffer le coussin chauffant.
- Placer la canule dans son support et vérifier si elle est droite.
- Allumez le système de gaz - mélange de l'air ambiant et d'oxygène (30-35% du débit total devrait être l'oxygène).
- Peser le rat et d'administrer l'anesthésie. Nous utilisons un mélange de kétamine (37,5 mg / kg) et dexmédétomidine (0,25 mg / kg) injectée par voie sous cutanée. Pour les protocoles d'anesthésie différents, voir Flecknell 4 et HellebrekerS et al. 7.
- Après le rat a perdu conscience, raser la zone de la tête va de l'oreille à juste entre les yeux avec un rasoir électrique.
- Placez le rat sur le coussin chauffant, avec son nez en face du tuyau à air. Utiliser un oxymètre de s'assurer que le rat a un niveau d'oxygénation sanguine adéquate (ne doit pas descendre <90%). S'il vous plaît suivez les instructions du fabricant pour une utilisation correcte du matériel.
- Appliquez la crème des yeux (Duratears Z, Alcon) sur les deux cornées pour éviter la déshydratation.
- Vérifiez réflexes du rat (tail réflexe ou le pincement pincer réflexe, comme démontré dans Walantus et al. 8) afin de s'assurer qu'il est correctement anesthésié. Si le rat continue de montrer des réflexes forte, la supplémentation d'anesthésie pourraient être nécessaires.
- Si aucun réflexe de toe-pincement est montré, place le rat dans l'appareil de stéréotaxie, d'ajuster les barres d'oreille afin qu'il montre la lecture égale des deux côtés, et placer à nouveau le tuyau d'air en face de l'animalen le fixant avec la barre de nez. Vérifiez à nouveau si le rat montre un niveau d'oxygénation du sang de 90% ou plus. Sinon, ajustez soit la tuyauterie, la rapprochant de la truffe, ou augmenter le débit d'oxygène. Surveiller le niveau d'oxygénation du sang et le rythme cardiaque tout au long de la chirurgie.
- Surveiller en permanence la température du rat avec un thermomètre rectal (de préférence relié à un coussin chauffant) et enregistrer les valeurs au début et à la fin de la chirurgie. Ajustez le coussin chauffant ou d'utiliser une couverture pour maintenir une température corporelle de 37,5 à 38,5 ° C.
2. Chirurgie
- Injecter l'analgésique. Nous utilisons un seul péri-opératoire administration de carprofène (4,0 à 5,0 mg / kg, voie sous-cutanée). Pour différents protocoles antalgiques, voir Hellebrekers et al. 7.
- Nettoyez la zone rasée de til la peau du centre vers le périmètre cheveux trois fois avec un désinfectant (par exemple, la chlorhexidine 0,5%) et localement injecter un mélange de lidocaïne (20 mg / ml) et d'adrénaline (5 mg / ml) pour l'anesthésie locale et une vasoconstriction (pour éviter saignement excessif).
- Faire une incision antéro-postérieure d'environ 2,5 cm sur la ligne médiane du cuir chevelu, allant entre les yeux jusqu'à l'arrière des oreilles. Utilisez 4-6 pinces bulldog pour pincer la peau et à garder l'incision ouverte. Retirez tout tissu conjonctif avec une spatule et / ou de coton tiges et nettoyer la zone afin d'exposer la surface du crâne.
- Vérifier si la tête est au niveau: d'abord, trouvez Lambda et le lieu de la canule guide exactement au-dessus de cet emplacement, en touchant le crâne. Enregistrement des coordonnées dorso-ventrale. Ensuite, placez la canule guide exactement au-dessus Bregma, touchant le crâne, et enregistrer son dorso-ventrale de coordonnées. Ces deux coordonnées devraient être identiques. Si la différence est> 0,3 mm, ajuster la barre du nez pour la corriger.
- MAke deux petits trous pour la fixation des vis du crâne à l'aide une perceuse à main stérilisés (une d'environ 5 mm en avant de l'emplacement canule dans l'un des hémisphères et l'autre postérieure de 5 mm à l'emplacement canule dans l'hémisphère controlatéral). Placez deux vis stérile dans ces trous jusqu'à ce qu'ils soient bien ancrés, sans être complètement insérée dans le crâne.
- Avec la canule guide placé exactement au bregma, enregistrer les coordonnées antéro-postérieure et latérale. L'emplacement correct du guide canule de placement pour chaque région du cerveau peut être calculé en ajoutant ou en soustrayant de Bregma, avec l'aide d'un atlas stéréotaxique 9-11.
- Position de la canule guider dans son emplacement correct, légèrement toucher le crâne. Enregistrement des coordonnées dorso-ventrale. Pour la canule de placement bilatéral, trouver l'emplacement suivant canule dans l'autre hémisphère, et à nouveau enregistrer les coordonnées dorso-ventrale. Les deux coordonnées devraient être identiques (ou diffèrent <0,3 mm).
- Marquez les emplacements canule sur le crâne avec un crayon stérile et, avec le foreur main, faire les trous bavure, la vérification de la taille et l'emplacement correct à l'aide de la canule guide. Une fois les trous sont faits, l'utilisation d'une aiguille stérile pour doucement poinçon les méninges pour permettre l'insertion sans obstruction de la canule.
- Placer la canule dans le premier trou et l'abaisser avec soin jusqu'à ce qu'elle atteigne la coordonnée finale ventraux. Préparez le ciment dentaire et l'appliquer généreusement autour de la canule et un ou deux vis pour fixer la canule. Attendez jusqu'à ce que le ciment a séché complètement. Ensuite, retirez soigneusement le support canule en tournant la barre de haut dorso-ventrale.
- Placez la deuxième canule dans le support et accédez à l'emplacement canule dans l'autre hémisphère. Placer la canule dans le trou et répétez l'étape précédente. Couvrir les vis et une grande surface des canules avec le ciment, et avant que le ciment est sec, enlever tout excédent de la peau.
- Injecter chaud (~ 37 ° C) une solution saline stérile (~ 10 ml / kg, sc) pour assurer la réhydratation.
- Après que le ciment est complètement sèche, retirez le support canule et placer une épingle stérile dans chaque canule pour empêcher l'obstruction.
- Nettoyer la plaie avec une solution saline stérile et suturer le recto et le verso de la plaie.
- Retirer l'animal de l'appareil de stéréotaxie, en remplacement de la tuyauterie de gaz à l'avant de son nez. Continuer à surveiller le niveau de saturation en oxygène et la température du corps.
- Si un anesthésique injectable avec dexmédétomidine est utilisé, injecter son atipamézole antagoniste (0,25 mg / kg, sc) et attendre que l'animal se réveille (environ 5 minutes).
- Placez le rat dans une cage de récupération. Pour éviter l'hypothermie, placez la cage dans un incubateur à 28 ° C ou sur un coussin chauffant dans un endroit où vous pouvez observer l'animal pendant au moins une heure, avant de le retourner à la salle de vivarium.
3. Soins post-chirurgicaux
- Durant les 4 premiers jours après la chirurgie, surveiller le rétablissement du rat par la tenue des registres quotidiens de poids et d'autres observations concernant l'état de l'animal dans des registres de laboratoire ou "journaux bien-être animal».
- Les animaux qui montrent des signes manifestes de la maladie, une infection de la plaie, perte de poids ou d'autres signes d'une attention particulière au bien-être réduite doivent subir: par exemple, une dose supplémentaire d'antalgiques afin de minimiser la douleur post-opératoire, un mélange de nourriture en poudre et l'eau en plus des standards chow pour stimuler l'appétit du rat, et / ou une injection sous-cutanée d'une solution saline pour soutenir la réhydratation.
- Si le rat ne montre aucune amélioration après ces interventions, ou de la perte de poids est> 15% (par rapport à la chirurgie pré-poids), le sacrifice de l'animal avec une surdose d'anesthésique (humaine point final).
- Les rats ont généralement besoin de récupérer pendant au moins 7 jours avant le début des expériences comportementales.
4. Les résultats représentatifs
jove_content "> Pour déterminer si les diverses modifications à notre intervention chirurgicale, notamment en matière de supplémentation en oxygène et la surveillance continue des niveaux d'oxygénation du sang, le rythme cardiaque et la température du corps, amélioré la survie de l'animal et l'amélioration de son état général après la chirurgie, nous avons comparé les non du taux de survie de 20 cohortes d'animaux (composé de 20 rats chacun) qui a subi une opération après que nous ayons mis en œuvre ces modifications avec le taux de non-survie de 24 cohortes (20 rats chacun) fonctionne avec le protocole standard. Comme il est montré dans la figure 1a , le taux de non-survie a été significativement réduite dans l'échantillon des cohortes qui a été opéré avec le protocole modifié (P <0,05; de Mann-Whitney U test, deux à queue). Par ailleurs, comme le montre la figure 1b, la perte de poids post-chirurgicale des rats opérés avec le protocole modifié a été également significativement réduite par rapport à celle des rats opérés à la procédure standard (jour post-opératoire 1: p <0,05; jour post-opératoire 2: P <0,01; jour post-opératoire 3: P = 0,17; t de Student-tests).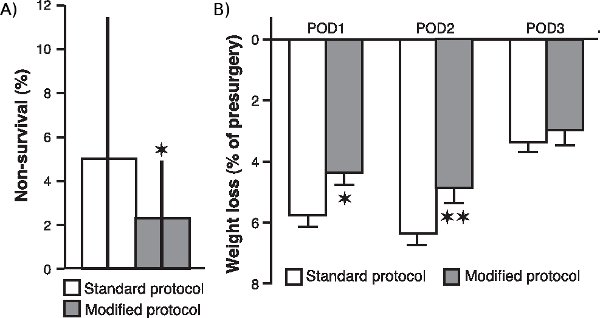
Figure 1. Effet des modifications sur la non-chirurgicale taux de survie et de la perte de poids post-chirurgicale. (A.) Non-Taux de survie des rats opérés avec le protocole modifié par rapport à celle des rats opérés avec le protocole standard. Le taux de non-survie (médiane ± interquartile gammes) a été calculé comme le pourcentage de rats, par cohorte de 20 rats, qui n'ont pas survécu chirurgie. * P <0,05, test de Mann-Whitney U test de deux Virginie (n = 20 cohortes pour le protocole modifié et 24 cohortes pour le protocole standard). La perte de poids (B.) (moyenne ± SEM en tant que pourcentage de la pré-chirurgie de poids) pendant la première (Pod1), deuxième (POD2) et troisième (POD3) jour post-opératoire. * P <0,05, ** P <0,01, test t de Student (n = 60 par groupe).
Discussion
Le but principal de cette vidéo de présentation est de familiariser les neuroscientifiques comportementaux avec les principes fondamentaux de la chirurgie stéréotaxique. Les chercheurs qui sont déjà de la chirurgie stéréotaxique pourraient également bénéficier de cette vidéo et d'examiner certains des raffinements de procédure pour l'utilisation dans leur propre laboratoire. Une connaissance de plus en plus sur l'optimisation des techniques chirurgicales 1-3, le développement de nouv...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs remercient le Dr Peter Gerrits pour les dessins utilisés dans la vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | ||
| 70% d'alcool | VWR | ||
| Antisedan (atipamézole) | Orion | ||
| Le sulfate d'atropine 0,5 | Pharmachemie BV | ||
| Bulldog pince hémostatique | Aesculap | ||
| Canules | Component Supply Co. | ||
| Chlorhexidine 0,5% | AppepPharma | ||
| Nettoyage de poudre | Alconox | ||
| Bâtonnets ouatés | Hartmann BV | ||
| Dexdomitor (dexmédétomidine) | Orion | ||
| Forage | Dremel 8000 | ||
| Duratears Z | Alcon | ||
| Durogrip Naaldvoerder converser 130mm | Aesculap | ||
| Durotip Fijne Schaar ret.sp / st 110 mm | Aesculap | ||
| Gaze | Medicomp (5x5) | ||
| Coussin chauffant | Harvard Apparatus | ||
| Broches d'insectes (stylets) | Entosphinx (République Tchèque) | ||
| La kétamine à 10% (kétamine) | Alfasan | ||
| Micro-Halsted panne droite | Aesculap-vet | ||
| Molinea | Hartmann BV | ||
| NaCl 0,9% | Baxter | ||
| Aiguilles (25G) | Terumo | ||
| Oxymètre | Edan Instruments, Inc | ||
| Pentobarbital | Pharmacie de l'UMCG | ||
| Rimadyl | Pfizer | ||
| Scalpel lame No. 23 | Swann Morton | ||
| NR Scalpelholder. 4 133 mm | Aesculap | ||
| Tournevis | Quincaillerie conventionnelles | ||
| Simplex rapide (ciment dentaire) | Kemdent | ||
| Vis Crâne | Component Supply Co. | ||
| Spatule | VWR | ||
| Spongestan spéciaux | Johnson & Johnson | ||
| Stereotacts | Kopf Instruments | ||
| Pinces chirurgicales 100mm | Aesculap | ||
| Matériel de suture Safil 5 / 0 | Aesculap | ||
| Seringue de 10 ml | Omnifix | ||
| Seringue 1ml | Terumo | ||
| Seringue 5ml | Omnifix | ||
| Xylocaïne (lidocaïne / adrénaline) | Astra Zeneca |
Références
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon