È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Chirurgia Stereotassica roditori e animali Miglioramenti Esito di assistenza sociale per Behavioral Neuroscience
In questo articolo
Riepilogo
Chirurgia stereotassica sui roditori permette per la somministrazione mirata di farmaci o di stimolazione elettrica e le registrazioni in sveglio, comportandosi animali. In questo video di presentazione mostreremo recenti perfezionamenti procedurali a questa lunga procedura che il tasso di sopravvivenza con successo migliorato e ridotto post-chirurgica perdita di peso.
Abstract
Chirurgia stereotassica per l'impianto di cannule in regioni specifiche del cervello è stata per molti decenni una tecnica di grande successo sperimentale per studiare gli effetti del neurotrasmettitore a livello locale manipolati e vie di segnalazione in sveglio, gli animali si comportano. Inoltre, l'impianto stereotassico di elettrodi per la stimolazione elettrofisiologica e studi di registrazione è stato determinante per la nostra comprensione attuale della neuroplasticità del cervello e delle reti nel comportarsi animali. Conoscenza sempre più su come ottimizzare le tecniche chirurgiche nei roditori 1-4, sensibilizzazione sulle questioni del benessere degli animali e legislazione (ad esempio, per il 2010 la direttiva dell'Unione Europea sull'uso degli animali da laboratorio 5) ci hanno spinto ad affinare queste procedure chirurgiche, con particolare riguardo ad attuare nuove procedure per la supplementazione di ossigeno e il monitoraggio continuo di ossigenazione del sangue e dei livelli di frequenza cardiaca durante l'intervento così comel'introduzione di un protocollo standardizzato per la cura post-chirurgica. Le nostre osservazioni indicano che queste modifiche ha comportato un tasso di aumento della sopravvivenza e un miglioramento delle condizioni generali degli animali dopo l'intervento chirurgico (ad esempio la perdita di peso in meno e un animale più attivo). Questa presentazione video mostrerà le procedure generali coinvolti in questo tipo di chirurgia stereotassica con particolare attenzione alle nostre diverse modifiche. Si illustreranno queste procedure chirurgiche nei ratti, ma è anche possibile eseguire questo tipo di intervento chirurgico nei topi o altri piccoli animali da laboratorio, utilizzando adattatori speciali per l'apparato stereotassico 6.
Protocollo
Nota: le tecniche di antisettico devono essere impiegati durante l'intera procedura. Tutti gli strumenti ed i materiali (cotone con punta tamponi, garze, ecc) che verranno utilizzati durante l'intervento chirurgico dovrebbe essere sterilizzati in autoclave. Una mascherina chirurgica, cofano capelli e guanti sterili devono essere indossati. L'area di lavoro e l'apparato stereotassico devono essere puliti accuratamente, e disinfettati con una soluzione di etanolo al 70%.
1. Pre-chirurgica procedure
- Sistemare il dispositivo stereotassico e tutti i materiali necessari. Preriscaldare il riscaldamento pad.
- Posizionare la cannula in suo sostegno e controllare se è diritta.
- Accendere il sistema gas - miscela di aria ambiente e ossigeno (30-35% del flusso totale dovrebbe essere di ossigeno).
- Pesare il ratto e amministrare l'anestetico. Stiamo usando una miscela di ketamina (37,5 mg / kg) e dexmedetomidina (0,25 mg / kg) iniettata per via sottocutanea. Per i protocolli di anestesia diverso, cfr Flecknell 4 e Hellebrekers et al. 7.
- Dopo il ratto perso conoscenza, radere la zona della testa va dalle orecchie al proprio in mezzo agli occhi con un rasoio elettrico.
- Posizionare il topo sul pad di riscaldamento, con il naso di fronte al tubo dell'aria. Usare un ossimetro per garantire che il ratto ha un adeguato livello di ossigenazione del sangue (non deve cadere <90%). Si prega di seguire le istruzioni del produttore per un uso corretto di attrezzature.
- Applicare la crema occhi (Duratears Z, Alcon) su entrambe le cornee per evitare la disidratazione.
- Verificare i riflessi del ratto (coda di riflesso o toe-pizzico riflesso, come dimostrato in Walantus et al. 8) per assicurare che sia adeguatamente anestetizzato. Se il topo continua a mostrare forti riflessi, la supplementazione di anestesia potrebbe essere necessario.
- Se non toe-pinch riflesso viene mostrato, posto il topo dell'apparato stereotassico, regolare le barre di orecchio in modo che si vede leggendo uguale su entrambi i lati, e posto di nuovo il tubo aria davanti l'animalefissandolo con la barra di naso. Verificare di nuovo se il topo mostra un livello di ossigenazione del sangue del 90% o superiore. In caso contrario, regolare le tubazioni, avvicinandolo al naso, o aumentare il flusso di ossigeno. Monitorare il livello di ossigenazione del sangue e la frequenza cardiaca durante l'intervento chirurgico.
- Monitorare costantemente la temperatura del ratto con un termometro rettale (preferibilmente collegato ad una piastra elettrica) e registrare i valori all'inizio e alla fine dell'intervento. Regolare il termoforo o utilizzare una coperta per mantenere una temperatura corporea di 37,5-38,5 ° C.
2. Chirurgia
- Iniettare l'analgesico. Stiamo utilizzando un unico peri-operatorio la somministrazione di carprofen (4,0-5,0 mg / kg per via sottocutanea). Per diversi protocolli di analgesici, vedere Hellebrekers et al. 7.
- Pulire l'area rasata di tha la pelle dal centro verso il perimetro dai capelli tre volte con un disinfettante (es. clorexidina 0,5%) e localmente iniettare una miscela di lidocaina (20 mg / ml) e adrenalina (5 mg / ml) per l'anestesia locale e vasocostrizione (per evitare eccessivo sanguinamento).
- Fate una antero-posteriore incisione di circa 2,5 cm sulla linea mediana del cuoio capelluto, che va dal mezzo agli occhi fino a quando la parte posteriore delle orecchie. Usa 4-6 morsetti bulldog per pizzicare fuori la pelle e per mantenere l'incisione aperta. Rimuovere eventuali tessuto connettivo con una / o spatola e tamponi di cotone e pulire l'area per esporre la superficie del cranio.
- Controllare se la testa è di livello: in primo luogo, trovare Lambda e posizionare la cannula guida esattamente su questa posizione, toccando il cranio. Registrare la dorso-ventrale coordinate. Quindi, posizionare la cannula guida esattamente nel bregma, toccando il cranio, e registrare il suo dorso-ventrale coordinate. Queste due coordinate dovrebbero essere identici. Se la differenza è> 0,3 mm, regolare la barra naso per correggerlo.
- Make due piccoli fori per il fissaggio delle viti cranio con un trapano a mano sterilizzato (uno di circa 5 mm anteriore alla posizione cannula in uno degli emisferi e gli altri 5 mm posteriormente alla posizione cannula nell'emisfero controlaterale). Inserire due viti sterili in questi fori fino a quando non sono strettamente ancorate, senza essere inserito completamente nel cranio.
- Con la cannula guida posizionato esattamente al bregma, registrare le coordinate antero-posteriore e laterale. La posizione corretta di guida posizionamento cannula per ogni regione del cervello può essere calcolato aggiungendo o sottraendo dal bregma, con l'aiuto di un atlante stereotassico 9-11.
- Posizionare la cannula guida nella sua posizione corretta, leggermente toccando il cranio. Registrare la dorso-ventrale coordinate. Per bilaterali posizionamento cannula, trovare accanto la posizione cannula nell'altro emisfero, e ancora una volta registrare il dorso-ventrale coordinate. Entrambe le coordinate dovrebbero essere identici (o differiscono <0,3 mm).
- Contrassegnare le posizioni cannula sul cranio con una matita e sterile, con il trapano a mano, fare i buchi bava, controllando la dimensione e la posizione corretta con l'aiuto della cannula guida. Una volta che i fori sono fatti, utilizzare un ago sterile a pugni con delicatezza le meningi per consentire l'inserimento della cannula ostruita.
- Posizionare la cannula nel foro prima e abbassarlo delicatamente fino a raggiungere la quota finale ventrale. Preparare il cemento dentale e generosamente si applica in tutto il cannula e una o due viti per fissare la cannula. Attendere che il cemento si è asciugato completamente. Successivamente, rimuovere con attenzione il supporto cannula girando il dorso-ventrale verso l'alto bar.
- Posizionare la cannula secondo nel supporto e andare alla posizione cannula nell'altro emisfero. Posizionare la cannula nel foro e ripetere il passaggio precedente. Coprire le viti e una grande superficie di cannule con il cemento, e prima che il cemento è secco, rimuovere eventuali eccedenze dalla pelle.
- Iniettare caldo (~ 37 ° C) soluzione salina sterile (~ 10 ml / kg, sc) per garantire la reidratazione.
- Dopo che il cemento si è completamente asciugato, rimuovere il supporto cannula e posto un perno in ogni cannula sterile per prevenire l'ostruzione.
- Pulire la zona ferita con soluzione salina sterile e suturare la parte anteriore e la parte posteriore della ferita.
- Rimuovere l'animale dal apparato stereotassico, sostituendo il tubo del gas davanti al suo naso. Continuare a monitorare il livello di saturazione di ossigeno e la temperatura corporea.
- Se un anestetico iniettabile con dexmedetomidina viene utilizzato, iniettare il suo antagonista atipamezolo (0,25 mg / kg, sc) e attendere che l'animale si sveglia (circa 5 minuti).
- Mettere il topo in una gabbia di recupero. Per evitare l'ipotermia, posto la gabbia in un incubatore a 28 ° C o su una piastra elettrica in un luogo dove si può osservare l'animale per almeno un'ora, prima di tornare alla sala vivaio.
3. Cura post-chirurgica
- Durante i primi 4 giorni dopo l'intervento, monitorare il recupero del ratto con la tenuta della contabilità quotidiana di peso e di altre osservazioni relative alla condizione degli animali nei giornali di bordo di laboratorio o "diari di benessere degli animali".
- Gli animali che mostrano evidenti segni di malattia, l'infezione della ferita della perdita, del peso corporeo o altri segni di ridotta benessere devono essere sottoposti a cure particolari: ad esempio, una dose supplementare di analgesici per ridurre al minimo dolore post-operatorio, una miscela di polvere di cibo e acqua in aggiunta al normale cibo per stimolare l'appetito del ratto, e / o l'iniezione sottocutanea di soluzione fisiologica a supporto reidratazione.
- Se il ratto non mostra alcun miglioramento dopo questi interventi, o la perdita di peso è> 15% (rispetto ai livelli pre-chirurgia peso), il sacrificio dell'animale con una dose eccessiva di anestetico (umano end-point).
- I ratti di solito bisogno di recuperare per almeno 7 giorni prima dell'inizio degli esperimenti comportamentali.
4. Rappresentante Risultati
jove_content "> Per determinare se le varie modifiche alla nostra procedura chirurgica, con particolare riguardo alla supplementazione di ossigeno e il monitoraggio continuo dei livelli di ossigenazione del sangue, battito cardiaco e temperatura corporea, migliorato la sopravvivenza dell'animale e migliorato la sua condizione generale dopo l'intervento, abbiamo confrontato l' non tasso di sopravvivenza di 20 coorti di animali (composto da 20 ratti ciascuno) che sottoposti a chirurgia dopo aver implementato queste modifiche con la non-sopravvivenza velocità di 24 coorti (20 ratti ciascuno), gestito con il protocollo standard. Come è mostrato in Figura 1a , il tasso di sopravvivenza non è risultata significativamente ridotta nel campione di coorti che è stato operato con il protocollo modificato (P <0,05; Mann-Whitney U test, a due code). Inoltre, come è mostrato nella figura 1b, post-chirurgica di perdita di peso di ratti operato con il protocollo è stato modificato anche significativamente ridotto rispetto a quello dei ratti operato con la procedura standard (giornata post-operatoria 1: p <0,05; giornata post-operatoria 2: P <0,01; giornata post-operatoria 3: P = 0.17; Student t-test).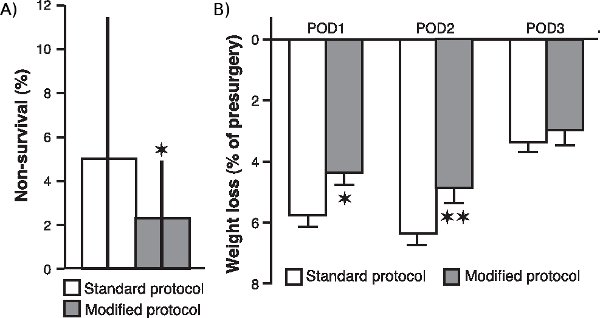
Figura 1. Effetto delle modifiche in materia di non-chirurgici tasso di sopravvivenza e post-chirurgica perdita di peso. (A.) Non tasso di sopravvivenza dei ratti operati con il protocollo modificato rispetto a quella dei ratti operato con il protocollo standard. Il non-tasso di sopravvivenza (mediana ± interquartile range) è stato calcolato come la percentuale di ratti, per coorte di 20 ratti, che non è sopravvissuto un intervento chirurgico. * P <0,05, Mann-Whitney U test a due code (n = 20 coorti per il protocollo modificato e 24 coorti per il protocollo standard). (B.) La perdita di peso (media ± SEM come percentuale del peso pre-intervento) durante i primi (POD1), secondo (POD2) e terzo (POD3) giornata post-operatoria. * P <0.05, ** P <0,01, test t di Student (n = 60 per gruppo).
Discussione
Lo scopo principale di questo video di presentazione è quello di familiarizzare i neuroscienziati comportamentali con i principi fondamentali della chirurgia stereotassica. I ricercatori che stanno già eseguendo la chirurgia stereotassica potrebbe anche beneficiare di questo video e prendere in considerazione alcuni dei perfezionamenti procedurali per l'uso in proprio laboratorio. Una sempre maggiore conoscenza su come ottimizzare le tecniche chirurgiche 1-3, lo sviluppo di nuovi anestetici e analgesici...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il Dott. Pietro Gerrits per i disegni utilizzati nel video.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | ||
| Alcool al 70% | VWR | ||
| Antisedan (atipamezolo) | Orion | ||
| Atropina solfato 0,5 | Pharmachemie BV | ||
| Bulldog pinza emostatica | Aesculap | ||
| Cannule | Componente Supply Co. | ||
| Clorexidina 0,5% | AppepPharma | ||
| Pulizia polvere | Alconox | ||
| Bastoncini di cotone | Hartmann BV | ||
| Dexdomitor (dexmedetomidina) | Orion | ||
| Trapano | Dremel 8000 | ||
| Duratears Z | Alcon | ||
| Durogrip Naaldvoerder conversare 130 millimetri | Aesculap | ||
| Durotip Fijne schaar ret.sp / st 110 millimetri | Aesculap | ||
| Garza | Medicomp (5x5) | ||
| Riscaldamento pad | Harvard Apparatus | ||
| Perni di insetti (stiletti) | Entosphinx (Repubblica Ceca) | ||
| Ketamina 10% (ketamina) | Alfasan | ||
| Micro-Halsted punta diritta | Aesculap-vet | ||
| Molinea | Hartmann BV | ||
| NaCl 0,9% | Baxter | ||
| Aghi (25G) | Terumo | ||
| Ossimetro | Edan Instruments, Inc. | ||
| Pentobarbital | Farmacia del all'UMCG | ||
| Rimadyl | Pfizer | ||
| Bisturi lama n. 23 | Swann Morton | ||
| Scalpelholder NR. 4 133 millimetri | Aesculap | ||
| Cacciavite | Hardware negozio convenzionale | ||
| Simplex Rapid (cemento dentale) | Kemdent | ||
| Cranio viti | Componente Supply Co. | ||
| Spatola | VWR | ||
| Spongestan speciale | Johnson & Johnson | ||
| Stereotacts | Kopf Instruments | ||
| Pinze chirurgiche 100 millimetri | Aesculap | ||
| Materiale di sutura Safil 5 / 0 | Aesculap | ||
| Siringa da 10 ml | Omnifix | ||
| Siringa da 1 ml | Terumo | ||
| Siringa da 5 ml | Omnifix | ||
| Xylocaine (lidocaina / adrenalina) | Astra Zeneca |
Riferimenti
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress?. Altern. Lab Anim. 33, 119-127 (2005).
- Stokes, E. L., Flecknell, P. A., Richardson, C. A. Reported analgesic and anaesthetic administration to rodents undergoing experimental surgical procedures. Lab Anim. 43, 149-154 (2009).
- Flecknell, P. A. . Laboratory Animal Anaesthesia - A Practical Introduction for Research Workers and Technicians. , (2009).
- . DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , (2010).
- Geiger, B. M., Frank, L. E., Caldera-Siu, A. D., Pothos, E. N. Survivable Stereotaxic Surgery in Rodents. J. Vis. Exp. (20), e880-e880 (2008).
- Hellebrekers, L. J., Booij, L. H. D. J., Flecknell, P. A., Van Zutphen, L. F. M., Baumans, V., Beynen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J. Vis. Exp. (6), e236-e236 (2007).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (1986).
- Paxinos, G., Watson, C. . The Rat Brain in Stereotaxic Coordinates. , (2007).
- Swanson, L. W. . Brain Maps: Structure of the Rat Brain. , (1992).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon