A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الإذابة والحيوية، من اقتران نقاط الكم وفحوصات السمية البكتيرية التي منحنى النمو والكونت بلايت
In This Article
Summary
ويمكن استخدام الجسيمات النانوية مثل نقاط الكم أشباه الموصلات (QDs) لإنشاء وكلاء photoactivatable لتطبيقات مضادة للميكروبات أو مضادة للسرطان. هذه التقنية يظهر كيفية المياه ذوبان تلوريد الكادميوم (تيل كد) QDs، المتقارن لهم مضاد حيوي، وإجراء فحص تثبيط البكتيريا على أساس منحنيات النمو والفرز لوحة.
Abstract
Quantum dots (QDs) are fluorescent semiconductor nanoparticles with size-dependent emission spectra that can be excited by a broad choice of wavelengths. QDs have attracted a lot of interest for imaging, diagnostics, and therapy due to their bright, stable fluorescence1,2 3,4,5. QDs can be conjugated to a variety of bio-active molecules for binding to bacteria and mammalian cells6.
QDs are also being widely investigated as cytotoxic agents for targeted killing of bacteria. The emergence of multiply-resistant bacterial strains is rapidly becoming a public health crisis, particularly in the case of Gram negative pathogens 7. Because of the well-known antimicrobial effect of certain nanomaterials, especially Ag, there are hundreds of studies examining the toxicity of nanoparticles to bacteria 8. Bacterial studies have been performed with other types of semiconductor nanoparticles as well, especially TiO2 9,10-11, but also ZnO12 and others including CuO 13. Some comparisons of bacterial strains have been performed in these studies, usually comparing a Gram negative strain with a Gram positive. With all of these particles, mechanisms of toxicity are attributed to oxidation: either the photogeneration of reactive oxygen species (ROS) by the particles or the direct release of metal ions that can cause oxidative toxicity. Even with these materials, results of different studies vary greatly. In some studies the Gram positive test strain is reportedly more sensitive than the Gram negative 10; in others it is the opposite 14. These studies have been well reviewed 15.
In all nanoparticle studies, particle composition, size, surface chemistry, sample aging/breakdown, and wavelength, power, and duration of light exposure can all dramatically affect the results. In addition, synthesis byproducts and solvents must be considered16 17. High-throughput screening techniques are needed to be able to develop effective new nanomedicine agents.
CdTe QDs have anti-microbial effects alone18 or in combination with antibiotics. In a previous study, we showed that coupling of antibiotics to CdTe can increase toxicity to bacteria but decrease toxicity to mammalian cells, due to decreased production of reactive oxygen species from the conjugates19. Although it is unlikely that cadmium-containing compounds will be approved for use in humans, such preparations could be used for disinfection of surfaces or sterilization of water.
In this protocol, we give a straightforward approach to solubilizing CdTe QDs with mercaptopropionic acid (MPA). The QDs are ready to use within an hour. We then demonstrate coupling to an antimicrobial agent.
The second part of the protocol demonstrates a 96-well bacterial inhibition assay using the conjugated and unconjugated QDs. The optical density is read over many hours, permitting the effects of QD addition and light exposure to be evaluated immediately as well as after a recovery period. We also illustrate a colony count for quantifying bacterial survival.
Protocol
1. QD الإذابة
هذا هو الأسلوب المناسب لتيل كد. ويمكن استخدام أساليب مماثلة مع أنواع أخرى من QDs مثل الشرطة الوطنية العراقية / 20 و اغشية CdSe / اغشية 21.
- يعد حل QDs تيل كد في التولوين في 15 ميكرومتر (الكثافة الضوئية = 2.5 في ذروة exciton الأول).
- نقل 200 ميكرولتر من هذا المخزون إلى قارورة من الزجاج. لا تستخدم البلاستيك!
- إضافة 800 التولوين ميكرولتر، 1 مل 200 مم العازلة بورات (الرقم الهيدروجيني 9) و 2 ميكرولتر من حامض M 11.5 mercaptopropionic (MPA).
- تتويج القارورة والتخلص منه بقوة لمدة 30-60 ثانية.
- وسوف المراحل مائي وعضوي المذيبات فصل من تلقاء أنفسهم. والمرحلة المائية يصبح لون QDs. لتجنب طبقة التولوين، إزالته والتخلص منه. ثم نقل المرحلة المائية إلى قارورة نظيفة.
- تنقية QDs solubilized بواسطة غسل / تصفية أربع مرات باستخدام ميكرولتر 500، 10000 قطع الوزن الجزيئي فلتر الطرد المركزي. يجب أن تكون المرشحاتنسج في 3000 XG لمدة 13 دقيقة. على الأقل ليغسل الماضيين، مع غسل العازلة النهائي المطلوب.
- بعد غسل النهائي، تعليق QDs غسلها في 50 ملي العازلة بورات في درجة الحموضة المطلوبة ومخزن في درجة مئوية 4 وسوف تكون مستقرة لمدة 1-2 أسابيع.
- قياس الامتصاصية وانبعاث الأطياف لتقدير تركيز على أساس الصيغ المنشورة 22.
نتائج ممثل: ويظهر الشكل 1 صورة QDs تيل كد تحت إضاءة مصباح الأشعة فوق البنفسجية، والأطياف الانبعاثات قبل وبعد الإذابة المياه، والتي تبين تغيير ضئيل للغاية من تاريخ تبادل قبعة. القيم هي حجم قطرها الأساسية التي تقاس المجهر الإلكتروني.
2. QD الإقتران إلى المضادات الحيوية
هذا الجزء من البروتوكول ينطبق على أي جسيمات متناهية الصغر للمياه solubilized المشحونة سلبا، بما في ذلك معظم QDs التجارية، والجزيئات المعدنية، و 19 أكثر.
- فإن أي عمل الجزيء الذي eithإيه ذاتيا إلى QDs المشحونة سلبا solubilized، أو أن لديه مجموعة على رد الفعل الذي يمكن أن يكون مترافق، مثل الأمينات الأولية. في هذا المثال، نحن نستخدم بوليميكسين باء (PMB)، والذي يحمل شحنة موجبة وذاتيا من دون الحاجة إلى اقتران الكواشف. حل PMB في H 2 O في 60 ميكرومتر. (وإذا كان اختيار المضادات الحيوية ليست قابلة للذوبان في H 2 O، ويحل في DMSO أو الإيثانول بتركيز 0،1-1 ملم). وسيكون هذا حلا 10X (في O 2 H) أو حل 100X (في المذيبات).
- حساب مقدار حل QD سوف تحتاج لتجارب سمية البكتيرية. لوحة 96-جيدا مع 0.3 مل لكل بئر في quadruplicates، هناك حاجة إلى 0.5 مل من المتقارن نانومتر 200. إعداد اثنين من أنابيب تحتوي على 100 ميكرولتر من النقاط الكم 1 ميكرومتر في 50 العازلة بورات ملي.
- إذا اقتران إلى أمين الأولية، وإعداد ملغ / 19 مل (100 ملم) حل من 1-الأثيل-3-[dimethylaminopropyl-3] هيدروكلوريد carbodiimide (EDC) في H 2 O. EDC في حل غير مستقر، واستخدام على الفور، ورمي ما تبقى بعيدا.
- إضافة 50 ميكرولتر من حل المضادات الحيوية 10X (في O 2 H) أو 5 ميكرولتر من الحل 100X (في المذيبات) إلى أنبوب المتقارن. لPMB: اقتران تيل كد في نسبة 30:1 من الرحى، بإضافة 50 ميكرولتر من PMB ميكرومتر 60. إضافة H 2 O أو مذيب للأنبوب مراقبة فقط QD.
- إذا لزم الأمر، إضافة 1 ميكرولتر من محلول المخزون EDC إلى أنبوب المتقارن.
- إظهار حجم المتقارن إلى 0.5 مل مع العازلة المناسبة (بورات عازلة أو برنامج تلفزيوني، ولا أمين المخازن التي تحتوي على مثل تريس، لأنها سوف تمنع EDC).
- أنابيب درع من الضوء مع رقائق الألومنيوم، ومكان على nutator أو الروك لمدة 1 ساعة. إذا تجميع يحدث، كرر اقتران مع تركيزات أقل من المضادات الحيوية. عاير صعودا حتى تركيز الجزيئات لا الكلي.
- غسل تقارن عن طريق تمرير من خلال مرشح مناسب. 10000 قطع الوزن الجزيئي يعمل لمعظم المضادات الحيوية، ولكن ليس للبروتينات أو الأجسام المضادة.
- وهذا يتوقف على جزيء، ويمكن استخدام أساليب مختلفة لتقدير عدد جزيئات مضاد حيوي لكل QD: الامتصاصية أو مضان الطيفي، هلام إستشراد، أو تحويل فورييه الطيفي بالأشعة تحت الحمراء (FTIR).
نتائج ممثل. في هذا المثال، يتميز PMB اقتران بسبب التغيرات في طيف الانبعاث QD. ويبين الشكل 2 أطياف QDs تيل كد مع إضافة PMB.
3. إعداد البكتيريا للشاشة 96-جيدا؛ تحديد IC المضادات الحيوية 50
هذا ينطبق على أي سلالة بكتيرية تقريبا نمت في المتوسط 18 مناسبة. طول الوقت الدقيق للتسجيلات ينبغي أن تستمر يتوقف على معدل نمو البكتيريا. في مثالنا، ونحن نستخدم القولونية التي تزرع في مرق lysogeny (LB) المتوسطة.
- من أجل اختيار المناسب تركيزات المتقارن QD، من المهم أن تعرفIC 50 من المضادات الحيوية ليكون مترافق وإذا كان وحده QDs سامة. وينبغي أن تبدأ هذه 2 قبل أيام من هذه التجربة الاقتران. في المساء، والبذور 10 مل من متوسط نمو البكتيريا من مستعمرة جديدة، وذلك باستخدام تقنية معقمة الصحيح والسلامة الحيوية.
- في اليوم التالي، 1-2 قبل ساعات من التجربة، وشغل كل من الآبار من لوحة 96-جيدا واضح القاع مع كمية تقريبا، الحد الأقصى من متوسط النمو. باستخدام الأقنية ماصة، والبذور بشكل جيد مع كل 1-50 ميكرولتر من ثقافة الجرثومي (تركيز سيعتمد على مدى سرعة سلالة معينة تنمو وسوف تحتاج إلى معايرة من قبل المختبرات الخاصة بك).
- وضع لوحة على القارئ لوحة وتعيينه لقراءة كل 10 دقائق لمدة 2 ساعة في طول موجة العزم (عادة 600 نانومتر). رصد لوحة بحيث لا تنمو بكتيريا كثيفة جدا بسرعة كبيرة جدا.
- عندما تصل إلى جميع الخلايا OD = 0،1-0،15، وإزالة لوحة من لوحة للقارئ، ووقف تسجيل.
- إضافة الدواء وحده، وحده في QDsتركيزات مختلفة في ما لا يقل عن triplicates. استخدام جانب واحد من لوحة كعنصر تحكم "الظلام" ونصف لتكون مضيئة. ويرد تخطيط واقترح في الشكل 3. يجب أن تركيزات تغطي مجموعة واسعة بما فيه الكفاية لتشمل واحدة تركيز الذي يمنع البكتيريا القليل جدا، واحد أن يقتل كل منهم.
- درع "الظلام" جانب من لوحة مع رقائق الألومنيوم. فضح الجانب الآخر لمصباح على الطول الموجي المطلوب. نستخدم عادة 96-جيدا، 440 نانومتر مصباح مصنوعة من المصابيح ميغاواط 2.4 (الشكل 4)، وأشرق لمدة 30-60 دقيقة. لوحات سوداء مع قيعان واضحة تساعد على حماية البكتيريا غير معلن من ضوء شارد. ويمكن أيضا عمود فارغ يمكن استخدامها بين الجانبين المكشوفة والمعرضة للامم المتحدة.
- بعد التعرض للضوء، ووضع لوحة في لوحة وقارئ سجل OD 600 كل 10 دقائق ل5-12 ساعة تبعا لمعدل النمو. الحفاظ على درجة الحرارة <32 درجة مئوية إذا كان ذلك ممكنا لتجنب جفاف الثقافات.
- رسم منحنيات النموفي نقطة زمنية محددة مقابل سجل [تركيز] وتحديد IC 50 من المضادات الحيوية باستخدام المعادلة هيل:

حيث H هو معامل هيل، واي ماكس هي أعلى نقطة من النمو (مثالي على هضبة)، و y دقيقة هي نقطة الصفر، من الناحية المثالية أيضا على هضبة. فمن غير المرجح أن QDs وحدها وسوف تظهر الكثير من سمية للخلايا في التركيزات المستخدمة، لذلك لم تحدد قيمة يمكن.
نتائج ممثل. في نهاية فترة التسجيل، والآبار واضحة تشير إلى وفاة الخلية كاملة، ونسبة تدرج تبلغ كثافة الخلية يجب أن تظهر على طول زيادة تركيزات الدواء. يجب أن تظهر منحنيات نمو البكتيريا على شكل S (الشكل 5 أ)، وموقع من الهضبة أقصى سوف تختلف اختلافا كبيرا من سلالة إلى سلالة ويتوقف أيضا على درجة الحرارة. ويمكن أن تكون نقطة زمنية معينةاختير الممثل ورسم القيم مقابل دخول [المضادات الحيوية] لاعطاء IC 50 (الشكل 5 ب). لتقييم سمية QD، البقاء على قيد الحياة مقابل دخول [QD] يمكن أيضا أن تآمر، ولكن تحقيق قتل البكتيريا كبيرة مع QDs وحده هو نادر (الشكل 5 C).
4. إعداد البكتيريا للشاشة 96-جيدا مع QDs / المضادات الحيوية
- في اليوم السابق للتجربة، والبذور 10 مل من ثقافة من مستعمرة جديدة في وسط الأغنياء المناسبة، وذلك باستخدام تقنية معقمة الصحيح والسلامة الحيوية. ينبغي إعداد المتقارن QD المضادات الحيوية في هذا اليوم، ما لم تكن مستقرة إلى حد كبير.
- 1-2 قبل ساعات من التجربة، وشغل كل من الآبار من لوحة 96-جيدا واضح القاع مع كمية ما يقرب من-القصوى من متوسط النمو. باستخدام الأقنية ماصة، والبذور بشكل جيد مع كل 1-50 ميكرولتر من ثقافة الجرثومي.
- وضع لوحة على القارئ لوحة وتعيينه لقراءة كل 10 دقائق لمدة 2 ساعة على الموجة ذاتها كما في الجزء 3.
- عندما تصل إلى جميع الخلايا OD = 0،1-0،15، وإزالة لوحة من لوحة للقارئ، ووقف تسجيل.
- إضافة تقارن QD في تركيزات مختلفة في ما لا يقل عن quadruplicate. استخدام جانب واحد من لوحة كعنصر تحكم "الظلام" ونصف لتكون مضيئة. ويرد تخطيط واقترح في الشكل (6). وينبغي دائما هناك قطاع مراقبة البكتيريا فقط ستدرج في مشاكل الحال مع درجة الحرارة، والثقافة، الخ. تؤثر ظروف النمو. وينبغي أيضا هناك قطاع واحد فقط من المخدرات وQD فقط ستدرج للتأكد من أنها تتناسب مع لوحة التحكم به من قبل. ويخصص ما تبقى من الآبار لتقارن من أجل السماح للإحصاءات جيدة.
- درع "الظلام" جانب من لوحة مع رقائق الألومنيوم. فضح الجانب الآخر لمصباح على الطول الموجي المطلوب.
- بعد التعرض للضوء، ووضع لوحة في لوحة وقارئ سجل OD 600 كل 10 دقائق ل5-12 ساعات. الحفاظ على درجة الحرارة <32 درجة مئوية إذا كان ذلك ممكنا لتجنب الدكتوريينغ الثقافات.
ممثل النتائج. قد يكون مزيجا من QDs والمضادات الحيوية تكون أقل سمية من المضادات الحيوية وحدها؛ السامة على حد سواء؛ السامة أو أكثر. يمكن قياس ذلك باستخدام منحنيات النمو وقياسات IC 50. يبين الشكل 7 مثال على أن تقارن السامة على قدم المساواة مع المضادات الحيوية وحدها، ومثال على تقارن التي هي أكثر سمية.
5. لوحة الكونت
- اختيار واحد أو أكثر من الآبار لوحة 96-جيدا المعالجة لاستخدامها في التخفيفات المتسلسلة والعد مستعمرة.
- جعل التخفيف من المسلسل كل من العينات البكتيرية مختارة مع الحل في برنامج تلفزيوني أو المالحة (0.9٪ كلوريد الصوديوم). نقل 20 ميكرولتر من الحل البكتيرية وتمييع مع حل 180 المالحة ميكرولتر، تغيير غيض ماصة، ومزيج نقل 20 ميكرولتر من حل البكتيرية المخفف إلى حل المالحة 180 ميكروليتر. كرر 6 مرات.
- يستغرق 10 ميكرولتر من كل لوحة على تخفيف ومناسبة الصلبة وسائل الاعلام لوحة. قد يكون مطلي جميع التركيزات 8 من عينة واحدة على طبق 10 سم بيتري الجولة، على الرغم من ويفضل أطباق مستطيلة الشكل لأنه من الأسهل على خط الامور.
- اتركها لتجف على مقاعد البدلاء لمدة 15 دقيقة. احتضان ثم في درجة حرارة مناسبة للبكتيريا الخاص لمدة 16 ساعة.
- عد المستعمرات وحساب وحدة مستعمرة تشكيل (CFU) وفقا ل(# المستعمرات X عامل تخفيف) / حجم = مطلي. كفو / مل
ويبين الشكل 8 لوحة CFU سبيل المثال.
6. ممثل النتائج
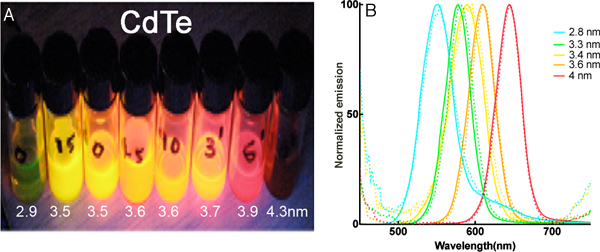
الشكل 1. QDs تيل كد. (أ) ثمانية الاستعدادات مضيئة من QDs تيل كد مع عصا للأشعة فوق البنفسجية (365 نانومتر). (ب) وامتصاص الانبعاثات أطياف من خمسة أحجام المحدد قبل وبعد الإذابة في المياه. والخطوط المتقطعة والأطياف في التولوين، وخطوط الصلبة في الماء.
files/ftp_upload/3969/3969fig2.jpg "/>
الشكل 2. التحليل الطيفي وهلام من QD-PMB تقارن. واستخدمت QDs تيل كد البرتقالي التي ينبعث منها على سبيل المثال هذا، والآثار المترتبة على أنواع أخرى من QDs سوف تحتاج إلى أن تقيم في كل تجربة. (A) الامتصاصية نموذجي (خط رمادي)، وانبعاث الطيف (الخط الأسود) من QDs قبل الاقتران من PMB والانبعاثات (خط متقطع) بعد إضافة 160 حكمه ضرس من PMB. (ب) العلاقة بين نسبة PMB وكثافة الانبعاثات QD (الساحات) وذروة الموجة موقع (المثلثات).
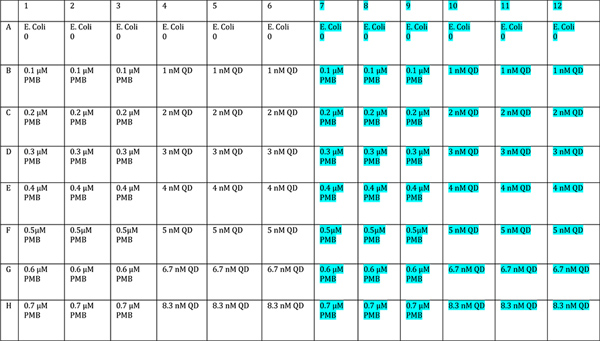
مقترح الشكل 3. تصميم لوحة لوحة تحكم نمو. وتمثل مجموعة واسعة من تركيزات PMB وQD. والمشع واحد من نصف لوحة (الضوء الأزرق)، ومحمية نصف متطابقة من ضوء. اضغط هنالمشاهدتها بشكل اكبر شخصية.

الشكل 4. مخصص 96-LED مصباح للإشعاع لوحة موحدة، والتي تبين ظهور وتشغيله. ويمكن أيضا نموذجي المحمولة باليد مصباح الأشعة فوق البنفسجية يمكن استخدامها، لكنها لن تغطي كامل لوحة موحدة.
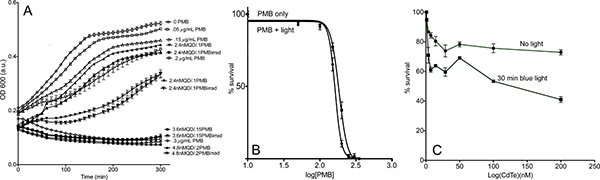
الشكل 5. النتائج سبيل المثال لوحة تحكم نمو. (أ) الممثل منحنيات نمو البكتيريا مع تركيزات مختلفة للمخدرات، من 0 إلى إكمال موت الخلية. رموز فتح ليست سوى PMB بتركيزات معينة؛ الرموز الصلبة تيل كد-PMB دون إشعاع، والرموز نصف مملوءة وتيل كد-PMB مع التشعيع. تشعيع لم يكن لها تأثير على عينات PMB فقط، لذلك حذفت هذه المنحنيات من أجل الوضوح. جميع تقارن PMB-تيل كد هي 30:1 PMB: نسب QD. (ب) من مؤامرات القيم منحنى النمو في 200 دقيقة في مقابل دخول [PMB] ويناسب إلى المعادلة. (1). وتابعرول للآثار الخفيفة، ويتم ذلك منحنى مع المضادات الحيوية فقط مع 30 دقيقة من التعرض للضوء. (ج) البقاء على قيد الحياة البكتيرية في 200 دقيقة في مقابل تركيز QD، وذلك باستخدام QDs تيل كد. وينظر بعض سمية مع التعرض للضوء، ولكن القليل جدا من أجل تحديد قيمة IC 50. انقر هنا لعرض أكبر شخصية .
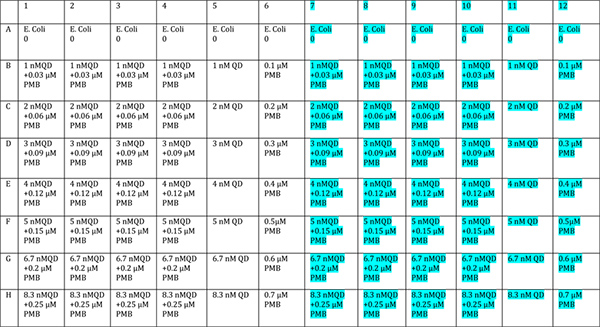
واقترح الشكل 6. تخطيط لوحة اختبار المتقارن. وينبغي أن يتعرض النصف الأزرق الضوء على لوحة للضوء، ومحمية النصف unhighlighted. انقر هنا لعرض أكبر شخصية .
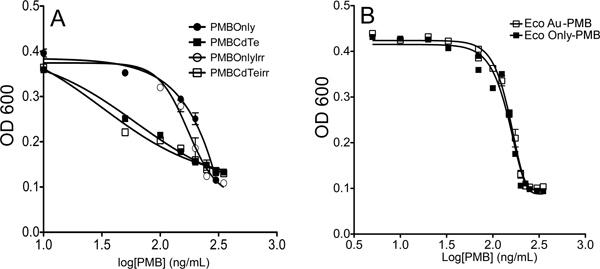
الشكل 7. مثال لوحة النتائج لاختبار المتقارن. وكانت القيم منحنى النمو في 200 دقيقة ررotted ويصلح لالمعادلة. (1). (أ) تبين زيادة تيل كد-PMB تقارن سمية خلال PMB وحدها. (ب) الذهب جسيمات متناهية الصغر الاتحاد الافريقي، PMB تقارن لا تظهر أي زيادة على مدى سمية PMB وحدها.
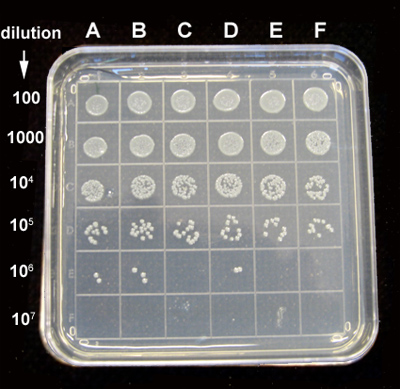
الرقم 8. مثال على لوحة CFU. E. عولج القولونية المصنف في لوحة 96-جيدا مع QD-PMB مع أو بدون تشعيع لمدة 30 دقيقة. ثم حضنت على 32 درجة مئوية لمدة 4 ساعات. ومطلي التخفيفات قدمت مسلسل من كل عينة جرثومية مع محلول ملحي، و 10 ميكرولتر من 100 X إلى 10 التخفيفات X 7 على لوحات أجار. وحضنت لوحات في 37 احصي درجة مئوية، والمستعمرات بعد 16 ساعة. لوحة يظهر التخفيفات على طول الصفوف على النحو المبين، وأعمدة هي: (أ) 0.06 ميكرومتر PMB + 2 نانومتر تيل كد، (ب) 0.12 ميكرومتر PMB + 4 نانومتر تيل كد (C) 0.2 ميكرومتر PMB + 6.7 نانومتر تيل كد، (D) 0.06 ميكرومتر PMB + 2 نانومتر تيل كد المشع، (E) 0.12 ميكرومتر PMB + 4 نانومتر تيل كد المشع، (F) 0.2 ميكرومتر PMB + 6.7 نانومتر تيل كد irradiated.
Discussion
النانوية تمثل نهجا واعدة لخلق عوامل جديدة مضادة للميكروبات. تحليل منحنى النمو هو وسيلة لرصد كثافة الخلية البكتيرية التي تميز الخلايا بنشاط زراعة الخلايا من النمو الكبت. عندما يقترن التهم لوحة، لأنها تتيح للحصول على تحليل دقيق للمضادات الحيوية المحتملة لالمتقارن. ش?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد تم تمويل هذا العمل من خلال برنامج اكتشاف الفرد NSERC، وNSERC / CIHR بحوث الصحية التعاونية برنامج (CHRP)، وCREATE NSERC التدريب البيولوجيا الفلكية الكندية برنامج (CATP).
Materials
| Name | Company | Catalog Number | Comments |
| اسم | شركة | فهرس العدد | تعليق (اختياري) |
| بورات مكون الاحتياطي # 1 | الصياد | حمض البوريك A-74-1 | |
| بورات مكون مخزن # 2 | سيغما الدريخ | Tetraborate الصوديوم B9876 | |
| MPA | سيغما الدريخ | M5801 | |
| Vivaspin 500 | جنرال إلكتريك للرعاية الصحية | 28-9322 | مختلف MWCO متاح |
| قارورة من الزجاج | الصياد | 03-338C | |
| EDC | سيغما الدريخ | E6383 | |
| بوليميكسين باء | سيغما الدريخ | P1004 | |
| بكتيريا غرامowth المتوسطة (LB) مكون # 1 | الصياد | كلوريد الصوديوم S271 | |
| بكتيريا المتوسطة النمو (LB) مكون # 2 | دينار بحريني | تريبتون 211705 | |
| بكتيريا المتوسطة النمو (LB) العنصر رقم 3 | دينار بحريني | خلاصة الخميرة 211929 | |
| مصباح عن التعرض للضوء | عرف | ||
| واضح من الأسفل 96-جيدا لوحات | الصياد | 07-200-567 أو 07-200-730 | |
| مضان الطيفي | الجزيئية الأجهزة | ||
| الامتصاصية لوحة قارئ | الجزيئية الأجهزة | ||
| BactoAgar عن وسائل الاعلام الصلبة | Bioshop | AGR001.1 | |
| أطباق بتري تقريب | الصياد | 08-75-12 | |
| أطباق بتري مستطيلة | الصياد | 08-757-11A |
References
- Michalet, X. Quantum dots for live cells, in vivo imaging, and diagnostics. Science. 307, 538-544 (2005).
- Jamieson, T. Biological applications of quantum dots. Biomaterials. 28, 4717-4732 (2007).
- Asokan, S. The use of heat transfer fluids in the synthesis of high-quality CdSe quantum dots, core/shell quantum dots, and quantum rods. Nanotechnology. 16, 2000-2011 (2005).
- Chan, W. C. W. Luminescent quantum dots for multiplexed biological detection and imaging. Curr. Opin. Biotechnol. 13, 40-46 (2002).
- Chan, W. C. W., Nie, S. M. Quantum dot bioconjugates for ultrasensitive nonisotopic detection. Science. 281, 2016-2018 (1998).
- Biju, V., Itoh, T., Ishikawa, M. Delivering quantum dots to cells: bioconjugated quantum dots for targeted and nonspecific extracellular and intracellular imaging. Chem. Soc. Rev. 39, 3031-3056 (2010).
- Boucher, H. W. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin. Infect. Dis. 48, 1-12 (2009).
- Morones, J. R. The bactericidal effect of silver nanoparticles. Nanotechnology. 16, 2346-2353 (2005).
- Mitoraj, D. Visible light inactivation of bacteria and fungi by modified titanium dioxide. Photochemical & Photobiological Sciences. 6, 642-648 (2007).
- Fu, G., Vary, P. S., Lin, C. T. Anatase TiO2 nanocomposites for antimicrobial coatings. J. Phys. Chem. B. 109, 8889-8898 (2005).
- Chung, C. J., Lin, H. I., Tsou, H. K., Shi, Z. Y., He, J. L. An antimicrobial TiO2 coating for reducing hospital-acquired infection. J. Biomed. Mater. Res. B. Appl. Biomater. 85, 220-224 (2008).
- Nair, S. Role of size scale of ZnO nanoparticles and microparticles on toxicity toward bacteria and osteoblast cancer cells. J. Mater. Sci. Mater. Med. 20, S235-S241 (2009).
- Heinlaan, M., Ivask, A., Blinova, I., Dubourguier, H. C., Kahru, A. Toxicity of nanosized and bulk ZnO, CuO and TiO2 to bacteria Vibrio fischeri and crustaceans Daphnia magna and Thamnocephalus platyurus. Chemosphere. 71, 1308-1316 (2008).
- Rincon, A. G., Pulgarin, C. Use of coaxial photocatalytic reactor (CAPHORE) in the TiO2 photo-assisted treatment of mixed Escherichia coli and Bacillus subtilis and the bacterial community present in wastewater. Catal. Today. 101, 331-344 (2005).
- Neal, A. L. What can be inferred from bacterium-nanoparticle interactions about the potential consequences of environmental exposure to nanoparticles. Ecotoxicology. 17, 362-371 (2008).
- Kovochich, M. Comparative toxicity of C60 aggregates toward mammalian cells: role of tetrahydrofuran (THF) decomposition. Environ. Sci. Technol. 43, 6378-6384 (2009).
- Hoshino, A. Physicochemical properties and cellular toxicity of nanocrystal quantum dots depend on their surface modification. Nano Letters. 4, 2163-2169 (2004).
- Dumas, E. M., Ozenne, V., Mielke, R. E., Nadeau, J. L. Toxicity of CdTe Quantum Dots in Bacterial Strains. IEEE Trans. NanoBiosci. 8, 58-64 (2009).
- Park, S., Chibli, H., Wong, J., Nadeau, J. L. Antimicrobial activity and cellular toxicity of nanoparticle-polymyxin B conjugates. Nanotechnology. 22, 185101 (2011).
- Cooper, D. R., Dimitrijevic, N. M., Nadeau, J. L. Photosensitization of CdSe/ZnS QDs and reliability of assays for reactive oxygen species production. Nanoscale. 2, 114-121 (2010).
- Pong, B. K., Trout, B. L., Lee, J. Y. Modified ligand-exchange for efficient solubilization of CdSe/ZnS quantum dots in water: A procedure guided by computational studies. Langmuir. 24, 5270-5276 (2008).
- Narayanaswamy, A., Feiner, L. F., Meijerink, A., Zaag, P. J. v. a. n. d. e. r. The effect of temperature and dot size on the spectral properties of colloidal InP/ZnS core-shell quantum dots. Acs Nano. 3, 2539-2546 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved