A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول لجمع البنكرياس الإنسان
In This Article
Summary
هذا الفيديو يشرح كيفية إجراء تشريح لمعالجة البنكرياس الإنسان إلى صيغ تخزين متعددة. ويحتفظ التوجه التشريحية في جميع أنحاء المناطق البنكرياس للسماح للتعريف تكوين جزيرة الإقليمية وكثافة.
Abstract
وقد تم تطوير هذا التشريح وإجراء المعاينة للشبكة لالمتبرعين البنكرياس مع برنامج (nPOD) مرض السكري لتوحيد إعداد البنكرياس تعافى من المتبرعين جثي. يتم تقسيم البنكرياس إلى 3 مناطق رئيسية (رأس والجسم، والذيل)، يليه المقاطع العرضية المسلسل في جميع أنحاء الإنسي إلى محور الأفقي. ومفروم تستخدم المقاطع بالتناوب لالبارافين ثابتة وكتل الطازجة والمجمدة وعينات من بقايا لاستعدادات مبكرة عينة مجمدة، سواء مع أو بدون ريبونوكلياز مثبطات، لDNA، RNA، أو عزل بروتين. الهدف العام المتمثل في البنكرياس إجراء تشريح هو لأخذ عينات من بنكرياس كامل مع الحفاظ على اتجاه التشريحية.
وتفيد التقارير الغدد الصماء خلية التجانس من حيث التكوين جزيرة، والحجم، وأرقام عن الجزر الإنسان بالمقارنة مع الجزر القوارض 1. غالبية الجزر الإنسان من رأس البنكرياس، وتتكون الجسم والذيل مناطق containin على الأنسولينز β خلايا يليه انخفاض نسب الجلوكاجون α التي تحتوي على خلايا والسوماتوستاتين المحتوية على δ خلايا. ببتيد البنكرياس التي تحتوي على خلايا PP وخلايا إبسيلون جريلين المحتوية موجودة أيضا ولكن بأعداد صغيرة. في المقابل، فإن منطقة الكلابي يحتوي على الجزر التي تتألف أساسا من خلايا البنكرياس PP ببتيد التي تحتوي على 2. هذه الاختلافات جزيرة الإقليمية تنشأ عن الاختلافات التنموية. البنكرياس يطور من براعم البنكرياس بطني وظهري في المعى الأمامي، وبعد التناوب على المعدة والاثني عشر، ينتقل الفص بطني والصمامات مع 3 ظهري. الفص بطني تشكل الجزء الخلفي من الرأس بما في ذلك عملية الكلابي في حين أن الفص الظهرية يؤدي إلى بقية الأعضاء. وأفادت التقارير أيضا الإقليمية اختلاف البنكرياس مع منطقة الذيل وجود أعلى كثافة جزيرة بالمقارنة مع مناطق أخرى، وظهري المكونات المشتقة من الفص تمر ضمور انتقائي في مرض السكري نوع 1 في كثير من الأحيان يتم استرداد أجهزة إضافية والأنسجة من المتبرعين، وتشمل الغدد الليمفاوية البنكرياس والطحال والغدد الليمفاوية غير البنكرياس. يتم استرداد هذه العينات مع تنسيقات مماثلة بالنسبة للبنكرياس مع إضافة عزل الخلايا cryopreserved. عندما يتم تضمين مع الاثني عشر القريبة من البنكرياس، قد يتم جمعها الغشاء المخاطي الاثنى عشر للكتل البارافين والمجمدة والاستعدادات المبكرة المفروم المجمدة.
Protocol
1. انشاء
- أشرطة التسمية لكتل البارافين يدويا مع قلم رصاص، أو تلقائيا مع طابعة كاسيت. وتشمل المعرف المانحة (CaseID)، ونوع العينة، وعدد قسامة، وتحديد أي إضافية فريدة من نوعها (ورقة حالة، الملحق 1 ).
- تسمية قوالب أكتوبر بالنسبة للأشرطة مع علامة دائمة. قطع مستطيلات 5-10 سم من رقائق الألومنيوم.
- طباعة أو يدويا التسمية مع علامة دائمة كل قوارير وأنابيب. وتشمل قوارير بما فيه الكفاية لعينات مبكرة مفروم مجمد ومواسير مع وسائل الاعلام RPMI لشحنات جديدة. لقوارير والمجمدة مبكرة مع RNAlater، إضافة 1 مل RNAlater إلى كل cryovial.
- لوحات تشريح مجموعة المتابعة في غطاء محرك السيارة السلامة البيولوجية وقمم مضادة للصكوك تشريح تعقيمها (ملقط والمشارط والشفرات، ومنصات الشاش (4X4))، فضلا عن أشرطة الكاسيت والقوالب أكتوبر مرتبة في ترتيب استخدامها.
- يعد حمام التجميد من خلال وضعالثلج الجاف في مربع الستايروفوم متوسطة الحجم (10x10 سم) على عمق لا يقل عن 3 سم وإضافة isopentane حتى يتم تغطيتها بالكامل من الثلج الجاف.
- اختياري: ملء وعاء ديوار صغير مع النيتروجين السائل.
- إذا كان هناك حاجة للبنكرياس المجهر الإلكتروني (EM)، وإعداد TAAB مثبت بإضافة 1.25 مل بارافورمالدهيد 16٪، 1.25 مل غلوتارالدهيد 8٪، و 7.5 مل PBS 0.1M. إعداد مثبت Lowicryl بإضافة 2.5 مل بارافورمالدهيد 16٪ إلى 7.5 PBS 0.1M مل.
- تحضير المحاليل المستخدمة لعزل الخلايا. على زجاجة 500 مل من DMEF (مع الجلوتامين)، اتبع تقنيات التعقيم في حين اضاف ما يلي:
- مصل بقري جنيني (FBS): تضاف 50mL، نهائي 10٪.
- البنسلين / الستربتومايسين عقار (القلم / بكتيريا، 10000 وحدة / مل / 10000 ميكروغرام / مل الأوراق المالية) - إضافة 5 مل القلم / بكتيريا الأوراق المالية إلى RPMI لتركيز النهائي من 100 يو / مل / 100ug/mL. أيضا إضافة إلى 5 مل زجاجة 500 مل من DPBS عندما تستخدم لعقد العقد اللمفاوية أو عينات الطحال.
2. أفراد
- ويتم إنجاز إجراءات على النحو الأمثل مع ثلاثة موظفين ومع ذلك، يمكن إجراء هذا الإجراء مع فرد واحد مدربة تدريبا جيدا. يمكن أن شخصين استكمال عموما الإجراء في 90 دقيقة. المدة الفعلية تعتمد على أرقام وردت من الأنسجة وسهولة العثور على الغدد الليمفاوية البنكرياس. وتعقد عينات للالعزلة خلية في 4 درجات مئوية حتى الانتهاء من تشريح الأنسجة في حين تتم معالجة عينات من مصل الدم بصورة متوازية.
- علم الامراض، علم الأمراض المساعد، أو ما يعادلها-1. موظف من ذوي الخبرة يؤدي التعامل مع الأنسجة ويؤدي التشريح الرئيسية بما في ذلك تقسيم (ق) من رأس البنكرياس والغدد الليمفاوية حصاد البنكرياس ويتم توجيه الجهود الأولية نحو البنكرياس تليها دراسة شبه البنكرياس الدهون للحصول على العقد اللمفاوية.
- تقني مختبر أو عضو ما يعادل الموظفين الذين تدربوا في الأنسجة وتقليم مسؤولياته الرئيسية هي على وزن البنكرياس والمناطق والأنسجة تقليم للكتل الثابتة والمجمدة والخامس المفاجئة المجمدةأمية. يستقبل العفج والطحال من مساعد علم الأمراض ومعالجتها في حين أن هذه الأجهزة مساعد الباثولوجيا يتم معالجة البنكرياس.
- مختبر مساعد الموظف الذي يساعد الآخرين بما في ذلك كتلة ووضع العلامات قارورة، عينة تنميق لcryovials، وتجهيز المصل.
3. تشريح البنكرياس
- إزالة الاثنى عشر والطحال والبنكرياس تنظيف من الدهون غير الضرورية، والسفن، والأعصاب باستخدام تشريح حادة وحادة
- وضع البنكرياس تنظيفها على لوحة تشريح مغطاة المناشف الورقية. تراجع قضيب من القطن ذات الرؤوس في الحبر الازرق وانتشارها على السطح الأمامي للبنكرياس. لطخة الزائدة.
- اختياري: يغمس قضيب جديد في الحبر الأسود وانتشارها على السطح الخلفي للبنكرياس. عودة البنكرياس إلى اتجاه طبيعي مع السطح الأمامي للمواجهة مشرح.
- قطع البنكرياس إلى 3 مناطق هي: الرأس، والجسم، والذيل (الشكل 1). قطع تقاطع بين هيئة التعليم العاليد والجسم ثم تقسيم الجزء المتبقي إلى ~ أجزاء متساوية للجسم وذيل.
- وزن كل منطقة من الأوزان البنكرياس وسجل (القضية workup ورقة ( الملحق 1 )).
- قسم (~ 0.5 سم) في كل منطقة من البنكرياس في نحو عرضي "الخبز رغيف" (الشكل 1).
- استخدام أجزاء من كل من تقاطعات بين المناطق لعينات مفروم. اعتمادا على حجم البنكرياس، قد يكون عينة من منطقة تقاطع الجسم الذيل يكون من الصعب الحصول عليها في هذه الحالة يمكن أن انخفض عدد كتل البارافين للحصول على عينات مفروم أو عينات فقط من منطقة الرأس والجسم ويمكن الحصول على البنكرياس. cryovials التسمية وفقا على الرأس أو الجسم للدلالة على المنطقة القريبة على مفترق الطرق.
- فرم قطع وتقسيم بالتساوي بين cryovials (≥ 1 غرام لكل قنينة). تجمد بسرعة قارورة من دون RNALater في النتروجين السائل أو في الثلج الجاف - isopentane الطين ثم نقل رالزراعة العضوية -80 الثلاجة درجة مئوية.
- الحفاظ على قارورة مع RNALater في درجة حرارة الغرفة لمدة 30 دقيقة للسماح للموازنة، ريمكس وبسرعة تجميد في النتروجين السائل أو في الطين الجليد isopentane جاف ثم نقل إلى الثلاجة -80 درجة مئوية.
- إزالة أجزاء بالتناوب لالبارافين وكتل أكتوبر بدءا من البارافين (الشكل 1).
- تتكئ جميع قطاعات عرضية إلى اليمين.
- مكان ~ 1.5 × 1.5 × 0.5 سم المقاطع في أشرطة الكاسيت. إذا المقاطع العرضية كبيرة جدا، وخفض الى النصف (الشكل 2B). أشرطة التسمية لمدة نصف الأمامي الأزرق كما "A" والنصف الخلفي مثل "ب".
- إذا قطع لا تزال كبيرة جدا، وقطع كل مقطع عمودي على خفض السابقة (الشكل 2C). أشرطة التسمية ميلادي بطريقة عقارب الساعة. تقليم قطعة أخرى حسب الحاجة لتناسب داخل الكاسيت.
- كتل عدد بالتتابع في المنطقة، بدءا من القسم الأكثر وسطي.
- لكتل البارافين، ج موقفassettes حتى التسمية إلى اليسار ومكان الأنسجة في الكاسيت، والحفاظ على توجهها. وثيقة مخزنة غطاء الكاسيت ونقلها إلى وعاء مع محايد 500 مل 10٪ ~ الفورمالين (NBF). بدء تثبيت توقيت عندما يتم وضع كاسيت مشاركة في مثبت.
- لكتل أكتوبر، صب طبقة رقيقة من وسائل الاعلام أكتوبر في القالب ثم وضع prelabeled النسيج في قالب يجري التأكد من الحفاظ على اتجاه وتغطية الأنسجة مع أكتوبر تزج بسرعة القوالب أكتوبر في الثلج الجاف - الطين isopentane لمدة دقيقة 1 ~. إزالة من الطين ووضعت على الثلج الجاف للتخزين المؤقت أو -80 درجة مئوية في الثلاجة لتخزين على المدى الطويل.
- الحصول ~ 0.5 × 0.5 سم شرائح من تقاطع رأس والجسم للالمجهر الإلكتروني (EM). مكان شريحة واحدة في مثبت TAAB وشريحة أخرى في مثبت Lowicryl. تخزين كلا النوعين من مثبت مع العينات في درجة مئوية (4) ل48 ساعة على الأقل و / أو إلى أجل غير مسمى حتى مزيد من المعالجة لEM.
4. الطحال والعقد اللمفية Dissecستعقد والإثنى عشر تشريح الغشاء المخاطي
- عزل الغدد الليمفاوية البنكرياس (PLN) من الدهون وتقليم كل النسيج الضام للكبسولة العقدة. في مكان معقم الخلية التي تحتوي على طبق ثقافة DMEF. اعتمادا على أرقام مجموع معزولة، تقسيم PLN إلى aliquots لشحنات جديدة، العزلة خلية cryopreserved، البارافين و / أو كتل أكتوبر، وقوارير. فرم العقد كبير الى قطع لا يزيد حجمها عن 0.5 سم.
- فرم الغدد الليمفاوية غير البنكرياس والطحال إلى مكعبات (~ 0.5 سم) صغير. في مكان مثبت وسائل الاعلام أكتوبر، وأو DMEM لشحنات عينة طازجة أو العزلة خلية cryopreserved وفقا لكميات من المواد الأولية.
- فتح الاثني عشر ويمسح برفق الاثنى عشر الغشاء المخاطي نظيف من المخاطية مع الشاش المبلل. قطع أجزاء من الغشاء المخاطي لالبارافين و / أو المجمدة كتل أكتوبر وعينات مفروم للقارورة، مع وبدون RNAlater. أما بالنسبة لتجميد عينات أخرى.
5. لف القطع أكتوبر في مرحلة ما قبل المسمى رقائق الألومنيوم ومكان كتل أكتوبر و قارورة في صناديق للتخزين على المدى الطويل في -80 درجة مئوية.
6. تقديم عينات الثابتة لمعالجة برافين
- إصلاح الأنسجة لمدة 16 ساعة (مجموعة 20 ± 4 ساعات) باستخدام معالج البارافين التلقائي أو باستخدام توقيت يدوي. معالجة إلى كتل البارافين باستخدام المعالج التلقائي ( الملحق 2 ).
- تضمين المقاطع في الاتجاه الصحيح كما وضعت من قبل مشرح مع التسمية كاسيت إلى اليسار. تضمين الغشاء المخاطي الإثنى عشر مع سطح تخفض للسماح للفحص عمودي الغشاء المخاطي للمخاطية.
7. تنظيف وتطهير المناطق تشريح. غسل أدوات تشريح وإعادة تعقيم. وضع بقايا أنسجة الإنسان في مثبت الفورمالين لتخزين النفايات والطب الحيوي. تجاهل النفايات الطبية طبقا للقوانين المحلية خلال شهر واحد.
8. تحديث نظام الجرد عينة
ve_title "> النتائج الممثل 9.وهذا الإجراء معالجة 1 البنكرياس السليم للإنسان مع عينة تمثيلية في جميع أنحاء الجهاز بما في ذلك ترسيم الحدود في ثلاث مناطق رئيسية، وهي: الرأس، الجسم والذيل في حدود 2 ساعة. يتم تضمين منطقة الكلابي، وجدت في منطقة رأس الخلفي، في تشريح الرأس. وكان متوسط وزن البنكرياس في المتبرعين بالأعضاء من دون مرض السكري 82.4 غرام (52،7-139،0 غراما). وكانت الأوزان البنكرياس الإقليمية متساوية تقريبا (الشكل 3).
ويمكن هذا الإجراء يسمح أيضا لإعادة الإعمار في البنكرياس بأكملها باستخدام الشرائح الملون من البارافين متتابعة وكتل أكتوبر بأشكال متعددة قابلة للتنفيذ مما يسمح الاستفادة القصوى للتكنولوجيات الحالية والمستقبلية. وتقدم ورقة العمل الحالية حالة nPOD ( الملحق 1 ) الذي يستخدم لتوثيق العينات تعافى وبروك لاحقessing من أنواع وكميات قسامة.
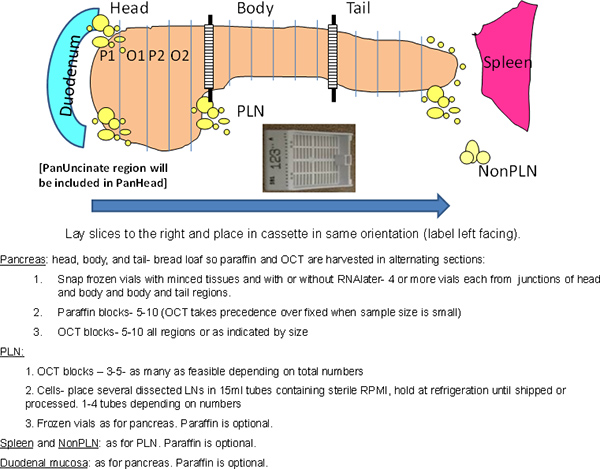
الشكل 1. الخطة الشاملة للالإجراء. تتم معالجة البنكرياس كامل مع الحفاظ على التوجهات التشريحية. منطقة رأس أطول في محور متفوقة-أدنى نظرا لوجود من الفص البنكرياس بطني في المنطقة الخلفية التي تشمل المنطقة الكلابي. منطقة تحاك في تقاطعات دلالة على المناطق المستخدمة للعينات مفروم في cryovials. ف، برافين، O، أكتوبر
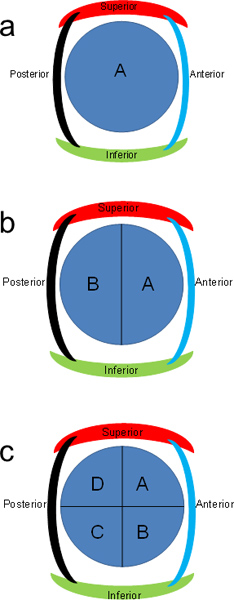
الشكل 2. ويمكن كتابة مخطط لمقاطع البنكرياس. شرائح عرضية البنكرياس كذلك تنقسم الى نصفين أو أرباع وبالحروف بطريقة عقارب الساعة.
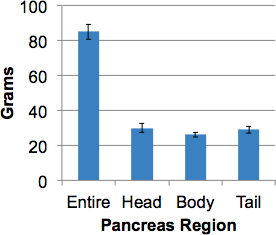
الشكل 3. الأوزان البنكرياس من المتبرعين من دون مرض السكري.وكان وزنه البنكرياس سليمة من المانحين الكبار (> 17 سنة) ثم تقسيمها إلى مناطق والأوزان الإقليمية التي تم الحصول عليها. بيانات وسائل ± SEM (N = 15).
Discussion
الهدف من هذا الإجراء هو لتحديد معالجة البنكرياس القياسية التي يمكن أن تكون منسقة عبر مواقع جمع متعددة، وبالتالي تسمح بإجراء مقارنات للنتائج التي تم الحصول عليها من قبل مجموعات مختلفة. وتستند هذه الطريقة على معايير وممارسات تشريح الأمراض الجراحية مع خطوات إضافية لش?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
المؤلفان بالشكر عائلات المانحين والمنظمات الحصول على الأعضاء المشاركين في هذا البحث ومارتينو وماريا Kusmartseva ايرينا للحصول على مساعدة الخبراء التابعة لها. وقد تم تمويل هذا العمل من قبل مؤسسة أبحاث السكري الأحداث (MC-T.، MA) لدعم الشبكة للمتبرعين بالأعضاء البنكرياس مع مرض السكري.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| الصكوك بما في ذلك تشريح المشارط مع 22 ريش | مختلف | مختلف | |
| أنابيب الطرد المركزي (15 و 50 مل) | فيشر العلمية | 05-539-5، 430828 | عقيم |
| Cryotubes (1.8 مل) | VWR أمريكا الشمالية | 89004-300 | معقم الرموز الشريطية، اختياري |
| RNAlater | Ambion | AM7021 | |
| علم الأمراض الجراحية الحبر | |||
| أشرطة الكاسيت | مرسيدس الطبية | CAS ECO109 | |
| 1التخزين المؤقت 0٪ محايد الفورمالين | فيشر العلمية | 23-245-685 | |
| وسائل الإعلام أكتوبر التجميد | TissueTek | 4583 | |
| قوالب | ThermoScientific | 58952 | مختلف الأحجام |
| Isopentane | فيشر العلمية | O3551-4 | أكتوبر حمام تقشعر لها الأبدان |
| الثلج الجاف | أكتوبر حمام تقشعر لها الأبدان | ||
| النيتروجين السائل في قارورة ديوار | المفاجئة cryovials تجميد | ||
| خلية طبق ثقافة (100mm) | كورنينج | 430167 | عقيم |
| Hyclone DMEF | ThermoScientific | SH30023.01 | وشملت الجلوتامين العقيمة، وتخزين المبرد، |
| مصل بقري جنيني | Cellgro | 35-010-CV | ، متجر معقم aliquots المجمدة |
| البنسلين / الستربتومايسين عقار / مضاد | GIBCO | 15240-062 | ، متجر معقم aliquots المجمدة |
| نوع 9 برافين | ريتشارد ألان، والعلم | 8337 | |
| 1X D-PBS | GIBCO | 14190-144 | عقيم |
| 16٪ لامتصاص العرق | EM العلوم | 15710 | جعل الطازجة والمبردة مخزن |
| 8٪ غلوتارالدهيد | EM العلوم | 16019 | جعل الطازجة والمبردة مخزن |
| السلامة البيولوجية المستوى 2 غطاء محرك السيارة | مختلف | ||
| منخفضة للغاية الفريزر | مختلف | ||
| ساكورا كاسيت طابعة | ساكورا | ||
| ساكورا VIP300 | ساكورا | التلقائي البارافين المعالج | |
| البارافين تضمينها محطة | ThermoFisher |
الجدول رقم 1. كواشف ومعدات معينة.
References
- Brissova, M. Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy. J. Histochem. Cytochem. 53, 1087-1097 (2005).
- Rahier, J. The pancreatic polypeptide cells in the human pancreas: the effects of age and diabetes. J. Clin. Endocrinol. Metab. 56, 441-444 (1983).
- Uchida, T., Takada, T., Ammori, B. J., Suda, K., Takahashi, T. Three-dimensional reconstruction of the ventral and dorsal pancreas: a new insight into anatomy and embryonic development. J. Hepatobiliary Pancreat. Surg. 6, 176-180 (1999).
- Wittingen, J., Frey, C. F. Islet concentration in the head, body, tail and uncinate process of the pancreas. Ann. Surg. 179, 412-414 (1974).
- Rahier, J., Goebbels, R., Henquin, J. Cellular composition of the human diabetic pancreas. Diabetologia. 24, 366-371 (1983).
- Vaught, J. An NCI perspective on creating sustainable biospecimen resources. J. Natl. Cancer Inst. Monogr. 42, 1-7 (2011).
- Gianani, R. Initial results of screening of nondiabetic organ donors for expression of islet autoantibodies. J. Clin. Endocrinol. Metab. 91, 1855-1861 (2006).
- Tauriainen, S., Salmela, K., Rantala, I., Knip, M., Hyöty, H. Collecting high-quality pancreatic tissue for experimental study from organ donors with signs of β-cell autoimmunity. Diabetes Metab. Res. Rev. 26, 585-592 (2010).
- In't Veld, P. Screening for insulitis in adult autoantibody-positive organ donors. Diabetes. 56, 2400-2404 (2007).
- Töns, H. A., Terpstra, O. T., Bouwman, E. Heterogeneity of human pancreata in perspective of the isolation of the islets of langerhans. Transplant Proc. 40, 367-369 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved