Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Sammlung Protokoll zur menschlichen Pankreas
In diesem Artikel
Zusammenfassung
Dieses Video zeigt eine Dissektion Verfahren zur Bearbeitung der menschlichen Bauchspeicheldrüse in mehrere Speicherformate. Anatomische Orientierung wird im Laufe der Bauchspeicheldrüse Regionen aufrechterhalten, um Definition von Regional-Inselchen Zusammensetzung und Dichte zu ermöglichen.
Zusammenfassung
Diese Zergliederung und Probenahmeverfahren wurde für das Netzwerk für Pankreas-Organ Donors mit Diabetes (nPOD) Programm zur Vorbereitung der Bauchspeicheldrüse von Organspendern gewonnen Leichen zu standardisieren entwickelt. Die Bauchspeicheldrüse ist in 3 Regionen (Kopf, Körper, Schwanz) von seriellen Querschnitten der ganzen medial nach lateral Achse gefolgt aufgeteilt. Abwechselnd Abschnitte sind für Paraffin und frisch gefrorenen Blöcken und Überrest Proben verwendet werden, für Snap gefrorene Probe Präparate zerkleinert, entweder mit oder ohne RNAse-Inhibitoren für DNA, RNA oder Protein isoliert. Das übergeordnete Ziel der Bauchspeicheldrüse Dissektion Verfahrens ist es, die gesamte Bauchspeicheldrüse zu probieren und gleichzeitig anatomische Orientierung.
Endokrine Zelle Heterogenität in Bezug auf die Inselzellen Zusammensetzung, Größe und Zahlen ist für den menschlichen Inseln im Vergleich zum Nagetier Inselchen 1 angegeben. Die Mehrheit der menschlichen Inselzellen aus der Bauchspeicheldrüse Kopf, Körper und Schwanz Regionen der Insulin-containin komponiertg β-Zellen durch geringere Anteile an gefolgt Glukagon-haltige α-Zellen und Somatostatin-haltigen δ-Zellen. Pankreaspolypeptid PP-haltige Zellen und Ghrelin-haltigen Epsilon Zellen sind auch vorhanden, aber in geringer Anzahl. Im Gegensatz dazu enthält das uncinatus Region Inseln, die vor allem von Pankreas-Polypeptid enthaltende PP-Zellen 2 zusammengesetzt sind. Diese regionalen Unterschiede ergeben sich aus Inselchen entwicklungsbedingte Unterschiede. Die Bauchspeicheldrüse entwickelt sich aus den ventralen und dorsalen Pankreas Knospen im Vorderdarm und nach der Drehung des Magens und des Duodenums, die Bauchlappen bewegt und verschmilzt mit der dorsalen 3. Die Bauchlappen bildet den hinteren Teil des Kopfes einschließlich der hakenförmigen durch, während der dorsalen Lappen führt zu dem Rest des Organs. Regionale Pankreas Variation ist auch mit der Heckbereich mit einer höheren Dichte Inselchen im Vergleich zu anderen Regionen und die dorsalen Lappen-abgeleiteten Komponenten durchlaufen selektive Atrophie bei Typ 1-Diabetes berichtet Zusätzliche Organe und Gewebe werden oft von den Organspendern gewonnen und zählen Lymphknoten, Milz und nicht-Lymphknoten an. Diese Proben werden mit ähnlichen Formaten wie der Bauchspeicheldrüse unter Zusatz von Isolierung von kryokonservierten Zellen gewonnen. Wenn der proximalen Duodenum mit der Bauchspeicheldrüse ist im Preis inbegriffen, kann Duodenalschleimhaut für Paraffin und gefrorenen Blöcken und Hackfleisch Snap gefrorener Zubereitungen gesammelt werden.
Protokoll
1. Set-up
- Label-Kassetten für Paraffin-Blöcke manuell mit einem Bleistift, oder automatisch mit einem Kassetten-Drucker. Fügen Sie den Geber-Kennung (CaseID), Probentyp, Aliquot-Nummer, und keine zusätzliche eindeutige Identifikation (Urteil Arbeitsblatt, Anhang 1 ).
- Label-Oktober Formen wie für Kassetten mit einem wasserfesten Filzstift. Schneiden Sie 5-10 cm Rechtecke aus Aluminiumfolie.
- Drucken oder manuell Etikett mit Edding alle Fläschchen und Tuben. Fügen Sie genug Fläschchen für Hackfleisch Snap gefrorenen Proben und Rohre mit RPMI-Medium für frische Sendungen. Für das Snap gefrorene Röhrchen mit RNAlater, 1 ml RNAlater jedem Kryoröhrchen.
- Set-up Dissektionstische Biosicherheit in Kapuze und Theken mit sterilisierten Dissektion Instrumente (Zangen, Skalpelle, Klingen, Gazekompressen (4x4)) sowie Kassetten und Oktober Formen in der Reihenfolge ihrer Verwendung angeordnet.
- Bereiten Sie eine Gefrierbad indemTrockeneis in einem mittelständischen Styropor-Box (10x10 cm) bis zu einer Tiefe von mindestens 3 cm und fügen Isopentan, bis das Trockeneis vollständig bedeckt ist.
- Optional: Füllen Sie eine kleine Dewar Behälter mit flüssigem Stickstoff.
- Wenn Bauchspeicheldrüse für Elektronenmikroskopie (EM) benötigt wird, vorzubereiten TAAB Fixativ, indem 1,25 ml 16% Paraformaldehyd, 1,25 ml 8% Glutaraldehyd und 7,5 ml 0,1 M PBS. Bereiten Lowicryl Fixativ durch Zugabe von 2,5 ml 16% Paraformaldehyd und 7,5 mL 0,1 M PBS.
- Planen Lösungen zur Isolierung von Zellen verwendet. Zu 500 ml Flasche DMEF (mit Glutamin), folgen Sie aseptische Techniken beim Hinzufügen der folgenden Schritte aus:
- Fötalem Rinderserum (FBS): Dazu 50mL, final 10%.
- Penicillin / Streptomycin (Pen / Strep, 10.000 U / mL / 10000 ug / ml Stammlösung) - fügt man 5 ml Pen / Strep Lager zu RPMI für Endkonzentration von 100 U / ml / 100ug/mL. Auch mit 5 ml in einen 500 ml Flasche DPBS, wenn für das Halten Lymphknoten oder der Milz Proben verwendet.
2. Personal
- Vorgehensweise wird optimal mit drei Mitarbeitern jedoch das Verfahren mit einem gut ausgebildeten einzelnen durchgeführt werden kann bewerkstelligt. Zwei Personen können in der Regel führen Sie das Verfahren in 90 Minuten. Tatsächliche Dauer ist abhängig von Anzahl von Geweben aufgenommen und Auffindbarkeit Lymphknoten an. Beispiele für die Zelle Isolierungen werden bei 4 ° C bis zur Vollendung der Gewebedissektion während Serumproben parallel verarbeitet werden.
- Pathologe, Pathologie-Assistent, oder gleichwertig-ein erfahrener Mitarbeiter führt das Gewebe Handhabung und führt wichtige Dissektionen einschließlich Division (en) der Bauchspeicheldrüse Kopf und Ernte Lymphknoten an. Die ersten Bemühungen sind auf die Bauchspeicheldrüse durch die Prüfung der peri-pankreatische Fett für Lymphknoten gefolgt gerichtet.
- Labor-Techniker oder gleichwertiger-Mitarbeiter im Gewebe ausgebildet Trimmen, deren primäre Aufgaben sind zu Pankreas-und Regionen-und Trimm-Gewebe für feste und gefrorene Blöcke und für Snap gefrorenen v wiegenIALS. Empfängt Duodenum und Milz aus der Pathologie Assistent und verarbeitet diese Organe während der Pathologie Assistent wird die Verarbeitung der Bauchspeicheldrüse.
- Laborantin-Mitarbeiter, der den anderen hilft einschließlich Block und Fläschchen Etikettierung, Probe Hacken für Kryoröhrchen, und Serum-Verarbeitung.
3. Pankreas Dissection
- Entfernen Sie den Zwölffingerdarm und der Milz und reinigen Sie das Pankreas von Fremdwasser Fett, Gefäße und Nerven mit stumpfer und scharfer Dissektion
- Setzen Sie den gereinigten Pankreas auf einem Seziertisch Board mit Papiertüchern abgedeckt. Tauchen Sie ein Wattestäbchen in blauer Tinte und Ausbreitung auf der Vorderfläche des Pankreas. Vorsichtiges Abtupfen der Exzess.
- Optional: Tauchen Sie einen neuen Applikator in schwarzer Tinte und Verbreitung auf der hinteren Fläche der Bauchspeicheldrüse. Zurück zum normalen Pankreas Orientierung mit vorderen Oberfläche nach Prosektor.
- Schneiden Sie das Pankreas in drei Regionen: Kopf, Körper und Schwanz (Abbildung 1). Schneiden Sie die Verbindung zwischen HEAd und Körper verteilen dann den restlichen Teil in ~ gleiche Portionen für Körper und Schwanz.
- Wiegen Sie jede Region der Bauchspeicheldrüse und der Rekord Gewichte (Urteil Aufarbeitung Blatt ( Anhang 1 )).
- Abschnitt (~ 0,5 cm) jede Region der Bauchspeicheldrüse in einer quer "Brotlaib" Weise (Abbildung 1).
- Verwenden Sie die Abschnitte aus beiden Kreuzungen zwischen den Regionen für Hackfleisch-Proben. Je nach Größe Pankreas, kann eine Probe aus dem Körper-Schwanz Übergangsbereich schwierig sein, zu erhalten, in welchem Fall die Anzahl der Paraffinblöcke verringert werden, um zerkleinerte Proben oder Proben nur aus dem Pankreas Kopf-Körper-Bereich zu erhalten, erhalten werden kann. Label-Kryoröhrchen nach wie Kopf-oder Körper zu proximalen Bereich an der Kreuzung zu bezeichnen.
- Mince Stücke teilen und gleichmäßig zwischen Kryoröhrchen (≥ 1 g pro Flasche). Schnell einfrieren, ohne RNAlater Fläschchen in flüssigem Stickstoff oder in Trockeneis - Isopentan Gülle übertragen Sie dann tOA -80 ° C Gefrierschrank.
- Halten Fläschchen mit RNAlater bei Raumtemperatur für 30 Minuten bis zur Gleichgewichtseinstellung zu ermöglichen, Remix und schnell in flüssigem Stickstoff oder in der Trockeneis-Isopentan Gülle frieren dann zu einer -80 ° C Gefrierschrank zu übertragen.
- Entfernen Sie abwechselnden Abschnitten für Paraffin-und Oktober-Blöcke beginnend mit Paraffin (Abbildung 1).
- Lehnen alle Querschnitte nach rechts.
- Ort ~ 1,5 x 1,5 x 0,5 cm Abschnitte in den Kassetten. Wenn die Querschnitte zu groß sind, um die Hälfte (Abbildung 2b) zu schneiden. Label-Kassetten für blaue vordere Hälfte als "A" und hinteren Hälfte als "B".
- Wenn die Stücke immer noch zu groß sind, schneiden sich senkrecht zu dem vorigen Schnitt (Abbildung 2c). Etikettenkassetten AD im Uhrzeigersinn. RANDSTÜCKE weiter wie notwendig, um innerhalb von Kassetten passen.
- Anzahl Blöcke sequentiell innerhalb der Region, beginnend mit dem mittleren Abschnitt.
- Für Paraffin-Blöcke, Position Cassettes mit dem Etikett nach links und die Gewebeschnitte in die Kassette unter Beibehaltung der Orientierung. Schließen Kassettenfachdeckel und Transfer zu einem Behälter mit ~ 500 ml 10% neutral gepuffertem Formalin (NBF). Starten Sie die Zeitnehmung Fixierung, wenn die letzte Kassette in Fixativ gelegt wird.
- Für Oktober Blöcke, gießen Sie eine dünne Schicht von Oktober Medium in den prelabeled Schimmel lag dann das Gewebe in der Form sicher zu sein, um Orientierung zu erhalten und decken Gewebe mit Oktober Schnell tauchen die Formen Oktober in einem Trockeneis - Isopentan Gülle für ~ 1 Minute. Entfernen von Schlamm und auf Trockeneis für die temporäre Speicherung oder im Gefrierschrank -80 ° C für die langfristige Lagerung.
- Erhalten ~ 0,5 x 0,5 cm dicke Scheiben von der Kopf-Körper-Knotenpunkt für Elektronenmikroskopie (EM). Eine Scheibe in der TAAB Fixativ und die andere Scheibe in der Lowicryl Fixativ. Bewahren Sie beide Arten von Fixativ mit Proben bei 4 ° C für mindestens 48 Stunden und / oder auf unbestimmte Zeit bis zur weiteren Verarbeitung zur EM.
4. Milz, Lymphknoten Zergen und Duodenalschleimhaut Dissektionen
- Isolieren Lymphknoten (PLN) aus Fett und schneiden alle Bindegewebe an den Knoten Kapsel. Platz in sterilen Zellkulturschale enthaltend DMEF. Je nach Gesamtzahl isoliert, teilen PLN in Aliquots für frische Lieferungen, kryokonservierten Zellen Isolationen, Paraffin und / oder Oktober Blöcke, und Vials. Hackfleisch großen Knoten in Stücke nicht größer als 0,5 cm.
- Hackfleisch nicht Lymphknoten und Milz in kleine (ca. 0,5 cm) Würfel. Place in Fixativ, Oktober Medien und DMEM oder für frische Probe Sendungen oder kryokonservierten Zellen Isolierungen nach Mengen an Ausgangsmaterialien.
- Öffnen Sie den Zwölffingerdarm und sanft über das Duodenalschleimhaut sauber von Schleim mit einem befeuchteten Gaze-Pad. Schneiden Sie Abschnitte der Schleimhaut für Paraffin und / oder gefrorene Blöcke Oktober und Hackfleisch-Proben für Vials, mit und ohne RNAlater. Frieren wie für die anderen Proben.
5. Wrap Oktober Blöcke in vorher beschriftete Aluminiumfolie und Oktober statt und Blöcke Vials in Schachteln für die langfristige Lagerung bei -80 ° C
6. Submit fixierten Proben für Paraffin-Verarbeitung
- Fix Gewebe für 16 Stunden (zwischen 20 ± 4 Stunden) mit Hilfe eines automatischen Paraffin-Prozessor oder mit manuellen Timing. Verarbeiten, um Paraffin-Blöcke mit einem automatischen Prozessor ( Anhang 2 ).
- Einbetten Abschnitte in der exakten Ausrichtung wie von der Prosektor mit der Kassette Etikett auf der linken Seite platziert. Betten Sie die Duodenalschleimhaut mit der Schnittfläche nach unten um die Prüfung der Schleimhaut senkrecht zur Submukosa zu ermöglichen.
7. Reinigen Sie Dissektion Bereichen und zu desinfizieren. Waschen Sie Dissektionsinstrumente und erneut sterilisieren. Platzieren Sie Überbleibsel menschlichen Geweben in Formalin Fixativ für die Lagerung wie biomedizinischen Abfällen. Entsorgen Sie biomedizinischen Abfällen nach den örtlichen Bestimmungen innerhalb eines Monats.
8. Aktualisieren Sie den Sample Inventory System
ve_title "> 9. repräsentative ErgebnisseDieses Verfahren wird eine intakte menschliche Bauchspeicheldrüse mit repräsentativen Stichproben im gesamten Organ einschließlich Abgrenzung der drei wichtigsten Regionen, nämlich Kopf, Körper und Schwanz innerhalb von 2 Stunden zu verarbeiten. Die hakenförmigen Bereich in der hinteren Kopfbereich gefunden wird, wird in den Kopf Dissektion enthalten. Das mittlere Gewicht der Bauchspeicheldrüse in Organspender ohne Diabetes war 82,4 Gramm (52,7 bis 139,0 Gramm). Pankreas regionalen Gewichte waren annähernd gleich (Abbildung 3).
Dieses Verfahren kann auch für die Rekonstruktion des gesamten Pankreas mit gefärbten Schnitten sequentielle Paraffin und Oktober Blöcke ermöglichen. Mehrere Formate sind machbar was eine maximale Auslastung für aktuelle und zukünftige Technologien. Der aktuelle Fall nPOD Arbeitsblatt zur Verfügung gestellt ( Anhang 1 ), die verwendet wird, um wieder Proben und anschließende proc dokumentierenEssing von aliquoten Arten und Mengen.
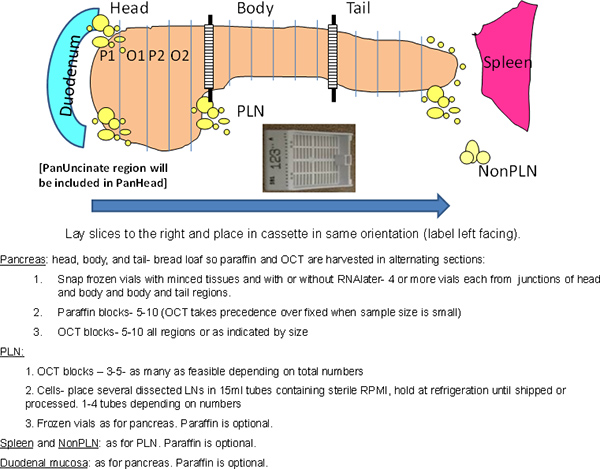
Abbildung 1. Allgemeine Systematik des Verfahrens. Die gesamte Bauchspeicheldrüse verarbeitet wird unter Beibehaltung anatomischen Orientierungen. Der Kopfbereich, geht in der Superior-inferior-Achse aufgrund der Anwesenheit des ventralen Pankreas Keule in der hinteren Region, die die hakenförmigen Region umfasst. Schraffierte Fläche an Kreuzungen bezeichnen Regionen für Hackfleisch-Proben in Kryoröhrchen verwendet. P, Paraffin, O, Oktober
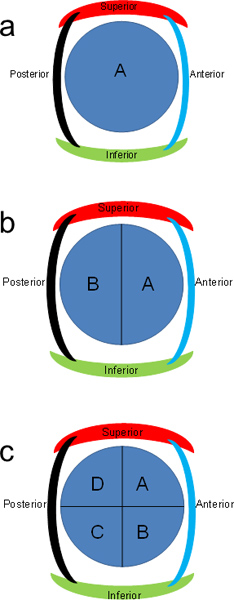
Abbildung 2. Lettering System für den Pankreas-Abschnitten. Transverse Bauchspeicheldrüse Scheiben lassen sich weiter in Hälften oder Viertel unterteilt und mit Buchstaben im Uhrzeigersinn.
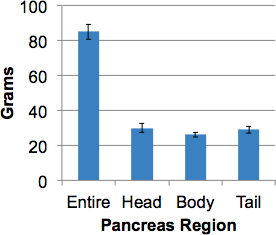
Abbildung 3. Bauchspeicheldrüse von Organspendern Gewichte ohne Diabetes. Dieintakten Bauchspeicheldrüse von erwachsenen Spendern (> 17 Jahre) wurde dann aufgeteilt in Regionen und der regionalen Gewichte erhalten gewogen. Die Daten sind Mittelwerte ± SEM (n = 15).
Diskussion
Das Ziel dieses Verfahrens ist es, einen Standard, der Bauchspeicheldrüse Verarbeitung harmonisiert werden auf mehreren Sammelstellen können definieren und ermöglichen so einen Vergleich der Ergebnisse von verschiedenen Gruppen erhalten. Die Dissektion Methode basiert auf Standard-chirurgischen Pathologie Praxen mit zusätzlichen Schritten zur Annotation von großen Regionen der Bauchspeicheldrüse durch intra-regionalen Unterteilungen gefolgt basiert. Die Standardisierung der Bioprobe Verarbeitungsmethoden ist erfor...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken den Spendern die Familien und die Orgel Beschaffung Organisationen in diesem Forschungs-und Maria Martino und Irina Kusmartseva für ihre fachkundige Unterstützung beteiligt. Diese Arbeit wurde von der Juvenile Diabetes Research Foundation (MC-T., MA) zur Unterstützung des Network for Organ Donors mit Pankreas-Diabetes gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Dissektionsinstrumente einschließlich Skalpelle mit 22 Klingen | Verschiedene | Verschiedene | |
| Zentrifugenröhrchen (15 und 50 ml) | Fisher Scientific | 05-539-5, 430828 | Steril |
| Kryoröhrchen (1,8 ml) | VWR Nordamerika | 89004-300 | Sterile, Barcodes optional |
| RNAlater | Ambion | AM7021 | |
| Klinische Pathologie Ink | |||
| Kassetten | Mercedes Medical | CAS ECO109 | |
| 10% neutral gepuffertem Formalin | Fisher Scientific | 23-245-685 | |
| Oktober Einfriermedien | TissueTek | 4583 | |
| Schimmelpilze | ThermoScientific | 58952 | Verschiedene Größen |
| Isopentan | Fisher Scientific | O3551-4 | Oktober chilling Bad |
| Trockeneis | Oktober chilling Bad | ||
| Flüssiger Stickstoff im Dewar-Gefäß | Rasten Sie das Einfrieren Kryoröhrchen | ||
| Zellkulturschale (100mm) | Corning | 430167 | Steril |
| Hyclone DMEF | ThermoScientific | SH30023.01 | Steril, kann gekühlt, enthalten Glutamin |
| fötalem Rinderserum | Cellgro | 35-010-CV | Sterile, speichern gefrorenen Aliquots |
| Penicillin / Streptomycin / antimykotische | GIBCO | 15240-062 | Sterile, speichern gefrorenen Aliquots |
| Typ 9 Paraffin | Richard-Allan Scientific | 8337 | |
| 1x D-PBS | GIBCO | 14190-144 | Steril |
| 16% Paraformaldehyd | EM Sciences | 15710 | Machen Sie frisch, gekühlt lagern |
| 8% Glutaraldehyd | EM Sciences | 16019 | Machen Sie frisch, gekühlt lagern |
| Biosafety Level 2 Haube | Verschiedene | ||
| Ultra-Low-Gefrierschrank | Verschiedene | ||
| Sakura Cassette Drucker | Sakura | ||
| Sakura VIP300 | Sakura | Automatische Paraffin-Prozessor | |
| Paraffineinbettung Bahnhof | ThermoFisher |
Tabelle 1. Spezifischen Reagenzien und Geräte.
Referenzen
- Brissova, M. Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy. J. Histochem. Cytochem. 53, 1087-1097 (2005).
- Rahier, J. The pancreatic polypeptide cells in the human pancreas: the effects of age and diabetes. J. Clin. Endocrinol. Metab. 56, 441-444 (1983).
- Uchida, T., Takada, T., Ammori, B. J., Suda, K., Takahashi, T. Three-dimensional reconstruction of the ventral and dorsal pancreas: a new insight into anatomy and embryonic development. J. Hepatobiliary Pancreat. Surg. 6, 176-180 (1999).
- Wittingen, J., Frey, C. F. Islet concentration in the head, body, tail and uncinate process of the pancreas. Ann. Surg. 179, 412-414 (1974).
- Rahier, J., Goebbels, R., Henquin, J. Cellular composition of the human diabetic pancreas. Diabetologia. 24, 366-371 (1983).
- Vaught, J. An NCI perspective on creating sustainable biospecimen resources. J. Natl. Cancer Inst. Monogr. 42, 1-7 (2011).
- Gianani, R. Initial results of screening of nondiabetic organ donors for expression of islet autoantibodies. J. Clin. Endocrinol. Metab. 91, 1855-1861 (2006).
- Tauriainen, S., Salmela, K., Rantala, I., Knip, M., Hyöty, H. Collecting high-quality pancreatic tissue for experimental study from organ donors with signs of β-cell autoimmunity. Diabetes Metab. Res. Rev. 26, 585-592 (2010).
- In't Veld, P. Screening for insulitis in adult autoantibody-positive organ donors. Diabetes. 56, 2400-2404 (2007).
- Töns, H. A., Terpstra, O. T., Bouwman, E. Heterogeneity of human pancreata in perspective of the isolation of the islets of langerhans. Transplant Proc. 40, 367-369 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten