A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس كمية Invadopodia بوساطة التحلل البروتيني المصفوفة خارج الخلية في سياقات متعددة الخلايا واحدة و
In This Article
Summary
نحن تصف طريقة تنميط لإنتاج المجهر coverslips المغلفة مع الجيلاتين الفلورسنت لتصور invadopodia بوساطة تدهور المصفوفة. وتعرض التقنيات الحاسوبية باستخدام البرمجيات المتاحة لقياس مستويات الناتجة من التحلل البروتيني مصفوفة واحدة من قبل خلايا داخل المختلط والسكان للمجموعات متعددة الخلايا المجهرية التي تشمل حقول بأكملها.
Abstract
غزو الأنسجة الخلوية في المحلية هو عملية مهمة في التنمية والتوازن. Malregulated الغزو وما تلاه من حركة الخلايا هو سمة من العمليات المرضية متعددة، بما في ذلك الالتهاب، أمراض القلب والشرايين والأورام الانبثاث الخلية 1. مبؤرة تدهور بروتين من مكونات خارج الخلية (ECM) مصفوفة في الغشاء القاعدي الظهارية أو البطانية هو خطوة حاسمة في بدء الغزو الخلوية. في الخلايا السرطانية، قررت واسعة في تحليل المختبر أن يتم إنجاز ECM من تدهور الهياكل الغشائية البطنية الأكتين الغنية تبارزي وصف invadopodia 2،3. Invadopodia النموذج في بدل بالقرب من ECM، حيث معتدلة ECM انهيار من خلال عمل مصفوفة metalloproteinases (MMPs). قدرة الخلايا السرطانية على تشكيل invadopodia يرتبط بشكل مباشر مع القدرة على غزو سدى في الأوعية الدموية والمكونات المحلية المرتبطة بها 3. _content "برزت> التصور من تدهور ECM invadopodia بوساطة الخلايا بواسطة المجهر الفلورسنت باستخدام مصفوفة البروتينات صبغ المسمى المغلفة coverslips على الزجاج والأسلوب الأكثر انتشارا لتقييم درجة التحلل البروتيني مصفوفة الخلوية وإمكانات الغازية 4،5. نحن هنا وصف يتم تحجيم بسهولة نسخة من الطريقة القياسية لتوليد coverslips الزجاج fluorescently التي تحمل علامات الاستفادة من ولاية أوريغون الخضراء المتاحة تجاريا-488 المتقارن الجيلاتين. هذه الطريقة لإنتاج بسرعة أعداد كبيرة من coverslips المغلفة. نعرض بعض من القطع الأثرية والمجهرية الشائعة التي غالبا ما واجهت يمكن خلال هذا الإجراء، وكيف يمكن تجنب هذه. وأخيرا، نحن تصف أساليب موحدة متاحة بسهولة باستخدام برامج الكمبيوتر للسماح الكمي للتدهور صفت مصفوفة الجيلاتين بوساطة الخلايا الفردية والسكان الخلوية بأكملها. والإجراءات المذكورة توفير القدرة على رصد دقيق وبتكاثر invadopodiaالنشاط، ويمكن أيضا أن تكون بمثابة منصة لتقييم فعالية بروتين تعبير تحوير أو اختبار المضادة للمركبات الغازية على تدهور المصفوفة خارج الخلية في أماكن متعددة الخلايا واحدة و.
Protocol
1. إنتاج الخضراء ولاية أوريغون 488-الجيلاتين المغلفة Coverslips
- إعداد الخالي من الملصقات 5٪ (وزن / وزن) سوق الأسهم الجيلاتين / حل السكروز بإضافة 1.25 غرام الجيلاتين و 1.25 غرام في PBS السكروز إلى الحجم النهائي من 50 مل. تدفئة محلول الجيلاتين لC ° 37 وضمان ذاب تماما قبل الاستخدام. تخزين الخليط النهائي في C. ° 4
- تنظيف 13 مم coverslips الزجاج # 1 بواسطة وضع ساترة الفردية في كل بئر من البلاستيك جيدا لمدة 24 لوحة الأنسجة الثقافة. إضافة 500 ميكرولتر من حمض النيتريك 20٪ إلى كل بئر واحتضان لمدة 30 دقيقة. نضح الحل حامض النيتريك ويغسل ثلاث مرات مع coverslips الماء منزوع الأيونات.
- coverslips معطف مع 500 ميكرولتر من 50 ميكروغرام / مل بولي-L-يسين (المحضرة من 0.1٪ محلول المخزون ومخففة في الماء منزوع الأيونات) إلى كل بئر لمدة 20 دقيقة في درجة حرارة الغرفة. نضح الحل ويغسل ثلاث مرات مع برنامج تلفزيوني. بولي-L-يسين طلاء طلاء حتى يسهل الترابط ولللا المغطيbeled الجيلاتين.
- إضافة 500 ميكرولتر من 0.5٪ غلوتارالدهيد (مصنوعة الطازجة قبل استخدامها) إلى كل بئر واحتضان لوحات جيدا على الجليد 24 لمدة 15 دقيقة. نضح ويغسل ثلاث مرات مع برنامج تلفزيوني الباردة. تأكد من إزالة كل آثار PBS قبل طلاء الجيلاتين. الحفاظ على لوحات على الجليد خلال جميع يغسل حتى تتم إضافة الجيلاتين.
- إعادة تشكيل الأخضر أوريغون 488، مترافق الجيلاتين المصنعة في كبروتوكول والحارة وبين 5٪ الخالي من الملصقات الجيلاتين حل السكروز / من (1.1) إلى 37 ° C. تمييع جزء واحد ولاية أوريغون الخضراء 488 الجيلاتين إلى ثمانية أجزاء من السكروز غير المسماة / الجيلاتين (أي؛ 500 ميكرولتر من الجيلاتين ولاية أوريغون 488 الأخضر إلى 4 مل من خليط الجيلاتين 5٪). الماصة 100 ميكرولتر من خليط الجيلاتين 488-المخفف (C ° الاحتفاظ بها في 37) على كل ساترة، وذلك باستخدام الجيلاتين يكفى لتغطية ساترة دون نشر دليل (والتي يمكن أن تؤدي إلى طلاء ساترة متفاوتة كما هو موضح في الشكل 3B). من المهم للحفاظ على المخفف 488-الجيلاتين خليط عند 37 درجة؛ C أثناء إجراء طلاء لمنع تصلب سابق لأوانه. وينبغي من هذا خطوة إلى الأمام أن تبقى في الظلام coverslips قدر الإمكان لتجنب photobleaching المحتملة. يمكن أن تكون بديلا البروتينات الأخرى ECM مترافق لfluorophores مختلفة للجيلاتين ولاية أوريغون 488 الأخضر (انظر المناقشة).
- مرة واحدة والمغلفة coverslips في كل لوحة واحدة، وعقد 24 لوحة جيدا في زاوية وإزالة الزائد من الجيلاتين جيدا من قبل كل الشفط. احتضان coverslips المغلفة في الظلام لمدة 10 دقيقة في درجة حرارة الغرفة.
- غسل coverslips ثلاث مرات مع برنامج تلفزيوني، ثم يضاف 500 ميكرولتر من بوروهيدريد الطازجة 5 الصوديوم ملغ / مل (NABH 4) لمدة 15 دقيقة في درجة حرارة الغرفة للحد من تعطيل وغلوتارالدهيد المتبقية. بوروهيدريد الصوديوم هو فوارة، وفقاعات صغيرة سوف يكون واضحا في وحول كل ساترة.
- إزالة 4 NABH حل عن طريق الشفط مع الحركة الكاسح السريع في جميع أنحاء خارج كل بئر. والحرص على عدم التقاط أي coverslips العائمة التي أصبحت بعيدة عن الجزء السفلي من لوحة الثقافة الأنسجة أثناء العلاج NABH 4. ويمكن أن coverslips منفصلة تطفو الى الاعلى بلطف مرة أخرى دفعت إلى أسفل أيضا، ولكن يجب توخي الحذر لتجنب إتلاف طلاء البروتين. يغسل كل بئر ثلاث مرات مع برنامج تلفزيوني واحتضان ثم coverslips في الايثانول 70٪ لمدة 30 دقيقة في درجة حرارة الغرفة.
- باستخدام تقنية معقمة، ونقل لوحات تحتوي على ساترة إلى نوع خلية ثقافة IIA / B تدفق الصفحي هود وشطف coverslips ثلاث مرات مع برنامج تلفزيوني العقيمة. يمكن في هذه المرحلة أن يتم تخزين coverslips في PBS محمية من الضوء عند 4 درجة مئوية لمدة شهرين على الأقل.
- نقل coverslips لاستخدامها في فحوصات لتدهور بئر فارغة من لوحة جيدا 24 جديدة عن طريق إزالة بعناية باستخدام ملقط وإبرة معقمة. تتوازن coverslips ل1-24 ساعة كاملة مع وسائل الإعلام الملائمة لنوع خلية معينة يجري يعاير. يجب الحرص على عدملعكس ساترة أو خدش طلاء الجيلاتين (انظر الشكل 3B).
2. الطلاء وتجهيز خلايا في ولاية أوريغون الخضراء 488-الجيلاتين المغلفة لتدهور Coverslips ECM الفحص
- 3-5x10 البذور 4 خلايا في الصعود إلى ساترة داخل كل بئر من لوحة البئر 24.
- إجراء دراسة لتحديد دوام الأوقات المثلى اللازمة لنشاط تدهور invadopodia للخط خلية معينة / نوع من الاهتمام. معظم الخلايا الغازية تتطلب وقتا بين 4-24 ساعة لتدهور لتصبح واضحة، على الرغم من هذا النطاق يمكن أن تختلف على نطاق واسع وينبغي أن تحدد تجريبيا. لمزامنة invadopodia النشاط، ويمكن علاج الخلايا مع مثبطات MMP (على سبيل المثال، GM 6001) لفترة زمنية المطلوب، ثم يغسل خارج المانع للسماح للمضي قدما invadopodia النشاط (على سبيل المثال، انظر 6).
- شطف coverslips ثلاث مرات مع برنامج تلفزيوني، ثم إصلاح الخلايا مع 500 ميكرولتر من 10٪ مخزنة الفورمالين phosphaالشركة المصرية للاتصالات لمدة 15 دقيقة. شطف ثلاث مرات مع برنامج تلفزيوني وpermeabilize لمدة 4 دقائق مع تريتون 0.4٪ X-100 في برنامج تلفزيوني. شطف ثلاث مرات مع برنامج تلفزيوني لإزالة تريتون X-100.
- الخلايا التسمية باستخدام أي بروتوكول قياسي لتلطيخ المناعي (انظر صفحة 7 على سبيل المثال) من خلال المشاركة في وضع العلامات مع الخلايا الفلورسنت phalloidin مترافق لتصور خيوط الأكتين (F-الأكتين) وعلامة لبروتين يعرف أن يموضع لinvadopodia (على سبيل المثال؛ cortactin 5، TKS5 8، أو N-دبور 9). حفظ تجنب استخدام الأجسام المضادة التي تحمل علامات 488 الثانوية أو GFP-صفت حالة استخدام البروتينات ولاية أوريغون الخضراء أو 488 FITC التي تحمل علامات الجيلاتين لمنع تداخل الإشارة.
- تحميل coverslips الملون على الشرائح الزجاجية المجهر من قبل ساترة للقلب بعناية ووضعه على قطرة من الذهب أو إطالة antifade كاشف مماثلة.
- لتقييم تدهور مصفوفة، وخلايا الصورة في القنوات المناسبة باستخدام مجهر الفلورسنت التقليدية أو مبائر. الجيلاتين تدهورهو تصور وقتامة المناطق على ساترة بسبب إزالة بروتين فلوري من الجيلاتين (الشكل 4A). وضع العلامات من الخلايا لالأكتين والبروتين علامة invadopodia يسمح لتأكيد invadopodia في مواقع تدهور المصفوفة في الصور المدمجة (الشكل 4A).
- ويمكن أيضا أن تراقب النشاط تدهور في الوقت الحقيقي من خلال التصوير الخلية الحية مع البروتينات المؤتلف الفلورسنت الموسومة لتتبع invadopodia تشكيل مصفوفة وتدهور 5،10،11.
3. الكمي للتدهور الجيلاتين نيون بواسطة قياس تطبيع تدهور مصفوفة
هذا التحليل يوفر منطقة تطبيع التدهور النسبي لمصفوفة مجال الخلايا أو عدد من الخلايا. ومن المفيد لتحليل المجالات المجهرية كاملة من حيث طريقة العرض خلايا متعددة موجودة التي تم التعامل بشكل جماعي مع عوامل النمو سيرنا، أو العوامل العلاجية. لهذا تحليل سياسيق والصور التي تم جمعها في أقل التكبير كافية لجمع المعلومات حول السكان بكفاءة من الخلايا.
- فتح الصور في يماغيج 12. ويمكن تحميل يماغيج للفحص المجهري من http://www.macbiophotonics.ca/imagej/ .
- تحقق من المعلومات على نطاق باختيار أمر القائمة "تحليل / تعيين الحجم". هذه المعلومات سوف تستورد تلقائيا مع العديد من تنسيقات الملفات، ولكن يمكن إدخالها يدويا إذا لزم الأمر. التحجيم المناسب من الضروري أن يقدم قياسات في ميكرون بدلا من بكسل.
- تحديد القياسات المناسبة لتتبع عن طريق اختيار "تحليل / تعيين القياسات". تحقق المنطقة والحد الى عتبة.
- حساب مساحة تدهور باستخدام صورة الفلورسنت الجيلاتين (الشكل 5A).
- عتبة صورة ("صورة / ضبط / عتبة") لتعيين بي العلوي والسفليسجلت قيم الكثافة لتحديد مجالات تدهور (مميزة باللون الأحمر؛ 5B الشكل). في الصور اللاحقة، استخدم الزر تعيين في إطار عتبة عتبة لتعيين نفسه بالنسبة لجميع الصور كهدف لتحديد منطقة يعني التدهور.
- في بعض الحالات، قد لا تكون ساترة مسطحة تماما عندما يتم الحصول على الصور. هذا يتسبب في شدة الجيلاتين لتغيير عبر الصورة. إذا هذا الاختلاف يخلق مشاكل عند العتبة الصورة، الإضاءة الصحيحة للتفاوت في جميع أنحاء الجيلاتين عن طريق طرح الخلفية ("عملية / طرح الخلفية") أو عن طريق الترشيح مع ممر الموجة مرشح ("عملية / FFT / ممر الموجة مرشح") أو flatfield الزائفة مرشح ("عملية / فلاتر / Flatfield الزائفة") حتى كثافة الخلفية موحدة.
- قياس مجال تدهور المصفوفة ("تحليل / تحليل الجزيئات"). في إطار تحليل الجزيئات، اختيار حجم الجسيمات> 0 لإزالة الضوضاء من tانه الاختيار. عرض الخطوط العريضة لتحديد المناطق ذات الأهمية (رويس). تحقق عرض النتائج وتلخيص لإظهار القياسات. إذا كان الرسم وحدد على وجه التحديد جميع المجالات من تدهور (الشكل 5C)، نسخ قياس المساحة الكلية في جدول بيانات. إذا تم تحديد كائنات أخرى (مثل الحطام)، فقط سجل مناطق رويس ذات الصلة.
- حساب مساحة الخلية باستخدام الملون phalloidin (F-الأكتين) الصورة (الشكل 5D).
- عتبة صورة ("صورة / ضبط / عتبة") لتعيين كثافة بكسل القيم العليا والسفلى بحيث يتم تحديد حواف الخلايا (مميزة باللون الأحمر؛ الشكل 5E). في الصور اللاحقة، استخدم الزر تعيين في إطار عتبة عتبة لتعيين نفسه بالنسبة لجميع الصور كهدف لتحديد منطقة يعني الخلية.
- 10 قياس مجال الخلايا ("تحليل / تحليل الجزيئات"). في تحليل الحزبالجسيمات النافذة، اختيار حجم الجسيمات> 0 لإزالة الضوضاء من التحديد. عرض الخطوط العريضة لتحديد مناطق للتحليل (الشكل 5F). تحقق عرض النتائج وتلخيص لإظهار قياسات المجال. لا تحقق تضمين ثقوب إذا كان هناك مسافات بين الخلايا في كتلة حتى لا بكسل غير المحددة ضمن الكتلة إدراجها في الخلية حساب المجال. اختر موافق.
- نسخ النتائج ذات الصلة رويس المنطقة لفي جدول بيانات.
- حساب مساحة تدهور الجيلاتين في المساحة الإجمالية للخلايا 13.
- وثمة نهج بديل يتمثل في الإبلاغ عن مجال تدهور في عدد الخلايا من العد نوى (الشكل 5G). هذا أمر ضروري إذا التلاعب تغيير المنطقة الخلية بين مختلف الفئات العلاج مقارنة. العد الآلي يعمل بشكل أفضل إذا يتم فصل النوى جيدا، وكثافة موحدة في الجولة. الاعتماد تلقائيا nucleط ("الإضافات / الجسيمات التحليل / مكافحة نواة"). اختيار أصغر وأكبر حجم الجسيمات، وأسلوب وطريقة عتبة تجانس. تحقق طرح الخلفية، تصفية مستجمعات المياه، إضافة إلى إدارة ROI الجسيمات وملخص عرض (الشكل 5H).
- إذا نوى تتداخل على نطاق واسع أو يكون لها شكل غير منتظم أو الملمس، قد لا تنتج العد الآلي حصيلة دقيقة (الشكل 5H، الأسهم على اليمين). في هذه الحالة، يمكن تسهيل العد اليدوي باستخدام أداة مكافحة الخلية ("الإضافات / الجسيمات التحليل / خلية مكافحة"). هذا وسوف تبقي العد ويتم وضع علامة الخلايا خلال العد اليدوي (الشكل 5I).
- نسخ عدد الخلايا (نوى) في جدول بيانات. حساب مساحة تدهور الجيلاتين في العدد الإجمالي للخلايا.
4. الكمي للتدهور نيون الجيلاتين من الخلايا الفردية في مجال السكان الخلوية المختلطة
لتقييم تدهور المصفوفة الناتجة عن خلايا معينة في السكان بصرف النظر عن خلايا أخرى داخل الحقل (على سبيل المثال، تقاس مقابل غير بالنقل الخلايا)، يمكن تعديل الإجراء في المقطع 3 لقياس مجال تدهور تحت الخلايا الفردية. هناك حاجة إلى قناة إضافية الفلورية للاحتفال الخلايا المصابة بالعدوى بالنقل. في هذا المثال، صور عالية التكبير والخلايا جيدا أسهل في فصل quantitate.
- تحقق من المعلومات على نطاق باختيار أمر القائمة "تحليل / تعيين الحجم". حدد القياسات المناسبة لتتبع عن طريق اختيار "تحليل / تعيين القياسات". تحقق المنطقة والحد الى عتبة.
- لخلايا الفردية التي ليست لمس، وتحديد كل خلية باستخدام صورة F-الأكتين (الشكل 6A). عتبة الصورة (انظر 3.9) (الشكل 6B). من المهم للقبض على حواف الخلايا، ولكن يمكن أن يكون هناك ثقبليست مدرجة في الداخل أنه في العتبة. استخدام قيم الكثافة نفسها عبر الصور لتحديد حدود الخلية.
- لقياس مجال الخلايا، استخدم "تحليل / تحليل الجزيئات". في إطار تحليل الجزيئات، اختيار حجم> 0 (للقضاء على الضوضاء) وهي توضح عرض،، وتحقق نتائج عرض، إضافة إلى إدارة وتشمل ثقوب (لتسجيل المنطقة بأكملها داخل المخطط). اختر موافق وتسجيل منطقة لكل خلية من إطار النتائج.
- تحديد الخلايا التي يتم تقاس (الشكل 6C).
- تحديد مجالات تدهور باستخدام صورة الفلورسنت الجيلاتين (الشكل 6D). إذا لزم الأمر، تصفية الصور الجيلاتين لشدة حتى الخلفية (انظر 3.6). عتبة لتحديد مجالات تدهور، مما يجعل علما إعدادات العتبة (الشكل 6E). على الصور اللاحقة، استخدم هذه القيم نفس كثافة العلوي والسفلي (باستخدام مجموعةالزر في نافذة عتبة) لاختيار الهدف من مجالات تدهور.
- قياس مجالات تدهور تحت الخلايا. على الصورة thresholded الجيلاتين الفلورسنت، وتبين الخطوط العريضة للخلايا عن طريق اختيار رويس في إطار إدارة ROI واختيار قياس (الشكل 6F). تسجيل النتائج وحساب مساحة تطبيع التدهور / خلية خلية أو منطقة.
5. ممثل النتائج
يظهر التخطيطي الشامل لإجراء في الشكل 1. الإجراء ينطوي على إعداد coverslips الزجاج وطلاء مع الجيلاتين، مترافق fluorescently، تصفيح من الخلايا على وcoverslips المغلفة للسماح لخلايا تدهور الجيلاتين، وتحديد ووضع العلامات على الخلايا المجهرية لتحليل مضان، والتصوير المصفوفة الفلورسنت لتقييم سلامة مصفوفة، وقياس موضوعي لدرجة التدهور مصفوفة الجيلاتين باستخدام الكمبيوتر سوفتواريه.

الشكل 1. التخطيطي الإجمالي تسليط الضوء على الخطوات الرئيسية المشاركة في الفلورية الطلاء طلاء الجيلاتين الخلية،، وتحديد وimmunolabeling، وتقييم التحلل البروتيني المصفوفة.
وترد الخطوات الإجرائية الرئيسية المشاركة في إعداد وطلاء الزجاج coverslips في الشكل 2.
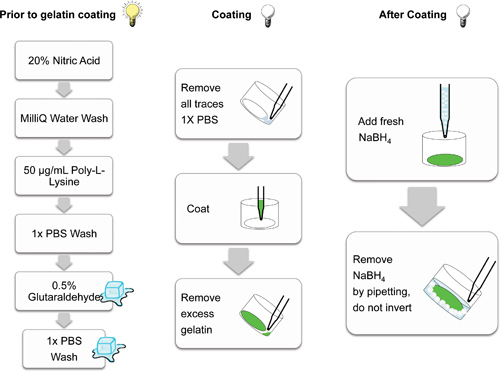
الشكل 2. تخطيطي مما يدل على الخطوات الفردية المشاركة في إعداد coverslips الزجاج لطلاء مصفوفة الجيلاتين. الخطوات التي أجريت في ضوء (لمبة مضاءة)، على الجليد (مكعبات) وفي (لمبة غير مضيئة) هي الظلام الكرتون المشار إليها. الخطوات التي أجريت في الظلام مساعدة منع photobleaching من المصفوفات الفلورسنت.
عندما يقوم بشكل صحيح، والمغلفة بشكل متساو مع coverslips الخضراء ولاية أوريغون 488-G مترافقelatin، وعرض مضان متجانسة عندما تصور بواسطة المجهر (الشكل 3A). التحف النموذجية التي يمكن أن تنشأ نتيجة لطلاء غير لائق، وتظهر المناولة والتخزين واستخدام coverslips المغلفة في الشكل 3B.
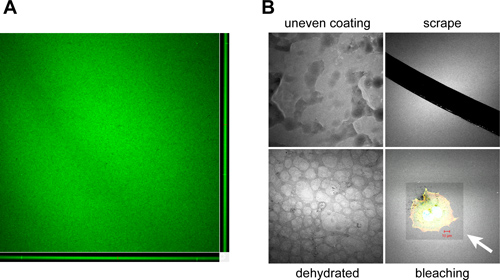
الشكل 3. مثال على القطع الأثرية واجهتها خلال الجيلاتين المغلفة إعداد ساترة والتعامل معها. A. مشاهدة متعامد من كومة-Z مبائر يظهر لون نموذجية والاتساق من ولاية أوريغون الخضراء 488، مترافق ساترة المغلفة الجيلاتين تنتج باستخدام بروتوكول المقررة. يجب أن يكون طلاء Coverslips متجانسة ~ 1-2 ميكرون سميكة كما هو موضح في XZ (القاع) وYZ (يمين) طائرات مبائر قطع أثرية B. التي يمكن أن تحدث خلال طلاء وتجهيز الجيلاتين المغلفة coverslips ما يلي:. غطاء غير لائق لل ساترة خلال عملية الطلاء بسببلسوء التصلب، والخلط اليدوي نشر أو الجزئي للخليط الجيلاتين (طلاء متفاوتة)، وإزالة المصفوفة المغلفة بتسجيله مع الإبر أو ملقط أثناء التداول (كشط)، جفاف سطح ساترة خلال فترات التخزين لفترات طويلة، مما أدى إلى حصوه " "ظهور (المجففة) وphotobleaching من سطح الجيلاتين الفلورسنت خلال التصوير بسبب لفترات طويلة أو التعرض للضوء عالية الكثافة (التبييض). السهم الأبيض يشير إلى منطقة رأس ابيض يشمل OSC19 مطلي والخلية الحرشفية سرطان عنق. وpseudocolored الخضراء ولاية أوريغون 488، مترافق الجيلاتين الأبيض لتعزيز تباين الصورة. بار، 10 ميكرومتر.
المصفوفات الناتجة رقيقة أنتجت خلال هذا الإجراء توفير وسيلة حساسة لتقييم قدرة الخلايا أن تتحلل ECM. الشكل 4 يوضح مثال للنشاط invadopodia من خلية OSC19 مطلي على ساترة الخضراء ولاية أوريغون-488 الجيلاتين مترافقوالتقط بواسطة المجهر متحد البؤر التقليدية وكذلك من حيث الحجم ملء تقديم صورة بعد ثلاثة deconvolution الأبعاد.

الشكل 4. أمثلة الممثل النشاط invadopodia تدهور المصفوفة. A. تصور invadopodia وما يقابلها من التحلل البروتيني مصفوفة الجيلاتين. OSC19 الخلايا مطلي على الأخضر أوريغون 488، مترافق coverslips الجيلاتين لمدة 10 ساعة تم إصلاحها وصفت مع رودامين مترافق-phalloidin (F-الأكتين) والمضادة للcortactin الأجسام المضادة (الأجسام المضادة تصور مع اليكسا 647 فلور الثانوية والأخضر pseudocolored). Invadopodia واضحة وتركيزات حشوية التنسيق من أكتين-F وcortactin التي تتداخل مع مجالات المقاصة الجيلاتين (الثقوب السوداء في المصفوفة) داخل الصورة المدمجة. المناطق التي تحتوي على رؤوس سهام تشير محاصر invadopodia الفردية ومجالات التنسيق التحلل البروتيني مصفوفة كما هو موضح في إعادة الموسعgions أدناه. بار، 10 ميكرومتر. B. حجم ملء التصور الاختراق invadopodia في ECM. وقدمت بصريا OSC19 الخلايا مطلي والملون كما في (A) من خلال الحصول على 23 ميكرومتر بصري المتعاقبة 0،32 Z-مجموعها 7،04 ميكرون شرائح لرودامين مترافق-phalloidin والأخضر ولاية أوريغون 488، مترافق الجيلاتين. تم فتح الملف الأصلي LSM تعيين كل قناة في مجال البرمجيات وX2.2 AutoQuant تم إجراء deconvolution 3D أعمى كل كومة الصورة باستخدام الإعدادات الموصى بها (10 التكرار، والضوضاء متوسطة). تم حفظ الصور ومعالجتها مداخن TIFF التي تم فتحها ثم في عناصر NIS وتقديم كطريقة عرض حجم مع مزج ألفا. تم تعديل طرفيات المستعملين المحليين، وتم إنشاء subvolume لإظهار ميزة داخل الخلية حيث invadopodia موجودة. الحافة الظهرية عرض يوضح invadopodia (الأحمر والسهام) إدراجها في الجيلاتين الأساسية (الخضراء). بطني الحافة تعرض شاشة العرض invadopodia تبارزي ومناطق تدهور الجيلاتين تحت ساترةكما الحاضر مناطق حمراء في المصفوفة الخضراء (النصال). يتم اقتصاص الصورة مجموع الحقل إلى 77 ميكرون قدم 65 ×؛ الخلية هو ~ 60 × 40 ميكرون.
ويبين الشكل 5 بعض الخطوات المهمة لتقدير حجم تطبيع تدهور مصفوفة الجيلاتين كما هو موضح في الخطوة 3 من البروتوكول. تم تصميم هذا الإجراء لإتاحة الكميات موضوعية حول تدهور الجيلاتين في حقل كامل من عرض، ومناسبة لتدهور مصفوفة المنسوبة إلى العديد من الخلايا داخل الميدان.
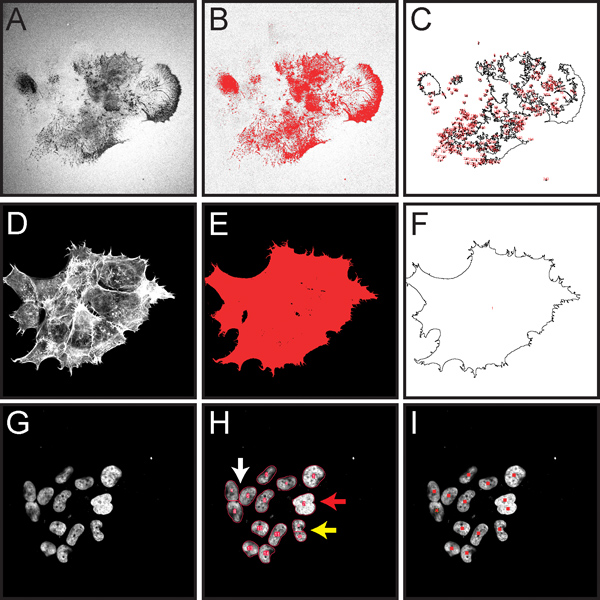
الشكل 5. التقاط الصور شاشة إظهار الخطوات الرئيسية في الحسابية بمساعدة الكمي للتدهور الجيلاتين تطبيع للخلايا داخل صورة مجهرية لكامل كما هو موضح في الخطوة بروتوكول 3. تم تحويل جميع الصور الفلورية إلى تدرج الرمادي لعرض أفضل العتبة الحمراء وعلامات ROI. A. ايمعمر الخضراء ولاية أوريغون 488، مترافق الجيلاتين، والتي تبين المناطق المظلمة ("الثقوب") حيث حدث تدهور (الخطوة 3.4). Thresholded B. صورة الجيلاتين تسليط الضوء على مجالات تدهور في الحمراء (الخطوة 3.5). C. رسم يظهر قياس لمنطقة رويس تدهور (الخطوة 3.7). D. تلطيخ phalloidin رودامين من F-الأكتين (الخطوة 3.8). Thresholded E. الصورة الأكتين تسليط الضوء على إجمالي مساحة الخلية باللون الأحمر (الخطوة 3.9). F. الرسم تظهر الخلية إلى مناطق يمكن قياسها (الخطوة 3.10) . G. صورة نوى الخلايا دابي الملطخة (الخطوة 3.13). H. الأحمر توضح النتائج تظهر من نوى العد التلقائي (الخطوة 3.13). تصفية مستجمعات المياه لديه القدرة على نواة منفصلة التي يتم لمس (السهم الأبيض). إذا نوى تتداخل على نطاق واسع، فإنها قد لا يمكن فصلها إلى كائنات فردية (السهم الأحمر). إذا كان لديه نواة شكل غير منتظم، قد يتم فصلها إلى كائنات متعددة (السهم الأصفر). I. </ النتائج> قوي من خلال وضع علامات نوى العد اليدوي باستخدام أداة مكافحة الخلية (الخطوة 3.14).
الشكل 6. يوضح الخطوات التي ينطوي عليها تحديد قياس الفلورسنت تدهور الجيلاتين من الخلايا الفردية ضمن المجموعة السكانية لالخلوية مختلطة كما هو موضح في الخطوة بروتوكول 4. هنا، يمكن تحليل المصفوفة تدهور الخلايا المصابة بالعدوى بالنقل من خلال مزيج من الخلايا المصابة بالعدوى بالنقل وغير بالنقل.
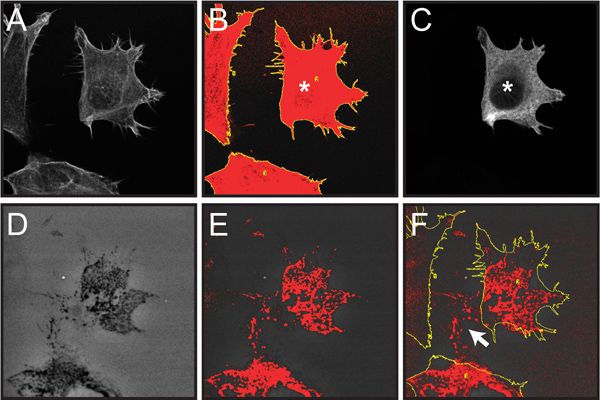
الشكل 6. الشاشة التقاط الصور من الخطوات المتبعة في تحديد مدى تردي الجيلاتين من الخلايا المصابة بالعدوى بالنقل الفردية داخل الخلية السكان. يظهر التحديد الكمي للواحد cortactin OSC19 بالنقل overexpressing الخلايا المؤتلف تنصهر إلى FLAG علامة حاتمة كمثال على ذلك. تم تحويل جميع الصور الفلورية إلى تدرج الرمادي لعرض أفضل العتبة الحمراء والصفراء علامات ROI. A. صورة متحد البؤر ثلاث خلايا المسمى مع رودامين-phalloidin (الخطوة 4.2). B. رسم المنطقة على أساس مجموع الخلية F-الأكتين تلطيخ بعد تطبيق العتبة وتحليل الجزيئات وظائف (الخطوة 4،2-3). C. متحد البؤر الصورة المضادة للFLAG immunolabeling من السكان يتظاهرون خلية خلية واحدة معربا عن FLAG الموسومة cortactin (المشار إليها بعلامة *) (الخطوة 4.4) صورة D.. من ولاية أوريغون الخضراء 488، مترافق الجيلاتين، والتي تبين المناطق المظلمة ("الثقوب") حيث تدهور ديه وقعت (الخطوة 4.5) E. Thresholded صورة الجيلاتين تسليط الضوء على المناطق المظلمة من تدهور في الحمراء (الخطوة 4.5). F. Thresholded الجيلاتين مضافين مع الخطوط العريضة الصورة خلية من B وحة (الخطوة 4.6). نلاحظ أن تحسب فقط بكسل thresholded داخل الخلية الخطوط العريضة في التحليل. مجالات تدهور خارج موقع الخلية الحالية (السهم الأبيض) نتيجة الهجرة من الخلايا عبر الجيلاتين مع مرور الوقت وليست incluدائرة التنمية الاقتصادية في التحليل.
Discussion
ساعد القدرة على تصور خلايا المصفوفة خارج الخلية المهينة في اكتشاف الآليات الجزيئية المستخدمة في الخطوات الأولى من الغزو الخلية. رائدها ون تيان تشين، في 4،14،15 اوائل عام 1980، برزت البروتينات خارج الخلية طلاء fluorescently المسمى على coverslips الزجاج للتحليل المجهري لاحق ك?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل الصناديق الوقفية من جامعة وست فرجينيا بوب ماري راندولف مركز السرطان. نشكر Susette مولر (جامعة جورج تاون) وكيلي لورا في وقت مبكر للحصول على المشورة والمساعدة. ومن المسلم به بامتنان استخدام مرفق جامعة فيرجينيا الغربية التصوير المجهري (بدعم من مركز السرطان بوب ماري راندولف و، NIH منح P20 RR16440، وRR032138 P30 P30 GM103488).
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف / الصك | شركة | كتالوج رقم | تعليقات |
| الجيلاتين | سيجما | G1890 | الخنزير الجلد |
| سكر القصب | الصياد | BP220 | |
| 12 مم coverslips | الصياد | 50-121-5159 | |
| 24 لوحات جيدة | الصياد | 08-772-1 | BD الصقر |
| حمض النيتريك | Ricca | R5326000 | حل 20٪ |
| بولي يسين-L- | علوم المجهر الإلكتروني | 19320-B | 0.1٪ الحل |
| غلوتارالدهيد | سيجما | G7526 | 8٪ الحل |
| ولاية أوريغون الخضراء 488، مترافق الجيلاتين | إينفيتروجن | G-13186 | |
| بوروهيدريد الصوديوم | سيجما | 213462 | |
| تريتون X-100 | الصياد | BP151 | |
| رودامين-phalloidin | إينفيتروجن | R415 | |
| مكافحة cortactin (استنساخ 4F11) | ميليبور | 05-180 | |
| مكافحة FLAG الأجسام المضادة | ميليبور | MAB3118 | |
| الكسا 647 فلور الماعز المضادة للمفتش الماوس | إينفيتروجن | A21235 | |
| إطالة antifade الذهب | إينفيتروجن | P36930 | |
| LSM 510 مجهر متحد البؤر | زايس | ||
| يماغيج البرمجيات | الملك العام | http://www.macbiophotonics.ca/imagej/ | |
| AutoQuant X2.2 البرمجيات | وسائل الإعلام علم التحكم الآلي | ||
| NIS عناصر البرمجيات | نيكون |
References
- Ridley, A. J. Life at the leading edge. Cell. 145, 1012-1022 (2011).
- Murphy, D. A., Courtneidge, S. A. The 'ins' and 'outs' of podosomes and invadopodia: characteristics, formation and function. Nat. Rev. Mol. Cell Biol. 12, 413-426 (2011).
- Linder, S., Wiesner, C., Himmel, M. Degrading Devices: Invadosomes in Proteolytic Cell Invasion. Annu. Rev. Cell. Dev. Biol. , (2010).
- Chen, W. T., Chen, J. M., Parsons, S. J., Parsons, J. T. Local degradation of fibronectin at sites of expression of the transforming gene product pp60src. Nature. 316, 156-158 (1985).
- Artym, V. V., Zhang, Y., Seillier-Moiseiwitsch, F., Yamada, K. M., Mueller, S. C. Dynamic interactions of cortactin and membrane type 1 matrix metalloproteinase at invadopodia: defining the stages of invadopodia formation and function. Cancer Res. 66, 3034-3043 (2006).
- Ayala, I., et al. Multiple regulatory inputs converge on cortactin to control invadopodia biogenesis and extracellular matrix degradation. J. Cell Sci. , (2008).
- Ammer, A. G., et al. Saracatinib impairs head and neck squamous cell carcinoma invasion by disrupting invadopodia function. J. Cancer Sci. Ther. 1, 52-61 (2009).
- Seals, D. F., et al. The adaptor protein Tks5/Fish is required for podosome formation and function, and for the protease-driven invasion of cancer cells. Cancer Cell. 7, 155-165 (2005).
- Yamaguchi, H., et al. Molecular mechanisms of invadopodium formation: the role of the N-WASP-Arp2/3 complex pathway and cofilin. J. Cell Biol. 168, 441-452 (2005).
- Kopp, P., et al. The kinesin KIF1C and microtubule plus ends regulate podosome dynamics in macrophages. Mol. Biol. Cell. 17, 2811-2823 (2006).
- Oser, M., et al. Cortactin regulates cofilin and N-WASp activities to control the stages of invadopodium assembly and maturation. J. Cell. Biol. 186, 571-587 (2009).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Kelley, L. C., et al. Oncogenic Src requires a wild-type counterpart to regulate invadopodia maturation. J. Cell Sci. 123, 3923-3932 (2010).
- Chen, W. T., Singer, S. J. Fibronectin is not present in the focal adhesions formed between normal cultured fibroblasts and their substrata. Proc. Natl. Acad. Sci. U.S.A. 77, 7318-7322 (1980).
- Chen, W. T., Olden, K., Bernard, B. A., Chu, F. F. Expression of transformation-associated protease(s) that degrade fibronectin at cell contact sites. J. Cell Biol. 98, 1546-1555 (1984).
- Bharti, S., et al. Src-dependent phosphorylation of ASAP1 regulates podosomes. Mol. Cell Biol. 27, 8271-8283 (2007).
- Albrechtsen, R., Stautz, D., Sanjay, A., Kveiborg, M., Wewer, U. M. Extracellular engagement of ADAM12 induces clusters of invadopodia with localized ectodomain shedding activity. Exp. Cell Res. 317 (10), 195-209 (2011).
- Scott, R. W., et al. kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell Biol. 191, 169-185 (2010).
- Mueller, S. C., Yeh, Y., Chen, W. T. Tyrosine phosphorylation of membrane proteins mediates cellular invasion by transformed cells. J. Cell. Biol. 119, 1309-1325 (1992).
- Bowden, E. T., Coopman, P. J., Mueller, S. C. Invadopodia: unique methods for measurement of extracellular matrix degradation in vitro. Methods Cell Biol. 63, 613-627 (2001).
- Baldassarre, M., et al. Dynamin participates in focal extracellular matrix degradation by invasive cells. Mol. Biol. Cell. 14, 1074-1084 (2003).
- Alexander, N. R., et al. Extracellular matrix rigidity promotes invadopodia activity. Curr. Biol. 18, 1295-1299 (2008).
- Artym, V. V., Yamada, K. M., Mueller, S. C. ECM degradation assays for analyzing local cell invasion. Methods Mol. Biol. 522, 211-219 (2009).
- Schoumacher, M., Goldman, R. D., Louvard, D., Vignjevic, D. M. Actin, microtubules, and vimentin intermediate filaments cooperate for elongation of invadopodia. J. Cell Biol. 189, 541-556 (2010).
- Clark, E. S., Whigham, A. S., Yarbrough, W. G., Weaver, A. M. Cortactin is an essential regulator of matrix metalloproteinase secretion and extracellular matrix degradation in invadopodia. Cancer Res. 67, 4227-4235 (2007).
- Yamaguchi, H., et al. Phosphoinositide 3-kinase signaling pathway mediated by p110alpha regulates invadopodia formation. J. Cell Biol. 193, 1275-1288 (2011).
- Li, A., et al. The actin-bundling protein fascin stabilizes actin in invadopodia and potentiates protrusive invasion. Curr. Biol. 20, 339-345 (2010).
- Yamaguchi, H., et al. Phosphatidylinositol 4,5-bisphosphate and PIP5-kinase Ialpha are required for invadopodia formation in human breast cancer cells. Cancer Sci. , (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved