A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת כמותית של Proteolysis מטריקס invadopodia בתיווך בקשרים יחידים ורבים תאיים
In This Article
Summary
אנו מתארים את שיטת האבטיפוס לייצור coverslips מיקרוסקופ פלואורסצנטי המצופה ג'לטין להמחשת הפחתת מטריצת invadopodia בתיווך. טכניקות חישוב באמצעות תוכנה זמינה מוצגות לכימות הרמות כתוצאה של proteolysis מטריצה של תאים בודדים בתוך אוכלוסייה מעורבת וקבוצות תאיות המקיפות את השדות מיקרוסקופים שלמים.
Abstract
פלישה ניידת לתוך רקמות מקומיות היא תהליך חשוב בפיתוח ובאיזון. פלישת Malregulated ותנועת התא הבאה היא אופיינית לתהליכים פתולוגיים רבים, כולל דלקת, מחלות לב וכלי דם וגרורות של תאי גידול 1. שפלת פרוטאוליטי Focalized של רכיבים תאיים מטריקס (ECM) בקרום המרתף אפיתל או האנדותל היא שלב קריטי בייזום פלישה סלולרית. בתאים סרטניים, רב בניתוח המבחנה קבעה כי השפלת ECM נעשתה על ידי מבני גחון יקטין עשיר קרום הבולט כינת invadopodia 2,3. צורת invadopodia בפרד קרוב לECM, שבו הם מנהלי התמוטטות ECM דרך הפעולה של מטריקס (metalloproteinases MMPs). היכולת של תאי גידול ליצירת invadopodia ישירות בקורלציה עם היכולת לפלוש לתוך stroma המקומי ורכיבים בכלי דם הקשורים 3. _content "> ויזואליזציה של שפלת ECM invadopodia בתיווך של תאים על ידי מיקרוסקופ פלואורסצנטי באמצעות חלבוני מטריצת צבע כותרת מצופית גבי הזכוכית coverslips התפתחה הטכניקה הנפוצה ביותר להערכת מידת proteolysis מטריצה והפוטנציאל פולשנית סלולרי 4,5. כאן אנו מתארים גרסה של השיטה הסטנדרטית לייצור הזכוכית coverslips כותרת-fluorescently ניצול גרין-488 הצמוד אורגון זמינה מסחרי ג'לטין. שיטה זו מדורגת בקלות לייצר במהירות כמויות גדולות של coverslips המצופה. אנחנו מראים כמה מהממצאים המיקרוסקופים הנפוצים, כי לעתים קרובות הם נתקלו במהלך הליך זה וכיצד אלה יכולים להימנע. לבסוף, אנו מתארים שיטות סטנדרטיות באמצעות תוכנת מחשב זמינה כדי לאפשר כימות של הפחתת מטריצת ג'לטין מסומן מתווכת על ידי תאים בודדים ועל ידי האוכלוסיות סלולריות כולו. ההליכים המתוארים לספק את היכולת במדויק וreproducibly לפקח invadopodiaפעילות, ויכול לשמש גם כפלטפורמה להערכת היעילות של ביטוי חלבון ויסות או בדיקה של תרכובות אנטי פולשניים בשפלת מטריקס בהגדרות בודדות ורבות תאיות.
Protocol
1. ייצור של אורגון גרין Coverslips מצופה 488-ג'לטין
- הכן 5% ללא תווית (w / w) המלאה ג'לטין / פתרון סוכרוז על ידי הוספת 1.25 גרם ג'לטין וסוכרוז גרם 1.25 ב PBS לנפח סופי של 50 מ"ל. לחמם את פתרון ג'לטין המניות עד 37 מעלות צלזיוס, ולהבטיח שהוא נמס לחלוטין לפני השימוש. אחסן את התערובת הסופית ב 4 ° C.
- נקה # 1 coverslips זכוכית קוטר 13 מ"מ על ידי נחת coverslip פרט לכל אחד גם מצלחת 24 גם פלסטיק רקמת תרבות. הוסף 500 μl של חומצה חנקתית 20% לכל באר ודגירה במשך 30 דקות. לשאוב את פתרון החומצה חנקתית ולשטוף coverslips שלוש פעמים במי deionized.
- coverslips המעייל עם 500 μl של 50 מיקרוגרם / מ"ל פולי-L-ליזין (שהוכן מפתרון מנייה 0.1% ובדילול במי deionized) לכל היטב במשך 20 דקות בטמפרטורת חדר. לשאוב את הפתרון ולשטוף שלוש פעמים עם PBS. ציפוי פולי-L-ליזין מאפשר אפילו ציפוי ומליטה של שמעליה labeled ג'לטין.
- הוסף 500 μl של glutaraldehyde 0.5% (עשה טרי לפני שימוש) לכל באר ולדגור על 24 גם צלחות על קרח במשך 15 דקות. לשאוב ולשטוף שלוש פעמים עם PBS הקר. הקפד להסיר את כל העקבות של PBS לפני ציפוי ג'לטין. שמור על צלחות על קרח במהלך כל הכביסות עד ג'לטין הוא הוסיף.
- לשקם אורגון גרין ג'לטין כפרוטוקול של היצרן וללחמם אותו ו5% / סוכרוז פתרון ג'לטין ללא תווית מ( 1.1) 488-מצומדות עד 37 ° C. לדלל חלק אחד אורגון גרין 488 ג'לטין לשמונה חלקים / סוכרוז ג'לטין ללא תווית (כלומר; 500 μl אורגון גרין 488 ג'לטין ל 4 מ"ל של תערובת הג'לטין 5%). 100 μl Pipet מתערובת 488-ג'לטין המדוללת (נשמר על 37 מעלות צלזיוס) על כל coverslip, באמצעות מספיק ג'לטין למעייל coverslip בלי מדריך למריחה (מה שעלול להוביל לציפוי coverslip אחיד, כפי שמוצג באיור 3 ב '). זה חשוב לשמור את התערובת המדוללת 488-ג'לטין ב 37 מעלות; C במהלך הליך הציפוי למניעת שפיכת מיצוק. מהצעד הזה קדימה את coverslips צריך להיות כל זמן בחושך עד כמה שניתן, כדי למנוע photobleaching הפוטנציאלי. חלבוני ECM אחרים מצומדות לfluorophores השונה יכולים להיות תחליף אורגון גרין 488 ג'לטין (ראה דיון).
- ברגע שכל coverslips הם מצופים בצלחת אחת, להחזיק את הצלחת גם 24 בזווית והסר ג'לטין עודף מכל באר על ידי שאיפת אבק. דגירת coverslips המצופה בחושך למשך 10 דקות בטמפרטורת חדר.
- שטוף את coverslips שלוש פעמים עם PBS, ואז להוסיף 500 μl של borohydride טרי 5 מ"ג / מיליליטר נתרן (NaBH 4) במשך 15 דקות בטמפרטורת חדר כדי לצמצם ולהשבית glutaraldehyde שיורית. borohydride נתרן הוא תוסס, ובועות קטנות תהיינה ברורות ובסביב כל coverslip.
- הסר 4 פתרון NaBH ידי שאיפת ואקום בתנועה גורפת מהירה סביב החלק החיצוני של כל אחד גם. יש להיזהר שלא להרים שום coverslips צף שניתק מתחתית צלחת תרבית הרקמה במהלך טיפול NaBH 4. coverslips המנותק שצף למעלה יכול להיות דחף בעדינות בחזרה לתחתית, אבל יש להקפיד כדי למנוע ניזק לציפוי החלבון. לשטוף 3 פעמים כל אחד גם עם PBS ולאחר מכן לדגור coverslips באתנול 70% למשך 30 דקות בטמפרטורת חדר.
- באמצעות טכניקה סטרילית, להעביר את צלחות coverslip המכיל למכסת מנוע סוג IIA / B תא תרבות מינרית זרימה ולשטוף coverslips שלוש פעמים עם PBS סטרילית. בשלב זה coverslips ניתן לאחסן PBS המוגן מפני אור ב 4 מעלות צלזיוס במשך חודשים לפחות.
- העברת coverslips לשמש למבחנים להשפלה גם ריק מצלחת גם 24 חדשה על ידי הסרה זהירה באמצעות מחט סטרילית ומלקחיים. לאזן coverslips ל1-24 שעות עם המדיה מתאימה לסוג התא הספציפי שבassayed מלאה. יש להקפיד לאכדי להפוך את coverslip או לשרוט את ציפוי ג'לטין (ראה איור 3 ב).
2. ציפוי ועיבוד התאים באורגון גרין Coverslips מצופה 488-ג'לטין שפלת ECM Assay
- זרעי 3-5x10 4 תאים על גבי coverslip בתוך כל גם מהצלחת גם 24.
- לערוך מחקר כמובן זמן כדי לקבוע זמנים אופטימליים הנדרשים לפעילות שפלת invadopodia לשורת תאים מסוימות / סוג של עניין. תאים פולשניים רוב ידרשו זמן בין 4-24 שעות לפירוק להתבהר, אם כי טווח זה יכול להשתנות במידה רבה וצריך להיקבע באופן אמפירי. כדי לסנכרן את פעילות invadopodia, תאים יכולים להיות מטופלים עם מעכבי MMP (למשל, 6001 GM) עבור תקופת זמן רצוי, ולאחר מכן לשטוף את המעכב כדי לאפשר פעילות invadopodia להמשיך (לדוגמה, ראה 6).
- שטוף coverslips שלוש פעמים עם PBS, ולאחר מכן לתקן את התאים עם 500 μl של 10% נאגר phospha פורמליןטה במשך 15 דקות. יש לשטוף שלוש פעמים עם PBS וpermeabilize ל4 דקות עם 0.4% Triton X-100 ב PBS. יש לשטוף שלוש פעמים עם PBS להסיר טריטון X-100.
- תאי תווית באמצעות כל פרוטוקול סטנדרטי לצביעת immunofluorescence (ראה 7 למשל) על ידי תאי שיתוף עם תיוג ניאון phalloidin מצומדת לדמיין סיבי יקטין (F-יקטין) ועבור סמן חלבון ידוע כי localizes לinvadopodia (למשל; cortactin 5, TKS5 8, או N-WASP 9). זכור להימנע משימוש ב488-נוגדנים שכותרת משנה או GFP שכותרת חלבונים אם באמצעות אורגון גרין 488 או FITC כותרתו ג'לטין כדי למנוע הפרעות אות.
- הר coverslips מוכתם על שקופיות מיקרוסקופ זכוכית על ידי זהירות היפוך coverslip והצבתו בטיפה להאריך antifade זהב או מגיבים דומה.
- כדי להעריך הפחתת מטריצה, תמונת תאים בערוצים מתאימים באמצעות מיקרוסקופ פלואורסצנטי או confocal קונבנציונלי. שפלת ג'לטיןמיוצג כאזורים כהים על coverslip בשל הסרת פרוטאוליטי של ג'לטין הניאון (איור 4 א). תיוג של תאים לאקטין וחלבון סמן invadopodia מאפשר אישור invadopodia באתרים של הפחתת מטריצה בתמונות ממוזגות (איור 4 א).
- פעילות פירוק יכולה גם להיות במעקב בזמן אמת על ידי הדמית תא חייה עם חלבונים רקומביננטיים ניאון מתויגים-לעקוב אחר היווצרות invadopodia והפחתת מטריצה 5,10,11.
3. כימות של ביזוי ג'לטין פלורסנט ידי מדידת הפחתת מטריצה מנורמלת
ניתוח זה מספק את האזור המנורמל של הפחתת מטריצה היחסית לאזור של התאים או במספר התאים. זה שימושי לניתוח מיקרוסקופים שדות שלמים של נוף שבו מספר תאים נמצאים שטופל באופן קולקטיבי עם siRNA, גורמי גדילה או סוכנים טיפוליים. לanalysi זהשל, תמונות שנאספו בהגדלה נמוכה מספיקות יעיל כדי לאסוף מידע אודות אוכלוסיות של תאים.
- פתח את התמונות ב12 ImageJ. ImageJ למיקרוסקופיה ניתן להוריד מhttp://www.macbiophotonics.ca/imagej/.
- בדוק את המידע בקנה המידה על ידי בחירת פקודת התפריט "נתח / הגדרת סולם". מידע זה יהיה לייבא באופן אוטומטי עם פורמטים של קבצים רבים, אך ניתן להזין באופן ידני במידת צורך. קנה מידה נכון הוא צורך לדווח על מדידות במיקרון ולא פיקסלים.
- בחר את המידות המתאימות למעקב על ידי בחירה "מדידות Analyze / גדר." בדוק שטח והגבל לסף.
- לחשב את השטח של שפלה באמצעות תמונת ג'לטין הניאון (5A איור).
- סף את התמונה ("תמונה / התאם / סף") כדי להגדיר את pi העליון והתחתוןערך עוצמת XEL כדי לבחור את תחומי השפלה (מסומן באדום; 5B איור). בתמונות באות, להשתמש בלחצן נקבע בחלון הסף כדי להגדיר את אותו סף לכל התמונות כאובייקטיביות אומר לבחור אזור שפלה.
- במקרים מסוימים, ייתכן שלא יהיה coverslip שטוח לחלוטין כאשר תמונות שנרכשו. זה גורם לאינטנסיביות של ג'לטין לשנות את פני התמונה. אם וריאציה זו יוצרת בעיות בעת קביעת ערכי סף התמונה, הנכונה לתאורה אחידה על פני ג'לטין על ידי חיסור הרקע ("תהליך / חיסור רקע") או על ידי סינון עם מסנן bandpass ("תהליך / FFT / bandpass סינון") או פסאודו flatfield מסנן ("תהליך / מסננים / Flatfield פסאודו") עד לעוצמת הרקע הוא אחיד.
- למדוד את השטח של מטריצת שפלה ("ניתוח / ניתוח חלקיקים"). בחלון חלקיקי ניתוח, בחר גודל חלקיקים> 0 כדי להסיר רעש מtהוא הבחירה. צג מתווה לזהות אזורים של עניין (Rois). בדקו תצוגת תוצאות וסכמו להראות מדידות. אם הציור תאר כל תחומי השפלה (איור 5 ג) באופן ספציפי, העתק את מדידת סך השטח לגיליון אלקטרוני. אם אובייקטים אחרים נבחרו (כגון פסולת), להקליט רק את התחומים הרלוונטיים Rois.
- לחשב את שטח התא באמצעות מוכתם phalloidin (F-יקטין) תמונה (האיור 5D).
- סף את התמונה ("תמונה / סף / כוון") כדי להגדיר את ערכי הפיקסלים בעצמה העליון ותחתונים, כך שהקצוות של התאים נבחרים (מסומן באדום; 5E איור). בתמונות באות, להשתמש בלחצן נקבע בחלון הסף כדי להגדיר את אותו סף לכל התמונות כאובייקטיביות אומר לבחור שטח תא.
- 10 למדוד את השטח של התאים ("ניתוח / ניתוח חלקיקים"). בפארטי נתחחלון cles, בחר גודל חלקיקים> 0 כדי להסיר רעש מהבחירה. צג מתווה לזיהוי אזורים לניתוח (האיור 5F). בדקו תצוגת תוצאות וסכמו להראות מדידות באזור. אל תבדקו כלול חורים אם יש רווחים בין תאים באשכול כך את הפיקסלים שלא נבחרו בתוך האשכול לא ייכללו בחישוב שטח התא. בחר אישור.
- העתק את התוצאות בשטח לRois הרלוונטי לגיליון אלקטרוני.
- לחשב את השטח של שפלת ג'לטין לשטח כולל של 13 תאים.
- גישה חלופית תהיה לדווח על השטח של שפלה למספר התאים מספירת גרעינים (האיור 5G). זה הכרחי אם מניפולציות לשנות את אזור התא בין קבוצות טיפול בהשוואה שונות. ספירה אוטומטית עובדת הכי טוב אם גרעינים גם נפרדו, אחידים בעוצמת ועגולה. באופן אוטומטי לספור nucleאני ("תוספים / ניתוח / דלפק גרעין חלקיקים"). בחר את הגודל קטן ביותר וחלקיקים גדולים, שיטת סף ושיטת החלקה. בדקו חיסור רקע מסנן, קו פרשת מים, הוסף חלקיקים למנהל החזר על השקעה וסיכום צג (איור 5H).
- אם גרעינים חופפים בהרחבה או צורה או מרקם לא סדירה, ספירה אוטומטית לא יכולה לייצר ספירה מדויקת (איור 5H, חצים על ימין). במקרה זה, ספירה ידנית ניתן להקל שימוש בכלי הנגדי התא ("תוספים / ניתוח / מונה חלקיקים ניידים"). זה יהיה לשמור על ספירה כתאים מסומנים בספירה ידנית (איור 5i).
- העתק את מספר התאים (גרעינים) לתוך גיליון אלקטרוני. לחשב את השטח של שפלת ג'לטין למספר כולל של תאים.
4. כימות של פלורסנט שפלת ג'לטין על ידי תאים בודדים באוכלוסייה ניידת מעורבת
כדי להעריך הפחתת מטריצה כתוצאה מתאים ספציפיים באוכלוסייה מלבד תאים אחרים בשדה (למשל, transfected לעומת תאים שאינם transfected), ההליך שבסעיף 3 יכול להיות שונה כדי למדוד את השטח של שפלה תחת תאים בודדים. ערוץ ניאון נוסף נדרש כדי לסמן תאי transfected. במקרה זה, תמונות בהגדלה גבוהות ותאים שמופרדים גם קלות יותר לכמת.
- בדקו את המידע בקנה המידה על ידי בחירת פקודת התפריט "נתח / הגדרת סולם." בחר את המידות המתאימות למעקב על ידי בחירה "מדידות Analyze / גדר." בדוק שטח והגבל לסף.
- לתאים בודדים שאינם נוגעים, לזהות כל תא באמצעות תמונת ה-F-תקטין (איור 6 א). סף את התמונה (ראה 3.9) (איור 6 ב). חשוב לתפוס את הקצוות של התאים, אבל לא יכול להיות חורבתוך הים שאינו כלול בסף. השתמש בערכים בעצמה הזהים בתמונות כדי לבחור גבולות תא.
- כדי למדוד את השטח של התאים, השתמש "ניתוח / ניתוח חלקיקים." בחלון חלקיקי ניתוח, בחר גודל> 0 (כדי למנוע רעש), קווי המתאר של הצגה, ולבדוק את תצוגת תוצאות, הוסף למנהל וכלול את החורים (כדי להקליט האזור כולו בתחומי הקו המתאר). בחר אישור ולהקליט את השטח לכל תא מחלון התוצאות.
- לזהות אילו תאים transfected (איור 6 ג').
- זהה את האזורים של שפלה באמצעות תמונת ג'לטין הניאון (איור 6 ד '). במידת צורך, לסנן את תמונת ג'לטין אפילו לעוצמת רקע (ראה 3.6). סף כדי לבחור את האזורים של שפלה, מה שהופך רשום את הגדרות הסף (איור 6E). בתמונות באות, השתמש באותם ערכים אלה עליונים ותחתונים (באמצעות עצמת הסטכפתור בחלון הסף) לבחירה אובייקטיבית של אזורים של שפלה.
- מדוד את האזורים של שפלה תחת התאים. בתמונת ג'לטין ניאון thresholded, להציג מתווה של תאים על ידי בחירת Rois בחלון מנהל ההחזר על ההשקעה ובחירת מדוד (איור 6F). רשום את התוצאות ולחשב את השטח המנורמל של שפלה / או תא שטח תא.
5. נציג תוצאות
סכמטי הכולל להליך מוצג באיור 1. ההליך כרוך בהכנת coverslips זכוכית וציפוי עם ג'לטין fluorescently מצומדת-, ציפוי של תאים על גבי את coverslips המצופה כדי לאפשר לתאים לבזות ג'לטין, תיקון וסימון של תאים לבדיקה מיקרוסקופית פלואורסצנטי, הדמית מטריצת הניאון כדי להעריך את תקינות המטריצה, ואובייקטיבי לכמת את מידת הפחתת מטריצת ג'לטין באמצעות המחשב softwarדואר.

איור 1. סכמטי כללי מדגיש את השלבים העיקריים המעורבים בציפוי, ציפוי ג'לטין תא ניאון, תיקון וimmunolabeling, והערכת proteolysis מטריצה.
הצעדים פרוצדורליים המרכזיים המעורבים בהכנה וcoverslips זכוכית הציפוי מתוארים באיור 2.
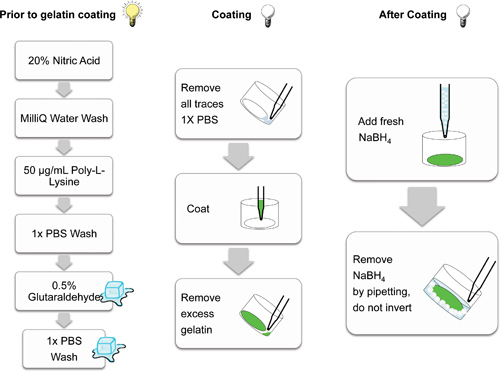
איור 2. סכמטי להדגים את הצעדים הבודדים המעורבים בהכנת coverslips זכוכית לציפוי המטריצה ג'לטין. צעדים שנערכו באור (נורה דולקת), על קרח (קוביות) וב( נורה שאינה מוארת) הכהה הם קריקטורה מצוינת. צעדים שנעשו בעזרה הכהה למנוע photobleaching של מטריצות הניאון.
כאשר מבוצעים כראוי, coverslips הם מצופים באופן שווה עם אורגון גרין 488-מצומדות גרמהelatin, הצגת פלואורסצנטי הומוגנית כשדמיין ידי מיקרוסקופ (איור 3 א). ממצאים אופייניים שיכול להתעורר עקב ציפוי לא תקין, טיפול, אחסון ושימוש במצופי coverslips מוצגים באיור 3B.
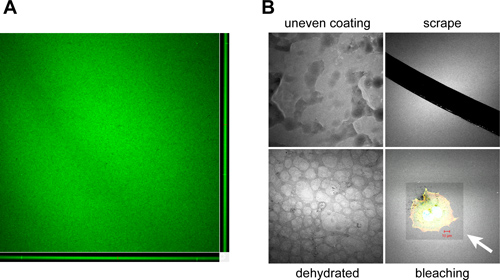
איור 3. דוגמאות לחפצים נתקלו במהלך הכנת ג'לטין המצופה coverslip וטיפול. נוף אורתוגונלית א מחסנית z confocal מראה את הצבע האופייני והעקביות של אורגון גרין coverslip המצופה ג'לטין 488-מצומדות מופק באמצעות הפרוטוקול שנקבע. Coverslips צריך ציפוי הומוגני עבה ~ 1-2 מיקרומטר כפי שמוצג בXZ (תחתון) ו( מימין) מטוסי confocal YZ חפצי B. שיכול להתרחש במהלך הציפוי והעיבוד של coverslips ג'לטין המצופה כוללים:. כיסוי לא נכון של coverslip במהלך תהליך הציפוי בשללהתמצקות עניי ערבוב, הפצה ידנית או חלקית של תערובת הג'לטין (ציפוי מחוספס), הסרה של המטריצה מצופית על ידי בקיע עם מחטים או מלקחיים במהלך הטיפול (שפשוף), ייבוש של פני שטח coverslip במהלך תקופות אחסון ממושכות, וכתוצאה מכך "מרוצף "מראה (התייבשות) וphotobleaching של פני שטח ג'לטין הניאון במהלך הדמיה עקב חשיפה לאור בעצמה ממושכת או גבוהה (הלבנה). חץ לבן מצביע על אזור מולבן מקיף את ראש OSC19 מצופה ותא קשקש קרצינומה של צוואר. אורגון גרין ג'לטין 488-מצומדת הוא pseudocolored לבן כדי לשפר את ניגוד תמונה. בר, 10 מיקרומטר.
המטריצות הדקות כתוצאה הופקו במהלך הליך זה מספקים אמצעים רגישים כדי להעריך את היכולת של תאים לבזות ECM. איור 4 מדגים דוגמה לפעילות invadopodia מOSC19 תא מצופה על גרין-488 coverslip ג'לטין מצומדת אורגוןוצלם באמצעות מיקרוסקופיה confocal הקונבנציונלית, כמו גם על ידי טיוח נפח מילוי תמונה הבאה deconvolution תלת ממדים.

איור 4. דוגמאות מייצגות של פעילות הפחתת מטריצת invadopodia.. ויזואליזציה של invadopodia וproteolysis המטריצה ג'לטין המקביל. OSC19 תאים המצופים באורגון גרין coverslips ג'לטין 488-מצומדות עבור 10 שעות היו קבועים ומסומנים עם phalloidin rhodamine מצומדות (F-יקטין) ונוגדנים כנגד cortactin (דמיין עם נוגדן Alexa פלואוריד 647 משני וירוקה pseudocolored). Invadopodia ניכר כריכוזי cytoplasmic מוקד של ה-F-תקטין וcortactin חופף עם אזורים של ג'לטין סליקה (חורים אפלים במטריצה) בתוך התמונה הממוזגת. אזורי Boxed המכילים ראשי חץ מצביעים invadopodia פרט ואזורים של proteolysis מטריצת המוקד כפי שמוצג במחדש המוגדלgions להלן. בר, 10 מיקרומטר. B. נפח מילוי הדמיה של חדירה לinvadopodia ECM. OSC19 תאים מצופים וצבעוני כמו ב() שניתנו חזותי על ידי קבלת 23 0.32 מיקרומטר אופטי Z-פרוסות רצופה בהיקף של 7.04 מיקרומטר לphalloidin rhodamine מצומדות ואורגון גרין 488-מצומדות ג'לטין. קובץ LSM היליד להגדיר עבור כל ערוץ נפתח בX2.2 תוכנת AutoQuant וdeconvolution עיוור 3D כל ערימת תמונה נעשתה שימוש בהגדרות המומלצות (10 חזרות, רעש בינוני). את התמונות המעובדות נצלו כערימות TIFF ואז שנפתחו באלמנטי ש"ח ושניתנו כתצוגת עוצמת קול עם מיזוג אלפא. את LUTs הותאמו, וsubvolume נוצר כדי להראות קצה בתוך התא שבי invadopodia הוא הווה. נוף הגבה קצה מדגים invadopodia (אדום, חיצים) מוכנס לתוך הג'לטין הבסיסי (ירוק). נוף גחון קצה מראה invadopodia הבולט ואזורים של שפלת ג'לטין מתחת coverslipכאזורים של הווה אדום בירוקה המטריצה (ראשי חץ). שדה התמונה הכוללת שהוצג ייחתך ל -77 65 מיקרומטר x; התא הוא ~ 60 x 40 מיקרומטר.
איור 5 מראה כמה מהצעדים החשובים לכימות של הפחתת מטריצת ג'לטין מנורמלת כמתואר בשלב 3 לפרוטוקול. הליך זה נועד לאפשר לquantitation המשוחד של שפלת ג'לטין בכל שדה הראייה, והוא מתאים להפחתת מטריצה המיוחסת לתאים רבים בשדה.
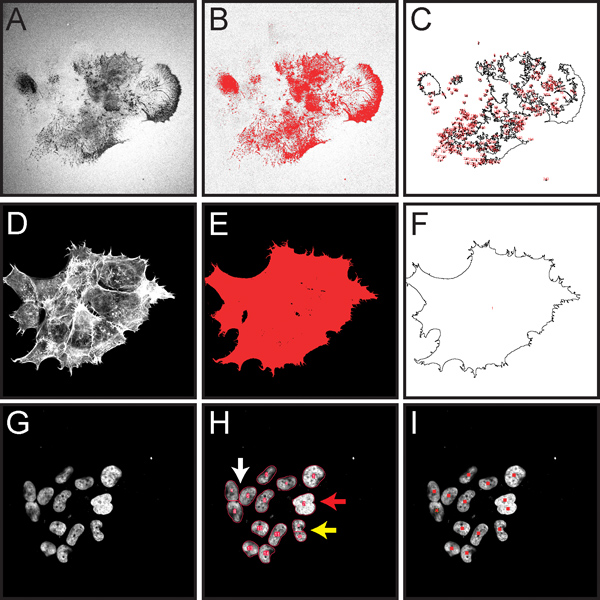
איור 5. תמונות לכידת מסך הממחישים את השלבים עיקריים בכימות חישובית בסיוע של שפלת ג'לטין מנורמלת לתאים בתוך תמונה מיקרוסקופית שלמה כמתואר בשלב הפרוטוקול 3. כל תמונות הניאון הומרו לגוונים אפורים טוב יותר כדי להציג את thresholding האדום וסימני החזר על השקעה. א Imגיל אורגון גרין 488-מצומדות ג'לטין, מראה אזורים כהים ("חורים") שבו חלה הידרדרות (שלב 3.4). ב Thresholded תמונת ג'לטין הדגשת אזורים של שפלה באדום (שלב 3.5). ציור ג מראה Rois נמדד לאזור של שפלה (שלב 3.7). מכתים phalloidin rhodamine ד F-תקטין (שלב 3.8). א Thresholded תמונה יקטין הדגשת שטח תא מוחלט באדום (שלב 3.9). ציור פ מראה שיש למדוד אזורים סלולריים (שלב 3.10) . תמונת ג'של גרעיני תאים DAPI מוכתמים (צעד 3.13). ח'אדום מתאר צג תוצאות מספירת גרעינים אוטומטיות (שלב 3.13). מסנן קו פרשת המים יש פוטנציאל גרעינים נפרדים הנוגעים ללב (חץ לבן). אם גרעינים חופפים בהרחבה, הם לא יכולים להיות מופרדים לאובייקטים בודדים (חץ אדום). אם גרעין יש צורה לא סדירה, ניתן להפריד למספר אובייקטים (חץ צהוב). I. </> תוצאות חזקות מסימון גרעינים במהלך ספירה ידנית באמצעות כלי נגדי התא (שלב 3.14).
איור 6. מדגים צעדים נבחרים מעורבים בכימות ניאון שפלת ג'לטין על ידי תאים בודדים בתוך אוכלוסיית תאים מעורבת כמתואר בשלב הפרוטוקול 4. כאן, הפחתת מטריצה על ידי תאי transfected ניתן לנתח בתוך אוכלוסייה מעורבת של תאי transfected ולא transfected.
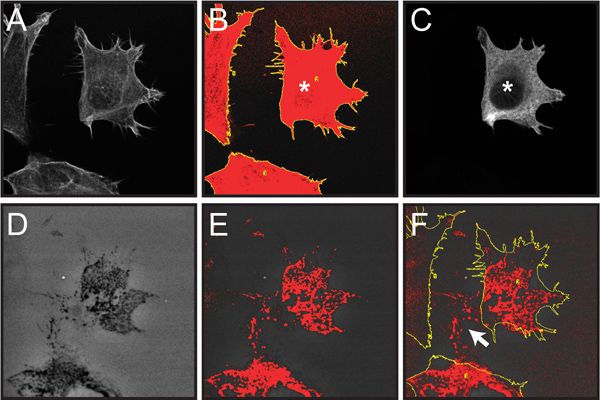
האיור 6. מסך ללכוד תמונות של שלבים הכרוכים בכימות שפלת ג'לטין מתאי transfected בודדים בתוך אוכלוסיית תאים. כימות של cortactin אחת transfected OSC19 תא overexpressing רקומביננטי התמזג לתג epitope הדגל מוצגת כדוגמה. כל תמונות הניאון הומרו לגוונים אפורים טוב יותר כדי להציג את thresholding האדום וסימני ROI צהובים. א תמונת Confocal מהשלושה תאים שכותרתו עם rhodamine-phalloidin (שלב 4.2). ציור ב 'של אזור תא סכום המבוסס על צביעת F-תקטין בעקבות יישום של הסף וניתוח פונקציות חלקיקים (צעד 4.2-3). תמונת Confocal ג של immunolabeling אנטי דגל של אוכלוסיית התאים מדגים תא בודד להביע דגל מתויג-cortactin (מסומן ב *) (שלב 4.4). תמונת ד אורגון גרין 488-מצומדות ג'לטין, מראה אזורים כהים ("חורים") שבו יש שפלה התרחש (שלב 4.5) ה Thresholded תמונת ג'לטין הדגשת אזורים אפלים של הידרדרות באדום (שלב 4.5). פ Thresholded מעולף תמונת ג'לטין עם קווים סלולריים מפנל ב '(שלב 4.6). שים לב שרק את הפיקסלים thresholded בתוך קווי מתאר התא נספרים בניתוח. תחומי השפלה מחוץ למיקום התא הנוכחי (חץ לבן) תוצאה מנדידת תאים פני ג'לטין לאורך זמן ואינם included בניתוח.
Discussion
היכולת לחזות תאים משפילים מטריקס סייעה בגילוי המנגנונים המולקולריים המועסקים בשלבים המוקדמים של פלישת תא. חלוץ ידי וון-טיין חן בתחילת 1980 4,14,15, ציפוי חלבונים תאיים שכותרתו fluorescently על coverslips זכוכית עבור ניתוח מיקרוסקופי שלאחר מכן התפתחו הטכניקה העיקרית בהערכת תפ...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי קרנות המיועדות לאוניברסיטת מערב וירג'יניה מרי אב רנדולף מרכז הסרטן. אנו מודים סוזט מילר (אוניברסיטת ג'ורג'טאון) ולורה קלי לייעוץ וסיוע בשלב מוקדם. השימוש במתקן אוניברסיטת מערב וירג'יניה מיקרוסקופי ההדמיה (נתמך על ידי מרי אב רנדולף מרכז הסרטן ו, מענקי NIH P20 RR16440, P30 RR032138 וP30 GM103488) הוא בברכה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב / Instrument | חברה | מספר קטלוגים | תגובות |
| ג'לטין | סיגמא | G1890 | עור חזירי |
| סוכרוז | דיג | BP220 | |
| 12 מ"מ coverslips | דיג | 50-121-5159 | |
| 24 גם צלחות | דיג | 08-772-1 | BD פלקון |
| חומצה חנקתית | Ricca | R5326000 | 20% פתרון |
| פולי-L-ליזין | מדעי מיקרוסקופ אלקטרונים | 19320-B | 0.1% פתרון |
| glutaraldehyde | סיגמא | G7526 | 8% פתרון |
| אורגון גרין 488-מצומדות ג'לטין | Invitrogen | G-13186 | |
| borohydride נתרן | סיגמא | 213462 | |
| טריטון X-100 | דיג | BP151 | |
| rhodamine-phalloidin | Invitrogen | R415 | |
| אנטי cortactin (שיבוט 4F11) | Millipore | 05-180 | |
| נוגדן אנטי דגל | Millipore | MAB3118 | |
| Alexa פלואוריד 647 עיזים אנטי עכבר IgG | Invitrogen | A21235 | |
| להאריך antifade זהב | Invitrogen | P36930 | |
| LSM 510 confocal מיקרוסקופ | Zeiss | ||
| ImageJ תוכנה | רשות הציבור | http://www.macbiophotonics.ca/imagej/ | |
| X2.2 תוכנת AutoQuant | מדיה קיברנטיקה | ||
| תוכנת אלמנטי ש"ח | ניקון |
References
- Ridley, A. J. Life at the leading edge. Cell. 145, 1012-1022 (2011).
- Murphy, D. A., Courtneidge, S. A. The 'ins' and 'outs' of podosomes and invadopodia: characteristics, formation and function. Nat. Rev. Mol. Cell Biol. 12, 413-426 (2011).
- Linder, S., Wiesner, C., Himmel, M. Degrading Devices: Invadosomes in Proteolytic Cell Invasion. Annu. Rev. Cell. Dev. Biol. , (2010).
- Chen, W. T., Chen, J. M., Parsons, S. J., Parsons, J. T. Local degradation of fibronectin at sites of expression of the transforming gene product pp60src. Nature. 316, 156-158 (1985).
- Artym, V. V., Zhang, Y., Seillier-Moiseiwitsch, F., Yamada, K. M., Mueller, S. C. Dynamic interactions of cortactin and membrane type 1 matrix metalloproteinase at invadopodia: defining the stages of invadopodia formation and function. Cancer Res. 66, 3034-3043 (2006).
- Ayala, I., et al. Multiple regulatory inputs converge on cortactin to control invadopodia biogenesis and extracellular matrix degradation. J. Cell Sci. , (2008).
- Ammer, A. G., et al. Saracatinib impairs head and neck squamous cell carcinoma invasion by disrupting invadopodia function. J. Cancer Sci. Ther. 1, 52-61 (2009).
- Seals, D. F., et al. The adaptor protein Tks5/Fish is required for podosome formation and function, and for the protease-driven invasion of cancer cells. Cancer Cell. 7, 155-165 (2005).
- Yamaguchi, H., et al. Molecular mechanisms of invadopodium formation: the role of the N-WASP-Arp2/3 complex pathway and cofilin. J. Cell Biol. 168, 441-452 (2005).
- Kopp, P., et al. The kinesin KIF1C and microtubule plus ends regulate podosome dynamics in macrophages. Mol. Biol. Cell. 17, 2811-2823 (2006).
- Oser, M., et al. Cortactin regulates cofilin and N-WASp activities to control the stages of invadopodium assembly and maturation. J. Cell. Biol. 186, 571-587 (2009).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Kelley, L. C., et al. Oncogenic Src requires a wild-type counterpart to regulate invadopodia maturation. J. Cell Sci. 123, 3923-3932 (2010).
- Chen, W. T., Singer, S. J. Fibronectin is not present in the focal adhesions formed between normal cultured fibroblasts and their substrata. Proc. Natl. Acad. Sci. U.S.A. 77, 7318-7322 (1980).
- Chen, W. T., Olden, K., Bernard, B. A., Chu, F. F. Expression of transformation-associated protease(s) that degrade fibronectin at cell contact sites. J. Cell Biol. 98, 1546-1555 (1984).
- Bharti, S., et al. Src-dependent phosphorylation of ASAP1 regulates podosomes. Mol. Cell Biol. 27, 8271-8283 (2007).
- Albrechtsen, R., Stautz, D., Sanjay, A., Kveiborg, M., Wewer, U. M. Extracellular engagement of ADAM12 induces clusters of invadopodia with localized ectodomain shedding activity. Exp. Cell Res. 317 (10), 195-209 (2011).
- Scott, R. W., et al. kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell Biol. 191, 169-185 (2010).
- Mueller, S. C., Yeh, Y., Chen, W. T. Tyrosine phosphorylation of membrane proteins mediates cellular invasion by transformed cells. J. Cell. Biol. 119, 1309-1325 (1992).
- Bowden, E. T., Coopman, P. J., Mueller, S. C. Invadopodia: unique methods for measurement of extracellular matrix degradation in vitro. Methods Cell Biol. 63, 613-627 (2001).
- Baldassarre, M., et al. Dynamin participates in focal extracellular matrix degradation by invasive cells. Mol. Biol. Cell. 14, 1074-1084 (2003).
- Alexander, N. R., et al. Extracellular matrix rigidity promotes invadopodia activity. Curr. Biol. 18, 1295-1299 (2008).
- Artym, V. V., Yamada, K. M., Mueller, S. C. ECM degradation assays for analyzing local cell invasion. Methods Mol. Biol. 522, 211-219 (2009).
- Schoumacher, M., Goldman, R. D., Louvard, D., Vignjevic, D. M. Actin, microtubules, and vimentin intermediate filaments cooperate for elongation of invadopodia. J. Cell Biol. 189, 541-556 (2010).
- Clark, E. S., Whigham, A. S., Yarbrough, W. G., Weaver, A. M. Cortactin is an essential regulator of matrix metalloproteinase secretion and extracellular matrix degradation in invadopodia. Cancer Res. 67, 4227-4235 (2007).
- Yamaguchi, H., et al. Phosphoinositide 3-kinase signaling pathway mediated by p110alpha regulates invadopodia formation. J. Cell Biol. 193, 1275-1288 (2011).
- Li, A., et al. The actin-bundling protein fascin stabilizes actin in invadopodia and potentiates protrusive invasion. Curr. Biol. 20, 339-345 (2010).
- Yamaguchi, H., et al. Phosphatidylinositol 4,5-bisphosphate and PIP5-kinase Ialpha are required for invadopodia formation in human breast cancer cells. Cancer Sci. , (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved