このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シングルおよび多細胞コンテキストでInvadopodia媒介細胞外マトリックスタンパク分解の定量測定
要約
我々はinvadopodia媒介マトリックス分解を可視化するための蛍光ゼラチンでコーティングされた顕微鏡のカバーガラスを製造するためのプロトタイプ的な方法を説明します。利用可能なソフトウェアを使用した計算手法は混合集団内および全体の顕微鏡視野を取り囲む多のグループに、単一細胞によるマトリックス分解の結果のレベルを定量化するために表示されている。
要約
地元組織への細胞浸潤は、開発と恒常性に重要なプロセスである。 Malregulated侵攻とその後の細胞運動は、炎症、心血管疾患や腫瘍細胞転移1を含む複数の病理学的プロセスの特徴である。上皮細胞や内皮の基底膜における細胞外マトリックス(ECM)成分のFocalizedタンパク質分解は細胞浸潤を開始する上で重要なステップである。腫瘍細胞では、in vitroでの解析では、広範なECM分解がinvadopodia 2,3と呼ばれる腹アクチンに富んだ膜突出構造によって達成されると判断しました。彼らはマトリックスメタロプロテアーゼ(MMP)の作用を介してECMの内訳は中等度のECMに近い同格のInvadopodiaフォーム。 invadopodiaを形成する腫瘍細胞の能力は直接ローカル間質および関連する血管成分3に侵入する能力と相関している。 カバーガラス上にコーティング色素標識マトリックスタンパク質を用いた蛍光顕微鏡による細胞の_content "の>可視invadopodia媒介ECM分解は、行列のタンパク質分解、4,5細胞の浸潤能の程度を評価するための最も一般的な手法として登場しましたが、ここでは説明し市販のオレゴングリーン-488ゼラチン複合体を利用した蛍光標識されたカバーガラスを生成するための標準メソッドのバージョン。このメソッドは、簡単に迅速にコーティングされたカバーガラスを大量に生成するためにスケーリングされます私たちはしばしば遭遇する一般的な顕微鏡の成果物の一部を示しています。この手順の中で、どのようにこれらを避けることができます最後に、我々は個々の細胞によって、全体の細胞集団によって媒介されるラベルの付いたゼラチンマトリックス分解の定量化を可能にするために容易に利用可能なコンピュータソフトウェアを使用して標準化された方法を説明します。説明する手順では、正確かつ再現性よく監視する機能を提供invadopodia活動、また、調節タンパク質の発現または単一および多設定で、細胞外マトリックス分解に及ぼす抗浸潤化合物の試験の有効性を評価するためのプラットフォームとして機能することができます。
プロトコル
1。オレゴングリーンの生産488-ゼラチン被覆カバーガラス
- 50ミリリットルの最終体積になるようにPBSで1.25グラムゼラチン及び1.25グラムのショ糖を加えることによって標識されていない5%(w / w)の株式ゼラチン/ショ糖溶液を調製します。 37°Cから株式ゼラチン溶液を温め、それを完全に使用する前に溶けていることを確認します。 4℃で最終混合物を保管
- 24ウェルプラスチック組織培養プレートの各ウェルに個別のカバーガラスを配置することによって直径13mmの第1カバーガラスを清掃してください。各ウェルに20%硝酸500μLを加え、30分間インキュベートする。硝酸溶液を吸引除去し、脱イオン水を用いてカバーガラスを3回洗浄する。
- 室温で20分間、各ウェルに50μg/ mlのポリ-L-リジン(0.1%ストック溶液から調製し、脱イオン水で希釈したもの)500μlでコートしたカバー。液を除き、PBSで3回洗浄する。ポリ-L-リジンコーティングは上層ラの均一なコーティング、ボンディングを容易にゼラチンbeled。
- 各ウェルに0.5%グルタルアルデヒドを500μl(使用前に新鮮な製)を追加し、15分間氷上で24ウェルプレートをインキュベートする。吸引し、冷PBSで3回洗浄する。ゼラチンコーティング前にPBSの痕跡をすべて削除してください。ゼラチンが追加されるまで、すべての洗浄中に氷の上にプレートを保管してください。
- 再構成する37℃〜から当たり、製造業者のプロトコルとそれを温め、ラベルの付いていない5パーセントゼラチン/ショ糖溶液(1.1)のようなゼラチンオレゴングリーン488-共役ラベルの付いていないゼラチン/ショ糖の8の部分(、5%のゼラチンの混合物の4ミリリットルにオレゴングリーン488ゼラチン500μlのIE)に1パートオレゴングリーン488ゼラチンを希釈します。十分なゼラチンマニュアル広がらずにコートカバースリップします( 図3(b)に示すように不均一なカバーガラスコーティングにつながることができます)に使用して、各カバースリップ上に希釈した488-ゼラチン混合物(37℃に保た)の100μlのピペット。 37℃希釈488ゼラチン混合保管しておくことが重要です°、時期尚早の凝固を防止するためのコーティング操作中にC。このステップから前方にカバースリップを潜在的な退色を避けるために、できるだけ暗所に保管してください。異なる蛍光体に結合させ、他のECMタンパク質は、オレゴングリーン488ゼラチン(説明を参照)に置き換えることができます。
- 一度、すべてのカバーガラスが一枚板で被覆され、角度で、24ウェルプレートを保持し、真空吸引により各ウェルから過剰なゼラチンを削除します。室温で10分間、暗闇の中でコーティングされたカバースリップをインキュベートする。
- PBSでカバースリップ3回洗浄し、次いで残留グルタルアルデヒドを削減し、不活性化するために、室温で15分間焼きたての5 mg / mlの水素化ホウ素ナトリウム(NaBH 4)500μlを添加する。水素化ホウ素ナトリウム、発泡性で、小さな気泡は、各カバースリップ上と周りには明らかであろう。
- 各ウェルの外側の周りに素早く弧を描く動きで真空吸引によってNaBH 4の溶液を除去。 NaBH 4を治療中の組織培養プレートの底から切り離さなった任意の浮動カバーガラスをピックアップしないように注意してください。最上部に浮遊する一戸建てカバースリップを優しくウェル底に戻ってプッシュダウンできるかもしれませんが、注意がタンパク質コーティングの損傷を避けるために注意しなければなりません。 PBSで各ウェルを3回洗浄した後、室温で30分間、70%エタノールでカバースリップをインキュベートする。
- 滅菌技術を使用して、タイプIIA / B細胞培養層流フードにカバースリップ含有プレートを転送し、滅菌PBSでカバーガラスを三回すすいでください。この時点で、カバーガラスは、少なくとも2ヶ月間、4℃で光から保護し、PBS中に保存することができます。
- 滅菌針とピンセットを用いて慎重に除去することによって新たな24ウェルプレートの空のウェルに分解アッセイに使用するカバースリップを転送します。アッセイされる特定の細胞型に適した完全なメディアで1〜24時間のためにカバースリップを平衡化します。注意がないように注意する必要がありカバースリップを反転または( 図3Bを参照)ゼラチンコーティングに傷を付けます。
2。アッセイのECM分解にオレゴングリーン488-ゼラチン被覆カバーガラス上にめっきおよびセルの処理
- 24ウェルプレートの各ウェル内のカバースリップ上にシード3-5×10 4個の細胞。
- 特定の細胞株/興味のあるタイプのinvadopodia分解活性に必要な最適なタイミングを決定するために経時的研究を行う。この範囲が大きく異なることがありますし、経験的に決定されるべきであるが、最も侵襲的な細胞は、分解のために4〜24時間の間の時間が明らかになるために必要です。 invadopodia活動を同期化するには、細胞が所望の期間のMMP阻害剤( 例えば 、GM 6001)で治療することができ、その後(たとえば、6を参照)invadopodia活動を続行できるように阻害剤を洗い流す。
- カバーグラスをPBSで3回すすぎ、次いで10%500μlの細胞を固定ホルマリンホスファをバッファリング15分間TE。 PBSで3回洗浄し、0.4%トリトンX-100、PBS中で4分間透過処理。 Triton X-100を除去するためにPBSで3回リンスする。
- cortactin 5、TKS5、アクチンフィラメントを可視化する蛍光共役ファロイジン(F-アクチン)を持つとinvadopodia(例に局在する既知のマーカータンパク質に対する共標識細胞による免疫蛍光染色用の標準プロトコルを使用してラベル細胞(例えば7を参照) 8、N-WASP 9)。オレゴングリーン488、または信号の干渉を防止するためにゼラチンFITC標識を使用している場合は488標識二次抗体またはGFP-標識タンパク質を使用しないようにすることを忘れないでください。
- 慎重に反転カバースリップによりガラス顕微鏡スライド上に染色されたカバースリップをマウントし、Gold退色防止または類似の試薬を長引かせるの降下にそれを置く。
- 従来の蛍光または共焦点顕微鏡を用いて適切なチャンネルにマトリックス分解、画像セルを評価する。ゼラチン分解蛍光ゼラチン( 図4A)のタンパク質分解除去のためにカバースリップ上に暗い領域として可視化される。アクチンとinvadopodiaマーカータンパク質に対する細胞のラベリングは、マージされた画像中のマトリックス分解の部位( 図4A)でinvadopodiaの確認が可能になります。
- 分解活性もinvadopodia形成とマトリックス分解5,10,11を追跡するために蛍光標識組換えタンパク質とライブセルイメージングによってリアルタイムで監視することができます。
3。正規化されたマトリックス分解測定による蛍光ゼラチン劣化の定量化
この分析では、セルの面積またはセルの数に対するマトリックス分解の正規化された領域を提供します。それは、複数の細胞が集合的にsiRNAを、成長因子または治療薬で治療されていることを存在しているビューの全体の顕微鏡視野を分析するのに有用である。このanalysi用秒、低い倍率で収集された画像は、効率的に細胞の集団に関する情報を収集するのに十分である。
- ImageJは12で画像を開きます。顕微鏡用ImageJはからダウンロードできますhttp://www.macbiophotonics.ca/imagej/ 。
- " スケールを設定/分析します。"この情報は多くのファイル形式で自動的にインポートされたメニューコマンドを選択することで、スケールの情報をチェックしますが、必要に応じて手動で入力することができます。適切なスケーリングは、ピクセルではなくミクロン単位で測定値を報告することが必要である。
- 選択して追跡するための適切な測定を選択し、 " 設定/分析測定 " エリアをチェックして、しきい値に制限します 。
- 蛍光ゼラチン画像( 図5A)を使用して劣化の面積を計算します。
- 上下のパイを設定するためのしきい値画像( " 画像/ /しきい値を調整する ")XEL強度値は、劣化の領域を(; 図5B赤で強調表示)を選択します。その後の画像では、目的は劣化エリアを選択する手段として、すべての画像に同じしきい値を設定するには、しきい値ウィンドウで、[設定]ボタンを使用します。
- 画像が取得されたときいくつかのケースでは、カバースリップは完全にフラットではありません。これは、画像全体で変更するには、ゼラチンの強度を引き起こす。背景を減算することにより、ゼラチンにわたる不均一な照明のための正しいイメージ( " プロセス/背景を減算")またはバンドパスフィルタを使用してフィルタリングすることで、( " プロセス/ FFT /バンドパス·フィルタ ")または擬似フラットフィールドを閾値処理するときに、この変化は、問題を作成した場合フィルター( "プロセス/フィルタ/擬似フラットフィールド")バックグラウンド強度が均一になるまで。
- 行列分解( " 粒子を分析/分析 ")の面積を測定します。粒子解析ウィンドウで、tからノイズを除去するために粒径> 0を選択彼が選考。ショーは、関心のある領域(ROI)を識別するために概要を説明します 。 表示結果を確認し、測定値を表示するようにまとめる 。図面は特に劣化の領域( 図5C)のすべてを概説している場合は、スプレッドシートに総面積の測定をコピーします。他のオブジェクトが(そのような破片など)を選択した場合は、関連するROIの領域のみを記録します。
- ファロイジン染色(F-アクチン)の画像( 図5D)を使用して、セル面積を計算します。
- 閾値セルのエッジが選択されるように、上下のピクセル強度値を設定するための画像( " 画像/調整/しきい値 ")(赤で強調; 図5E)を 。その後の画像では、目的は、セル面積を選択する手段として、すべての画像に同じしきい値を設定するには、しきい値ウィンドウで、[設定]ボタンを使用します。
- 10測定セルの面積( " 粒子を分析/解析 ")。分析パルティでClesのウィンドウには、選択からノイズを除去するために粒径> 0を選択します。ショーは、分析( 図5F)のための領域を識別するために概要を説明します 。 表示結果を確認し、面積の測定値を表示するようにまとめる 。クラスタ内の非選択の画素がセル面積の計算に含まれないように、クラスタ内の細胞の間に空白がある場合は、 穴を含める]にチェックマークを付けないでください。 [OK]を選択します。
- スプレッドシートに関連したROIのための地域の結果をコピーします。
- セル13の総面積あたりのゼラチン分解の面積を計算します。
- 別のアプローチは、核( 図5G)をカウントするから細胞数あたりの劣化の面積を報告することであろう。操作が異なると比較して治療群間のセル面積を変更する場合に必要です。核がよく強度とのラウンドで、制服を区切られている場合は、自動計数に最適に動作します。自動的にnucleを数えるI( " プラグイン/粒子解析/核カウンター ")。 最小と最大粒径 、 閾値法と平滑化法を選択してください。 ROI Managerおよびショーの概要 ( 図5H) にパーティクルを追加、背景、流域フィルタを減算チェック。
- 核が広範囲に重なったり、不規則な形状やテクスチャを持っている場合は、自動計数は正確なカウント( 図5H、右側の矢印)を得られないことがあります。この場合、手動カウントが( " プラグイン/パーティクル分析/セルカウンター ")セルカウンタツールを使用して容易に行うことができる。細胞は手動カウント( 図5I)の間にマークされているので、これはカウントを続けます。
- スプレッドシートへのセル数(原子核)をコピーします。細胞の総数あたりのゼラチン分解の面積を計算します。
4。混合細胞集団内の個々のセルによって蛍光ゼラチン劣化の定量化
フィールド内の他の細胞( 例えば 、非トランスフェクト細胞に対してトランスフェクション)とは別に集団で特定の細胞から得られるマトリックスの劣化を評価するために、第3節で説明する手順は、個々のセルの下劣化の面積を測定するように変更できます。追加の蛍光チャンネルがトランスフェクションされた細胞をマークするために必要とされる。このインスタンスでは、高倍率の画像とよく分離された細胞は、定量化が容易です。
- " スケールを設定/分析します"を選択して追跡するための適切な測定を選択し、メニューコマンドを選択することで、スケールの情報を確認する"を設定して解析/測定 " エリアをチェックして、しきい値に制限します 。
- 触れていない個々の細胞については、F-アクチンのイメージを( 図6A)を使用して、各セルを識別します。 しきい値画像(3.9参照)( 図6B)。これは、セルのエッジをキャプチャすることが重要ですが、穴がある場合もあります内側sがしきい値には含まれません。セルの境界を選択する画像間で同じ強度の値を使用します。
- セルの面積を測定するには、 " 粒子を分析 / 解析します"を使用し分析した粒子のウィンドウで、[サイズ]> 0(ノイズを排除するために)、表示のアウトラインを選択し、表示結果を確認し、マネージャに追加し、(記録するための穴を含むアウトラインの内側全体の面積)。 [OK]を選択すると、[結果]ウィンドウから各セルの面積を記録します。
- ( 図6C)にトランスフェクトされた細胞を識別します。
- 蛍光ゼラチン画像( 図6D)を使用して劣化の領域を識別します。必要であれば、(3.6を参照)背景強度を均等にゼラチン画像をフィルタリングします。 しきい値低下の領域を選択するために、しきい値の設定( 図6E)のメモを作る。以降の画像では、これらの同じ上下強度値( セットを使用してを使用して劣化の領域の客観的な選択のためのしきい値]ウィンドウのボタン)をクリックしてください。
- セルの下劣化の領域を測定します。閾値処理ゼラチン蛍光画像では、ROI ManagerウィンドウにROIを選択して測定します ( 図6F)を選択することによって、細胞の概略を示す。結果を記録し、劣化/セルまたはセル領域の正規化された面積を計算する。
5。代表的な結果
手順については、全体の概略を図1に示します。手順では、細胞はゼラチンを分解することができるようにコーティングされたカバーガラス上に細胞のプレーティング固定とイメージングマトリクスの整合性を評価するために、蛍光顕微鏡分析のための細胞の蛍光マトリックス標識、蛍光共役ゼラチンでカバーガラスとコーティングの準備を伴うと客観的にコンピュータを使用してsoftwarをゼラチンマトリックス分解の程度を定量化電子。

図1固定と免疫標識、およびマトリックスタンパク分解を評価し、蛍光ゼラチンコーティングは、細胞播種に関与する重要なステップを強調全体概略。
準備およびコーティングガラスカバースリップに関与する重要な処理手順を図2に概説されています。
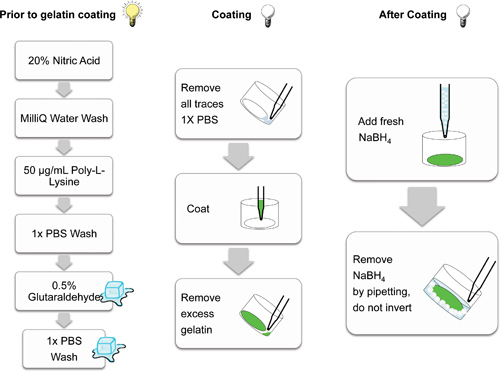
図2:ゼラチンマトリックスコーティング用カバーガラスを製造するのに関与する個々のステップを示す模式図。氷(キューブ)で、ダーク(非照光式バルブ)で、(点灯電球)を考慮して行う手順漫画が示されています。手順では、蛍光灯行列の光退色を防ぐ暗いヘルプで行った。
適切に実行する場合は、カバースリップを均等にオレゴングリーン488-共役グラムでコーティングされているelatin、均質な蛍光を表示する際に顕微鏡で観察( 図3A)。不適切なコーティングに起因して発生することができる典型的なアーチファクトは、取り扱い、保管、コーティングされたカバーガラスの使用量は、図3Bに示されている。
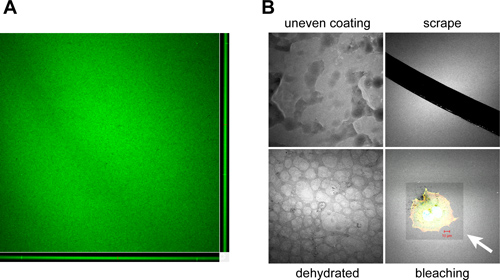
オレゴングリーン488-共役ゼラチンコーティングされたカバースリップの典型的な色と一貫性を示す共焦点zスタックの図3。ゼラチンコーティングされたカバースリップの準備と処理中に発生した成果物の例。A.直交ビューは、所定のプロトコルを用いて製造。 XZ( 下 )とYZ( 右 )焦点面に示されているようにカバースリップは〜1-2μmの厚さの均質なコーティングを有するべきであるゼラチンコートしたカバーガラスのコーティングと、処理中に発生する可能性があるBの成果物は、次のとおりです。の不適切な覆いをによるコーティングプロセス中にカバースリップに貧しいミキシング、マニュアルでは"玉石で、その結果、拡散またはゼラチン混合物( 塗布むら )、ハンドリング( スクレープ )の間に針やピンセットで得点によってコーティングされたマトリックスの除去部分凝固、長期の貯蔵期間中にカバーガラス表面の乾燥"外観( 脱水 )と長期にわたる、または、高強度の光露光(漂白)のために撮影時の蛍光ゼラチン表面の光退色。白い矢印はメッキOSC19の頭頸部扁平上皮癌細胞を包含漂白領域を示している。オレゴングリーン488-共役ゼラチンは、画像のコントラストを向上させるため白疑似カラーされています。バーは10μm。
この手順の実行中に生成され得られた薄膜の行列は、ECMを分解する細胞の能力を評価するための敏感な手段を提供します。 図4は、オレゴングリーン-488共役ゼラチンカバースリップ上に播種OSC19セルからinvadopodia活動の例を示していと3次元デコンボリューションに続くボリュームフィル画像レンダリングによってだけでなく、従来の共焦点顕微鏡により撮像された。

図4 invadopodiaマトリックス分解活性の代表的な例。 invadopodiaおよび対応ゼラチンマトリックスのタンパク質分解の可視化。オレゴングリーン上のメッキOSC19細胞は、10時間488共役ゼラチンカバーガラスを固定し、ローダミン共役ファロイジン(F-アクチン)と抗cortactin抗体(のAlexa Fluor 647二次抗体と疑似カラーの緑で可視化)で標識した。 Invadopodiaは、マージされた画像内のゼラチンクリア(マトリックスの暗い穴)の領域と重なってF-アクチンとcortactinの焦点質濃度として明らかである。拡大された再に示すように、矢印が含まれている箱入りの領域は、個々のinvadopodiaと焦点マトリックスタンパク分解の領域を示す以下gions。バーは10μm。B。ボリュームは、ECMにinvadopodia浸透の可視化を埋める。メッキと同様に染色された細胞OSC19()が視覚的にローダミン共役ファロイジンおよびオレゴングリーン488-共役ゼラチンの7.04μmを合計23連続0.32μmでのzスライス光を得ることによってレンダリングされていました。各チャネルごとに設定ネイティブLSMファイルはAutoQuant X2.2ソフトウェアにオープンした各画像スタックの3次元ブラインドデコンボリューションは、推奨される設定(10回、媒体ノイズ)を用いて行った。処理された画像は、次にNISの要素にオープンしたアルファブレンディングを使ってボリュームのビューとしてレンダリングされたTIFFスタックとして保存されていました。 LUTは調整され、サブボリュームはinvadopodiaが存在している細胞内のエッジを表示するために作成されました。背縁ビューは、基盤となるゼラチン(緑)に挿入invadopodia(赤矢印)を示しています。腹縁ビューはカバースリップの下にゼラチン分解の突出invadopodiaと領域を示していますグリーンマトリックス(矢じり)に赤い現在の領域のような。提示総画像フィールドは77×65μmにトリミングされ、細胞は約60×40μmである。
図5は、プロトコールのステップ3で説明したように正規化されたゼラチンマトリックス分解の定量化のための重要なステップのいくつかを示しています。この手順は、視野全体にゼラチン分解の公平な定量を可能にするために設計されており、フィールド内に多くの細胞に起因するマトリックス分解に適しています。
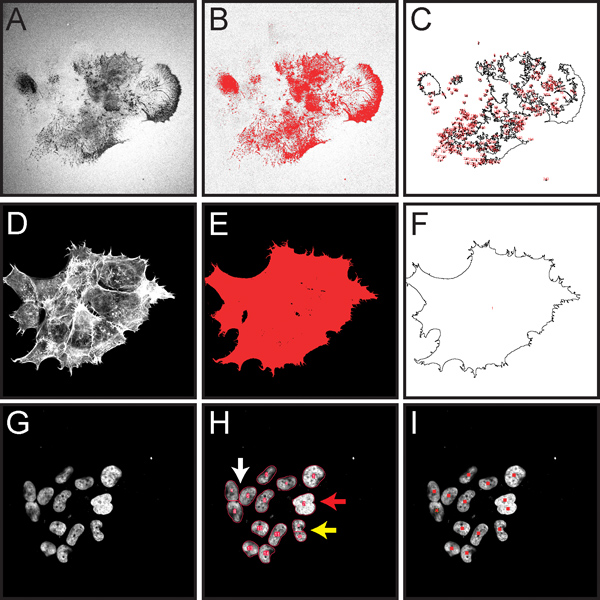
プロトコールステップ3で説明したように全体の顕微鏡画像内のセルの正規化されたゼラチン分解の計算アシスト定量化における重要なステップを示す図5の画面キャプチャ画像。全ての蛍光イメージは良い赤閾値化とROIのマーキングを表示するためにグレースケールに変換されています。A. Imはオレゴングリーン劣化が発生した暗い部分を示す488共役ゼラチン、( "穴")の年齢は(ステップ3.4)B.は赤(ステップ3.5)の劣化の領域を強調ゼラチン画像を閾値処理℃ での描画面積を測定したROIを示す劣化(ステップ3.7)、F-アクチンのD.ローダミンファロイジン染色(ステップ3.8)。ますE.は、赤の総セル面積(ステップ3.9)強調アクチン画像を閾値処理し、測定するセル領域を示すFの図面 (ステップ3.10) DAPI染色細胞核のG·イメージ (ステップ3.13)。H.赤は自動核カウント(ステップ3.13)からのshowの結果を概説しています。流域フィルターが触れている独立した核(白い矢印)に可能性を秘めています。核が広範囲に重なっている場合、それらは個々のオブジェクト(赤い矢印)に分離することはできません。核は不規則な形状をしている場合は、複数のオブジェクト(黄色の矢印)に分けることができる。Ⅰ。 <セルカウンタツール(3.14ステップ)を使用して、手動カウント中に核をマーキングから/ strong>の結果。
図6。プロトコールステップ4で説明したように混合した細胞集団内の個々の細胞によって蛍光ゼラチン劣化を定量化に関わる選択手順を示しています。ここでは、トランスフェクトされた細胞によるマトリックス分解は、トランスフェおよび非トランスフェクトされた細胞の混合集団内で分析することができます。
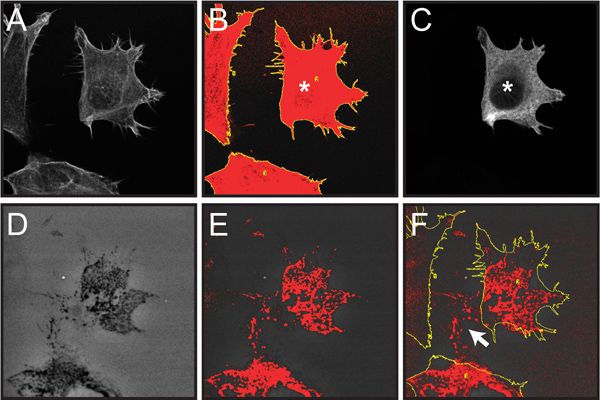
図6細胞集団内の個々のトランスフェクションされた細胞からゼラチン劣化を定量化するために必要な手順の画面キャプチャ画像。 FLAGエピトープタグと融合し、単一のトランスフェクトOSC19細胞を過剰発現する組換えcortactinの定量は、例として示されています。全ての蛍光イメージは良い赤黄色のしきい値とROIのマーキングを表示するには、グレースケールに変換されています。A. 共焦点画像。総セル面積のB.のデッサンしきい値のF-アクチン染色は、次のアプリケーションに基づいており、粒子の機能を分析し(ステップ4.2-3)℃ で共焦点画像劣化があり、暗い部分を( "穴")を示す、オレゴングリーン488-共役ゼラチンのFLAGタグcortactin(*印)(ステップ4.4)。D.のイメージを表現する単一のセルを示す細胞集団の抗FLAG免疫標識の発生し(ステップ4.5)、E.は、赤(ステップ4.5)で劣化の暗い部分を強調ゼラチン画像を閾値処理。F.はパネルB(ステップ4.6)からセルのアウトラインを持つゼラチンイメージオーバーレイを閾値化。セルのアウトライン内でのみ閾値処理のピクセルが解析でカウントされることに注意してください。現在のセルの場所外劣化の領域(白矢印)が時間をかけてゼラチンを越え細胞遊走の結果と合わせたもの含めるません分析にDEDに。
ディスカッション
細胞外マトリックス分解細胞を可視化する能力は、細胞侵入の初期段階で採用する分子メカニズムを発見する際に支援しています。 1980年代初期の4,14,15のWEN-ティエンチェンによって開拓、その後の顕微鏡分析用のカバーガラス上にコーティング蛍光標識された細胞外タンパク質は、細胞の種類の広い範囲にわたってinvadopodia機能を評価する上で主要な技術として浮上している。所定?...
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ウェストバージニア大学メアリーBabbのランドルフがんセンターからの寄付金によって支えられている。我々は、早期の助言や支援をスゼットミューラー(ジョージタウン大学)とローラ·ケリーに感謝します。ウェストバージニア大学顕微鏡イメージング機能(メアリーBabbのランドルフがんセンターと、NIHの助成P20 RR16440、P30およびP30 RR032138 GM103488でサポートされている)の使用は感謝して承諾されます。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/インストゥルメントの名前 | 会社 | カタログ番号 | 注釈 |
| ゼラチン | シグマ | G1890 | ブタ皮膚 |
| スクロース | フィッシャー | BP220 | |
| 12ミリメートルカバースリップ | フィッシャー | 50-121-5159 | |
| 24ウェルプレート | フィッシャー | 08-772-1 | BDファルコン |
| 硝酸 | Ricca | R5326000 | 20%溶液 |
| ポリエルリジン | 電子顕微鏡学 | 19320-B | 0.1%溶液 |
| グルタルアルデヒド | シグマ | G7526 | 8%溶液 |
| オレゴングリーン488-共役ゼラチン | インビトロジェン | G-13186 | |
| 水素化ホウ素ナトリウム | シグマ | 213462 | |
| トリトンX-100 | フィッシャー | BP151 | |
| ローダミン - ファロイジン | インビトロジェン | R415 | |
| 抗cortactin(クローン4F11) | ミリポア | 05から180 | |
| 抗FLAG抗体 | ミリポア | MAB3118 | |
| のAlexa Fluor 647ヤギ抗マウスIgG | インビトロジェン | A21235 | |
| Gold退色防止を長引かせる | インビトロジェン | P36930 | |
| LSM 510共焦点顕微鏡 | ツァイス | ||
| ImageJのソフトウェア | パブリックドメイン | http://www.macbiophotonics.ca/imagej/ | |
| AutoQuant X2.2ソフトウェア | メディアサイバネティクス | ||
| NISの要素ソフトウェア | ニコン |
参考文献
- Ridley, A. J. Life at the leading edge. Cell. 145, 1012-1022 (2011).
- Murphy, D. A., Courtneidge, S. A. The 'ins' and 'outs' of podosomes and invadopodia: characteristics, formation and function. Nat. Rev. Mol. Cell Biol. 12, 413-426 (2011).
- Linder, S., Wiesner, C., Himmel, M. Degrading Devices: Invadosomes in Proteolytic Cell Invasion. Annu. Rev. Cell. Dev. Biol. , (2010).
- Chen, W. T., Chen, J. M., Parsons, S. J., Parsons, J. T. Local degradation of fibronectin at sites of expression of the transforming gene product pp60src. Nature. 316, 156-158 (1985).
- Artym, V. V., Zhang, Y., Seillier-Moiseiwitsch, F., Yamada, K. M., Mueller, S. C. Dynamic interactions of cortactin and membrane type 1 matrix metalloproteinase at invadopodia: defining the stages of invadopodia formation and function. Cancer Res. 66, 3034-3043 (2006).
- Ayala, I., et al. Multiple regulatory inputs converge on cortactin to control invadopodia biogenesis and extracellular matrix degradation. J. Cell Sci. , (2008).
- Ammer, A. G., et al. Saracatinib impairs head and neck squamous cell carcinoma invasion by disrupting invadopodia function. J. Cancer Sci. Ther. 1, 52-61 (2009).
- Seals, D. F., et al. The adaptor protein Tks5/Fish is required for podosome formation and function, and for the protease-driven invasion of cancer cells. Cancer Cell. 7, 155-165 (2005).
- Yamaguchi, H., et al. Molecular mechanisms of invadopodium formation: the role of the N-WASP-Arp2/3 complex pathway and cofilin. J. Cell Biol. 168, 441-452 (2005).
- Kopp, P., et al. The kinesin KIF1C and microtubule plus ends regulate podosome dynamics in macrophages. Mol. Biol. Cell. 17, 2811-2823 (2006).
- Oser, M., et al. Cortactin regulates cofilin and N-WASp activities to control the stages of invadopodium assembly and maturation. J. Cell. Biol. 186, 571-587 (2009).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. Image Processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Kelley, L. C., et al. Oncogenic Src requires a wild-type counterpart to regulate invadopodia maturation. J. Cell Sci. 123, 3923-3932 (2010).
- Chen, W. T., Singer, S. J. Fibronectin is not present in the focal adhesions formed between normal cultured fibroblasts and their substrata. Proc. Natl. Acad. Sci. U.S.A. 77, 7318-7322 (1980).
- Chen, W. T., Olden, K., Bernard, B. A., Chu, F. F. Expression of transformation-associated protease(s) that degrade fibronectin at cell contact sites. J. Cell Biol. 98, 1546-1555 (1984).
- Bharti, S., et al. Src-dependent phosphorylation of ASAP1 regulates podosomes. Mol. Cell Biol. 27, 8271-8283 (2007).
- Albrechtsen, R., Stautz, D., Sanjay, A., Kveiborg, M., Wewer, U. M. Extracellular engagement of ADAM12 induces clusters of invadopodia with localized ectodomain shedding activity. Exp. Cell Res. 317 (10), 195-209 (2011).
- Scott, R. W., et al. kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell Biol. 191, 169-185 (2010).
- Mueller, S. C., Yeh, Y., Chen, W. T. Tyrosine phosphorylation of membrane proteins mediates cellular invasion by transformed cells. J. Cell. Biol. 119, 1309-1325 (1992).
- Bowden, E. T., Coopman, P. J., Mueller, S. C. Invadopodia: unique methods for measurement of extracellular matrix degradation in vitro. Methods Cell Biol. 63, 613-627 (2001).
- Baldassarre, M., et al. Dynamin participates in focal extracellular matrix degradation by invasive cells. Mol. Biol. Cell. 14, 1074-1084 (2003).
- Alexander, N. R., et al. Extracellular matrix rigidity promotes invadopodia activity. Curr. Biol. 18, 1295-1299 (2008).
- Artym, V. V., Yamada, K. M., Mueller, S. C. ECM degradation assays for analyzing local cell invasion. Methods Mol. Biol. 522, 211-219 (2009).
- Schoumacher, M., Goldman, R. D., Louvard, D., Vignjevic, D. M. Actin, microtubules, and vimentin intermediate filaments cooperate for elongation of invadopodia. J. Cell Biol. 189, 541-556 (2010).
- Clark, E. S., Whigham, A. S., Yarbrough, W. G., Weaver, A. M. Cortactin is an essential regulator of matrix metalloproteinase secretion and extracellular matrix degradation in invadopodia. Cancer Res. 67, 4227-4235 (2007).
- Yamaguchi, H., et al. Phosphoinositide 3-kinase signaling pathway mediated by p110alpha regulates invadopodia formation. J. Cell Biol. 193, 1275-1288 (2011).
- Li, A., et al. The actin-bundling protein fascin stabilizes actin in invadopodia and potentiates protrusive invasion. Curr. Biol. 20, 339-345 (2010).
- Yamaguchi, H., et al. Phosphatidylinositol 4,5-bisphosphate and PIP5-kinase Ialpha are required for invadopodia formation in human breast cancer cells. Cancer Sci. , (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved