A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تعداد خلايا الدم البيضاء الكبرى الطرفية بالسكان الدم للمحاكمات متعددة المراكز السريرية باستخدام الدم الكامل الفحص Phenotyping
In This Article
Summary
في هذا التقرير، إلا أننا شرح الخطوات تلطيخ وتحليل لفحص phenotyping أجريت على الدم الكامل الطازج تعداد السكان الرئيسية الكريات البيض الفطرية والتكيفية. نؤكد اعتبارات لأداء هذه الإجراءات في سياق محاكمة متعددة المراكز السريرية.
Abstract
ويستخدم على نطاق واسع الحفظ بالتبريد من الكريات البيض في الدم المحيطي للحفاظ على خلايا لتقييم الاستجابة المناعية في التجارب السريرية وتوفر العديد من المزايا لسهولة وتوحيد المقررة المناعية، ولكن لوحظت آثار ضارة لهذه العملية على بعض مجموعات فرعية الخلية، مثل المحببة وخلايا B ، والخلايا الجذعية 1-3. يعاير الكريات البيض الطازج يعطي صورة أكثر دقة للدولة في الجسم الحي من الخلايا، ولكن في كثير من الأحيان من الصعب القيام بها في سياق التجارب السريرية الكبيرة. المقايسات الخلية الطازجة تعتمد على الالتزامات المتطوعين والأطر الزمنية، وإذا كان يستغرق وقتا طويلا، يمكن أن يكون تطبيقها غير عملي نظرا لساعات العمل المطلوبة من العاملين في المختبرات. وبالإضافة إلى ذلك، عندما يتم إجراء محاكمات في مراكز متعددة، قد لا المختبرات مع الموارد والتدريب اللازم لأداء فحوصات تكون موجودة على مقربة كافية لمواقع السريرية. لمعالجة هذه القضايا، لدينا جمعةتم تطويرها لتلطيخ الأجسام المضادة 11-لون لوحة التي يمكن استخدامها مع أنابيب Trucount (بيكتون ديكنسون، سان خوسيه، كاليفورنيا) لوالنمط الظاهري تعداد السكان الرئيسية الكريات البيض في الدم المحيطي، مما أسفر عن أكثر قوة من نوع الخلية معلومات محددة من فحوصات مثل عد الدم الكامل (CBC) أو المقايسات المتاحة تجاريا مع لوحات مصممة لأنابيب Trucount أن وصمة عار فقط لأنواع الخلايا قليلة. الإجراء تلطيخ بسيط، يتطلب سوى 100 ميكرولتر من الدم الكامل الطازج، ويستغرق حوالي 45 دقيقة، مما يجعل من الممكن لمعيار الدم تجهيز مختبرات لتنفيذ. أنها مقتبسة من الأنبوب Trucount BD رقة البيانات الفنية ( الإصدار 8/2010 ). ويمكن إعداد كوكتيل الضد تلطيخ مقدما بكميات كبيرة في مختبر الفحص المركزي وشحنها إلى معامل معالجة الموقع. يمكن ان تكون ثابتة أنابيب الملونوجمدت لشحنها إلى المختبر المركزي للفحص تدفق متعدد الألوان التحليل الخلوي. ويمكن استخدام البيانات الناتجة عن هذا الفريق تلطيخ لتعقب التغييرات في تركيزات الكريات البيض مع مرور الوقت فيما يتعلق التدخل ويمكن بسهولة مزيد من التطوير لتقييم الدول تفعيل أنواع معينة من الخلايا في المصالح. في هذا التقرير، علينا أن نبرهن للإجراءات التي استخدمها فنيي المختبرات تجهيز الدم لأداء تلطيخ على الدم الكامل الطازج والخطوات لتحليل هذه العينات في مختبر الملون مقايسة وسط دعم متعددة المراكز السريرية محاكمة. تفاصيل الفيديو الإجراء كما يتم تنفيذ ذلك في سياق محاكمة التعادل الدم السريرية في شبكة لقاح فيروس نقص المناعة البشرية المحاكمات (HVTN).
Protocol
ملاحظة: لحماية الأجسام المضادة، مترافق fluorophore من الضوء، نفذ جميع الخطوات في خزانة السلامة البيولوجية مع قبالة الضوء.
1. إعداد الأجسام المضادة لوحة تلوين
- ويمكن الاطلاع على لوحة تلوين الأجسام المضادة في الجدول 1. وينبغي تحديد تركيز الأجسام المضادة من الدم الكامل مع المعايرة واستخدام التدفق الخلوي نفس المعدات والإجراءات التي سيتم استخدامها للحصول على عينات phenotyping الملون.
- مرة واحدة يتم تحديد التتر تلطيخ المناسبة، والجمع بين الأضداد في كل مزيج واحد في أنبوب قفل الغطاء. إضافة تدفق العازلة غسل (PBS Dulbecco مع 2٪ مصل بقري جنيني الحرارة المعطل) لتبرزي حجم إجمالي إلى 100 ميكرولتر. توسيع نطاق الخليط لعدد من العينات التي ملطخة. يمكن تخزين هذا الخليط في C ° 4 لمدة تصل إلى ثمانية أسابيع.
2. تلطيخ
- إذا كان الدم التي يتم جمعها لاستخدامها لأغراض أخرى في الإعلانتعيين dition لهذا الاختبار، وقسامة جانبا بينما يتم تنفيذ المزيد من الوقت على إجراءات تراعي الدم المتبقية. يمكن تخزين قسامة في درجة حرارة الغرفة لمدة تصل إلى 4 ساعات بعد بزل الوريد دون فقدان الخلية كبيرة.
- تحقق من أن هناك حبة سليمة بيليه في أسفل الأنبوب Trucount وتسمية الأنبوب لتحديد يجري ملطخة العينة. في التجارب السريرية HVTN، ونظام إدارة البيانات مختبر (الحدود علوم والتكنولوجيا مؤسسة البحوث؛ أمهرست، NY) يستخدم لتسمية وتتبع العينات الملون.
- تسجيل أرقام وتواريخ انتهاء الصلاحية من جميع الكواشف. تسجيل Trucount العد حبة عدد أنبوب المقدمة من قبل الشركة المصنعة على كيس من الأنابيب، تأكد أن عدد الكثير على الكيس مطابق لرقم كثيرا على الأنبوب.
- استخدام ماصة لعكس pipetting بدقة 100 ميكرولتر من الدم الكامل في أنبوب Trucount، فقط فوق التجنيب المعادن. تجنب تلطيخ الدم أسفل الجانب من الأنبوب.
- استخدام العادية (إلى الأمام) تقنية pipetting، ماصة 100 ميكرولتر من الأجسام المضادة لوحة تلوين مختلطة (انظر الجدول 1) في أنبوب Trucount. سقف الأنبوب ودوامة بسرعة منخفضة لحوالي 15 ثانية لخلط. تفقد البصر الأنبوب للتأكد من أن يذوب تماما بيليه حبة.
- احتضان الأنبوب Trucount لمدة 15 دقيقة في درجة حرارة الغرفة (15-30 ° C) في الظلام.
- إذا لزم الأمر، وتمييع قسامة من 10 × FACS حل lysing ل1X باستخدام DIH 2 O. إضافة ميكرولتر 900 1 × FACS حل lysing إلى الأنبوب.
- سقف الأنبوب ودوامة جيدا على سرعة منخفضة لثانية ما يقرب من 15 إلى المزيج. دفع الحد الأقصى للأسفل بقوة في تأمين موقف من أنبوب وختم مع فيلم المختبر.
- تخزين أنبوب في -65 درجة مئوية إلى -95 ° C حتى تكون العينة جاهزة للشحن إلى المختبر المركزي أو تحليل للتحليل في المنزل. عينات مستقرة في هذه المرحلة لأربعة أسابيع على الأقل. إذا شحن أو يعاير IMMEdiately، يمكن حذف هذه الخطوة.
3. الشحن
ملاحظة: الاستفادة من الإرشادات التالية نظام الشحن المعزولة من شركة SAF-T-باك مصممة خصيصا لفئة المواد البيولوجية B الشحن معفاة وفقا لالجوي الدولي واتحاد النقل (IATA) اللوائح. إذا تحليل العينات في نفس الموقع مثل تلطيخ حدث، انتقل إلى القسم 4.
- يمكن شحنها مباشرة بعد تلطيخ عينات أو مرة وتجميدها في -65 درجة مئوية إلى -95 ° C. التفاف كل أنبوب تماما في احباط ومكان في المربع عينة الملون. وضع مربع العينة الملون داخل حقيبة بولي مانعة للتسرب مع مادة ماصة.
- وضع مانعة للتسرب بولي كيس ومحتويات في كيس وختم تايفك مع الهواء وأقل قدر ممكن في الحقيبة.
- وضع حزمة العينة (عينة داخل العبوة الثانوية) داخل المربع البني الداخلية.
- وضع الداخلي البني بالثور داخل الصدر الستايروفوم، وتأمين عليه في المسافة البادئة لمنع تحول.
- ملء الصدر الستايروفوم مع الثلج الجاف (حوالي 8 كلغ) ووضع غطاء محكم على الصدر.
- آمن الشريط مربع الشحن والسفن ومادة بيولوجية، الفئة B (UN3373) مع الثلج الجاف المناسب (UN1845) علامات، اتبع IATA PI-650 تعليمات.
- على إيصال، يتم تخزين العينات في -65 درجة مئوية إلى -95 ° C إلى أن يتم تحليلها.
4. ذوبان وتحليل التدفق الخلوي
- إزالة عينة الملون من الفريزر إلى ذوبان الجليد في درجة حرارة الغرفة في الظلام قبل جمع على قياس التدفق الخلوي. إذا جمع بيانات عن أكثر من عينة واحدة، وتوحيد عملية لجميع الأنابيب التي كتبها مذهلة ذوبان بحيث لا يجلس أنابيب في درجة حرارة الغرفة لأكثر من 1 ساعة لكل منهما.
- ينبغي الحصول عليها باستخدام عينات تدفق عداد الكريات الليزر 4 مجهزة الفلاتر المناسبة، مثل LSR BDII. معايرة عداد الكريات استخدام معيار التعويض وطرق جمع البيانات عن مضان 4.
ملاحظة: لا تقم بتعيين عتبات مبعثر إلى الأمام أو الجانب مبعثر خلال جمع 5. يمكن الخرز Trucount تقل الإعداد عتبة ادنى حد ممكن لهذه المعايير مما يؤدي إلى مجموعة فرعية من لا الخرز حسابها خلال التحليل. إذا طلبت منه أداة لوضع عتبة، على ادنى حد ممكن آم عتبة قناة سماوي. لأن كريات الدم البيضاء + CD45 ملطخة لوحة سيتم آم سماوي إيجابية، والخرز Trucount يتألق أيضا في قناة آم سماوي، هذا يجب أن تسمح لجميع البيانات ذات الصلة التي يتعين جمعها بشكل مناسب.
- دوامة أنبوب عينة لمدة 5 ثوانى قبل التحميل على قياس التدفق الخلوي. الخرز Trucount يتألق بشكل كبير في العديد من القنوات. بوابة الخرز خلال جمع السكان من خلال إيجاد وهذا هو غاية مزدوجة إيجابية لPE Cy5 وAPC (لكولو 2قد RS أن معظم بسهولة التمييز بين حبات من الخلايا تختلف تبعا الأجهزة). حدد بوابة حبة والخاص بوابة توقف، وتسجيل البيانات حتى يتم الحصول على لا يقل عن 20،000 الخرز.
- تحليل البيانات باستخدام البرامج المناسبة، مثل FlowJo (Treestar؛ آشلاند، OR). ويظهر الشكل 1 مخطط النابضة تستخدم لتحليل السكان الكريات البيض تختلف عن التعادل التحكم الدم ممثل.
5. Trucount الحسابات
- كل أنبوب يحتوي على Trucount بيليه مجفف بالتجميد من الخرز الفلورسنت. بعد إضافة السائل إلى الأنبوب وvortexing، ينبغي أن تصبح حبات موزعة بالتساوي في جميع أنحاء العينة. عدد الخرز في بيليه يختلف قليلا من حيث عدد الكثير، ويمكن العثور على الحقيبة لتخزين الأنابيب.
- بوابة الخرز Trucount والسكان الخلية كما هو موضح في الشكل رقم 1 لتحديد التهم لكل حالة السكان. مقارنة عدد من الأحداث طن سوف البوابة حبة إلى العدد الإجمالي من الخرز أصلا في أنبوب يسمح لك لتحديد نسبة العينة التي تم جمعها، والتي يمكن بعد ذلك أن تستخدم لتحديد تركيز المطلق (أي خلية / ميكرولتر) لكل السكان. ويمكن استخدام المعادلة التالية لهذا الغرض: تركيز خلية (# خلية / ميكرولتر من الدم الكامل) = [# السكان الأحداث / (الأحداث حبة # / # الخرز إجمالي بيليه)] / 100 ميكرولتر.
6. ممثل النتائج
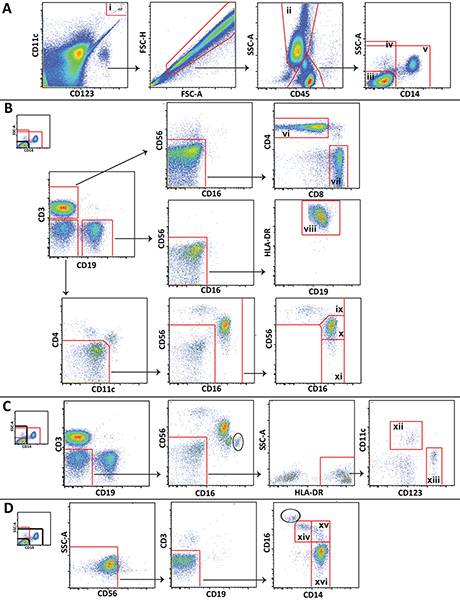
مخطط الرقم الصب 1. تستخدم لتحليل السكان الكريات البيض كبيرة تظهر بيانات تمثيلية من المتطوعين الأصحاء. A) الخرز Trucount (ط) هي بوابات واستبعادها من الخلايا. ويتم رسم المحببة (الثاني) وتنقسم lympohcytes وحيدات إلى 3 popluations: CD14الخلايا الليمفاوية السلبية (الثالث)، كافة الخلايا CD14 السلبية (الرابع)، والخلايا الليمفاوية غير (الخامس). B) CD14 الخلايا الليمفاوية السلبية بوابات للتمييز CD4 + الخلايا T (السادس)، CD8 + الخلايا T (السابع)، والخلايا B (الثامن)، CD56 خلايا NK مشرق (التاسع)، CD56 قاتمة خلايا NK (خ)، وCD56 خلايا NK السلبية (الحادي عشر). C) جميع خلايا CD14 السلبية للتمييز بوابات النخاعي (الثاني عشر) والخلايا الجذعية بلازماوية الشكل (الثالث عشر). D) غير lympocytes هي بوابات للتمييز غير الكلاسيكية (الرابع عشر)، المتوسطة (الخامس عشر)، والكلاسيكية (السادس عشر) حيدات. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
ويمكن أيضا مجموعات فرعية أكثر تحديدا الخلايا التي لا تظهر في الشكل 1 (على سبيل المثال، خلايا العدلات أو NKT) يمكن تمييزها باستخدام لوحة نقدم، ويمكن توسيع المخطط أو تعديل لالنابضة لتلبية احتياجات محددة الدراسة. خطوات معينة أظهرت النابضة هي فريدة من نوعها لهذا الأسلوب. تجدر الإشارة بوجه خاص، وبوابة إدراجيتم رسمها بوابة الاستبعاد حول الخرز Trucount ووضعها على رأس واحد آخر، واحدة لبوابة الخرز لالعد، واحد لاستبعاد حبات من التحليل الخلوي (الشكل 1A). أيضا، لأنه لم يتم الخلايا الليمفاوية، وحيدات، والمحببة التي تتميز بسهولة في الدم الكامل كما هي الحال في خلايا الدم المحيطية وحيدات النوى من قبل مبعثر إلى الأمام والجانب مبعثر، تبوب هذه الخلايا باستخدام CD45 التعبير ومبعثر الجانب غالبا ما يكون ضروريا (الشكل 1A). تلويث المحببة (دائري) التي لا يمكن فصلها عن الخلايا الليمفاوية وحيدات باستخدام CD45 ومبعثر الجانب يمكن تمييزها في بعض المخططات من قبل التعبير عنها CD16 عالية (الشكل 1C و 1D الشكل). عدد تلويث المحببة عادة ما تكون صغيرة، وأنها لا تتداخل مع الخلية النابضة الوحيدات وNK.
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذا التقرير، نقدم طريقة حبة المستندة إلى تعداد السكان لالكريات البيض في الدم الكامل الطازج بنسبة تغطية التدفق الخلوي والمعلمات الضرورية لاستخدامها في محاكمة متعددة المراكز السريرية مع تحليل عينة مركزية. هذا الأسلوب يعتمد على ويحسن بروتوكول Trucount BD وتمكن استخدام?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر جيسيكا جونز، إيريكا كلارك، Ducar كونستانس، دونا سميث، لويس روي، Apedaile ليلى، يزنر جوان، آدمز ديفين، McBain كوري وVoght ستيفن لمساعدتها في تطوير هذه المخطوطة، وطريقة والفيديو.
وأيد هذا العمل من قبل مؤسسة بيل وميليندا غيتس CAVD منحة 38645 (MJM) والمعاهد الوطنية للصحة منح UM1 AI068618 وAI069481 U01 (MJM). EA-N. معتمد من قبل المعاهد الوطنية للصحة منح T32 AI007140. نشكر الاستئماني جيمس بندلتون B. الخيرية للتبرع السخي من المعدات.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| كاشف اسم | شركة | كتالوج رقم | |
| Trucount المطلق أنابيب عد | BD العلوم البيولوجية | 340334 | |
| FACS 10X Lysing الحل | BD العلوم البيولوجية | 349202 | |
| الفئة B & إعفاء نظام الشحن، معزول | SAF-T-باك | STP-320 | |
| CD45 AmCyan الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 339192 | |
| CD3 الأجسام المضادة أحادية المنشأ FITC | BD العلوم البيولوجية | 349201 | |
| CD8 PerCp-CY 5،5 الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 341051 | |
| CD4 اليكسا فلور 700 antibo وحيدة النسيلةDY | BD العلوم البيولوجية | 557922 | |
| HLA-DR ECD الأجسام المضادة أحادية المنشأ | بيكمان كولتر | IM3636 | |
| CD14 الأجسام المضادة أحادية المنشأ V450 | BD العلوم البيولوجية | 560349 | |
| CD19 PE الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 555413 | |
| CD16 APC-H7 الأجسام المضادة وحيدة النسيلة | BD العلوم البيولوجية | 560195 | |
| PE-CD56 Cy7 الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 335791 | |
| CD11c APC الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 559877 | |
| PE-CD123 Cy5 الأجسام المضادة أحادية المنشأ | BD العلوم البيولوجية | 551065 |
References
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M. The handbook of Experimental Immunology. Herzenberg, L., Blackwell, C., Weir, D. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6(2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved