JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전체 혈액 Phenotyping 분석을 사용하여 Multicenter 임상 시험을위한 주요 말초 혈 백혈구 인구의 열거
요약
이 보고서에서, 우리는 주요 타고난 및 적응 백혈구 인구를 열거하는 신선한 전체 혈액에서 수행 phenotyping 분석의 착색 및 분석 단계를 보여줍니다. 우리는 multicenter 임상 실험의 맥락에서이 절차를 수행하기위한 고려 사항을 강조.
초록
말초 혈 백혈구의 Cryopreservation 널리 임상 실험에 면역 반응 평가를위한 세포를 보존하기 위해 사용하고 면역 평가의 용이성 및 표준화를위한 많은 장점을 제공하지만,이 과정의 해로운 효과는 같은 과립 성 백혈구와 같은 일부 세포 집합, B 세포에 관찰 된 수 있습니다 , 1-3 및 수지상 세포. 신선한 백혈구를 시금하면 세포의 생체 상태에서의보다 정확한 사진을 제공하지만, 종종 큰 임상 시험의 맥락에서 수행 할 수 어렵습니다. 신선한 세포 assays은 시간이 오래 걸릴 경우, 자신의 응용 프로그램으로 인해 실험실 직원의 필요한 노동 시간에 비현실적 일 수 자원 봉사 약속과 시간대에 의존하고. 또한, 재판이 여러 센터에서 실시하는 경우, assays을 수행하기 위해 필요한 자원과 훈련 연구소는 임상 사이트에 충분한 가까이에 위치 할 수 없습니다. 이러한 문제를 해결하기 위해, 우리는 devel이예와 같은 assays보다 더 강력한 세포 유형 특정 정보를하였으며, 표현형과 말초 혈 내의 주요 백혈구 인구를 열거, Trucount 튜브 (산호세, CA Becton 디킨슨)와 함께 사용할 수있는 11 색 항체 염색법 패널을 oped 완전한 혈액 카운트 (CBC) 또는 몇 세포 유형에 얼룩 Trucount 관을위한 상용 가능한 패널 assays. 착색 절차는 간단합니다, 신선한 전체 혈액의 약 100 μl가 필요하고 가능한 표준 혈액 처리 연구소가 수행 할 수있게 약 45 분 정도 소요됩니다. 그것은 BD Trucount 튜브 기술 데이터 시트 (에서 적응 버전 2,010분의 8 ). 착색 항체 칵테일은 중앙 검정 실험실에서 대량으로 사전에 준비 사이트 처리 실험실로 배송 될 수 있습니다. 스테인드 튜브가 해결 될 수 있습니다및 다색의 유동 세포 계측법 분석을위한 중앙 분석 실험실에 배송을 위해 냉동. 이 착색 패널에서 생성 된 데이터는 개입과 관련하여 시간이 지남에 따라 백혈구 농도의 변화를 추적 할 쉽게 더 관심의 특정 세포 유형의 활성화 상태를 평가하기 위해 개발 될 수 사용할 수 있습니다. 이 보고서에서 우리는 신선한 전체 혈액 및 multicenter 임상 실험을 지원하는 중앙 검정 실험실에서 이러한 스테인드 샘플을 분석하는 단계에 착색을 수행 할 혈액 처리 연구실 기술자가 사용하는 절차를 보여줍니다. 비디오 정보는 HIV 백신 평가판 네트워크 (HVTN)에 임상 시험 혈액 추첨의 컨텍스트에서 수행되기 때문에 절차.
프로토콜
참고 : 빛의 형광 - 복합 항체를 보호하기 위해 라이트와 바이오 안전 캐비넷의 모든 단계를 수행합니다.
1. 항체 염색법 패널 준비
- 항체 염색법 패널은 표 1에서 찾을 수 있습니다. 항체 농도는 전체 피와 적정에 의해 정의하고 동일한 유동 세포 계측법 장비와 스테인드 phenotyping 샘플을 취득하는 데 사용됩니다 절차를 사용해야합니다.
- 적절한 착색의 titers가 결정되면 잠금 캡 튜브에서 하나의 혼합으로 모든 항체가 조화를 이루고 있습니다. 100 μl에 총 볼륨을 가져다 흐름 세척 버퍼 (2 % 열 inactivated 태아 소 혈청과 Dulbecco의 PBS)를 추가합니다. 물들되는 샘플 수에 대한 혼합물을 확장. 이 혼합물은 최대 8 주까지에 대해 4 ° C에 저장할 수 있습니다.
2. 더럽히는 것
- 수집 된 혈액은 광고에 다른 목적을 위해 사용하는 경우시간에 민감한 절차 남아있는 혈액 수행하는 동안이 분석에 dition은 따로 나누어지는을 설정할 수 있습니다. 나누어지는이 중요한 세포의 손실없이 venipuncture 후 4 시간 동안 실온에서 최대 저장할 수 있습니다.
- 그대로 비드 펠렛은 Trucount 튜브 및 라벨 샘플 묻은되는 식별 할 수있는 튜브의 하단에 있다는 것을 확인합니다. HVTN 임상 실험에서 실험 데이터 관리 시스템 (프론티어 과학 기술 연구 재단, 애 머스트, NY)은 스테인드 샘플을 라벨 및 추적하는 데 사용됩니다.
- 많은 번호와 모든 시약의 유효 날짜를 기록합니다. 튜브의 가방에있는 제조업체에서 제공 Trucount 관 구슬 카운트 번호를 기록하고, 가방에있는 많은 번호가 튜브에 많은 번호를 일치하는지 확인하십시오.
- 정확하게 단지 금속 리테이너 위에 Trucount 튜브에 전체 혈액의 100 μl를 피펫에 pipetting 반대로 사용합니다. 관의 측면 아래로 번짐의 피를 사용하지 마십시오.
- Trucount 튜브에 일반 (앞으로) pipetting 기술, 혼합 항체 염색법 패널의 피펫 100 μl를 (표 1 참조)를 사용. 약 15 초 혼합하기위한 낮은 속도로 관과 소용돌이를 캡. 시각 비드 펠렛이 완전히 용해되어 있는지 확인하기 위해 튜브를 검사한다.
- 어둠 속에서 실내 온도 (15-30 ° C)에서 15 분 동안 Trucount 관을 품다.
- 필요한 경우, diH 2 O.를 사용하여 1X에 10 나누어지는 × FACS Lysing 솔루션을 희석 900 μl 1 × 튜브에 FACS Lysing 솔루션을 추가 할 수 있습니다.
- 혼합하는 약 15 초에 낮은 속도로 철저하게 관과 소용돌이를 캡. 실험실 필름과 관 및 봉인에 위치를 잠금으로 단단히 뚜껑을 아래로 밀어 넣습니다.
- -65에서 튜브를 저장 ° C -95 ° C의 예제는 중앙 분석 실험실로 배송이나 집에 분석을위한 준비가 될 때까지. 샘플은 적어도 4 주 동안이 단계에서 안정적입니다. imme을 배송 또는 시금 경우diately,이 단계는 생략 할 수 있습니다.
3. 해운
참고 : 다음 지침은 구체적으로 국제 항공 및 운송 협회 (IATA) 규정에 따라 운송 카테고리 B 면제 생물학적 물질을위한 SAF-T-박 주식회사에서 절연 배송 시스템을 사용합니다. 착색이 발생한 같은 위치에 샘플을 분석하는 경우, 섹션 4로 이동합니다.
- 샘플은 즉시 염색 후 배송하거나 일단은 -65에서 얼 ° C -95 ° C 사이 스테인드 표본 상자에 호일과 장소에 완전히 각 관을 넣어. 흡착제로 leakproof 폴리 가방 내부에 스테인드 표본 상자를 놓으십시오.
- 가방에 가능한 한 공기와 같은과 Tyvek 가방과 인감에 leakproof 폴리 가방과 내용을 넣으십시오.
- 내부 갈색 상자 안에 표본 패키지 (보조 포장 내부의 표본) 놓습니다.
- 내부 갈색 B를 배치스티로폼 상자 내부의 소는 변화를 방지하기 위해 들여 쓰기로 확보.
- 드라이 아이스 (약 8kg)와 스티로폼 상자를 작성하고 가슴에 단단히 뚜껑을 놓습니다.
- 안전하게 테이프 배송 상자와 배는 생물 물질로 적절한 드라이 아이스 (UN1845) 표시가있는 카테고리 B은 (UN3373), IATA PI-650 지시 사항을 따르십시오.
- 수령시, 샘플이 -65에 저장됩니다 ° C -95 ° C에 그들이 분석까지.
4. 해동 및 유동 세포 계측법 분석
- 흐름 cytometer에 수집 전에 어둠 속에서 실온에서 해동은 냉장고에서 스테인드 샘플을 제거합니다. 하나 이상의 샘플에 대한 데이터를 수집하면 튜브가 1 시간 이상 각각에 대해 실온에서 앉아하는 일이 없도록 해동 망설으로 모든 튜브에 대한 프로세스를 표준화.
- 샘플은 같은 BD LSR 적절한 필터가 장착 된 네 레이저 흐름 cytometer를 사용하여 취득해야합니다II. 데이터 수집 4 표준 cytometer 보정 및 형광 보상 방법을 사용하십시오.
참고 : 컬렉션 5 중 앞으로 분산 또는 측면 분산 형 임계 값을 설정하지 마십시오. Trucount 비즈는 구슬의 일부는 분석을하는 동안 설명 할 수하지 원인이 이러한 매개 변수에 대한 낮은 임계 값 설정 아래 떨어질 수 있습니다. 임계 값을 설정하려면 악기가 필요한 경우, 가장 낮은가요 시안 채널 임계 값을 설정합니다. 패널 물들 CD45 +의 백혈구는 시안이 긍정적인가되며, Trucount 구슬도 앰 시안 채널에 형광 때문에,이 적절히 수집 할 모든 관련 데이터를 허용해야합니다.
- 흐름 cytometer에로드하기 전에 5 초에 소용돌이 샘플 튜브를. Trucount 구슬은 여러 채널에서 높은 형광. PE Cy5와 APC (두 colo에 대한 높은 더블 긍정적 인 인구를 찾아서 게이트 수집하는 동안 구슬을가장 쉽게 세포에서 구슬을 구분하는 RS)은 장비에 따라 달라질 수 있습니다. 최소한 2 만 구슬이 획득되기 전까지는 중단 게이트로 구슬 문을 선택하고 기록 데이터입니다.
- 이러한 FlowJo (Treestar, 애쉬 랜드, OR)와 같은 적절한 소프트웨어를 사용하여 데이터를 분석합니다. 그림 1은 대표적인 제어 혈액 추첨 다른 백혈구 인구의 분석에 활용 게이팅 구조를 보여줍니다.
5. Trucount 계산
- 각 Trucount 튜브는 형광 구슬의 동결 건조 된 펠렛이 포함되어 있습니다. 관에 액체를 추가하고 vortexing 후, 구슬 동일하게 시료 전체에 분산 될 것입니다. 펠렛의 구슬의 수는 많은 번호로 약간 다르며 튜브의 저장소 가방에서 찾을 수 있습니다.
- 게이트는 Trucount 비즈와 세포 인구 각 인구에 대한 이벤트 카운트를 결정하기 위해 그림 1과 같이. 이벤트의 수를 비교 전N 관 원래 구슬의 총 개수에 구슬 문은 다음 각 인구의 절대 농도 (즉, 세포 / μl)를 결정하는 데 사용할 수있는 샘플 수집의 비율을 결정 할 수 있습니다. 세포 농도 (# 세포 / μl 전체 혈액) = [/ # 인구 이벤트 (# 비드 이벤트 / # 펠렛의 총 구슬)] / 100 μl 다음 방정식이 목적을 위해 사용할 수 있습니다.
6. 대표 결과
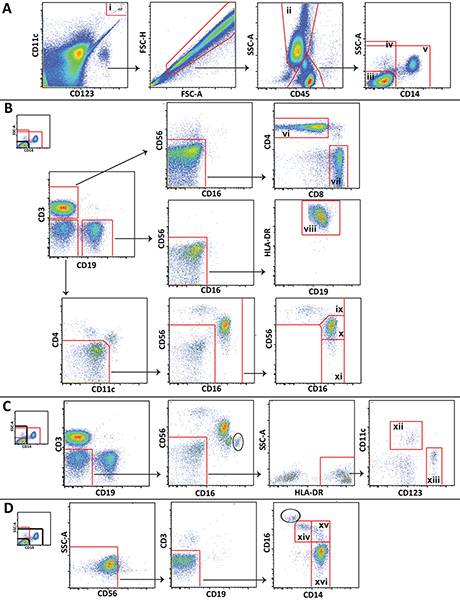
그림 1. 게이팅 제도는 건강한 자원 봉사의 대표 데이터를 보여주는 주요 백혈구 인구의 분석에 활용. A) Trucount 비즈는 (i) 출입을 금지하고 세포에서 제외됩니다. 과립 성 백혈구 (II)이 구분되어 있으며 lympohcytes와 단핵 세포는 3 popluations로 구분됩니다 : CD14부정적인 림프구 (3) 모든 CD14 음성 세포 (IV), 비 림프구 (V). B) CD14 부정적인 림프구는 CD4 + T 세포 (바이올렛), CD8 + T 세포 (VII), B 세포 (VIII), CD56 밝은 NK 세포 (IX), CD56 희미 NK 세포 (X) 및 CD56 부정적인 NK 세포를 구별 할 게이트 아르 (사이). C) 모든 CD14 음성 세포는 골수 양 (XII) 및 plasmacytoid (XIII) 수지상 세포를 구별 할 수 출입을 금지합니다. D) 비 lympocytes은 비 고전 (XIV), 중급 (XV), 그리고 클래식 (XVI) 단핵 세포를 구별 할 수 출입을 금지합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
그림 1 (예를 들어, NKT 세포 나 호중구)에 표시되지 않습니다보다 구체적인 셀 집합은 우리가 제시 패널을 사용하여 구별 할 수 있으며, 게이팅 스키마는 확장 또는 특정 학습 요구를 충족하도록 수정할 수 있습니다. 표시 특정 게이팅 단계는이 방법의 특징이다. 특히 메모, 포함 게이트 및제외 게이트는 Trucount 구슬 주위에 그려 서로의 상단에 위치, 계산을위한 게이트 구슬을 한, 하나는 세포 분석 (그림 1A)에서 비즈를 제외 할 수 있습니다. 사람들이 CD45 표현과 사이드 분산은 (그림 1A) 종종 필요가 있습니다를 사용하여 앞으로 분산과 측면 산란, 게이팅 셀에게이 말초 혈 mononuclear 세포에로도, 때문에 림프구, 단핵 세포, 그리고 과립 성 백혈구는 쉽게 전체 혈액에 구별되지 않습니다. CD45과 측면 분산을 사용하여 림프구와 단핵 세포 분리 할 수 없습니다 오염 과립 성 백혈구가 (원) 높은 CD16 표현 (그림 1C와 그림 1D)에 의해 일부 플롯에서 구별됩니다. 오염 과립 성 백혈구의 수는 일반적으로 작고, 그들은 단핵 세포와 NK 세포 게이팅을 방해하지 않습니다.
Access restricted. Please log in or start a trial to view this content.
토론
이 보고서에서 우리는 유동 세포 계측법에 의해 신선한 전체 혈액의 백혈구 인구를 열거위한 구슬 기반의 방법을 제시하고 중앙 샘플 분석 multicenter 임상 시험에서의 사용에 대한 매개 변수가 필요 다룹니다. 이 방법은 토대로 및 BD Trucount 프로토콜을 최적화 multicenter 임상 실험 환경에서의 신뢰성 사용할 수 있습니다. 착색 분석은 간단하다하고 가능한 혈액 처리 연구실 기술자가 수행 할 및 분석...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
우리는이 방법, 원고 및 비디오의 개발에서의 도움을 제시카 존스, 에리카 클락, 콘 스턴스 Ducar, 도나 스미스, 로이 루이스, 릴리 Apedaile, 조앤 Wiesner, 데빈 아담스, 코리 McBain와 스티븐 Voght 감사드립니다.
이 작품은 빌과 멜린다 게이츠 재단 CAVD 보조금 38,645 (MJM)와 건강 교부금의 국립 연구소 UM1 AI068618 및 AI069481 U01 (MJM)에 의해 지원되었다. EA-N. NIH 그랜트 T32 AI007140에서 지원됩니다. 우리는 그들의 관대 한 장비 기증을 위해 제임스 B. 펜들턴 자선 신탁 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약 이름 | 회사 | 카탈로그 번호 | |
| 절대 계산 튜브를 Trucount | BD Biosciences | 340334 | |
| 10X FACS는 솔루션을 Lysing | BD Biosciences | 349202 | |
| 절연 카테고리 B & 면제 운송 시스템, | SAF-T-박 | STP-320 | |
| CD45 단클론 항체 AmCyan | BD Biosciences | 339192 | |
| 3 번 CD FITC 단클론 항체 | BD Biosciences | 349201 | |
| CD8 PerCp - 사 5.5 단클론 항체 | BD Biosciences | 341051 | |
| CD4 알렉사 형석 700 단클론 antibo마구 | BD Biosciences | 557922 | |
| HLA-DR ECD 단클론 항체 | Beckman 보습 바로 앞에 달린 풀 베는 날 | IM3636 | |
| CD14 단클론 항체 v450 | BD Biosciences | 560349 | |
| CD19 PE 단클론 항체 | BD Biosciences | 555413 | |
| CD16 APC-H7 단클론 항체 | BD Biosciences | 560195 | |
| CD56 PE-Cy7 단클론 항체 | BD Biosciences | 335791 | |
| CD11c APC 단클론 항체 | BD Biosciences | 559877 | |
| CD123 PE-Cy5 단클론 항체 | BD Biosciences | 551065 |
참고문헌
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M. The handbook of Experimental Immunology. Herzenberg, L., Blackwell, C., Weir, D. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6(2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유