A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ספירה של אוכלוסיות גדולות דם היקפיות יקוציט לניסויי multicenter קליניים באמצעות Assay phenotyping דם מלא
In This Article
Summary
בדו"ח זה, אנו מדגימים את שלבי צביעה וניתוח של assay phenotyping מבוצע על כל דם טרי למנות אוכלוסיות מולד אדפטיבית עיקריות יקוציט. אנו מדגישים שיקולים לביצוע הליכים אלה בהקשר של ניסוי קליני רב מרכזי.
Abstract
Cryopreservation של לויקוציטים דם ההיקפי נמצא בשימוש נרחב לשימור תאים להערכות תגובה חיסוניות בניסויים קליניים, ומציע יתרונות רבים לנוחות וסטנדרטיזציה של הערכות חיסוניות, אך השפעות מזיקות של תהליך זה נצפה בכמה תת קבוצות של תאים, כגון גרנולוציטים, תאי B , ותאים דנדריטיים 1-3. Assaying לויקוציטים הטרי נותן תמונה מדויקת יותר של המצב בvivo של התאים, אבל לעתים קרובות קשה לביצוע בהקשר של ניסויים קליניים גדולים. מבחני תא טריים תלויים התחייבויות התנדבות ולוחות זמנים, ואם זמן רב, היישום שלהם יכול להיות מעשי בשל שעתי העבודה הנדרשות מאנשי מעבדה. בנוסף, כאשר ניסויים נערכים במרכזים מרובים, מעבדות עם המשאבים וההכשרה הדרושים כדי לבצע את המבחנים לא יכולות להיות ממוקמות בקרבה מספיקה לאתרים קליניים. כדי לטפל בבעיות אלה, יש לנו develלאומי למטרולוגיה חוקית פנל מכתים נוגדנים 11-צבע שניתן להשתמש בו עם Trucount צינורות (הקיטון דיקינסון, סן חוזה, קליפורניה) לפנוטיפ ולמנות את אוכלוסיות ליקוציט מרכזיות בתוך הדם ההיקפי, מניב מידע ספציפי תא מסוג חזק יותר ממבחנים כגון ספירת דם מלא (CBC) או מבחנים עם לוחות, זמינים מסחריים המיועדים לצינורות Trucount שמכתימים אותו רק לכמה סוגי תאים. הליך ההכתמה הוא פשוט, דורש רק 100 μl של כל דם טרי, ולוקח כ 45 דקות, מה שהופך את זה אפשרי עבור מעבדות סטנדרטיות דם לעיבוד שיש לבצע. זה מותאם מגיליון BD Trucount צינור הנתונים הטכני (גרסה 8/2010). קוקטייל הנוגדן המכתים יכול להיות מוכן מראש בכמויות גדולות במעבדת assay מרכזית ונשלח למעבדה לעיבוד באתר. צינורות מוכתמים ניתן לתקןוקפא למשלוח למעבדת הבדיקה המרכזית לניתוח cytometry זרימה ססגונית. נתונים המופקים מפנל מכתים זה יכול לשמש כדי לעקוב אחר שינויים בריכוזים ליקוציט לאורך הזמן ביחס להתערבות ויכול היה בקלות להיות מפותח יותר להעריך מצבי הפעלה של סוגי תאים ספציפיים של עניין. בדו"ח זה, אנו מדגימים את התהליך בשימוש על ידי טכנאי מעבדת דם עיבוד לבצע צביעה על כל דם טרי ואת הצעדים כדי לנתח דגימות מוכתמות אלה במעבדת assay מרכזית תומכת בניסוי קליני רב מרכזי. פרטי וידאו ההליך כפי שהוא מתבצע בהקשר של תיקו דם ניסוי קליני בחיסון ה-HIV משפטי הרשת (HVTN).
Protocol
הערה: כדי להגן על נוגדני fluorophore-מצומדות מאור, לבצע את כל השלבים בארון בטיחות ביולוגית עם האור הכבוי.
1. הכנת לוח כתמי נוגדן
- פנל מכתים הנוגדן ניתן למצוא בטבלת 1. ריכוז נוגדנים צריך להיות מוגדר על ידי טיטרציה עם כל דם ושימוש באותו הציוד ונהלים שישמשו לרכישת דגימות phenotyping המוכתמות cytometry זרימה.
- ברגע titers הצביעה המתאימה נקבעים, לשלב את כל הנוגדנים לתערובת אחת בצינור מנעול בכובע מצחיה. הוסף חיץ לשטוף זרימה (PBS של Dulbecco עם סרום 2% חום מומת עוברים מבקרים) כדי להביא את הנפח הכולל עד 100 μl. הרחב את התערובת במשך מספר הדגימות שמוכתמות. תערובת זו ניתן לאחסן ב 4 מעלות צלזיוס למשך עד שמונה שבועות.
2. הכתמה
- אם הדם שנאסף כדי לשמש למטרות אחרות במודעהdition לassay זה, קבע aliquot צד בעת שהליכים יותר רגישים לזמן מבוצעים על הדם שנותר. Aliquot ניתן לאחסן בטמפרטורת חדר עד 4 שעות לאחר venipuncture ללא אובדן תא משמעותי.
- ודא שיש שלמות חרוז גלולה בתחתית של התחתית ותווית Trucount הצינור לזהות המדגם שהוכתם. בניסויים קליניים HVTN, מערכת ניהול נתוני המעבדה (Frontier מדע וטכנולוגית קרן מחקר; אמהרסט, ניו יורק) משמשת לתייג ולעקוב אחר דגימות מוכתמות.
- רשום את מספרי מגרשים ותאריכי תפוגה של כל החומרים כימיים. רשום את מספר Trucount צינור חרוז הספירה מסופק על ידי היצרן על השקית של צינורות; לוודא שהמספר הרבה על השקית תואם למספר הרבה ברכבת התחתית.
- השתמש להפוך pipetting במדויק פיפטה μl 100 מכל הדם לתוך צינור Trucount, ממש מעליו את מקדמת המתכת. הימנע ממריחת דם למטה בצד של הצינור.
- באמצעות טכניקה רגילה (קדימה) pipetting, 100 μl פיפטה של לוח מכתים הנוגדן המעורב (ראה טבלה 1) לתוך צינור Trucount. מכסה את הצינור ומערבולת במהירות נמוכה למשך כ 15 שניות כדי לערבב. חזותי לבדוק את הצינור כדי להבטיח שחרוז הגלולה נמסה לחלוטין.
- דגירת צינור Trucount במשך 15 דקות בטמפרטורת חדר (15-30 מעלות צלזיוס) בחושך.
- אם יש צורך, מדלל aliquot של 10 × פתרון Lysing FACS ל1X באמצעות diH 2 O. הוסף 900 μl 1 × פתרון Lysing FACS לצינור.
- מכסה את הצינור ומערבולת ביסודיות במהירות נמוכה למשך כ 15 שניות כדי לערבב. דחוף את המכסה כלפי מטה בחוזקה לנעילת עמדה בצינור וחותם עם סרט מעבדה.
- אחסן את הצינור ב-65 ° C עד -95 ° C עד המדגם הוא מוכן למשלוח למעבדה המרכזית הניתוח או לניתוח בבית. דוגמאות הן יציבות בשלב זה לפחות ארבעה שבועות. אם משלוח או assaying immediately, צעד זה יכול להיות מושמט.
3. משלוח
הערה: בהנחיות הבאות לנצל מערכת משלוח מבודד מSaf-T-פאק, Inc תוכננה במיוחד עבור קטגורית חומרים ביולוגיים פטורים B משלוח בהתאם לאוויר הבינלאומי ותחבורה אגודה (IATA) תקנות. אם מנתח את הדגימות באותו המיקום כמו הכתמים התרחשו, עבור לסעיף 4.
- דוגמאות ניתן להעבירה מייד לאחר צביעה או ברגע שהם קפאו ב-65 ° C עד -95 ° C. עוטף כל צינור לחלוטין בנייר הכסף ומניח בתיבת הדגימה המוכתמת. הנח את תיבת הדגימה המוכתמת בתוך שקית פולי leakproof עם חומר סופג.
- הנח את שקית פולי leakproof והתוכן לתוך שקית Tyvek וחותם עם כאוויר קטן ככל האפשר בתיק.
- הנח את חבילת הדגימה (דגימה בתוך אריזה משנית) בתוך קופסא החומה הפנימית.
- הנח את החום הפנימי בשור בתוך חזה הקלקר, לקבע אותו בכניסה כדי למנוע תזוזה.
- מלא חזה הקלקר עם קרח יבש (כ 8 ק"ג) ומניח את המכסה בחוזקה על החזה.
- מאובטח קלטת תיבת המשלוח והספינה כחומר ביולוגי, הקטגוריה B (UN3373) עם הקרח היבש הנאות (UN1845) סימונים; לעקוב-650 PI הוראות IATA.
- עם הקבלה, דגימות נשמרות ב-65 ° C עד -95 ° C עד שהם נתחו.
4. מפשיר וניתוח זרימת cytometry
- הסר את הדגימה המוכתמת מהמקפיא להפשיר בטמפרטורת חדר בחושך לפני האיסוף על cytometer הזרימה. אם איסוף נתונים על מדגם אחד או יותר, סטנדרטיזציה של התהליך עבור כל הצינורות על ידי מדהים הפשרה כך שהצינורות לא יושבים בטמפרטורת חדר למשך יותר משעה 1 כל אחד.
- דוגמאות יש רכשה באמצעות cytometer זרימת ליזר 4 מצויד במסננים מתאימים, כגון BD LSRהשני. השתמש כיול cytometer סטנדרטי ושיטות תגמול קרינה לנתוני גבייה 4.
הערה: אין להגדיר סף פיזור פיזור או צד קדימה במהלך איסוף 5. חרוזי Trucount יכולים לרדת מתחת לסף הגדרה הנמוכה ביותר האפשרית עבור פרמטרים אלו גורמים לקבוצת משנה של חרוזים כדי לא תטופל בזמן הניתוח. אם נדרש על ידי המכשיר לקביעת סף, קבע את הסף הנמוך ביותר האפשרי Am ציאן הערוץ. בגלל CD45 + leukocytes מגואלים בפנל יהיה Am ציאן חיובי, וחרוזי Trucount גם לזרוח בAm ציאן הערוץ, זה אמור לאפשר לכל הנתונים הרלוונטיים שנאסף כראוי.
- מערבולת צינור המדגם למשך 5 שניות לפני הטעינה על cytometer הזרימה. חרוזי Trucount לזרוח מאוד בערוצים רבים. שער החרוזים במהלך איסוף על ידי מציאת האוכלוסייה, כי הוא מאוד כפול חיובי עבור PE Cy5 וAPC (2 קולוRS שרוב להבחין בקלות את החרוזים מהתאים עשוי להשתנות בהתאם למכשור). בחר את שער החרוז כשער העצירה שלך, ונתוני שיא לפחות עד 20,000 חרוזים הם נרכשים.
- נתח את הנתונים באמצעות תוכנה מתאימה, כגון FlowJo (Treestar; אשלנד, או). איור 1 מציג את ערכת gating מנוצלת לניתוח של אוכלוסיות שונות ליקוציט מתיקו דם שליטת נציג.
5. חישובי Trucount
- כל שפופרת מכילה Trucount גלולת lyophilized של חרוזי ניאון. לאחר הוספת נוזל לצינור וvortexing, החרוזים צריכים להיות מופצים באופן שווה בכל המדגם. מספר החרוזים בגלולה משתנה במקצת על ידי מספר רב וניתן למצוא בשקית האחסון לצינורות.
- שער חרוזי Trucount ואוכלוסיות תאים כפי שמוצג באיור 1 כדי לקבוע ספירות אירוע לכל אוכלוסייה. השוואת מספר האירועים אניn שער החרוז למספר הכולל של חרוזים במקור בצינור יאפשר לך לקבוע את יחס הדגימה שנאספה, אשר לאחר מכן ניתן להשתמש כדי לקבוע את הריכוז המוחלט (כלומר, תאים / μl) לכל אוכלוסייה. המשוואה הבאה יכולה לשמש למטרה זו: = [אירועים # / אוכלוסייה (אירועים # # / חרוזי חרוזים כלל בגלולה)] / 100 μl ריכוז תאים (תאים # / כל דם μl).
6. נציג תוצאות
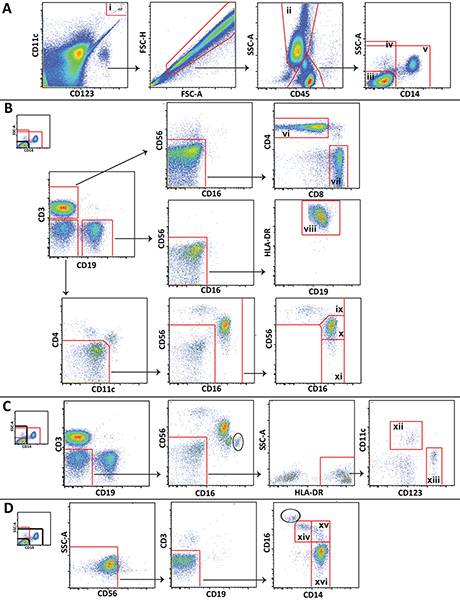
איור 1. ערכת gating מנוצלת לניתוח של אוכלוסיות גדולות ליקוציט מראים נתונים מייצגים מן מתנדב בריא. ) חרוזי Trucount (i) הם מגודרים והוצא מתאים. גרנולוציטים (ii) מסומנים וlympohcytes ומונוציטים מחולקים 3 popluations: CD14הלימפוציטים שליליים (ג), כל התאים CD14 השליליים (ד), ושאינו לימפוציטים (v). B) CD14 ימפוציטים שליליים הם מגודרים להבחין CD4 + תאי T (vi), CD8 + תאי T (ז), תאי B (ח), CD56 תאי NK בהירים (לט), CD56 תאי NK עמומים (X), וCD56 תאי NK שליליים (יא). ג) כל התאים CD14 השליליים הם מגודרים להבחין מיאלואידית (יב) ו( XIII) תאי דנדריטים plasmacytoid. D)-lympocytes עישון הנו מגודרים להבחין (XIV), ביניים (XV), וקלסיים מונוציטים הלא קלסיים (XVI). לחץ כאן לצפייה בדמות גדולה.
תת תא ספציפי יותר שאינם מוצגים באיור 1 (לדוגמה, תאים או נויטרופילים NKT) גם ניתן להבחין באמצעות לוח אנו מציגים, וערכת gating ניתן להרחיב או שונה כדי לענות על צרכי הלימוד ספציפיים. צעדי gating מסוימים המוצגים הם ייחודיים לשיטה זו. שים לב במיוחד, שער והכללהשער הדרה נמשך סביב חרוזי Trucount ומונח על גבי זה, אחד לשער החרוזים לספירה, ואחד שלא לכלול את החרוזים מהניתוח הסלולרי (איור 1 א). כמו כן, משום לימפוציטים, מונוציטים וגרנולוציטים לא הבחינו בקלות בדם כולו כפי שהם בתאי דם היקפיים mononuclear ידי פיזור קדימה וצד פיזור, gating התאים האלה באמצעות CD45 ביטוי ופיזור צד לעתים קרובות יש צורך (איור 1 א). גרנולוציטים מזהמים (מוקף בעיגול) שלא יכול להיות מופרד מלימפוציטים ומונוציטים באמצעות CD45 ופיזור צד ניתן להבחין בחלקות מסוימות על ידי CD16 הביטוי הגבוה שלהם (התרשים 1C ו1D איור). מספר גרנולוציטים מזהמים הוא בדרך כלל קטן, והם לא מפריעים לgating התא monocyte ונ"ק.
Access restricted. Please log in or start a trial to view this content.
Discussion
בדו"ח זה, אנו מציגים שיטת חרוז מבוססת על ספירת אוכלוסיות שלמות ליקוציט בדם טרי על ידי cytometry זרימה ולכסות את הפרמטרים דרושים לשימוש בו בניסוי קליני רב מרכזי בניתוח מדגם ריכוזי. שיטה זו מתבססת על ומייעלת את פרוטוקול Trucount BD ומאפשר השימוש האמין שלה בהגדרת ניסוי רב מרכז?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
אנו מודים ג'סיקה ג'ונס, אריקה קלארק, קונסטנס Ducar, דון סמית, רוי לואיס, לילי Apedaile, ג'ואן ויזנר, דווין אדאמס, הקורים McBain וסטיבן Voght על עזר בפיתוח של שיטה, וכתב יד בסרטון זה.
עבודה זו נתמכה על ידי קרן ביל ומלינדה גייטס CAVD מענק 38645 (MJM) ומכונים הלאומיים לבריאות מענקי UM1 AI068618 וU01 AI069481 (MJM). EA-N. הוא נתמך על ידי NIH גרנט T32 AI007140. אנו מודים לקרן ג'יימס ב 'פנדלטון צדקה לתרומת ציודם הנדיבה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגים | |
| Trucount צינורות ספירה מוחלטים | BD Biosciences | 340334 | |
| FACS 10X Lysing פתרון | BD Biosciences | 349202 | |
| הקטגוריה B & מערכת משלוח פטורה, מבודדים | Saf-T-Pak | STP-320 | |
| נוגדן חד שבטי CD45 AmCyan | BD Biosciences | 339192 | |
| נוגדן חד שבטי CD3 FITC | BD Biosciences | 349201 | |
| CD8 PerCp-סיי 5.5 נוגדן חד שבטי | BD Biosciences | 341051 | |
| CD4 Alexa פלואוריד 700 antibo חד שבטיdy | BD Biosciences | 557922 | |
| נוגדן חד שבטי HLA-DR ECD | Beckman Coulter | IM3636 | |
| CD14 v450 נוגדן חד שבטי | BD Biosciences | 560349 | |
| נוגדן חד שבטי CD19 PE | BD Biosciences | 555413 | |
| APC-CD16 H7 נוגדן חד שבטי | BD Biosciences | 560195 | |
| PE-CD56 Cy7 נוגדן חד שבטי | BD Biosciences | 335791 | |
| CD11c APC נוגדנים חד שבטיים | BD Biosciences | 559877 | |
| PE-Cy5 נוגדן חד שבטי CD123 | BD Biosciences | 551065 |
References
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M. The handbook of Experimental Immunology. Herzenberg, L., Blackwell, C., Weir, D. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6(2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved