A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تجميع وتشغيل نيون الأساسية للاستشعار عن Microcavities Refractometric
In This Article
Summary
أجهزة الاستشعار microcavity الفلورسنت النواة توظيف عالية مؤشر الكم دوت الطلاء في قناة microcapillaries السيليكا. التغيرات في معامل الانكسار من السوائل ضخها في قضية قناة الشعرية تحولات في microcavity الطيف مضان التي يمكن استخدامها لتحليل المتوسطة القناة.
Abstract
هذه الورقة تناقش الفلورسنت الأساسية المستندة إلى الاستشعار microcavity التي يمكن أن تعمل في إعداد تحليل ميكروفلويديك. وتستند هذه الهياكل على تشكيل طلاء الفلورسنت (QD) الكم نقطة على سطح القناة لmicrocapillary التقليدية. QDs السيليكون هي جاذبية خاصة لهذا التطبيق، ويرجع ذلك جزئيا إلى سميتها ضئيلة مقارنة II-VI وQDs مجمع II-VI، والتي يتم التحكم تشريعيا المواد في العديد من البلدان. في حين أن طيف الانبعاث الفرقة واسع وملامح، فيلم سي QD على الحائط قناة ملامح الشعرية مجموعة من القمم، وشارب ضيقة في الطيف مضان، المقابلة لالأصداء الكهرومغناطيسية للضوء محاصرين داخل الفيلم. الطول الموجي ذروة هذه الأصداء حساسة إلى متوسطة الخارجية، مما يسمح الجهاز ليعمل كجهاز استشعار refractometric التي لا تأتي أبدا QDs في اتصال جسدي مع الحليلة. التجريبيةوتناقش الأساليب المرتبطة تلفيق من microcapillaries الفلورسنت الأساسية بالتفصيل، وكذلك أساليب التحليل. وأخيرا، يتم إجراء مقارنة بين هذه الهياكل وأكثر على نطاق واسع التحقيق السائل الأساسية مرنانات حلقة البصرية، من حيث القدرات ميكروفلويديك الاستشعار عن بعد.
Introduction
يمكن الكيميائية أنظمة الاستشعار التي تتطلب كميات عينة صغيرة فقط والتي يمكن إدراجها في الأجهزة المحمولة باليد أو حقل قابلة للتشغيل-يؤدي إلى تطوير مجموعة واسعة من التكنولوجيات الجديدة. يمكن أن تشمل هذه التكنولوجيات التشخيص الميداني للأمراض والعوامل الممرضة، 1 الملوثات البيئية و 2 و سلامة الأغذية. وتمثل 3 في عدة تكنولوجيات استكشاف بنشاط عن أجهزة استشعار كيميائية ميكروفلويديك، مع الأجهزة القائمة على فيزياء الرنين مأكل السطحية (SPR) بين الأكثر تقدما. (4) هذه هي أجهزة الاستشعار الآن قادرة على اكتشاف الجزيئات الحيوية محددة كثيرة وحققت نجاحا تجاريا، على الرغم أساسا معدات المختبرات على نطاق أوسع .. 5
في السنوات الأخيرة، وارتفعت microcavities البصرية للتنافس مع SPR النظم القائمة. يمكن أن تكون حساسة بشكل مثير للدهشة Microcavities، مع إظهار القدرة على اكتشاف الفيروسات واحد 6 و ربما حتى الجزيئات الحيوية واحد 7 (هذا الأخير لا يزال موضوع بعض الجدل، 8 ولكن ليس هناك شك في أن حدود الكشف الشامل صغيرة هي 9). في microcavities، وآلية الكشف يعتمد على التغييرات في الأصداء البصرية الناجمة عن وجود الحليلة داخل الملف المجال الكهربائي للصدى. عادة، سوف تعطى الحليلة يسبب صدى للتغيير في وتيرة المركزية، والرؤية، أو linewidth. كما هو الحال مع أنظمة SPR، يمكن microcavities بمثابة المجسات غير محددة refractometric، أو أجهزة الاستشعار functionalized لتحليل محددة.
وتتميز المجهرية عازلة مع قطاع عريض دائري (مثل المجهرية، والأقراص، أو اسطوانات) من الأصداء كهرومغناطيسية تعرف باسم وسائط معرض يهمس، أو WGMs، وهو مصطلح يعود تاريخها إلى التحقيقات الرب رايليغ من الآثار الصوتية مشابهة 10 أساسا، وهو WGM البصرية عندما يحدث موجة يبحر عبر التعميم قection من الانعكاس الداخلي الكامل، والعودة إلى نقطة البداية في المرحلة. ويتضح مثال بالرنين الكهرومغناطيسي لالمكروية السيليكا في الشكل 1A. ويتميز هذا صدى من جانب واحد كحد أقصى في الاتجاه شعاعي (ن = 1)، في حين أن ما مجموعه 53 موجات تناسب جميع أنحاء خط الاستواء (ل = 53)، وتظهر فقط بعض منها. الجزء زائل من شدة الحقل يمتد إلى خارج حدود المتوسطة المجال، وبالتالي في WGM المكروية يمكن الشعور الوسط الخارجي.
الشعيرات الدموية هي مثال للاهتمام خاصة من جهاز استشعار WGM مقرا لها. يمكن في WGMs، الشعرية أسطواني حول تشكيل التعميم عبر الفرع، على غرار الحال بالنسبة للكرة. إذا كان الجدار الشعرية رقيقة جدا، وهي جزء من المجال الكهرومغناطيسي يمتد إلى القناة الشعرية (1B الشكل). وهكذا، يمكن أن تكون الشعرية جهاز استشعار لميكروفلويديك analytes حقنها في القناة. هذا هو بأسيس من عمل عصابة الأساسية البصرية مرنان السائل (LCORR) 11 LCORRs تعتمد على توصيل زائل الضوء من مصدر ليزر بدقة tuneable للتحقيق في WGMs. جانبا هاما من LCORR هو أن جدران الشعيرات الدموية يجب أن تكون رقيقة (~ 1 ميكرومتر) للتأكد من أن عينات وضع وسيلة القناة. هذا يضع بعض الصعوبات في تصنيع ويسبب لها أن تكون هشة ميكانيكيا.
في عملنا، وضعنا هيكل بديل نسميه microcavity الأساسية الفلورسنت (FCM). 12،13 لتشكيل FCM، ونحن معطف الجدران قناة لشعري مع fluorophore عالية الانكسار فهرس (على وجه التحديد، طبقة من أكسيد السيليكون جزءا لا يتجزأ من نقاط الكم). مطلوب من ارتفاع الرقم القياسي للفيلم لحصر الإشعاعات المنبعثة، مما يساعد على بناء حتى WGMs (الشكل 1C). وعلى النقيض من LCORR، في وسائط FCM تظهر ماكسيما حاد في الطيف مضان المنبعثة. السماكة منفيلم مهم للغاية، وإذا كان سميكا جدا في WGM لا تذوق المتوسطة في القناة الشعرية، وإذا كانت رقيقة جدا يتم فقدان الحبس البصرية وWGMs تصبح ضعيفة. وهكذا، فإن تلفيق من FCM هي عملية صعبة، تتطلب إعداد دقيق. هذا هو الموضوع الرئيسي لهذه الورقة.
Protocol
1. إعداد مواد
- Microcapillaries الحصول على الشعيرات الدموية السيليكا من مورد التجارية. نقوم بشراء الشعيرات الدموية لدينا من تقنيات Polymicro. اختيار قطر الصغيرة الداخلية (~ 25 حتي 30 ميكرون) لالأصداء الطيفية أكثر على نطاق واسع فصل (أي أكبر المدى الطيفي مجانا) أو أكبر قطرها الداخلي (~ 100 ميكرون) لالأصداء بشكل وثيق مع العوامل متباعدة جودة أعلى. A كبيرة قطرها الخارجي يضمن FCMs هي دائمة والتلاعب بها بسهولة.
- الشعيرات الدموية تأتي مع سترة بوليميد الملونة، والتي لا بد أولا من إزالة. قطع ما يقرب من 10 قطعة من سم شعري من لفة، وذلك باستخدام الألياف الساطور الماس. كل قطعة تشكل عينة واحدة. تسخين هذه في فرن أنبوب في C ° 650 للساعة واحدة في الأكسجين لحرق الطلاء. هذه العملية يزيل المواد سترة، ويعرض السيليكا الشعرية في الداخل. بعد التبريد إلى درجة حرارة الغرفة، وإزالة capillariوفاق من القارب التدفئة.
- وتفيد التقارير الهيدروجين الهيدروجين حلول silsesquioxane silsesquioxane (HSQ) لتتكون من 12 H 8 جزيئات سي 12 O مع بنية تشبه القفص. 14 هذه المواد متاحة تجاريا من داو كورنينج. شراء HSQ في واحدة من سلسلة فوكس والخمسين (أكسيد flowable) الحلول، مثل الثعلب-15. هذه الحلول مكلفة ولها مدة صلاحية محدودة، لذلك هناك حاجة إلى تخطيط دقيق. تبخر المذيب MIBK يوفر تركيز HSQ ما يقرب من 18٪ من وزنها. إذا كان تركيز HSQ منخفض جدا، قد لا تشكل نقاط الكم في الفيلم. إذا كان مرتفع جدا، قد تكون سميكة جدا الأفلام وdelaminate من سطح القناة الشعرية. في تجربتنا، لشعري يبلغ قطرها ميكرون 25-30 الداخلية، وإيجاد حل فوكس تحتوي على ~ 25 وزن٪ HSQ هو أفضل. وهكذا، قد يكون من الضروري لتتبخر المذيبات أو إضافة المزيد HSQ (التأكد من أن يجف) من أجل ضبطالتركيز. ما إذا كان تخفيف أو تركيز ضروري من الصعب تحديد من دون محاكمة والخطأ، أي جعل بعض العينات ودراسة النتائج، كما هو مبين أدناه.
2. تلفيق من الشعيرات الدموية المغلفة
- ملء الشعرية خذ قطعة من الشعرية أعدت في الخطوة 1.1 و تراجع لهم في حل فوكس. عندما انخفض شعري في الحل، يجب أن تكون قادرة على متابعة رؤية السطح المحدب في القناة وكما يوجه الحل في (الشكل 2A) الشعرية.
- عندما تصل إلى أعلى السطح المحدب، وإزالة الشعيرات الدموية وضعها في بوتقة من الزجاج الصلب. وينبغي الآن أن يكون شغلها تماما مع الحل فوكس. كرر هذا لكعينات عدد ممكن، لزيادة فرص النجاح. ونحن عادة تشغيل دفعات من 20-30 واستخدام اثنين من تركيزات مختلفة من الحلول HSQ من حيث الوزن. ملأنا الشعيرات الدموية في الهواء، ولكن حفظ رانه من المستحسن فوكس حل برود في صندوق قفازات إذا كان ذلك ممكنا، من أجل تقليل التعرض للحل لبخار الماء والأوكسجين. يمكن التعرض حتى الصغيرة يؤدي إلى الهلام من الحل.
- يصلب الصلب الشعيرات الدموية في عملية المرحلة الثانية. الصلب يتبخر المذيب وينهار الهيكل قفص HSQ، وتشكيل فيلم X شافي التمسك جدران القناة. الصلب عند ارتفاع درجات الحرارة disproportionates الفيلم X شافي في نقاط الكم سي الموزعة في مصفوفة السيليكا. وتشمل الخطوات الصلب منحدر 30 دقيقة بالسيارة من درجة حرارة الغرفة إلى 300 ° C، ويسكن لمدة 3 ساعة حتى يتبخر المذيب، ثم منحدر إلى 1،100 ° C في 45 دقيقة، ويسكن لمدة ساعة لترسيب QDs.
- السماح للالشعيرات الدموية ببطء باردة (~ 12 ساعة) العودة إلى درجة حرارة الغرفة. وهذا يساعد على تقليل الإجهاد ذات الصلة تكسير للفيلم تترسب على جدار الشعيرات الدموية. البروتوكولات الأخرى الصلب يمكنربما ينبغي اتباعها، وربما تكون أكثر موثوقية، ولكن ارتفاع درجة الحرارة. يصلب في المرحلة 1،000-1،100 ° C الضروري دائما لتشكيل QDs في نهاية هذه الخطوة، ينبغي للمرء أن (أمل) لديها 20-30 الشعيرات الدموية بطبقة من QDs الفلورسنت المدمجة في السيليكا طلاء الجدران المصفوفة القناة.
3. وصف
- عينة فحص المجهر مضان التي تقام على الشعيرات الدموية يجب تنفيذ كل من التصوير والتحليل الطيفي في نطاق الطول الموجي 700-900 نانومتر. الاجهزة Epifluorescence أو مبائر هي مناسبة لهذا الغرض. وضع صف من الشعيرات الدموية مرشح على المسرح بحيث أنه من السهل للتنقل بين منهم لتحليلها البصرية سريعة (الشكل 2B). تثير الشعرية مع الإشعاع الأزرق أو الأشعة فوق البنفسجية سواء في المساحة الحرة على المسرح المجهر، أو مباشرة من خلال عدسة الهدف باستخدام فلتر مزدوج اللون، ومراقبة صورة مضان باستخدام العدساتأو كاميرا اللون.
- مراقبة مضان الشعرية. إذا كانت ناجحة تلفيق، فإن الشعيرات الدموية تظهر ومضان أحمر. هذا هو أول مؤشر لعينة مواتية. الشعيرات الدموية العارضة البرتقالي والأصفر مضان (بدلا من اللون الأحمر المرتبطة QDs) في العام ليست لديهم الخصائص المطلوبة البصرية. هذه العينات تميل أيضا إلى تشكيل كثير من الأحيان في الحلول مع التركيز على HSQ منخفضة. قد يكون بعض الشعيرات الدموية لا تظهر أي مضان على الإطلاق، وفي هذه الحالة الفيلم QD لا تشكل ويمكن تجاهل الشعرية (زجاج الأدوات الحادة). هذا هو إشارة إلى أن الحل قد لا وقد وضعت في شعري، أو أنه قد يكون من نقص في HSQ. وأخيرا، قد تظهر بعض العينات فيلم متصدع أو محكم، ويمكن أيضا أن تكون هذه نبذها.
- تجاهل جميع العينات المذكورة في الخطوة السابقة باستثناء تلك التي تظهر مشرقة مميزة مضان أحمر من QDs السيليكون.
- تحقق من وجود أطياف WGMs في مضان تأكد من محاذاة الصورة على النحو المرغوب فيه على شق مدخل مطياف وجمع طائفة ومضان. ضبط الوقت وذلك لجمع إنتاج مقبولة إشارة إلى نسبة الضوضاء. أداء الطول الموجي وشدة المعايرة كما هو مطلوب. يجب أن تكون مكثفة أطياف QD في نطاق الطول الموجي 700 حتي 900 نانومتر. يجب الأطياف المأخوذة من المنطقة المقابلة لجدار الشعيرات الدموية الداخلية تظهر التذبذبات القوية بسبب وجود وسائط يهمس معرض أسطواني (WGMs)، وهذا هو الشرط الثاني إلى مشاركة من أجهزة الاستشعار لrefractometric ناجحة.
- بعض العينات قد يكون لامع مضان أحمر ولكن التذبذبات QD WGM نقص في الطيف. هذا هو إشارة إلى الفيلم QD متصدع أو delaminated من الجدار الشعرية، التي تقضي على الأصداء البصرية. تجاهل الشعيرات الدموية دون WGMs. عند هذه النقطة، فقط (SMA عادةليرة لبنانية) جزء من العينات التي تلبي متطلبات استشعار لا تزال قائمة. هناك واحد الاختبار النهائي التي يتعين القيام بها.
- تحليل Refractometric إرفاق الشعيرات الدموية لمرشح البولي ايثلين وtygon، تفلون، أو أنابيب أخرى متوافقة كيميائيا مع حلول الحليلة المقصود الذي ينبغي أن يكون قطرها الداخلي أكبر قليلا من قطر الخارجي الشعرية. وينبغي أن يتم اختيار أنابيب حتى لا تتفاعل مع الحلول التي يمكن ضخها في شعري.
- استخدام مادة لاصقة جيدة لتوصيل الزجاج الشعرية إلى أنابيب، وإلا واجهة الشعرية، أنابيب وتسرب. لدينا نجاح جيدة بشكل معقول باستخدام نورلاند NOA-76 أو هلام لاصق التميمة الفورية. اختيار الغراء يعتمد على تمسكها الزجاج الشعرية وأنابيب، وعدم وجود رد فعل مع سوائل القناة. استخدام الرعاية لمنع تسرب لاصقة من في القناة الشعرية ومنع ذلك.
- واجهة الأنبوبعبر حقنة لنظام micropumping. ويمكن استخدام مركبات مع مؤشرات الانكسار المعروفة مثل الميثانول والايثانول والمياه لتحديد حساسية refractometric للجهاز. هذا هو الاختبار النهائي لاستشعار ناجحة. ضخ السوائل كل واحد في وقت واحد، في الشعرية، والتأكد من عدم انفجار لاصقة ختم بين الشعرية وأنابيب و(الشكل 2C).
- جمع أطياف مع كل السائل داخل الشعيرات الدموية. استخدام محلل في مسار ضوء التمييز بين TE-الاستقطاب WGMs (الموازية لمحلل الشعرية محور) وTM-الاستقطاب WGMs (عمودي محلل لمحور الشعرية). يجب أن يكون هناك تحول في الطول الموجي للالأصداء WGM، إما TE أو TM، مع كل حل مختلف في شعري. إذا لم يكن هناك تحول ملاحظتها، والفيلم الكم دوت سميكة جدا وWGMs لا تذوق بما فيه الكفاية المتوسطة القناة. في عينات ناجحة نلاحظ الحساسيات عادة ما بين 5 و 15 نانومترفي حل وحدة معامل الانكسار (RIU). تقريبا جميع العينات التي لا تظهر WGMs يبرهن على وجود حساسية قابلة للقياس، ولكن فقط عادة جزء صغير من المعدة سوف تظهر الشعيرات الدموية WGMs.
4. تحليل البيانات
- الحصول على أطياف الطيف مضان خذ من مضان من عينتك. لتطبيقات biosensing، سطح القناة لديها أول من functionalized لanalytes محددة. سطح الفيلم هو السيليكا أساسا QD، لذلك العديد من وصفات تعديل سطح الوجود. بغض النظر عن التطبيق، والخطوة الأخيرة هي معالجة البيانات وتحليلها.
- تحقيق حدود الكشف منخفضة يتطلب قياس الطيفي الصغيرة التحولات-مثالي "القرار تحول" يجب أن يكون أصغر بكثير من القرار مطياف الاسمية أو الملعب. يجب الحرص في معالجة الطيفية ونتيجة لهذا. على وجه الخصوص، على مطياف التصوير العديد منقد لا يكون هذا الطيف المتوقع أفقيا تماما على اتفاقية مكافحة التصحر، وبالتالي إذا، بين التحليلات، وصورة عينة الانجرافات عموديا على فتحة، ويمكن الحصول على التحولات الطيفية كاذبة. استعمال أي وسيلة ضرورية لضمان أن لا يحدث هذا، على سبيل المثال استخدام المعايرة القياسية لتحديد زاوية من الطيف المتوقعة وتصحيح لذلك، والحد من الانجراف العينة، وضمان أن يتم استخدام نفس بكسل CCD للحصول على كافة الأطياف .
يظهر صورة طيفية سبيل المثال في الشكل 3، حيث تظهر أنماط التذبذبات القوية في مواقع الجدران المقابلة لقناة. استخدام رمز الكمبيوتر الرياضيات (أو ما يفضل مجموعتك) لاستيراد الصور الطيفية، خرج البيانات الطيفية 1D، وأداء منحنى المناسب وتحليل فورييه للتحولات WGM، كما هو موضح أدناه.
- تحقيق حدود الكشف منخفضة يتطلب قياس الطيفي الصغيرة التحولات-مثالي "القرار تحول" يجب أن يكون أصغر بكثير من القرار مطياف الاسمية أو الملعب. يجب الحرص في معالجة الطيفية ونتيجة لهذا. على وجه الخصوص، على مطياف التصوير العديد منقد لا يكون هذا الطيف المتوقع أفقيا تماما على اتفاقية مكافحة التصحر، وبالتالي إذا، بين التحليلات، وصورة عينة الانجرافات عموديا على فتحة، ويمكن الحصول على التحولات الطيفية كاذبة. استعمال أي وسيلة ضرورية لضمان أن لا يحدث هذا، على سبيل المثال استخدام المعايرة القياسية لتحديد زاوية من الطيف المتوقعة وتصحيح لذلك، والحد من الانجراف العينة، وضمان أن يتم استخدام نفس بكسل CCD للحصول على كافة الأطياف .
- منحنى المناسب تحديد الطول الموجي الذروة لقياس التحولات WGM الطيفية الصغيرة بسبب analytes طن القناة FCM. تناسب طريقة واحدة لوظيفة يصف الشكل الطيفي - وهذا هو وسيلة شائعة للحصول على موقف الذروة. في الحالة المثالية، فإن ذلك لن يكون وظيفة Lorentzian (مع تحويل السليم من الطول الموجي للوحدات عن طريق التردد δλ = │-cδf / F 2 │ حيث c هي سرعة الضوء):
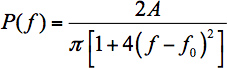
في المعادلة. 1، A معلمة والتحجيم و 0 هو التردد المركزي. للأسف، ليست FCMs الحالة المثالية.- في تجاويف أسطواني وانحرف نحو WGMs ترددات أعلى، وذلك بسبب المرجح أن تطوير الأصداء المتصاعد (WGMs مع عنصر غير صفرية المحوري للwavevector) 15 Lorentzian يناسب أداء ضعيفا ولذلك لتحديد موقف الذروة. للأسف، لا توجد وظيفة السوف تناسب في توزيع Lorentzians متداخلة من WGMs المتصاعد. في العمل السابقة 16 اقترحنا أن الانحراف Lorentzian 17 سوف تعطي أفضل مناسبا:

هنا، ألف وباء وانحراف المعلمات. كما يمكن أن يرى في الشكل 4، المعادلة. 2 هل تعطي اكثر ملاءمة لبيانات من المعادلة. 1، ولكن للأسف ليس لديها أي أساس المادية في نظرية WGMs.
- في تجاويف أسطواني وانحرف نحو WGMs ترددات أعلى، وذلك بسبب المرجح أن تطوير الأصداء المتصاعد (WGMs مع عنصر غير صفرية المحوري للwavevector) 15 Lorentzian يناسب أداء ضعيفا ولذلك لتحديد موقف الذروة. للأسف، لا توجد وظيفة السوف تناسب في توزيع Lorentzians متداخلة من WGMs المتصاعد. في العمل السابقة 16 اقترحنا أن الانحراف Lorentzian 17 سوف تعطي أفضل مناسبا:
- تحليل فورييه التحول بدلا من ذلك، يمكن معالجة البيانات باستخدام تحويل فورييه المنفصل، والتحولات قياس مرحلة المقابلة من الطيف فورييه. هذه الطريقة يستفيد من وتيرة من الطيف كله، بدلا من استخدام واحد WGM التعسفي. لا قياس الطول الموجي موقف الذروة، ولكن بدلا من ذلك يقيس تحول عاممن طائفة معينة WGM فيما يتعلق بجريمة من الطيف إشارة التعسفي.
- استخدام Δφ فرق الطور للمكون فورييه عالية الطاقة الذي يتوافق مع التذبذب WGM الرئيسية الطيفية للحصول على التحول الطيفي. هذا يتوافق مع تحول WGM الحقيقية تردد:
δf = Δφ (و ماكس - و دقيقة) / (2πk)،
حيث و Min و Max و هي الحد الأدنى والحد الأقصى تردد في الأطياف. ومع ذلك، يمكن التخلص منها الكثير من المعلومات فقط إذا تم استخدام العنصر الرئيسي؛ بالإضافة إلى ذلك، اقتطاع القضايا قد يجعل من الصعب تحديد أي مكون واحد هو الرئيسي. في كثير من الأحيان، فإن أفضل النتائج تتطلب بعض التجربة والخطأ على النحو الذي فورييه لتحديد مكونات. - نظرية التحول بدلا من ذلك يستخدم كافة المكونات فورييه. وفقا لذلك، لتحول الخالص، يتم إزاحة كل مكون على حدة تتناسب مع ك (ك معيجري عدد مكون). وبعبارة أخرى، ك = δφ عضو الكنيست، حيث التناسب م هو قياس التحول الحقيقي. ويرد بذلك تحول مجموع تكرار حسب:
δf = م (و ماكس - و دقيقة) / (2π).
هذا يتطلب م الحصول عليها من نوبة الخطية إلى الاختلافات المرحلة ΔΦ ك لبعض أو كل مكونات فورييه. - لبيانات حقيقية، والعلاقة الخطية سوف ΔΦ ك = MK يكون عدم اليقين بسبب إشارة الضوضاء الخلفية والتي يمكن أن يكون لها تأثير كبير في مكونات فورييه الطاقة المنخفضة. وبالتالي، فإننا نوصي نوبة المرجح الخطية، التي وزن كل مكون ليتناسب مع قوتها، من أجل الحصول على منحدر مقابل ك ΔΦ ك الرسم البياني. ويمكن تصفية الطيف حول العنصر الرئيسي قبل تركيب، لإزالة كل الترددات العالية (نسور) وانخفاض الترددات (فكت مضان الخلفية). وتيرة التحولات من المعادلة. ثم يتم تحويل 4 في وحدة الطول الموجي.
- على عكس الحال بالنسبة للمنحنى المناسب، يتم أبدا الحصول على WGM "الطول الموجي"، ولكن بدلا من ذلك يتم قياس التحول الطول الموجي خلال مجموعة كاملة فيما يتعلق بجريمة من الطيف إشارة التعسفي. ثم يتم تكرار هذا الإجراء لليتم تحليلها كل الطيف. الخطوات لهذا الإجراء على النحو التالي:
- تحويل إلى وحدات أطياف التردد لضمان ثابت المدى الطيفي مجانا.
- اختيار مجموعة البيانات المرجعية (أي أول الطيف مضان WGM) التي سيتم قياسها جميع التحولات.
- أقحم أطياف موحدة للحصول على تباعد التردد 18
- إجراء المنفصلة تحويل فورييه للحصول على مكونات السلطة ومرحلة من كل الطيف.
- العثور على الاختلافات المرحلة لجميع المكونات ك من WGM نظراالطيف الذي هو المطلوب قيمة التحول، فيما يتعلق الطيف المرجعي.
- العثور على مرحلة التحول باستخدام فرق الطور إما المكون الرئيسي فورييه فقط، أو نوبة المرجح الخطية إلى المكونات المحددة. وسوف يعطي هذا δf مرحلة التحول أو δλ بين الطيف WGM وطيف الإشارة.
- ويمكن قياس الأخطاء في التحولات الطيفية (حد الكشف) عن طريق جمع أطياف المتكررة لنفس الحليلة. ويمكن الحصول على حالة عدم اليقين في حساسية من الخطأ في تناسب خطي المرجح، إذا تم استخدام مكونات متعددة.
- استخدام Δφ فرق الطور للمكون فورييه عالية الطاقة الذي يتوافق مع التذبذب WGM الرئيسية الطيفية للحصول على التحول الطيفي. هذا يتوافق مع تحول WGM الحقيقية تردد:
كرر الخطوات من 1-7 لكل تحليل. بينما هذا الإجراء يبدو معقدا، بعد تنفيذ الإجراء الأولي بسيط لأتمتة، بحيث مجموعات كبيرة من البيانات يمكن أن تكون دفعة للعثور على معالجة التحولات. نستخدم الرياضيات رمز مكتوبة خصيصا للص هذا الإجراء، بحيث كاملة مجموعات البيانات يمكن أن تكون دفعة معالجة "مع الضغط على زر". من حيث المبدأ، يمكن للتحولات الطيفية حتى تحسب "لايف"، على الرغم من أننا لم تفعل هذا حتى الان.
النتائج
يمكن الانحرافات الصغيرة في الإجراء تلفيق الشعرية تؤدي إلى تغييرات كبيرة في عينة معدل النجاح. في الشكل 5 (م)، وتبين لنا أمثلة ممثل الشعيرات الدموية وكذلك فشلت واحدة ناجحة. عموما، وإشارة مرئية من عينة الناجح هو مضان أحمر جنبا إلى جنب مع كثافة عالية في جدران الش?...
Discussion
ويمكن استخدام الفلورسنت الأساسية microcavities وأجهزة الاستشعار refractometric. في حين أن هناك أمثلة معزولة من microtubes "طوى" التي يمكن أن تكون بمثابة أجهزة استشعار ميكروفلويديك، 22 مقارنة microtubes، وسوف يكون من الأسهل الشعيرات الدموية على الاندماج في الاجهزة ميكروفلويديك ?...
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
وقد تم تمويل هذا البحث من قبل NSERC، كندا.
Materials
| Name | Company | Catalog Number | Comments |
| جدول المواد | شركة | كتالوج # | تعليقات |
| السيليكا microcapillaries | |||
| مرنة أنابيب microbore | البولي ايثلين وtygon، الخ | ||
| لاصق | التميمة، نورلاند NOA | ||
| HSQ الذائبة في MIBK | على سبيل المثال، فوكس-15 | ||
| الميثانول | |||
| الإيثانول | |||
| الماء المقطر |
الجدول 1. قائمة المواد المستخدمة.
References
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic Systems for Pathogen Sensing. A Review. Sensors. 9, 4804-4823 (2009).
- Jokerst, J. J., Emory, J. M., Henry, C. S. Advances in microfluidics for environmental analysis. Analyst. 137, 24-34 (2012).
- Neethirajan, N., Kobayashi, K., et al. Microfluidics for food, agriculture and biosystems industries. Lab on a Chip. 11, 1574-1586 (2011).
- Amarie, D., Alileche, A., et al. Microfluidic Devices Integrating Microcavity Surface-Plasmon-Resonance Sensors: Glucose Oxidase Binding-Activity Detection. Analytical Chemistry. 82, 343-352 (2010).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering-gallery mode. PNAS. 105, 20701-20704 (2008).
- Armani, A. M., Kulkarni, R. P., et al. Single-Molecule Detection with Optical Microcavities. Science. 317, 783-787 (2007).
- Arnold, S., Shopova, I., Holler, S. Whispering gallery mode bio-sensor for label-free detection of single molecules: thermo-optic vs. reactive mechanism. Optics Express. 18, 281-287 (2009).
- Vollmer, F., Braun, D., et al. Protein detection by optical shift of a resonant microcavity. Applied Physics Letters. 80, 4057-4059 (2002).
- Rayleigh, L. The problem of the whispering gallery. Philosophical Magazine. 20, 115-120 (1910).
- White, I. M., Oveys, H., Fan, X. Liquid-core optical ring-resonator sensors. Optics Letters. 9, 1319-1321 (2006).
- Rodriguez, J. R., Bianucci, P., et al. Whispering gallery modes in hollow cylindrical microcavities containing silicon nanocrystals. Applied Physics Letters. 92, 131119 (2008).
- Bianucci, P., Rodriguez, J. R., et al. Whispering gallery modes in silicon nanocrystal coated microcavities. Physica Status Solidi A. 206, 965 (2009).
- Hessel, C. M., Henderson, E. J., et al. Hydrogen Silsesquioxane: A Molecular Precursor for Nanocrystalline Si-SiO2 Composites and Freestanding Hydride-Surface-Terminated Silicon Nanoparticles. Chemistry of Materials. 18, 6139-6146 (2006).
- Poon, A. W., Chang, R. K., Lock, J. A. Spiral morphology-dependent resonances in an optical fiber: effects of fiber tilt and focused Gaussian beam illumination. Opt. Lett. 23, 1105-1107 (1998).
- Silverstone, J. W., McFarlane, S., Manchee, C. P. K., Meldrum, A. Ultimate resolution for sensing with microcavities. Optics Express. 20, 8284-8295 (2012).
- Stancik, A. L., Brauns, E. B. A simple asymmetric lineshape for fitting infrared absorption spectra. Vibrational Spectroscopy. 47, 66-69 (2008).
- Lomb, N. R. Least-squares frequency analysis of unequally spaced data. Astrophysics and Space Science. 39, 447-462 (1976).
- Scott, R. P. W. The thermodynamic properties of methanol-water association and its effect on solute retention in liquid chromatography. Analyst. 125, 1543-1547 (2000).
- Manchee, C. P. K., Zamora, V., et al. Refractometric sensing with fluorescent-core microcavities. Optics Express. 19, 21540-21551 (2011).
- Teraoka, I., Arnold, S. Enhancing Sensitivity of a Whispering Gallery Mode Microsphere Sensor by a High-Refractive Index Surface. Layer. J. Opt. Soc. Am. B. 23, 1434-1441 (2006).
- Huang, G., Bolanos Quinones, V. A., et al. Rolled-up optical microcavities with subwavelength wall thicknesses for enhanced liquid sensing applications. ACS Nano. 4, 3123-3130 (2010).
- Fan, X. D., White, I. M., et al. Overview of novel integrated optical ring resonator bio/chemical sensors. Proceedings of the Society of Photo-Optical Instrumentation Engineers (SPIE). 6452, M4520-M4520 (2007).
- White, I. M., Zhu, , et al. Refractometric sensors for lab-on-a-chip based on optical ring resonators. IEEE Sensors J. 7, 28-35 (2007).
- Li, H., Fan, X. Characterization of sensing capability of optofluidic ring resonator biosensors. Applied Physics Letters. 97, 011105 (2010).
- Zamora, V., Díez, A., et al. Refractometric sensor based on whispering gallery modes of thin capillaries. Optics Express. 15, 12011-12016 (2007).
- Suter, J. D., White, I. M., et al. Label-free quantitative DNA detection using the liquid core optical ring resonator. Biosensors and Bioelectronics. 23, 1003-1009 (2008).
- White, I. M., Oveys, H., et al. Integrated multiplexed biosensors based on liquid core optical ring resonators and antiresonant reflecting optical waveguides. Applied Physics Letters. 89, 191106 (2006).
- Yang, G., White, I. M., Fan, X. An opto-fluidic ring resonator biosensor for the detection of organophosphorus pesticides. Sensors and Actuators B: Chemical. 133, 105-112 (2008).
- Zhu, H., Dale, P. S. Rapid and Label-Free Detection of Breast Cancer Biomarker CA15-3 in Clinical Human Serum Samples with Optofluidic Ring Resonator Sensors. Anal. Chem. 81, 9858-9865 (2009).
- Redding, B., Marchena, E., et al. Comparison of raised-microdisk whispering-gallery-mode characterization techniques. Optics Letters. 35, 998-1000 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved