このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
Refractometricセンシング用蛍光コアマイクロキャビティの合成と操作
要約
蛍光コアマイクロキャビティセンサは、シリカマイクロキャピラリーのチャンネルに高屈折率の量子ドットのコーティングを採用しています。チャネルの中程度を分析するために使用することができるマイクロキャビティ蛍光スペクトルにおける毛管チャネル原因シフトに圧送流体の屈折率の変化。
要約
本稿では、マイクロ流体解析セットアップで動作することができ、蛍光コアマイクロキャビティベースのセンサについて説明します。これらの構造は、従来のマイクロキャピラリーのチャネル表面上の蛍光量子ドット(QD)コーティングの形成に基づいています。シリコン量子ドットは、立法上、多くの国で物質を制御されているII-VI族およびII-VI族化合物の量子ドットに比べて、彼らのせいで無視できる毒性の一部には、このアプリケーションのために特に魅力的である。アンサンブルの発光スペクトルは、毛細血管の機能膜内に捕捉された光の電磁共鳴に対応する蛍光スペクトルに鋭い、狭いピークのセットのチャネル壁上のSi量子ドットのフィルム広範かつ特徴のないですが。これらの共鳴のピーク波長はこのように量子ドットは、検体と物理的に接触したことがないているrefractometricセンサーとして機能するようにデバイスを可能にして、外部媒体に敏感です。実験的蛍光コアマイクロキャピラリーの作製に関連付けられたメソッドは、同様の分析方法として、詳細に説明します。最後に、比較は、マイクロ流体センシング機能の面では、これらの構造を、より広く調査し、液体コア光リング共振器との間で行われます。
概要
わずかなサンプル量を必要とし、ハンドヘルドまたは現場操作可能な機器に組み込むことができ、その化学センシングシステムは、新技術の広い範囲の開発につながる可能性がある。このような技術は、病気や病原体、1環境汚染物質、2および食品安全のためのフィールド診断を含めることができます。3いくつかの技術を積極的に最先端の間で表面プラズモン共鳴(SPR)の物理学に基づいてデバイスと、マイクロ流体化学センサーのために検討されています。 4これらのセンサは、主に大規模な実験装置などが、今では多くの特定の生体分子を検出することが可能であり、商業的な成功を達成している。5
近年、光マイクロキャビティは、SPRベースのシステムと競合する上昇している。マイクロキャビティは、単一のウイルス6そしておそらく単一生体分子を検出するための実証された能力で、驚くほど敏感になることができます9小であることは疑う余地がありませんしかし、8、いくつかの議論の対象のまま)7>まで。マイクロキャビティにおいて、検出機構は共振の電界プロファイル内の分析物の存在に起因する光学共振の変化に依存しています。一般に、与えられた検体は、中心周波数、可視性、または線幅での変化に対する共振が発生します。 SPRのシステムと同様に、マイクロキャビティは非特異refractometricセンサーとして、あるいは特定の分析のために官能化されたバイオセンサーとして機能することができます。
円形断面( 例えばマイクロスフェア、ディスクまたはシリンダー)を有する誘電体微細ウィスパリングギャラリーモード、またはWGMsとして知られる電磁共鳴によって特徴付けられ、類似した音響効果のレイリー卿の調査にまで遡る用語。基本的に10、光WGM波が円形断面sをcircumnavigatesときに発生します内部全反射し、位相で、その出発点に戻りによってECTION。シリカ微小球の電磁共鳴の例を図1aに示されている。この共鳴は、赤道付近のフィット53波長(L = 53)が示されているそのうちのいくつかだけの合計ながら、半径方向に最大1(n = 1)とすることを特徴とする。電界強度のエバネッセント部分が球体の境界の外培地内に延び、従って、マイクロスフェアWGMは外部媒体を感知することができる。
毛細血管はWGMベースのセンサの特に興味深い例です。毛細血管では、円筒形WGMsは球の場合と同様、円形断面の周囲に形成することができます。毛細血管壁が非常に薄い場合には、電磁界の一部は、毛細管チャネル( 図1b)に延びている。このように、キャピラリーはチャネル内に注入検体のためのマイクロ流体センサとすることができる。これはbです共振液体コア光リングの動作ASIS(LCORR)が11 LCORRsはWGMsを調べるために精密な同調可能レーザ光 源からの光のエバネッセント結合に依存しています。 LCORRの重要な側面は、毛細血管壁がそのモードのサンプルは、チャネルの中程度確保するために(〜1μm)を薄くしなければならないということです。これは、それらの製造上のいくつかの困難を配置し、それらを機械的に脆弱であることが原因。
私たちの仕事では、我々は、蛍光コアマイクロキャビティ(FCM)を呼び出す別の構造を開発しました。12,13 FCMを形成するために、我々のコート高屈折フルオロフォア(具体的には、の層で毛細血管のチャネル壁酸化物が埋め込まれたシリコン量子ドット)。フィルムの高屈折することにより、WGMs( 図1c)を構築し、放出される放射線を閉じ込めるために必要です。 LCORRとは対照的に、FCMで、モードが発せられた蛍光スペクトルに鋭い最大値として表示されます。の厚さフィルムは非常に重要であり、それが厚すぎるWGMは毛管チャネル媒体をサンプリングしない、それが薄すぎると光閉じ込めが失われ、WGMsが弱くなっています。したがって、FCMの製造は、入念な準備を必要とする困難なプロセスです。これは、現在の論文の主要なトピックである。
プロトコル
1。材料の調整
- マイクロキャピラリーは市販のサプライヤーからシリカキャピラリを取得します。我々はポリマイクロ·テクノロジーズから我々の毛細血管を購入してください。もっと広く分離スペクトル共鳴のため( すなわち大きい自由スペクトル領域)以上の品質係数でより密集した共鳴用の大きい内径(〜100μm程度) -内径が小さい(30〜25ミクロン)を選択します。大外径はFCMSは耐久性があり、簡単に操作が保証されます。
- 毛細血管は、最初に削除する必要があります色付きのポリイミドジャケット、付属しています。ダイヤモンドファイバカッタを使用して、ロールからキャピラリーの約10cmの部分をカット。それぞれの作品は、単一のサンプルを構成している。コーティングを焼失させる酸素で1時間650℃でチューブ炉でこれらを温める。このプロセスは、シリカが内部毛細管露光、ジャケット材料を除去する。室温まで冷却した後、capillariを削除加熱ボートからのES。
- 水素シルセスキオキサンのソリューション水素シルセスキオキサン(HSQ)がかご状構造を持つH 12のSi 8 O 12分子からなると報告されています14この材料は、Dow Corning社から市販されている。そのようなFOX-15としてのFOX系列(フロアブル酸化物)ソリューションの一つにHSQを購入します。これらのソリューションは高価であり、限られた貯蔵寿命を持っているので、慎重な計画が必要とされている。 MIBK溶媒を蒸発させて、重量比で約18%のHSQ濃度を提供する。 HSQ濃度が低すぎる場合には、量子ドットは、映画の中で形成されないことがあります。それが高すぎると、フィルムは毛管チャネル表面から厚すぎると離層かもしれません。我々の経験では、25から30μmの内径、約25重量%のHSQを含むFOX溶液をキャピラリーに最適です。したがって、調整するために(それが乾燥していることを確認してください)溶剤もっとHSQを蒸発させるか、または追加が必要になることがあり濃度。希釈や濃度が必要かどうかは試行錯誤しないと決定するのが困難であり、 すなわち、いくつかのサンプルを作成し、以下に述べるように、結果を調べます。
2。コーティングキャピラリーの作製
- 毛細血管は、ステップ1.1で調製した毛細血管の部分を取り、キツネのソリューションにそれらを浸し充填 。毛細管を溶液に浸漬されている場合は、ソリューションが毛細管( 図2a)に引き込まれるように視覚的に、チャンネルアップメニスカスをフォローすることができるはずです。
- メニスカスがトップに到達すると、毛細血管を除去し、ガラスアニールルツボに入れてください。それが今では完全にFOXの溶液で満たされるべきである。成功の可能性を高めるために、できるだけ多くのサンプルに対してこの手順を繰り返します。我々は一般的に20から30のバッチを実行して、重量HSQソリューションの2つの異なる濃度を使用します。私たちは、空気中の毛細血管が、維持トンを埋める可能であれば、彼はグローブボックスで冷やしキツネ溶液を酸素や水蒸気への解決策の曝露を最小限にするために、推奨されます。たとえ小さなエクスポージャーは、溶液のゲル化をもたらすことができます。
- 2段階のプロセスで毛細血管をアニールするアニール 。アニーリングは、溶媒を蒸発させ、流路壁に付着した SiO x膜を形成し、HSQケージ構造が折りたたまれます。より高い温度でアニールするSi量子ドットにSiO x膜はシリカマトリックス中に分散disproportionates。アニール工程は、30分間、室温から300℃のランプ、溶媒を蒸発させるために3時間滞留し、1100までのランプ℃で45分間、および量子ドットを沈殿させるために1時間ドエルのCが含まれる。
- 室温に戻して(〜12時間)毛細血管がゆっくり冷ます。これは、毛細血管壁に堆積された膜のストレス関連の割れを最小限に抑えることができます。他のアニーリングのプロトコルでしたぶん続かれる、より信頼性の高いかもしれませんが、高温1,000-1,100段階をアニール°Cは常に量子ドットを形成する必要がある。この段階の最後に、人は(たぶん)シリカマトリックスコーティングチャネル壁に埋め込まれた蛍光量子ドットの層で20から30毛細血管を持っている必要があります。
3。特性評価
- 700から900 nmの波長範囲のイメージングと分光法の両方を実行する必要があります毛細血管が搭載されている蛍光顕微鏡をチェックするサンプル 。落射蛍光または共焦点のセットアップは、この目的に適している。それは、視覚的にすばやく分析( 図2b)のためにそれらの間を移動しやすくなるように、ステージ上で候補毛細血管の行を置きます。どちら顕微鏡ステージ上の空き領域に、または直接ダイクロイックフィルタを使用して対物レンズを介して青や紫外線でキャピラリーを励起し、接眼レンズを用いた蛍光像を観察またはカラーカメラ。
- キャピラリー蛍光を観察します。製作が成功した場合、毛細血管が明るい赤色蛍光を示すであろう。これは、良好なサンプルの最初の徴候である。一般的には橙黄色の蛍光を(代わりに量子ドットに関連付けられている赤い色の)を示す毛細血管は、所望の光学特性を持っていない。これらのサンプルはまた、低HSQ濃度の溶液中でより頻繁に形成する傾向がある。いくつかの毛細血管は全く蛍光を示さないことがあり、この場合には、QDフィルムが形成されなかったとキャピラリー(ガラス鋭利なもの)を捨てることができます。これは、溶液は毛細管に引き込まれていないか、またはそれはHSQの欠損であったかもしれないことを示しています。最後に、いくつかのサンプルは、ひび割れやテクスチャフィルムを示すことがあるが、これらはまた、廃棄することができる。
- シリコン量子ドットの明るい赤色の蛍光特性を示すものを除いて、前の手順で説明したすべてのサンプルを破棄します。
- 蛍光スペクトルにおけるWGMsの存在は、分光器の入射スリット上で、必要に応じて画像が整列されていることを確認し、蛍光スペクトルを収集するかどうかを確認します 。許容可能な信号対雑音比を生成するように収集時間を調整します。必要に応じて波長と強度の校正を実行します。 QDのスペクトルは、700〜900 nmの波長範囲で強烈であるべきである。キャピラリー内壁に対応する領域から採取したスペクトルは、円筒形のささやきギャラリーモード(WGMs)の存在のために、強力な振動を示すべきであるが、これは成功したrefractometricセンサの最後から2番目の要件である。
- いくつかのサンプルは、スペクトル中の明るい赤色の蛍光量子ドットが、不足のWGM振動を持っているかもしれません。これは、量子ドットの光学フィルムが共鳴を破壊する毛細血管壁から、ひび割れや剥離を示しています。 WGMsずに毛細血管を破棄します。この時点で、唯一の(典型的にはSMAセンサの要件を満たすサンプルのLL)画が残っている。実行すべき1最終テストがあります。
- Refractometric分析は 、ポリエチレン、タイゴン、テフロン、または内径毛細管外径よりも僅かに大きくする必要があり、意図検体溶液と化学的に適合性のチューブに候補毛細血管を取り付けます。キャピラリー内に圧送されるソリューションと反応しないようにチューブの選択はそうすべきである。
- チューブにガラスキャピラリーを接続するために良好な接着剤を使用し、それ以外のキャピラリーチューブインターフェイスのリークが発生します。我々は、ノーランドNOA-76またはマスコット瞬間接着剤ゲルを用いて合理的に良好な成功を持っています。接着剤の選択は、ガラスキャピラリーやチューブ、およびチャネルの流体との反応の欠如への密着性に依存します。毛管チャネルに浸透し、それをブロッキングから接着しないように注意して使用してください。
- チューブをインタフェースmicropumpingシステムへシリンジを介して。例えば、メタノール、エタノール、および水などのよく知られた屈折率を有する化合物は、デバイスのrefractometric感度を決定するために使用することができます。これは成功したセンサの最終テストです。 ( 図2c)、キャピラリとチューブの間に接着剤シールを破裂しないように確認しながら、キャピラリーに各流体を、一つずつポンプ。
- キャピラリー内の各液体とスペクトルを収集します。 TE偏WGMs(軸、毛管アナライザ平行)とTM偏WGMs(軸、毛管アナライザ·垂直)を区別するための光路にアナライザを使用する。キャピラリー内のそれぞれ異なった溶液を用いて、WGM共振、TEまたはTMのいずれかの波長のシフトがあるはずです。観察可能なシフトがない場合は、量子ドットのフィルムが厚すぎるとWGMsは十分チャネルの中程度をサンプリングしないでください。成功した試料では、我々は一般的に5〜15 nmの感度を観察ソリューションごとの屈折率ユニット(RIU)。ほとんどショーWGMsを行うすべてのサンプルは、測定感度を示しますが、一般的に準備された毛細血管のごく一部はWGMsが表示されます。
4。データ解析
- 蛍光スペクトルを得ることはあなたのサンプルの蛍光スペクトルを取る。バイオセンシングのアプリケーションでは、チャネル表面は、特定の検体のために官能化されて最初に持っています。 QDの膜の表面は基本的にシリカであるので、多くの表面改質のレシピが存在します。アプリケーションに関係なく、最後のステップでは、データ処理と分析である。
- 低い検出限界を達成するためには、 "シフトの解像度は"名目分光解像度やピッチよりも大幅に小さくする必要があります小さなスペクトルシフト - 理想的に測定する必要があります。ケアは、これに起因するスペクトル処理に行使されなければならない。特に、多くの撮像分光計でのスペクトルは、CCD上に完全に水平に投影されないかもしれません。分析の間、サンプル画像がスリットに縦にドリフトし、もしこのように、偽のスペクトルシフトを得ることができる。このようなことが起こらないことを保証するために必要なあらゆる手段を使用しています。 例えば投影スペクトルの角度を判定し、それを修正するために標準的なキャリブレーションを使用して、サンプルのドリフトを最小限に抑え、同じCCDの画素がすべてのスペクトルを得るために使用されていることを確認。
例えば分光画像モードはチャンネル壁に対応する位置に、強い振動として現れる、 図3に示されている。後述するように、スペクトル画像、出力1Dスペクトルデータをインポートし、WGMシフトのカーブフィッティングとフーリエ解析を実行するためにMathematicaのコンピュータコードを(または何あなたのグループが好む)を使用します。
- 低い検出限界を達成するためには、 "シフトの解像度は"名目分光解像度やピッチよりも大幅に小さくする必要があります小さなスペクトルシフト - 理想的に測定する必要があります。ケアは、これに起因するスペクトル処理に行使されなければならない。特に、多くの撮像分光計でのスペクトルは、CCD上に完全に水平に投影されないかもしれません。分析の間、サンプル画像がスリットに縦にドリフトし、もしこのように、偽のスペクトルシフトを得ることができる。このようなことが起こらないことを保証するために必要なあらゆる手段を使用しています。 例えば投影スペクトルの角度を判定し、それを修正するために標準的なキャリブレーションを使用して、サンプルのドリフトを最小限に抑え、同じCCDの画素がすべてのスペクトルを得るために使用されていることを確認。
- カーブフィッティングは、検体に起因する小さなスペクトルシフトを測定するために、WGMピーク波長を決定する私のFCMチャネルn。スペクトル形状を記述した関数への単一モードをフィットさせる - これは、ピーク位置を取得するための一般的な方法です。理想的なケースでは、これはローレンツ関数(δλ=│-cδf/ fの2│cは光の速度である経由周波数単位の波長からの適切な変換を含む)になります。
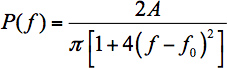
式の。 1、スケーリングパラメータであり、f 0は中心周波数です。残念なことに、FCMSは、理想的なケースではありません。- 円筒状の空洞にWGMsは高い周波数、螺旋共振の開発に可能性が高いせいで(波数ベクトルの非ゼロの軸方向成分を持つWGMs)に偏っている。15ローレンツは、したがって、ピーク位置を決定するためにパフォーマンスが低下し合う。残念なことに、何の機能thはありませんには、らせん状WGMsから重複Lorentziansの分布をフィットします。前作16では、我々は偏ったローレンツ17がより良いフィット感を与えることを提案した:

ここで、AとBは、パラメータを曲がって。 図4は、式に見られるように。 2式より、データへのより良いフィット感を与えてくれる。 1、残念ながらそれはWGMsの理論では物理的な根拠がありません。
- 円筒状の空洞にWGMsは高い周波数、螺旋共振の開発に可能性が高いせいで(波数ベクトルの非ゼロの軸方向成分を持つWGMs)に偏っている。15ローレンツは、したがって、ピーク位置を決定するためにパフォーマンスが低下し合う。残念なことに、何の機能thはありませんには、らせん状WGMsから重複Lorentziansの分布をフィットします。前作16では、我々は偏ったローレンツ17がより良いフィット感を与えることを提案した:
- フーリエシフト解析あるいは、データは離散フーリエ変換を用いて処理することができ、対応する位相をフーリエスペクトルから測定シフト。単一の任意WGMを使用するのではなく、この方法では、全体のスペクトルの周期性を利用しています。これは、ピーク波長位置を測定するのではなく、全体的なシフトを測定していません任意の基準スペクトルに対して所定WGMスペクトルの。
- スペクトルシフトを取得するためにメインWGMスペクトルの振動に対応し、ハイパワーフーリエ成分の位相差Δφを使用しています。これは、現実のWGM周波数シフトに対応しています。
ΔF=Δφ(f maxの- F 分 )/(2πk)
ここで、f minとf maxのは、スペクトル内の最小値と最大周波数です。唯一のメインコンポーネントが使用されている場合は、多くの情報が廃棄されることがあります。さらに、切り捨ての問題は、それが困難な成分が主なものであるかを決定することがあります。多くの場合、最良の結果を得るには、フーリエ成分にどのようないくつかの試行錯誤を選択する必要があります。 - シフト定理ではなくフーリエ成分のすべてを使用しています。したがって、純粋なシフトのために、個々のコンポーネントは、(kに比例してシフトされるkとA)成分の数である。比例mは実際のシフトの尺度である言い換えれば、δφK = MK、。総周波数シフトは、このように次式で与えられます。
ΔF= M(f maxの- F 分 )/(2π)。
これは、フーリエ成分の一部またはすべての位相差ΔΦkへの線形フィットから得られるメートル必要です。 - 実際のデータでは、線形関係がΔΦK = mkは、低消費電力のフーリエ成分で有意な効果を持つことができ、ノイズとバックグラウンド信号に起因する不確実性を持つことになります。従って、我々はΔΦkの 対の勾配を得るために、各コンポーネントの重量は、自身のパワーに比例した、加重線形フィットをお勧めしますkのグラフ。スペクトルは高周波数(nの両方を削除するには、フィッティングの前に主要コンポーネントの周囲にフィルタリングすることができますオワーズ)と低周波(非結合蛍光バックグラウンド)。周波数は、式からずれる。 4その後、波長の単位に変換されます。
- カーブフィッティングのためのケースとは異なり、WGM "波長"を得ることはありませんが、代わりに波長シフトは任意の基準スペクトルに対してスペクトル全体にわたって測定されます。すべてのスペクトルを分析するための手順を繰り返す。このプロシージャのステップは次のとおりです。
- 一定の自由スペクトル領域を確保するための周波数単位にスペクトルを変換します。
- すべてのシフトが測定され、そこから参照データセット( すなわち、最初のWGMの蛍光スペクトル)を選択してください。
- 補間する均一な周波数間隔を取得するためのスペクトルを図18
- 各スペクトルのパワーと位相成分を得るために、離散フーリエ変換を実行します。
- 与えられたWGMのすべてのk個の要素のための位相の違いを見つける参照スペクトルに関してシフト値が望まれるスペクトル。
- どちらかだけメインフーリエ成分、または選択したコンポーネントへの加重線形フィットの位相差を利用して位相シフトを見つける。これは、WGMスペクトルと参照スペクトルとの間の位相シフト量 Δfまたはδλを与えるだろう。
- スペクトルシフト(検出限界)のエラーは同じ分析のために繰り返さスペクトルを収集することによって測定することができる。感度の不確実性は、複数のコンポーネントが使用されている場合、重み付き線形フィットでエラーから取得することができます。
- スペクトルシフトを取得するためにメインWGMスペクトルの振動に対応し、ハイパワーフーリエ成分の位相差Δφを使用しています。これは、現実のWGM周波数シフトに対応しています。
を繰り返し、すべての分析のために手順1〜7を繰り返します。この手順が複雑に聞こえますが、初期の実装後の手順では、大規模なデータセットがシフトを見つけるためにバッチ処理もできるように、自動化するのは簡単です。我々は、具体的に書かれたfoのMathematicaコードを使用完全なデータセット "ボタンを押すだけで、"バッチ処理できるように、rはこの手順。我々はまだこれを行っていないものの、原則的には、スペクトルのシフトがあっても、 "ライブ"で計算することができます。
結果
キャピラリー製造手順で小さな偏差は、サンプル成功率の大きな変化につながることができます。 図5(広告)では、私たちは失敗した毛細血管の代表例と同様に成功したものを示しています。一般的に、成功したサンプルの視覚的な表示は、毛細血管壁や特徴のない内装で高い強度と組み合わせた赤色蛍光である。蛍光スペクトルはまた、明らかに成功と失敗( 図5e)
ディスカッション
蛍光コアマイクロキャビティrefractometricセンサとして使用することができる。マイクロ流体センサー、マイクロチューブに比べ22として作用することができる"ロールアップ"マイクロチューブの隔離された例がありますが、それらを簡単に分析して取り扱うとインターフェイスへの単純されているので、毛細血管は、マイクロ流体セットアップに統合し、かなり実用的な利点を?...
開示事項
我々は、開示することは何もない。
謝辞
この研究は、NSERC、カナダによって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 材料の表 | 会社 | カタログ# | 注釈 |
| シリカマイクロキャピラリー | |||
| 柔軟なマイクロボアチューブ | ポリエチレン、タイゴンなど | ||
| 接着剤 | マスコット、ノーランドNOA | ||
| HSQはMIBKに溶解 | 例えば 。、FOX-15 | ||
| メタノール | |||
| エタノール | |||
| 蒸留水 |
使用される材料の表1。一覧。
参考文献
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic Systems for Pathogen Sensing. A Review. Sensors. 9, 4804-4823 (2009).
- Jokerst, J. J., Emory, J. M., Henry, C. S. Advances in microfluidics for environmental analysis. Analyst. 137, 24-34 (2012).
- Neethirajan, N., Kobayashi, K., et al. Microfluidics for food, agriculture and biosystems industries. Lab on a Chip. 11, 1574-1586 (2011).
- Amarie, D., Alileche, A., et al. Microfluidic Devices Integrating Microcavity Surface-Plasmon-Resonance Sensors: Glucose Oxidase Binding-Activity Detection. Analytical Chemistry. 82, 343-352 (2010).
- Vollmer, F., Arnold, S., Keng, D. Single virus detection from the reactive shift of a whispering-gallery mode. PNAS. 105, 20701-20704 (2008).
- Armani, A. M., Kulkarni, R. P., et al. Single-Molecule Detection with Optical Microcavities. Science. 317, 783-787 (2007).
- Arnold, S., Shopova, I., Holler, S. Whispering gallery mode bio-sensor for label-free detection of single molecules: thermo-optic vs. reactive mechanism. Optics Express. 18, 281-287 (2009).
- Vollmer, F., Braun, D., et al. Protein detection by optical shift of a resonant microcavity. Applied Physics Letters. 80, 4057-4059 (2002).
- Rayleigh, L. The problem of the whispering gallery. Philosophical Magazine. 20, 115-120 (1910).
- White, I. M., Oveys, H., Fan, X. Liquid-core optical ring-resonator sensors. Optics Letters. 9, 1319-1321 (2006).
- Rodriguez, J. R., Bianucci, P., et al. Whispering gallery modes in hollow cylindrical microcavities containing silicon nanocrystals. Applied Physics Letters. 92, 131119 (2008).
- Bianucci, P., Rodriguez, J. R., et al. Whispering gallery modes in silicon nanocrystal coated microcavities. Physica Status Solidi A. 206, 965 (2009).
- Hessel, C. M., Henderson, E. J., et al. Hydrogen Silsesquioxane: A Molecular Precursor for Nanocrystalline Si-SiO2 Composites and Freestanding Hydride-Surface-Terminated Silicon Nanoparticles. Chemistry of Materials. 18, 6139-6146 (2006).
- Poon, A. W., Chang, R. K., Lock, J. A. Spiral morphology-dependent resonances in an optical fiber: effects of fiber tilt and focused Gaussian beam illumination. Opt. Lett. 23, 1105-1107 (1998).
- Silverstone, J. W., McFarlane, S., Manchee, C. P. K., Meldrum, A. Ultimate resolution for sensing with microcavities. Optics Express. 20, 8284-8295 (2012).
- Stancik, A. L., Brauns, E. B. A simple asymmetric lineshape for fitting infrared absorption spectra. Vibrational Spectroscopy. 47, 66-69 (2008).
- Lomb, N. R. Least-squares frequency analysis of unequally spaced data. Astrophysics and Space Science. 39, 447-462 (1976).
- Scott, R. P. W. The thermodynamic properties of methanol-water association and its effect on solute retention in liquid chromatography. Analyst. 125, 1543-1547 (2000).
- Manchee, C. P. K., Zamora, V., et al. Refractometric sensing with fluorescent-core microcavities. Optics Express. 19, 21540-21551 (2011).
- Teraoka, I., Arnold, S. Enhancing Sensitivity of a Whispering Gallery Mode Microsphere Sensor by a High-Refractive Index Surface. Layer. J. Opt. Soc. Am. B. 23, 1434-1441 (2006).
- Huang, G., Bolanos Quinones, V. A., et al. Rolled-up optical microcavities with subwavelength wall thicknesses for enhanced liquid sensing applications. ACS Nano. 4, 3123-3130 (2010).
- Fan, X. D., White, I. M., et al. Overview of novel integrated optical ring resonator bio/chemical sensors. Proceedings of the Society of Photo-Optical Instrumentation Engineers (SPIE). 6452, M4520-M4520 (2007).
- White, I. M., Zhu, , et al. Refractometric sensors for lab-on-a-chip based on optical ring resonators. IEEE Sensors J. 7, 28-35 (2007).
- Li, H., Fan, X. Characterization of sensing capability of optofluidic ring resonator biosensors. Applied Physics Letters. 97, 011105 (2010).
- Zamora, V., Díez, A., et al. Refractometric sensor based on whispering gallery modes of thin capillaries. Optics Express. 15, 12011-12016 (2007).
- Suter, J. D., White, I. M., et al. Label-free quantitative DNA detection using the liquid core optical ring resonator. Biosensors and Bioelectronics. 23, 1003-1009 (2008).
- White, I. M., Oveys, H., et al. Integrated multiplexed biosensors based on liquid core optical ring resonators and antiresonant reflecting optical waveguides. Applied Physics Letters. 89, 191106 (2006).
- Yang, G., White, I. M., Fan, X. An opto-fluidic ring resonator biosensor for the detection of organophosphorus pesticides. Sensors and Actuators B: Chemical. 133, 105-112 (2008).
- Zhu, H., Dale, P. S. Rapid and Label-Free Detection of Breast Cancer Biomarker CA15-3 in Clinical Human Serum Samples with Optofluidic Ring Resonator Sensors. Anal. Chem. 81, 9858-9865 (2009).
- Redding, B., Marchena, E., et al. Comparison of raised-microdisk whispering-gallery-mode characterization techniques. Optics Letters. 35, 998-1000 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved