Method Article
ماوس واحدة، واثنين من الثقافات: العزلة وثقافة الكبار الخلايا الجذعية العصبية من المناطق العصبية اثنان من الفئران الفردية
In This Article
Summary
نحن هنا وصف بروتوكول مفصلة للجيل في وقت واحد من مزارع الخلايا العصبية السلائف، إما الطبقات الوحيدة ملتصقة أو neurospheres، من منطقة subventricular والتلفيف المسنن من الفئران الكبار الفردية.
Abstract
مقايسة neurosphere ونظام الثقافة أحادي الطبقة ملتصقة هي أدوات قيمة لتحديد إمكانية (الانتشار أو تمايز) من الكبار الخلايا الجذعية العصبية في المختبر. هذه المقايسات يمكن استخدامها لمقارنة المحتملة السلائف الخلايا المعزولة من مختلف وراثيا أو المعالجة بشكل مختلف الحيوانات لتحديد تأثير العوامل الخارجية على تكاثر الخلايا العصبية السلائف والتمايز والعصبية لتوليد خطوط الخلايا السلائف التي يمكن أن يعاير أكثر المقاطع المستمر. يتم استخدام مقايسة neurosphere تقليديا لتحديد بعد خاص من الخلايا الجذعية، ويرجع ذلك أساسا إلى عدم وجود علامات نهائية مع التي يمكن أن تكون معزولة عن الأنسجة الأولية ولديه ميزة كبيرة لإعطاء تقدير الآن من أعداد الخلايا السلائف في أنسجة المخ المشتقة من الحيوانات الفردية. الثقافات أحادي الطبقة ملتصقة، في المقابل، لا تستخدم عادة للمقارنة بين انتشار الحيوانات الفردية، كما بدأت كل ثقافة عموما من النسيج مجتمعة بين 5-8 حيوانات. ومع ذلك، لديهم ميزة كبيرة أنه، خلافا neurospheres، أنها تتكون من مجموعة من السكان معظمهم متجانسة من الخلايا السلائف ومفيدة لمتابعة عملية التمايز في الخلايا واحدة. هنا، نحن تصف، بالتفصيل، وجيل من الثقافات neurosphere و، لأول مرة، والثقافات ملتصقة من الحيوانات الفردية. وهذا له العديد من الآثار الهامة بما في ذلك تحليل يقترن الانتشار و / أو المحتملة التمايز في كل من منطقة subventricular (SVZ) والتلفيف المسنن (DG) من خطوط الماوس أو معاملة مختلفة وراثيا، فضلا عن خفض كبير في استخدام الحيوان.
Introduction
مقايسة neurosphere 1،2 و ثقافة أحادي الطبقة ملتصقة 3،4، كل من البلدان المتقدمة في 1990s في وقت مبكر، لا يزال المعيار الذهبي في المختبر فحوصات الخلايا الجذعية العصبية. في هذه المقايسات، الأنسجة الابتدائي الجزئي تشريح الدماغ من منطقة معينة، نأت الى تعليق خلية واحدة والمثقف في وجود عامل نمو البشرة mitogens (صندوق تعديل العولمة الأوروبي) وعامل نمو الخلايا الليفية-2 (FGF2) لتشكيل إما مجانا العائمة مجموعات (neurospheres) أو الطبقات الوحيدة ملتصقة. كلا النظامين لديها وينبغي إيلاء عدد من مزايا وعيوب ودراسة متأنية للمسألة التي يتعين معالجتها قبل اختيار واحد أو نظام آخر.
Neurospheres تسمح لقراءة واضحة للخروج من الخلافات في عدد الخلايا السلائف والمحتملين. بالإضافة إلى ذلك، neurospheres هي أيضا أداة مفيدة لدراسة المواصفات الذاتية للخلايا عند إزالتها من البيئة الخارجية العادية. Extrinالعظة كذا يمكن دراستها ببساطة عن طريق إضافة عامل تهم متوسطة النمو وتحديد عدد وحجم neurospheres المتولدة. العيب الرئيسي من neurospheres ومع ذلك، هو أنها تشكل مكانة خاصة بهم، مع الخلايا في وسط neurospheres (neurospheres كبيرة على وجه الخصوص) كونها أكثر تمايزا من تلك التي على السطح 5. Neurospheres تحتوي على مزيج من الخلايا الجذعية، التي ارتكبت الأسلاف، وخلايا متباينة، والتفاعلات خلية خلية داخل neurospheres مواجهة صيانة الخلايا الجذعية. هذا هو السبب في neurospheres تحتوي إلا على عدد قليل من الخلايا الجذعية صحيح 6-8.
الثقافات أحادي الطبقة ملتصقة أيضا توفير نظام جيد في المختبر إلى نموذج في انتشار الجسم الحي. يمكن الثقافات ملتصقة، في الخلايا التي تبقى أكثر عزلة ومتجانسة، والقضاء على الطبيعة غير المتجانسة للneurosphere. في ظل هذه الظروف نمو الخلايا السلائف تتكاثر RAPIDLY والخلايا كلها تقريبا يتم تقسيم والتعبير عن علامات مميزة السلائف العصبية Nestin، Sox2، وBLBP. والعيب الرئيسي لنظام أحادي الطبقة الثقافة مقارنة مع مقايسة neurosphere هو أن الحيوانات المستنسخة الفردية المستمدة من السلائف غير قادرين على رصد وكميا.
وكان من العيب معظم بروتوكولات لكلا النوعين من الثقافات ضرورة لاستخدام أعداد كبيرة نسبيا من الحيوانات، لأن العائد من استراتيجيات العزلة كثيرا ما كان الفقراء. في نفس الوقت، فقد أصبح من الواضح أن تكوين الخلايا العصبية الكبار يساهم في تفريد الدماغ 9، مما أدى إلى ضرورة فردية فيفو السابقين النماذج كذلك. هذه الاحتياجات يمكن تلبيتها عن طريق بروتوكولات "الفأر واحد، ثقافة واحدة" كما هو موضح في هذا التقرير.
يصف بروتوكول البصرية التالية جيل في وقت واحد من الثقافات السلائف العصبية من كل من SVZ وDG الحيوانات الفردية إما ملتصقة مonolayers أو كما neurospheres. الجيل الثقافات من الحيوانات الفردية مفيد بشكل خاص عندما يتطلب الأمر مقارنات بين الحيوانات المعالجة بشكل فردي أو المعدلة وراثيا مختلف الفردية أو البرية من نوع الفئران. ويشمل هذا البروتوكول تعليمات مفصلة للتسليخ مجهري في وقت واحد من المناطق SVZ وDG من الفئران الكبار، تفارق بهم في تعليق خلية واحدة، والثقافة في المختبر إما الثقافات أحادي الطبقة ملتصقة أو neurospheres وتحليل multipotentiality والمحتملة على المدى الطويل، الكاردينال اثنين خصائص الخلايا الجذعية النية العظام.
Protocol
1. الإعداد الأساسية وإعداد متوسطة الثقافة
- يومين على الأقل قبل بدء التجربة، وإعداد بولي-D-يسين (PDL) / Laminin المغلفة لوحات للثقافات أحادي الطبقة ملتصقة. لإعداد الآبار / قوارير إضافة ما يكفي PDL (10 ملغ / مل في DH 2 O) إلى معطف السطح واحتضان بين عشية وضحاها في درجة حرارة الغرفة. إزالة حل من الطبق وغسل الطبق ثلاث مرات مع DH 2 O. السماح للهواء الجاف. إضافة Laminin (5 ملغ / مل في DMEM الباردة: F12)، واحتضان عند 37 درجة مئوية خلال الليل. إزالة Laminin وإما استخدام لوحات على الفور أو تخزين مع Laminin في -20 درجة مئوية حتى المطلوبة.
- إعداد النار مصقول مع ماصات المملون "صغيرة" "المتوسطة" و من خلال تناوب ماصات باستور الزجاج في لهب حتى تصبح حواف مدورة. الأوتوكلاف لتعقيم.
- في يوم من تشريح، وإعداد كمية مناسبة من الثقافة المتوسطة عن طريق خلط العصبية بصل متوسطة مع 2٪ B27، 1x أداة GlutaMAX، 2 ملغ / مل الهيبارين، 50 وحدة / مل البنسلين / الستربتوميسين، 20 نانوغرام / مل عامل النقاء الماوس مستقبلات الصف نمو البشرة (صندوق تعديل العولمة الأوروبي)، و 20 نانوغرام / عامل نمو الخلايا الليفية البقري المؤتلف مل (FGF-2). تدفئة مستنبت إلى 37 درجة مئوية في حمام مائي.
- لتفارق SVZ، وإعداد 0.05٪ التربسين EDTA-و0.125 ملغ / مل مثبط التربسين التي تحتوي على 0.01 ملغ / مل DNaseI. تتوازن هذه الحلول إلى 37 درجة مئوية.
- انشاء المجهر تشريح وإعداد الأدوات اللازمة لإزالة الدماغ (مقص وملعقة صغيرة) وSVZ وتشريح DG (مشرط، 27 G إبرة تعلق على حقنة 1 مل، 1 × # 7 ملقط، 1 × # 5/45 ملقط) عن طريق نقع في الايثانول 70٪.
2. حصاد العقول الكبار ماوس وSVZ / DG Microdissections
- تخدير الفئران الكبار واحد (عمره 8 أسابيع) وفقا للمبادئ التوجيهية المؤسسية المناسبة. أداء خلع عنق الرحم.
- رذاذ الرأس مع الايثانول 70٪ لتعقيم المنطقة وتقليل كمية الفراء أنdheres إلى مقص والدماغ. باستخدام مقص حاد قطع رأس الحيوان في قاعدة جذع الدماغ.
- عقد رئيس في قاعدة الجمجمة، وقطع الجمجمة بين اثنين من بصيلات الشم عن طريق وضع شفرة واحدة من زوج من مقص صغير في كل تجويف العين وقطع coronally. المقبل، وجعل اثنين من التخفيضات الوحشي في قاعدة الجمجمة، تليها قطع طولية من خلال الجمجمة على طول الدرز السهمي تنبيه: ضمان زاوية مقص ضحلة قدر الإمكان لتجنب إتلاف الدماغ الكامنة.
- فضح الدماغ عن طريق تقشير الظهر الجمجمة مع أي شفرة من مقص أو زوج من ملقط المنحني. تحرير الدماغ من الجمجمة باستخدام ملعقة صغيرة ومكان في برنامج تلفزيوني الباردة.
- شطف أدمغة مع برنامج تلفزيوني لإزالة الدم والفراء.
- نقل العقول إلى 10 سم من البلاستيك طبق بتري تحتوي على برنامج تلفزيوني
- وضع طبق بتري تحتوي على الدماغ تحت المجهر تشريح في التكبير المنخفض وموقف المخن على سطحه البطني. باستخدام ملقط المنحني غرامة إزالة بصيلات الشم في حين الضغط على الدماغ في الموقف من المخيخ.
- تدوير الدماغ على الجانب الظهري واستخدام مشرط اجراء خفض الاكليلية من خلال الدماغ على مستوى chiasm البصرية
- لmicrodissect في SVZ (للحصول على تعليمات أكثر تفصيلا، انظر أيضا آزاري وآخرون 10)، وضع جزء منقاري من الدماغ بحيث يواجه السطح الاكليلية قطع صعودا وتركيز المجهر على التكبير العالي. إزالة وتجاهل الحاجز باستخدام ملقط المنحني يرام.
- تشريح SVZ (طبقة رقيقة من الأنسجة المحيطة البطين) عن طريق وضع غيض من شفرة واحدة من زوج من ملقط المنحني غرامة في الزاوية الجانبية للبطين الوحشي فورا تحت الجسم الثفني والآخر ما يقرب من 1 ملم في الأنسجة فورا المجاورة إلى البطين. اضغط لأسفل ملقط نحو قاعدة الطبق ونحو الجانب البطني من ventrICLE لإزالة قطعة صغيرة من الأنسجة الثلاثي. وضع SVZ تشريح في طبق بتري على الجليد.
- لmicrodissect المدير العام (للحصول على تعليمات أكثر تفصيلا، انظر أيضا Hagihara وآخرون 11)، وضع جزء الذيلية من الدماغ في طبق بتري وقطع على طول الشق الطولي باستخدام مشرط.
- تحت المجهر تشريح، وإزالة المخيخ والدماغ البيني باستخدام ملقط.
- إعادة تركيز المجهر بحيث الحدود حول DG مرئية الآن. لإزالة التلفيف المسنن، إدراج غيض من إبرة 27 G والانزلاق على طول الحدود بين المديرية العامة وقرن آمون. باستخدام ملقط غرامة، وتحرير DG من الأنسجة المحيطة بها.
3. SVZ الأنسجة التفكك
- اللحم المفروم والأنسجة باستخدام شفرة مشرط لحوالي 1 دقيقة حتى لا تظل القطع الكبيرة.
- نقل الأنسجة المفروم إلى أنبوب 15 مل باستخدام 1 مل من prewarmed 0.05٪ التربسين EDTA-واحتضان لمدة 7 دقائق فيحمام مائي تعيين إلى 37 درجة مئوية.
- لوقف رد الفعل الأنزيمية، إضافة 1 مل من التربسين المانع تحتوي على DNaseI وتخلط محتويات عبها بواسطة الأنبوب.
- بيليه تعليق بواسطة الطرد المركزي في 300 x ج لمدة 5 دقائق وتجاهل طاف
- resuspend الكرية في 1 مل من النمو المتوسط وفصل من قبل pipetting بلطف صعودا ونزولا حوالي 7-10X باستخدام ماصة P1000 تحذير: أكثر من الطحن يمكن أن يؤدي إلى زيادة موت الخلايا وسيؤثر سلبا على نمو الخلايا اللاحقة.
- إضافة إلى النمو متوسطة الحجم الكلي لل5 مل وتمرير تعليق الخلية من خلال 40 مم منخل لإزالة الأنقاض وكتل الأنسجة undissociated.
- أجهزة الطرد المركزي في 300 x ج لمدة 5 دقائق، وتجاهل طاف و resuspend بيليه الناتج في 200 مل متوسطة النمو.
4. DG الأنسجة التفكك
- اللحم المفروم والأنسجة باستخدام شفرة مشرط لحوالي 1 دقيقة حتى لا تظل القطع الكبيرة ونقلفي prewarmed PDD انزيم مزيج (غراء 2.5 U / مل، Dispase 1 U / مل، DNaseI 250 U / مل). احتضان لمدة 20 دقيقة عند 37 درجة مئوية، والاختلاط بواسطة قلب الأنبوب كل 3-5 دقائق.
- فصل الأنسجة ميكانيكيا باستخدام تتحمل المتوسطة، النار مصقول، باستور ماصة من قبل pipetting بلطف صعودا ونزولا 10X.
- احتضان لمدة 10 دقيقة إضافية عند 37 درجة مئوية، والاختلاط بواسطة قلب الأنبوب كل 3-5 دقائق.
- مزيد من فصل الأنسجة ميكانيكيا باستخدام تجويف صغير، مصقول النار ماصة باستير بواسطة pipetting بلطف صعودا ونزولا 10X.
- أجهزة الطرد المركزي في 130 x ج لمدة 5 دقائق.
- إزالة طاف و resuspend بيليه في 1 مل من محلول العازلة (1X HBSS، 30 ملي الجلوكوز، 2 ملي HEPES (درجة الحموضة 7.4)، 26 مم 3 NaHCO). جعل ما يصل الى 10 مل مع حل العازلة.
- أجهزة الطرد المركزي في 130 x ج لمدة 5 دقائق.
- إزالة طاف و resuspend بيليه في 5 مل من 20٪ Percoll. (لتحضير 90٪ Percoll، إضافة 4.5 مل من 100٪ Percoll إلى 0.5 مل من برنامج تلفزيوني 10X ثم مزيد من تمييع هذه إلى 20٪ عن طريق إضافة 1.1 مل من 90٪ إلى 3.9 مل Percoll برنامج تلفزيوني 1X).
- أجهزة الطرد المركزي ل450 x ج لمدة 15 دقيقة.
- إزالة طاف و resuspend بيليه في 10 مل العازلة.
- أجهزة الطرد المركزي في 130 x ج لمدة 5 دقائق.
- resuspend وبيليه في 200 ميكرولتر المتوسطة النمو.
5. جيل من الثقافات أحادي الطبقة تمسكا
- لوحة للSVZ فصلها أو الأنسجة DG الى احد PDL / Laminin المغلفة جيدا لوحة 96 جيدا واحتضان عند 37 درجة مئوية مع 5٪ CO 2.
- ما يقرب من 24 ساعة بعد الطلاء، ومرة واحدة انضمت الخلايا إلى السطح المطلي، تبادل متوسطة النمو إلى مزيد من إزالة الحطام الزائدة.
- كل 3-4 أيام لاحقة، وتبادل نصف المتوسط مع نمو متوسطة جديدة لتجديد عوامل النمو.
- كرر حتى الخلايا تصل إلى ما يقرب من 80٪ confluency وجاهزة للpassaged ملاحظة: الوقت بين الطلاء ومرور الأول يمكن أن تصل إلى 2-3 أسابيع.
الطبقة = "jove_title"> 6. الركض الثقافات أحادي الطبقة تمسكا
- عندما تصل الثقافات حوالي 80٪ confluency إزالة المتوسطة من البئر ويغسل مع برنامج تلفزيوني.
ملاحظة: لا تسمح للخلايا أن تتجاوز 90٪ confluency لأن هذا يمكن أن يؤدي إلى انفصال الخلايا وتشكيل neurosphere وبالإضافة إلى ذلك، ارتفعت مستويات موت الخلية. - إضافة 50 مل Accutase واحتضان عند 37 درجة مئوية لمدة 2-3 دقيقة (فحص لمعرفة ما إذا كانت الخلايا تقريب ومنفصلة).
- إزالة الخلايا إلى أنبوب 15 مل ويغسل مرة واحدة بشكل جيد مع برنامج تلفزيوني ونقل إلى نفس الأنبوب.
- تمييع الخلايا إلى 5 مل مع برنامج تلفزيوني وأجهزة الطرد المركزي 300 x ج لمدة 5 دقائق.
- لمرور الأول، وتمييع الخلايا إلى 1 مل وطبق في PDL / Laminin المغلفة جيدا من 24 لوحة جيدا.
- لالمقاطع اللاحقة، وخلايا resuspend في 200 مل متوسطة النمو والعد باستخدام عدادة الكريات. لوحة في 1 × 10 4 خلية / سم 2 في البئر المغلفة الحجم المناسب أو القارورة. ط>
7. تمايز الثقافات أحادي الطبقة تمسكا
- التفريق بين الثقافات أحادي الطبقة ملتصقة، والخلايا المتكاثرة لوحة على PDL / Laminin coverslips المغلفة في مناطق ذات كثافة من 1 × 10 4 خلية / سم 2 في النمو المتوسط تحتوي على 20 نانوغرام / مل EGF و 10 نانوغرام / مل bFGF.
- عندما تصل خلايا حوالي 80٪ confluency (عادة 2 أيام)، يستعاض عن متوسط النمو مع المتوسط تحتوي على bFGF 5 نانوغرام / مل و 0 نانوغرام / مل EGF.
- 2 أيام التالية في 5 نانوغرام / مل bFGF، استبدل المتوسطة مع النمو المتوسطة في ظل غياب كل من mitogens ل 3 أيام أخرى ملاحظة: خلال هذه الفترة قدرا كبيرا من موت الخلايا سوف تحدث.
- بعد ما مجموعه 5 أيام، وغسل الخلايا مع برنامج تلفزيوني متباينة لإزالة أي خلايا ميتة ثم إصلاح مع بارافورمالدهيد 4٪ (PFA) لمدة 20 دقيقة في درجة حرارة الغرفة.
- يغسل مرة أخرى مع برنامج تلفزيوني لإزالة أي coverslips PFA وتخزينها في الآبار في 1 مل PBS في 4 درجات مئوية.
- تمييع SVZ فصلها أو الأنسجة DG من حيوان واحد في 20 مل من مستنبت لوحة و200 مل / جيد عبر لوحة 96 جيدا باستخدام ماصة 10 مل multidoser.
- احتضان عند 37 درجة مئوية مع نسبة 5٪ CO 2 لمدة 6-7 أيام لneurospheres SVZ المستمدة من و10-12 يوما لneurospheres DG-مشتقة.
ملاحظة: سوف النمو لفترة أطول من هذه الأوقات حضانة أوصت يؤدي إلى فرط وسوف يؤدي إلى موت الخلايا في وسط neurospheres و / أو مرفق عفوية والتمايز. - عد وقياس القطر من neurospheres باستخدام graticule العدسة تركيبها على ضوء المجهر تستقيم
9. الركض على Neurospheres
بعد أن تم فرز neurospheres الأولية وحجمها تسجيلها يمكن توسيعها على مدى عدة مقاطع تبدأ إما مع neurosphere واحدة أو ثقافة السائبة.
- معظم التوسع الثقافة neurosphere
- لمرور neurospheres مجتمعة بوصفها ثقافة السائبة، وإزالة المتوسطة التي تحتوي على neurospheres من لوحة، ونقل إلى أنبوب 15 مل وأجهزة الطرد المركزي في 300 x ج لمدة 5 دقائق.
- تجاهل طاف و resuspend neurospheres في 1 مل من prewarmed 0.05٪ التربسين EDTA-ويحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة حجم مساو من مثبط التربسين التي تحتوي على DNaseI وتخلط جيدا.
- أجهزة الطرد المركزي لمدة 5 دقائق في 300 x ج، وإزالة طاف وإضافة 1 مل من النمو المتوسط.
- يسحن صعودا وهبوطا حوالي 10X مع ماصة P1000 ليفرق بين neurospheres.
- إزالة 10 مل من تعليق خلية وتخلط مع حجم مساو من التريبان الأزرق وإجراء تعداد الخلايا الحية باستخدام عدادة الكريات.
- RESEED الخلايا في مناطق ذات كثافة من 1 × 10 4 خلية / سم 2 في خلية ثقافة الحجم المناسب بشكل جيد أو القارورة.
- احتضان عند 37 درجة مئويةمع 5٪ CO 2 حتى شكل neurospheres الثانوية.
- التوسع neurosphere واحد
- لمرور neurospheres الفردية اختيار الآبار التي تحتوي على neurosphere واحد وإزالة بعناية وتجاهل ما يقرب من 160 ميكرولتر من متوسط النمو من كل بئر من دون إزعاج neurosphere.
- إضافة 100 مل من 0.05٪ التربسين EDTA-إلى كل بئر إلى أن passaged ويحضن في درجة حرارة الغرفة لمدة 3 دقائق.
- إضافة 100 ميكرولتر من التربسين المانع تحتوي على DNAseI لوقف رد الفعل.
- يسحن ما يقرب من 10 مرات صعودا وهبوطا مع ماصة P200 لتحطيم neurosphere.
- نقل 200 مل تحتوي على neurosphere نأت إلى بئر جديدة من 24 لوحة جيدا تحتوي على 1.5 مل من النمو المتوسط. احتضان عند 37 درجة مئوية مع 5٪ CO 2 حتى شكل neurospheres الثانوية.
ملاحظة: لتحديد المحتملة على المدى الطويل، واحدة من الخصائص الأساسية للليالي العصبية الحقيقيةخلية تيم، ينبغي passaged neurospheres لمدة 5-10 على الأقل الممرات. انظر أيضا ما كتب حول تفسير جزء مثير للجدل في تلك النتائج 12-14.
10. تمايز الثقافات Neurosphere
يمكن أن تكون متباينة neurospheres الأولية أو passaged لتحديد multipotentiality.
- إزالة neurospheres في تعليق لوحة من ثقافتهم أو قارورة ونقلها إلى طبق بتري 10 سم من البلاستيك.
- تحت المجهر تشريح إزالة ما يقرب من 15-20 neurospheres من المتوسطة باستخدام ماصة P20 ونقل إلى لوحة 24 أيضا تحتوي على مستنبت دون عوامل النمو وساترة المغلفة PDL / Laminin.
- التفريق لحوالي 7 أيام عند 37 درجة مئوية مع نسبة 5٪ CO 2.
- غسل neurospheres متباينة مع برنامج تلفزيوني لإزالة أي خلايا ميتة ثم إصلاح مع PFA 4٪ لمدة 20 دقيقة في درجة حرارة الغرفة.
- يغسل مرة أخرى مع برنامج تلفزيوني لصemove أي coverslips PFA وتخزينها في الآبار في 1 مل PBS في 4 درجات مئوية
11. المناعية من Neurosphere والثقافات تمسكا
ملاحظة: للحصول على تلطيخ مع الأجسام المضادة O4 حذفت تريتون من الحجب وتلطيخ الخطوات وتذكر أن استخدام الغلوبولين المناعي الأجسام المضادة الثانوية المناسبة.
- لاحتضان coverslips تحتوي على neurospheres متباينة أو الثقافات أحادي الطبقة ملتصقة في عرقلة الحل (10٪ عادي حمار مصل في برنامج تلفزيوني يحتوي على 0.2٪ تريتون X-100) لمدة 60 دقيقة في درجة حرارة الغرفة.
- احتضان في عرقلة الحل الطازجة التي تحتوي على الابتدائية bIII-تويولين، Map2a + ب، الدبقية ييفي الحمضية البروتين (GFAP) أو الأجسام المضادة للO4 60min للبرمجة في درجة حرارة الغرفة.
- غسل 3X مع برنامج تلفزيوني.
- احتضان في عرقلة الحل الطازجة التي تحتوي على الأجسام المضادة الثانوية مترافق مضان المناسبة و4،6-diamidino-2-phenylindole (دابي؛ 1:5،000) لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام. يغسل ثلاث مرات مع برنامج تلفزيوني.
- جبل لل coverslips على الشرائح باستخدام المجهر مضان تصاعد المتوسطة والهواء الجاف في ليلة وضحاها الظلام
- عرض والصورة باستخدام المجهر مضان.
النتائج
على الرغم من أن المنطقتين العصبية للدماغ الفأر الكبار على حد سواء تحتوي على خلايا العصبية السلائف، ويمكن لهذه الخلايا تتصرف بشكل مختلف تماما عند تربيتها في المختبر. تظهر الثقافات أحادي الطبقة ملتصقة المتولدة من كلتا المنطقتين يمكن تمييزها شكليا (الشكل 1A)، ومع ذلك، فإن الثقافات ملتصقة SVZ مشتقة تتكاثر بشكل أسرع وتحتاج إلى passaged، في المتوسط، في وقت سابق من 1-2 أيام من تلك المستمدة من DG. كما neurospheres، والخلايا السلائف SVZ مشتقة أيضا تتكاثر بشكل أسرع وأكبر تشكيل neurospheres (الشكل 1B) من الخلايا السلائف DG-مشتقة (الشكل 1C). في حين neurospheres SVZ المستمدة من عادة تحسب بعد 6-7 أيام في الثقافة، وعادة ما تكون كميا neurospheres DG-مشتقة بعد 10-12 يوما. بالإضافة إلى ذلك، عددا أكبر بكثير من الخلايا العصبية السلائف يقيمون في SVZ مقارنة DG، كما يتضح من عدد ما يقرب من 10 أضعاف أكبر من neurospheres التي يمكن أن تكون جنساتيد من هذه المنطقة (SVZ: 1،173 ± 74.9 مقابل DG: 145.3 ± 26.4، P = <0.0001، ن = 10 الحيوانات لكل مجموعة؛ الشكل 2A).
وقد أظهرت الدراسات أن خلايا السلائف داخل SVZ وDG الرد على محفزات مختلفة. يتم تنشيط الخلايا السلائف في المديرية العامة عن طريق أنواع معينة من التعلم المكاني والمنبهات مثل تخصيب البيئية والنشاط البدني، في حين يتم تنشيط الخلايا السلائف SVZ عن طريق التعلم عن حاسة الشم وحاسة الشم تخصيب. واتساقا مع ذلك، واحد منا (TLW) أظهرت في وقت سابق ان DG يحتوي على عدد سكانها الجذعية الكامنة والخلايا الاصلية التي يمكن تفعيلها من خلال الإثارة العصبية 15-18. في المقابل، وجدنا أن الخلايا السلائف SVZ تستجيب بشكل مختلف تماما لهذا الحافز، مع انخفاض في عدد neurosphere ردا على إزالة إستقطاب مستويات بوكل 17. هنا، ونحن قد تتكرر هذه التجربة، والطلاء نصف الخلايا المعزولة المستمدة من SVZ والمديرية العامة لدائرة الهجرة والجنسيةividual الحيوانات في إزالة إستقطاب مستويات بوكل، والنصف الآخر في السيطرة مستويات بوكل. علينا أن نبرهن، كما سبق، أنه في حين يتم تنشيط الخلايا السلائف DG بواسطة الاستقطاب (101.2 ± 17.4 مقابل 184.8 ± 12.5، ص = 0.005، ن = 5 الحيوانات)، وانتشار الخلايا المشتقة من SVZ هو في الواقع انخفضت بشكل ملحوظ ( 368.0 ± 62.9 مقابل 266.6 ± 41.6، ص = 0.02، ن = 5 الحيوانات؛ الشكل 2B).
لتأكيد المحتملة على المدى الطويل، واحدة من السمات الأساسية للخلية الجذعية صحيح، neurospheres واحد أو الثقافات أحادي الطبقة ملتصقة يجب أن تكون قادرة على التوسع طويلة أي أكثر من 10 على الأقل الممرات. في كل ممر، وبعد إعداد تعليق خلية واحدة، يتم حساب عدد الخلايا ويتم احتساب التوسع أضعاف. ثم يتم احتساب مجموع الخلية النظري بضرب التوسع أضعاف خلال تلك مرور على مجموع النظرية من مرور السابقة. هذا هو DISP الأصغر حجما مثل رسم بياني خط مع عدد مرور تآمر ضد LOG10 من إجمالي عدد الخلايا النظرية (انظر المثال الشكل 3). لتأكيد multipotentiality، سواء الثقافات أحادي الطبقة وneurospheres يمكن تفريقها mitogen الانسحاب وأن تظهر لتؤدي إلى كل من الخلايا العصبية، والخلايا الدبقية (الشكل 4).
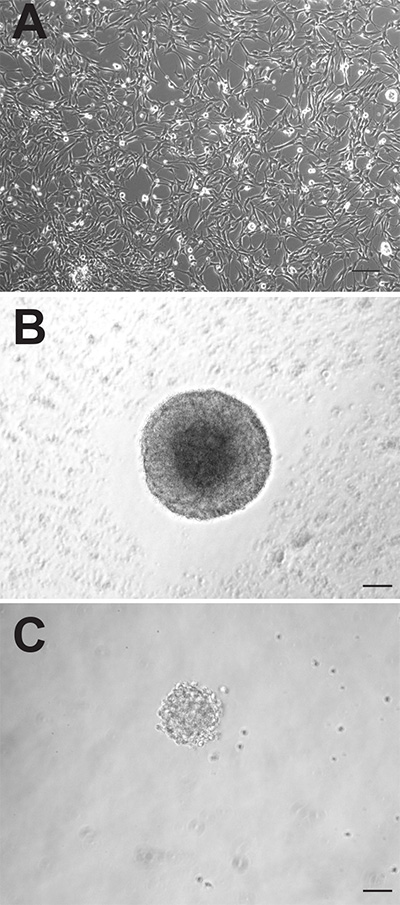
. الرقم 1 الماوس خلايا السلائف الكبار يمكن تربيتها، لأن الحضارات أحادي الطبقة ملتصقة (A) أو كما neurospheres (B: SVZ، C: DG). شريط مقياس هو 50 ملم اضغط هنا لمشاهدة صورة أكبر.
load/51225/51225fig2highres.jpg "سرك =" / files/ftp_upload/51225/51225fig2.jpg "/>
الشكل 2. بشكل ملحوظ يتم إنشاء أكثر من neurospheres SVZ مقارنة DG من الفئران واحدة (A). الخلايا السلائف SVZ وDG تستجيب بشكل مختلف لإزالة الاستقطاب في المختبر (B).

الرقم 3. لتأكيد التقوية على المدى الطويل، يتم توسيع neurospheres لأكثر من 10 المقاطع.

الشكل 4. يمكن أن تكون متباينة في Neurospheres bIII-الأنبوبةلين + الخلايا العصبية (A: أحمر)، GFAP + الخلايا النجمية (A: الأخضر)، O4 + قليلة التغصن (B: أحمر) وMap2ab + الخلايا العصبية (C: أحمر). اضغط هنا لمشاهدة صورة أكبر.
Discussion
تعرض هذه الورقة بروتوكول مفصلة لبدء الثقافات السلائف العصبية، سواء الطبقات الوحيدة ملتصقة كما وneurospheres، من المنطقتين العصبية الرئيسية في مخ الفأر الكبار. هناك عدد من النقاط الهامة التي يجب أن يوضع في الاعتبار عند محاولة أي من هذه النظم في المختبر الثقافة. أولا، اختيار أسلوب التفكك مهم جدا وتعتمد الأنسجة. في أيدينا، 0.05٪ التربسين EDTA-فعالة جدا لتفكك النسيج SVZ، والنتائج في عدد أكبر من neurospheres من عند استخدام تقنية التفكك القائم على غراء. لتفكك النسيج DG ومع ذلك، فإننا نوصي بشدة نهج التفكك القائم على غراء. عند مقارنة مباشرة الأساليب تفارق اثنين على الأنسجة DG، لاحظنا العائد أقل بكثير من خلايا قابلة للحياة، وحوالي 10 أضعاف أقل neurospheres عند استخدام التربسين. هذا الاختلاف في التفكك يمكن أن يكون راجعا إلى الاختلاف في الأنسجة compositioن بين المنطقتين. وتحيط الأنسجة المدمجة التابعة للإدارة العامة من قبل neuropil واسعة ويمكن أن تحدث أضرار واسعة النطاق من خلال العمليات الخلوية التفكك.
والنقطة الثانية الهامة هو أن نلاحظ أنه في حين أن الفحص neurosphere يمكن أن تكون مفيدة في الإدلاء ببيانات كمية عن عدد الخلايا السلائف موجودة في عينة نسيج معين، يجب، مع ذلك، أن تستخدم بعض الحذر في تفسير هذه الأرقام المطلقة. انصهار neurospheres يمكن أن يكون عاملا رئيسيا التباس. وقد أظهرت العديد من الدراسات أن الخلايا العصبية هي متحركة للغاية ويمكن أن تندمج، حتى في ظل ما من المفترض أن تكون الظروف 'النسيلي' 7،19. تردد neurosphere الناتجة يمكن أن تكون تعتمد اعتمادا كبيرا على العوامل بما في ذلك مكونات المتوسطة، وإجراء تشريح وعملية التفكك. حتى بين معالجات خبرة بعض الاختلاف في عدد neurospheres المتولدة من العينات متطابقة يفترض هو واضح (انظر الشكل 1A.) أكثر فائدة، هو المقارنة المباشرة من وتيرة السلائف بين عينتين معين (أي سيطرة مقابل معاملة أو من النوع البري مقابل خروج المغلوب) التي تمت معالجتها بواسطة نفس الشخص في تجربة واحدة، بدلا من بيان الكمي من مجموع عدد الخلايا السلائف.
عند البت فيها الطرق الثقافة الاثنين هو الأكثر ملاءمة لإجراء تجربة معينة فمن المهم أن نلاحظ أن هذه الأنظمة ثقافة اثنين تختلف في تجانس أنواع الخلايا المتولدة. بالمقارنة مع تكاثر الخلايا الملتصقة الثقافات، والتي تظهر على تجمع الخلايا السلائف متجانسة إلى حد ما (~ 98٪ من الخلايا هي Sox2 +) 20، neurospheres أكثر غير متجانسة وتحتوي، فضلا عن تكاثر الخلايا السلائف، الخلايا العصبية متباينة، والخلايا النجمية 21،22. من المهم أن neurospheres ليست مثقف لفترات طويلة بين المقاطع كما أكبر neurosphere تصبح الأرجح هو أن تجد أنواع الخلايا المتمايزة في جوهرها.
نبدأ عادة ملتصقة أحادي الطبقة الثقافات السلائف العصبية من الأنسجة DG ما بين 5-8 الفئران. لذلك، عند محاولة إنشاء الثقافات أحادي الطبقة ملتصقة من DG أو SVZ من ماوس واحدة، يحتاج الرعاية القصوى التي يجب اتخاذها أثناء إجراء تفارق الأنسجة من أجل تجنب موت الخلايا المفرطة الناجمة عن أكثر من الطحن من الأنسجة، أو أخذ تمديد الفترات الزمنية بين تشريح وخطوات زراعة النهائي. يصف هذا البروتوكول، للمرة الأولى، جيل من الثقافات أحادي الطبقة ملتصقة السلائف من كل من SVZ وDG الحيوانات الفردية. هناك العديد من الحالات عندما يحتاج المقارنة بين انتشار السلائف والتمايز إلى أن يتم على أساس حيوان واحد. وتشمل هذه القدرة على مقارنة مباشرة للإدارة العامة لوSVZ الحيوانات الفردية المقترنة باستخدام الإحصاءات والبيانات لإقران الثقافة مع البيانات السلوكية أو الفسيولوجية الفردية 9. ثقافات حيوان واحد أيضا:انخفاض استخدام الحيوانات النادرة المعدلة وراثيا، حيث مجموعة من المانحين 5-8 في ثقافة مطابقة سن غير ممكن، وكذلك الحيوانات الفريدة (مثل الصلبان F2 أو الحيوانات المرباة خارج) لجمعية دراسات الجينية.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد TLW من قبل زمالة ماري كوري الدولية الواردة. وقد تم تمويل هذا العمل أيضا من التمويل المؤسسية الأساسية، Bundesministerium الفراء Bildung وForschung (BMBF) والتمويل جزئيا بدعم من برنامج البحوث ذات الأولوية (SFB) 655 لGK. فإن الكتاب أود أن أشكر آن Karasinsky للرعاية وصيانة جميع الحيوانات المستخدمة في هذه الدراسة وأوديت ليتر، سوزان Ruhwald، فاني بوهمه، وريتشارد يتزيل لزراعة الخلايا والمساعدة المجهري.
Materials
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| poly-D-lysine | Sigma | P7280-5MG | |
| laminin | Roche | 11243217001 | |
| glass pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1X | Life Technologies | 21331-020 | |
| Neural Basal Medium (1X) | Life Technologies | 21103-049 | |
| B27 supplements (50X) | Life Technologies | 17504-044 | |
| Glutamax | Life Technologies | 35050-038 | |
| Heparain | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% trypsin-EDTA | Life Technologies | 25300-054 | |
| trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium & Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1mL syringes | Braun | 2016-10 | |
| 27 Gauge needles | Braun | 4657705 | |
| scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| hemocytometer | Marienfeld | 650010 | |
| trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R & D systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | eppendorf | 30089677 | |
| plastic 10ml and 25mL serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra biosciences | 521942 | |
| multidoser pipette | eppendorf | ||
| 37C waterbath | |||
| dissecting microscope | |||
| 37C:5%Co2 incubator | |||
| centrifuge | eppendorf | 5810R |
References
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved