Method Article
Один мышь, двух культур: Выделение и культивирование взрослых нервных стволовых клеток из двух Нейрогенные зон отдельных мышей
В этой статье
Резюме
Здесь мы описываем подробный протокол для одновременной генерации нейронных клеточных культур предшественник, либо как прикрепленных монослоев или нейросферах, от субвентрикулярной зоны и зубчатой извилине отдельных взрослых мышей.
Аннотация
Нейросфера анализ и приверженец системы культуры монослоя являются ценными инструментами для определения потенциала (пролиферации или дифференцировки) взрослых нервных стволовых клеток в пробирке. Эти анализы могут быть использованы для сравнения потенциал предшественника клеток, выделенных из генетически различных дифференциально или обработанных животных, чтобы определить воздействие внешних факторов на пролиферацию нейронных клеток-предшественников и дифференциации и генерировать нервные линии клеток-предшественников, которые могут быть проанализированы в течение непрерывных проходов. Нейросфера анализ традиционно используется для пост-специальной идентификации стволовых клеток, в первую очередь из-за отсутствия окончательных маркеров, с которой они могут быть выделены из основного ткани и имеет главное преимущество дает быстрый оценку количества клеток предшественника в мозговой ткани происходит от отдельных животных. Адгезивные культуры монослой, напротив, традиционно не использовали для сравнения пролиферацию между отдельными животными, Так как каждый культура обычно инициируют с комбинированной ткани между 5-8 животных. Тем не менее, у них есть большое преимущество, что, в отличие от нейросферы, они состоят из преимущественно однородной популяции клеток-предшественников и полезны для следующих процесса дифференцировки в одиночных камерах. Здесь мы описываем, в деталях, генерацию нейросфер культур и, в первый раз, прилипшие культур от отдельных животных. Это имеет много важных последствий, включая парный анализ пролиферации и / или дифференцировки потенциала как в субвентрикулярной зоне (SVZ) и зубчатой извилине (DG) обработанных или генетически различных линий мышей, а также к значительному сокращению использования животных.
Введение
Нейросфера анализ 1,2 и приверженцем монослой культуры 3,4, как развитых, так в начале 1990-х, до сих пор остаются золотым стандартом в пробирке нервных стволовых клеток анализов. В этих анализах основной ткани микро рассекали от конкретной области мозга, диссоциируют в суспензии отдельных клеток и культивировали в присутствии фактора роста эпидермиса митогены (EGF) и фактора роста фибробластов-2 (FGF2) с образованием либо свободно плавающего кластеры (нейросферы) или прилипшие монослоя. Обе системы имеют ряд преимуществ и недостатков и тщательного рассмотрения должно быть уделено вопросу, который должен решить, прежде чем тот или иной системы выбирается.
Нейросферы позволяют простой считывание различий в числе клеток предшественника и потенциал. Кроме того, нейросферы также являются полезным инструментом для изучения внутренней спецификацию клеток при снятии с их нормальной внешней среды. ExtrinSIC сигналы могут быть изучены путем простого добавления фактор интереса к питательной среды и количественной количество и размер нейросферы генерируемых. Основным недостатком нейросферы однако, является то, что они образуют свою собственную нишу, с клетками в центре нейросферы (особенно крупные нейросферы), являющихся более дифференцированы, чем на поверхности 5. Нейросферы содержат смесь стволовых клеток, совершенных предшественников и дифференцированных клеток и межклеточных взаимодействий в рамках нейросферы противодействия содержание стволовых клеток. Вот почему нейросферы содержать только небольшое количество истинных стволовых клеток 6-8.
Приверженец культуры монослой также обеспечивают хорошую систему в пробирке для моделирования в естественных условиях распространения. Адгезивные культуры, в которой клетки остаются более изолированными и однородной, может устранить гетерогенный характер нейросфера. В этих условиях роста клетки-предшественники размножаться RAPIжественной и почти все клетки делятся и выразить характерные нервные маркеры предшественников нестин, Sox2, и BLBP. Основным недостатком системе культуры монослоя по сравнению с нейросфера анализа является то, что отдельные предшественники полученные клоны не могут быть проверены и количественно.
Недостатком большинства протоколов для обоих типов культур была необходимость использовать относительно большое количество животных, поскольку выход из стратегий изоляции часто было бедных. В то же время, стало ясно, что взрослый нейрогенез способствует индивидуализации мозга 9, в результате чего необходимость в индивидуальных исключая виво моделей. Эти потребности могут быть удовлетворены с помощью "один-мышь-один-культуры" протоколами, как описано в настоящем докладе.
На следующем рисунке протокол описывает одновременное поколение нейронных культур-предшественников как из СВЗ и DG отдельных животных или как приверженец мonolayers или как нейросферы. Генерирование культур от отдельных животных особенно полезно, когда сравнение между индивидуально обработанных животных или различных индивидуальных трансгенных или мышами дикого типа не требуется. Этот протокол содержит подробные инструкции для одновременного микродиссекции СВЗ и DG регионов от взрослых мышей, их разобщенность в суспензии отдельных клеток, культуру в пробирке, как ни приверженцем культур однослойных или нейросферы и анализа multipotentiality и долгосрочным потенциалом, два кардинала свойства костной истинного стволовых клеток.
протокол
1. Основные настройки и подготовка питательной среды
- По крайней мере, за два дня до начала эксперимента, подготовить поли-D-лизин (PDL) / Ламинин покрытием пластин для прикрепленных культурах монослоя. Для подготовки скважин / колбы добавить достаточно PDL (10 мг / мл в дН 2 O) для покрытия поверхности и инкубировать в течение ночи при комнатной температуре. Снимите решение от блюда и мыть блюду три раза по немецкой шкале 2 O. Дайте высохнуть на воздухе. Добавить ЛАМИНИНА (5 мг / мл в холодную DMEM: F12) и инкубировать при 37 ° С в течение ночи. Извлеките ламинин и либо сразу использовать или хранить пластины с ламинин при -20 ° С до использования.
- Подготовить стеклянные шлифованные пипетки с «средний» и «малых» отверстий, поворачивая стекло Пипетки Пастера в пламени, пока края не станут округлые. Автоклав для стерилизации.
- В день вскрытия, подготовить соответствующее количество культуральной среды путем смешивания Neural базальной среде с 2% B27, 1x глютамаксом, 2 мг / мл гепарина, 50 единиц / мл пенициллина / стрептомицина, 20 нг / мл очищенного фактора мышь рецептор класса роста эпидермиса (EGF) и 20 нг / мл рекомбинантного фактора бычьего роста фибробластов (FGF-2). Теплый культуральной среды до 37 ° С на водяной бане.
- Для SVZ диссоциации, готовят 0,05% трипсин-ЭДТА и 0,125 мг / мл ингибитора трипсина, содержащий 0,01 мг / мл DNAseI. Равновесие этих решений до 37 ° C.
- Настройка рассечение микроскоп и подготовить необходимые инструменты для удаления мозг (ножницы и малых шпатель) и СВЗ и DG вскрытий (скальпель, 27 G игла прикреплена к 1 мл шприц, 1 х # 7 щипцы, 1 х # 5/45 щипцы) путем замачивания в 70% этанола.
2. Заготовка Мозги взрослой мыши и СВЗ / DG Microdissections
- Обезболить один взрослый (8-недельных) мышей согласно соответствующим ведомственным руководящим принципам. Выполните шейки дислокации.
- Спрей голову с 70% этанола для стерилизации области и свести к минимуму количество меха, чтоdheres к ножницы и мозга. Использование острыми ножницами обезглавить животное у основания ствола мозга.
- Держа голову у основания черепа, разрезать череп между двумя обонятельных луковиц, помещая одно лезвие небольшого ножницами в каждой полости глаза и резки коронально. Далее, убедитесь, две боковые порезы в то основания черепа, после чего продольного разреза через череп вдоль стреловидного шва Внимание:. Обеспечения угол ножниц является как мелкой, чтобы избежать повреждения основной мозг.
- Expose мозг посредством отслаивания череп с любой лезвия ножниц или парой изогнутых щипцов. Освободите мозг от черепа с помощью небольшого шпателя и место в холодную PBS.
- Промыть мозги с PBS, чтобы удалить кровь и мех.
- Трансфер мозги в 10 см пластиковой чашке Петри, содержащей PBS
- Поместите чашку Петри, содержащую мозг при вскрытии микроскопом при малом увеличении и положение BRAIн на его вентральной поверхности. Использование тонких изогнутых щипцов удалить обонятельные луковицы, удерживая мозг в положении мозжечка.
- Поверните мозг на спинной части и с помощью скальпеля сделать корональной разрез через мозг на уровне зрительного перекреста
- Для microdissect СВЗ (для получения более подробных инструкций, см. также Азари и др.. 10), поместите ростральной части мозга, так что сократить корональной поверхность обращена вверх, а сфокусировать микроскоп на большем увеличении. Снимите и выбросьте перегородки с использованием тонких изогнутых щипцов.
- Рассеките SVZ (тонкий слой ткани, окружающей желудочек), немедленно помещая кончик одного лезвия парой тонких изогнутых щипцов в боковом углу бокового желудочка непосредственно под мозолистого тела и других примерно 1 мм в ткани примыкает к желудочка. Надавите щипцы к основанию блюдо и к вентральной части VENTRключицы, чтобы удалить небольшой треугольный кусок ткани. Поместите расчлененный SVZ в чашку Петри на льду.
- Для microdissect ГД (для получения более подробных инструкций, см. также Hagihara др.. 11), поместите хвостовой части мозга в чашке Петри и разрезать вдоль продольной трещины с помощью скальпеля.
- Под микроскопом рассечение, удалить мозжечок и промежуточного мозга с помощью щипцов.
- Перефокусируйте микроскоп, чтобы границы вокруг ГД теперь видны. Для удаления зубчатой извилине, вставьте кончик иглы 27 G и слайд вдоль границы между ГД и рога Аммона. Используя тонкий пинцет, освободить DG от окружающей ткани.
3. СВЗ ткани Диссоциация
- Фарш ткани с использованием лезвие скальпеля в течение приблизительно 1 мин, пока никаких больших листа не остались.
- Передача фарш ткани на 15 мл пробирку с использованием 1 мл предварительно нагретого 0,05% трипсин-ЭДТА и инкубировали в течение 7 минут вводяная баня установлен на 37 ° С
- Чтобы остановить ферментативную реакцию, добавить 1 мл ингибитор трипсина, содержащим DNAseI и перемешать содержимое, щелкая трубки.
- Гранул подвеску центрифугированием при 300 х г в течение 5 мин и отбросить супернатант
- Ресуспендируют гранул в 1 мл среды роста и диссоциации, осторожно пипеткой вверх и вниз приблизительно 7-10X с использованием P1000 пипетки. Внимание: более перетирания может привести к увеличению гибели клеток и может негативно сказаться на последующем росте клеток.
- Добавить питательную среду до общего объема 5 мл и передать клеточной суспензии через 40-мм сито для удаления мусора и недиссоциированные сгустки ткани.
- Центрифуга при 300 х г в течение 5 мин, отбросить супернатант и ресуспендируют осадок в результате 200 мл среды роста.
4. Д.Г. ткани Диссоциация
- Фарш ткани с использованием лезвие скальпеля в течение приблизительно 1 мин, пока никаких больших листа не остались и передачав предварительно нагретом PDD смеси ферментов (папаин 2,5 ед / мл, диспаза 1 ед / мл, ДНКазой I 250 U / мл). Инкубировать в течение 20 мин при 37 ° С, перемешивание путем обращения трубки каждые 3-5 минут.
- Диссоциируют ткани механически, используя средний отверстие, огонь полированные, пипетки Пастера с помощью пипетки вверх и вниз, осторожно 10x.
- Инкубировать в течение еще 10 мин при 37 ° С, перемешивание путем обращения трубки каждые 3-5 минут.
- Далее отделить ткань механически с помощью небольшой отверстие, огонь полированные пипетки Пастера с помощью пипетки вверх и вниз, осторожно 10x.
- Центрифуга при 130 мкг в течение 5 мин.
- Удалить супернатант и ресуспендируют осадок в 1 мл буфера раствором (1x HBSS, 30 мМ глюкозы, 2 мМ HEPES (рН 7,4), 26 мМ NaHCO 3). Сделать до 10 мл буферного раствора.
- Центрифуга при 130 мкг в течение 5 мин.
- Удалить супернатант и ресуспендируют осадок в 5 мл 20% Percoll. (Чтобы приготовить 90% Перколла, добавьте 4,5 мл 100% Percoll в 0,5 мл 10х PBS затем дополнительно разбавить это до 20%добавлением 1,1 мл 90% Перколла в 3,9 мл 1x PBS).
- Центрифуга 450 мкг в течение 15 мин.
- Удалить супернатант и ресуспендируют осадок в 10 мл буфера.
- Центрифуга при 130 мкг в течение 5 мин.
- Ресуспендируют осадок в 200 мкл ростовой среды.
5. Генерация Приверженец однослойные культуры
- Plate Диссоциированные SVZ или DG ткани в единую PDL / ЛАМИНИНА покрытием лунку 96-луночного планшета и инкубировать при 37 ° С с 5% CO 2.
- Примерно 24 ч после посева, когда клетки присоединились к поверхности, покрытой, обмен питательную среду для дальнейшего удаления избытка мусора.
- Каждые последующие 3-4 дней, обмен половина питательной среды свежей средой для пополнения факторы роста.
- Повторяйте, пока клетки не достигнут примерно 80% слияния и готовы пассировать Примечание:. Промежуток времени между обшивкой и первого прохождения может занять до 2-3 недель.
- Когда культур составит около 80% слияния удалить среды из скважины и промыть PBS.
Примечание: Не позволяют клеткам превышать 90% слияния, так как это может привести к отрыву клеток и нейросфера образования и, кроме того, повышение уровня гибели клеток. - Добавить 50 мл Accutase и инкубировать при 37 ° С в течение 2-3 мин (проверять, если клетки округлены и отдельный).
- Удаление клеток в 15 мл пробирку и промыть хорошо один раз ЗФР и передачи одной и той же трубе.
- Развести клеток в 5 мл с PBS и центрифугировать 300 мкг в течение 5 мин.
- Для первого прохода, разбавленных клеток в 1 мл и пластины в PDL / ламинин покрытием лунку 24-луночного планшета.
- Для последующих проходах, ресуспендирования клеток в 200 мл среды роста и подсчет с помощью гемоцитометра. Пластина в 1 х 10 4 клеток / см 2 в соответствующего размера с покрытием скважины или колбу. я>
7. Дифференциация Приверженец однослойные культуры
- Чтобы различать прилипшие культур монослоев, пластины пролиферирующих клеток на покровных стеклах PDL / ламинин покрытием с плотностью 1 × 10 4 клеток / см 2 в ростовой среде, содержащей 20 нг / мл EGF и 10 нг / мл BFGF.
- Когда клетки достигают примерно 80% слияния (обычно 2 дня), замените питательную среду средой, содержащей 5 нг / мл и оФРФ 0 нг / мл EGF.
- После 2 дней в 5 нг / мл оФРФ, замените носитель с ростовой среде в отсутствие обоих митогены еще в течение 3 дней. Примечание: в этот период значительное количество гибели клеток происходит.
- После в общей сложности 5 дней, мыть дифференцированных клеток с PBS, чтобы удалить любые мертвые клетки затем исправить с 4% параформальдегида (PFA) в течение 20 мин при комнатной температуре.
- Вымойте снова PBS, чтобы удалить любые PFA и хранить покровные в скважинах в 1 мл PBS при 4 ° С.
- Развести диссоциированных SVZ или DG ткани от одного животного в 20 мл культуральной среды и пластины 200 мл / лунку через 96-луночного планшета с использованием 10 мл multidoser пипетки.
- Инкубировать при 37 ° C с 5% CO 2 в течение 6-7 дней для СВЗ-производных нейросферы и 10-12 дней для DG-производных нейросферы.
Примечание: рост более чем на этих рекомендованного времени инкубации приведет к чрезмерно быстрый рост и приведет к гибели клеток в центре нейросферы и / или, спонтанной привязанности и дифференциации. - Граф и измерить диаметр нейросферы помощью окуляра координатную сетку, установленный на вертикальном светового микроскопа
9. Пассажей нейросферы
После первичного нейросферы были подсчитаны и записаны их размер, они могут быть расширены за несколько проходов начиная с любой одной или нейросфера объемной культуры.
- Массовая экспансия культуры нейросфера
- Для прохода в сочетании нейросферы как насыпной культуры, удалите среды, содержащей нейросферы из пластины, трансфер в 15 мл трубки и центрифуге при 300 мкг в течение 5 мин.
- Жидкость над осадком сливают и вновь суспендируют в нейросферы 1 мл предварительно нагретого 0,05% трипсин-ЭДТА и инкубировали при комнатной температуре в течение 3 мин.
- Добавить равный объем ингибитор трипсина, содержащим ДНКазой I и хорошо перемешать.
- Центрифуга течение 5 мин при 300 мкг в, удалите супернатант и добавить 1 мл ростовой среды.
- Растирают вверх и вниз приблизительно в 10 раз с P1000 пипетки для диссоциации нейросферы.
- Удалить 10 мл клеточной суспензии и смешать с равным объемом трипанового синего и выполнить живых клеток с помощью гемоцитометра.
- Повторное заполнение клеток при плотности 1 х 10 4 клеток / см 2 в соответствующей культуры клеток размера скважины или колбу.
- Инкубировать при 37 ° Cс 5% CO 2 до вторичные нейросферы форме.
- Одноместный расширение нейросфера
- Для прохождения отдельных нейросферы выбрать скважин, которые содержат один нейросфера и тщательно удалить и уничтожить около 160 мкл питательной среды из каждой лунки, не нарушая нейросфера.
- Добавить 100 мл 0,05% трипсина-ЭДТА в каждую лунку в пассировать и инкубируют при комнатной температуре в течение 3 мин.
- Добавьте 100 мкл ингибитора трипсина, содержащий DNAseI, чтобы остановить реакцию.
- Растирают примерно в 10 раз вверх и вниз с P200 пипетки Чтобы разбить нейросфера.
- Передача 200 мл, содержащие диссоциированных нейросфера к новому лунку 24-луночного планшета, содержащего 1,5 мл ростовой среды. Инкубируют при 37 ° С с 5% CO 2 до вторичные нейросферах форме.
Примечание: для определения долгосрочного потенциала, один из кардинальных свойств истинного нейронных скамере ПЭК, нейросферы следует пассировать в течение не менее 5-10 проходов. См. также литературу по в части спорной интерпретации таких результатов 12-14.
10. Дифференциация нейросфера культур
Первичные или пассированные нейросферы могут быть дифференцированы для определения multipotentiality.
- Удалить нейросферы в виде суспензии из питательных пластины или колба и перенести их на 10 см пластиковой чашке Петри.
- Под микроскопом рассечение удалить примерно 15-20 нейросферы из среды с помощью пипетки P20 и переносят в 24-луночный планшет, содержащий культуральную среду без факторов роста и покровным PDL / ламинин покрытием.
- Дифференцировать в течение примерно 7 дней при 37 ° С с 5% CO 2.
- Промыть дифференцированные нейросферы с PBS, чтобы удалить любые мертвые клетки затем исправить с 4% PFA в течение 20 мин при комнатной температуре.
- Вымойте снова PBS до галить любые PFA и хранить в покровные скважин в 1 мл PBS при 4 ° С
11. Иммуноокрашивание нейросфера и приверженцем культур
Примечание: Для окрашивания антитела O4 опустить Тритон от блокирующих и окрашивания шагов и не забудьте использовать соответствующий IgM вторичного антитела.
- Инкубируйте покровные, содержащие дифференцированные нейросферы или прилипшие культур монослоев в блокирующем растворе (10% нормальный осел сыворотки в PBS, содержащем 0,2% Тритон Х-100) в течение 60 мин при комнатной температуре.
- Инкубировать в пресной блокирующего раствора, содержащего первичную BIII-тубулина, Map2a + В, глиального фибриллярного кислого белка (GFAP) или O4 антитела в течение 60 мин при комнатной температуре.
- Вымойте 3x с PBS.
- Инкубировать в пресной блокирующего раствора, содержащего соответствующие флуоресцентные конъюгированные вторичные антитела и 4,6-диамидино-2-фенилиндола (DAPI; 1:5000) в течение 30 мин при комнатной температуре в темноте.
- Промыть три раза PBS.
- Установите покровные на предметных стеклах с помощью флуоресцентной монтажный среднего и сухой воздух в темной ночи
- Просмотр и изображения с помощью флуоресцентного микроскопа.
Результаты
Хотя два нейрогенные области мозга взрослых мышей как содержат нервные клетки-предшественники, эти клетки могут вести себя совершенно по-разному при культивировании в лабораторных условиях. Адгезивные культуры монослой, полученные от обеих областях появляются морфологически неразличимы (рис. 1А), однако, SVZ-производные прилипшие культуры размножаться быстрее и должны быть пассируют, в среднем, 1-2 дней раньше, чем те, которые получены из DG. Как нейросферы, СВЗ-производные клетки-предшественники также размножаются быстрее и более крупные нейросферы (Рисунок 1б), чем DG-производных клеток-предшественников (рис. 1в). В то время СВЗ-производные нейросферы обычно подсчитывают через 6-7 дней в культуре, DG-производные нейросферы обычно количественно через 10-12 дней. Кроме того, гораздо большее число нейронных клеток-предшественников находиться в SVZ по сравнению с ГД, о чем свидетельствует почти в 10 раз большего числа нейросферах, которые могут быть родыТед из этого региона (СВЗ: 1173 ± 74,9 против DG: 145,3 ± 26,4, р = <0,0001; п = 10 животных в группе; 2А).
Исследования показали, что клетки-предшественники в пределах SVZ и DG реагировать на различные стимулы. Клетки-предшественники в ГД активируются конкретные виды пространственного обучения и стимулы, такие как охрана окружающей обогащения и физической активности, в то время как СВЗ клетки-предшественники активируются обонятельной обучения и обонятельной обогащения. В соответствии с этим, один из нас (TLW) ранее показали, что DG содержит население скрытой стебля и клеток-предшественников, которые могут быть активированы нервного возбуждения 15-18. В противоположность этому, мы обнаружили, что клетки-предшественники SVZ совершенно по-разному реагировать на этот раздражитель, с уменьшением числа нейросфера в ответ на уровни деполяризации KCl 17. Здесь мы повторили этот эксперимент, покрытие половину выделенных клеток, полученных из СВЗ и ГД индividual животных в деполяризующий уровни KCl, а другая половина в уровнях KCl управления. Мы демонстрируем, как и ранее, что в то время как клетки-предшественники DG активируются деполяризации (101,2 ± 17,4 против 184,8 ± 12,5, р = 0,005, п = 5 животных), распространение СВЗ-клеток, полученных из фактически значительно сократилось ( 368.0 ± 62.9 против 266,6 ± 41,6, р = 0,02, N = 5 животных; Рисунок 2B).
Чтобы подтвердить долгосрочный потенциал, один из кардинальных особенностей истинного стволовой клетки, отдельных нейросферы или прикрепленных культурах монослоя должны быть способны длительного расширения т.е. по меньшей мере 10 пассажей. На каждом проходе, после получения одного клеточной суспензии, число клеток подсчитывали и кратное увеличение рассчитывается. Общая теоретическая клеток затем вычисляется путем умножения кратное увеличение в течение этого прохода теоретической итогом с предыдущем абзаце. Это DISP уложены в виде линейного графика с числом пассажей в виде зависимости от log10 от теоретического общего числа клеток (см. пример рисунок 3). Чтобы подтвердить multipotentiality, оба однослойные культуры и нейросферы могут быть дифференцированы по митогена вывода и быть показано, приводят к обоим нейронов и глии (рис. 4).
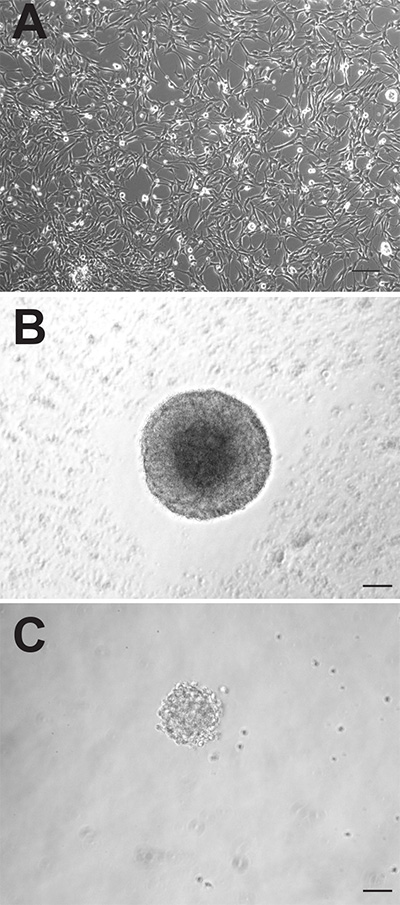
. Мыши клетки-предшественники Рисунок 1 взрослый можно культивировать как прилипшие культур однослойные (А) или как нейросферы (B: СВЗ, C: DG).. Бар шкала 50 мм Кликните здесь, чтобы посмотреть увеличенное изображение.
load/51225/51225fig2highres.jpg "Первоначально" / files/ftp_upload/51225/51225fig2.jpg "/>
Рисунок 2. Значительно больше нейросферы сгенерированы СВЗ по сравнению с ГД одной мышей (А). Клетки-предшественники СВЗ и DG-разному реагируют на деполяризации в пробирке (B).

Рисунок 3. Для подтверждения долговременную потенциацию, нейросферы расширена на протяжении более 10 пассажей.

Рисунок 4. Нейросферы могут быть дифференцированы в Biii-тубулин + нейроны (A: красный), GFAP + астроциты (A: зеленый), O4 + олигодендроциты (B: красный) и Map2ab + нейроны (C: красный). Кликните здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Эта статья представляет собой подробный протокол для инициирования нейронных культур-предшественников, как в качестве прикрепленных монослоев и нейросферы, от двух основных нейрогенных областей мозга взрослых мышей. Есть ряд важных моментов, которые необходимо иметь в виду, при попытке любой из этих культурах клеток. Во-первых, выбор метода диссоциации очень важно и ткань зависимыми. В наших руках, 0,05% трипсин-ЭДТА является очень эффективным для диссоциации SVZ ткани и приводит к более высоким числом нейросферах, чем при использовании методики диссоциации папаин основе. Для диссоциации DG ткани однако, мы настоятельно рекомендуем папаин основе диссоциации подход. Когда непосредственно сравнении двух методов диссоциации на ткани DG, мы наблюдали значительно более низкий выход жизнеспособных клеток и примерно в 10 раз меньше нейросферы при использовании трипсина. Эта разница в диссоциации может быть связано с разницей в ткани СОСТАВн между двумя регионами. Компактный ткань ГД окружен обширным нейропиля и обширные повреждения клеточных процессов может произойти во время диссоциации.
Второй важный момент, который следует отметить, что, в то время как нейросфера анализ может быть полезным, чтобы сделать количественные заявления о количестве клеток-предшественников, присутствующих в данном образце ткани, некоторая осторожность, однако, должны быть использованы в интерпретации этих абсолютных цифрах. Слияние нейросферы может быть основным отягощающим фактором. Несколько исследований показали, что нейроны являются весьма подвижны и могут сливаться, даже в то, что якобы "клоновых" условия 7,19. Результирующая частота нейросфера может быть очень зависит от факторов, включая компонентов среднего, порядок вскрытия и процесса диссоциации. Даже между опытными обработчиков некоторые различия в количестве нейросферы, полученных от якобы идентичных образцов очевидно (см. Рисунок 1a.) Более полезным, является прямое сравнение частоты предшественника между двумя заданными образцов (то есть контроль против лечить или дикого типа против нокаут), обработанных тем же лицом в течение одного эксперимента, а не количественный заявления общего числа клеток-предшественников число.
Решая, какой из двух методов культуры больше всего подходит для конкретного эксперимента, важно отметить, что эти две системы культуры различаются по однородности типов клеток, генерируемых. По сравнению с пролиферирующих прилипшие культур клеток, которые показывают пул достаточно однородной клеточной предшественник (~ 98% клеток Sox2 +) 20, нейросферы более неоднородны и содержат, а также пролиферирующие клетки-предшественники, дифференцированные нейроны, астроциты и 21,22. Важно, что нейросферы не культивировали в течение длительных периодов между проходами как чем больше нейросфера стать тем больше вероятность того, чтобы найти дифференцированные типы клеток в их ядре.
Мы традиционно инициировать прилипшие однослойных нейронных культур-предшественников из DG ткани между 5-8 мышей. Таким образом, при попытке установить прилипшие однослойных культур из ГД или СВЗ одного мыши, все внимание должно быть принято во время процедуры ткани диссоциации для того, чтобы избежать чрезмерного гибель клеток, вызванную более перетирания ткани, или принимая продлен периоды времени между рассечения и заключительных шагов культивирования. Этот протокол описывает, впервые, генерация адгезивных культур монослой предшественников как из SVZ и DG индивидуальных животных. Есть много случаев, когда сравнение пролиферации предшественника и дифференциации должно быть сделано на одном основе животного. Они включают в себя возможность непосредственно сравнить DG и SVZ отдельных животных с использованием парных статистику и для сопряжения культуры данные с отдельных поведенческих или физиологических данных 9. Холост культуры животных также др.низкий использование редких трансгенных животных, где возраст сопоставления пул 5-8 доноров в культуре не представляется возможным, а также уникальных животных (например, F2 крестов или из животных, выращенных) для исследований генетических ассоциаций.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
TLW поддержали Марии Кюри международного входящего стипендий. Эта работа была также финансируется из основного институционального финансирования, Bundesministerium für Bildung и Forschung (BMBF) финансирование и частично при поддержке приоритетного исследовательской программы (SFB) 655 ГК. Авторы хотели бы поблагодарить Энн Karasinsky для ухода и содержания всех животных, используемых в данном исследовании и Одетты Лейтер, Сюзанн Ruhwald, Фанни Беме, и Ричард Ветцель для культуры клеток и помощи микроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| poly-D-lysine | Sigma | P7280-5MG | |
| laminin | Roche | 11243217001 | |
| glass pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1X | Life Technologies | 21331-020 | |
| Neural Basal Medium (1X) | Life Technologies | 21103-049 | |
| B27 supplements (50X) | Life Technologies | 17504-044 | |
| Glutamax | Life Technologies | 35050-038 | |
| Heparain | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% trypsin-EDTA | Life Technologies | 25300-054 | |
| trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium & Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1mL syringes | Braun | 2016-10 | |
| 27 Gauge needles | Braun | 4657705 | |
| scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| hemocytometer | Marienfeld | 650010 | |
| trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R & D systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | eppendorf | 30089677 | |
| plastic 10ml and 25mL serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra biosciences | 521942 | |
| multidoser pipette | eppendorf | ||
| 37C waterbath | |||
| dissecting microscope | |||
| 37C:5%Co2 incubator | |||
| centrifuge | eppendorf | 5810R |
Ссылки
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены