Method Article
Eine Maus, zwei Kulturen: Isolierung und Kultur von adulten neuralen Stammzellen aus dem Zwei Neurogene Zonen der einzelnen Mäuse
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine detaillierte Protokoll für die gleichzeitige Erzeugung von neuralen Vorläuferzellkulturen, entweder als Mono-oder haftNeuroSphären, aus der Subventrikularzone und Gyrus dentatus der einzelnen erwachsenen Mäusen.
Zusammenfassung
Die Neurosphären Assay und die anhaftende Monoschichtkultur-System sind wertvolle Werkzeuge, um das Potential (Proliferation oder Differenzierung) von adulten neuralen Stammzellen in vitro zu bestimmen. Diese Assays können verwendet werden, um das Potenzial der Vorläuferzellen von genetisch unterschiedlichen oder unterschiedlich behandelten Tieren isoliert zu vergleichen, um die Wirkung von exogenen Faktoren auf neurale Vorläuferzellproliferation und Differenzierung zu bestimmen und um neurale Vorläuferzelllinien, die auf kontinuierliche Passagen untersucht werden können, zu erzeugen. Die Neurosphäre Assay wird traditionell für die post-hoc-Identifizierung Stammzellen verwendet, vor allem wegen der mangelnden endgültigen Marker, mit denen sie von primärem Gewebe isoliert werden und hat den großen Vorteil, dass eine schnelle Schätzung der Vorläuferzellzahlen im Hirngewebe von einzelnen Tieren. Adhärenten Monolayer-Kulturen hingegen sind nicht traditionell verwendet, um die Proliferation zwischen den einzelnen Tieren zu vergleichen, Da jede Kultur wird im Allgemeinen aus dem kombinierten Gewebe zwischen 5-8 Tieren begonnen. Allerdings haben sie den großen Vorteil, dass, anders als Neurosphären, einer überwiegend homogenen Population von Vorläuferzellen bestehen, und sie sind nützlich für die nach der Differenzierung in einzelne Zellen. Hier beschreiben wir im Detail die Erzeugung von Neuro Kulturen und zum ersten Mal, adhärenten Kulturen einzelner Tiere. Das hat viele wichtige Auswirkungen einschließlich gepaart Analyse der Proliferation und / oder Differenzierungspotenzial sowohl in der Subventrikularzone (SVZ) und Gyrus dentatus (DG) der behandelten oder genetisch unterschiedlichen Mauslinien, sowie eine signifikante Reduktion in der Tiernutzung.
Einleitung
Die Neurosphäre Assay 1,2 und die adhärenten Monolayer-Kultur 3,4, die beide in den frühen 1990er Jahren entwickelt, immer noch der Goldstandard in vitro neuronale Stammzellassays. In diesen Assays wird Primärgewebe Mikro von einer bestimmten Hirnregion seziert, dissoziiert in eine Einzelzellsuspension in Gegenwart von Mitogenen der epidermale Wachstumsfaktor (EGF) und Fibroblastenwachstumsfaktor kultiviert-2 (FGF2) zu bilden, freischwimm Cluster (Neurosphären) oder adhärenten Monoschichten. Beide Systeme haben eine Reihe von Vor-und Nachteilen und reiflicher Überlegung sollte auf die Frage, die angesprochen werden, bevor eine oder das andere System gewählt wird, ist gegeben.
Neurosphären ermöglichen eine einfache Auslesen der Unterschiede in der Vorläuferzellzahl und Potenzial. Darüber hinaus sind auch Neurosphären ein nützliches Werkzeug zur Festlegung der inneren Zellen zu untersuchen, wenn sie von ihrem normalen Außenumgebung entfernt. Extrinsic Signale können durch einfaches Hinzufügen der Faktor von Interesse in das Wachstumsmedium und zur Quantifizierung der Anzahl und Größe der erzeugten Neurosphären untersucht werden. Der Hauptnachteil der Neurosphären ist jedoch, dass sie ihre eigene Nische bilden, wobei die Zellen in der Mitte der Neurosphären (besonders großen Neurosphären) wobei differenzierter als die auf der Oberfläche 5. Neurosphären enthalten eine Mischung von Stammzellen, Vorläuferzellen gebunden und differenzierten Zellen und die Zell-Zell-Wechselwirkungen in den Neurosphären wirken der Wartung der Stammzellen. Deshalb Neurosphären enthalten nur eine geringe Anzahl von wahren Stammzellen 6-8.
Adhärenten Monolayer-Kulturen bieten auch eine gute In-vitro-System, um in vivo die Proliferation zu modellieren. Adhärenten Kulturen, in denen die Zellen bleiben mehr getrennt und homogen ist, kann die heterogene Natur der Neurosphäre zu beseitigen. Unter diesen Wachstumsbedingungen die Vorläuferzellen vermehren rapidly und fast alle Zellen teilen und drücken die charakteristischen Marker Nestin neuralen Vorläufer, Sox2 und BLBP. Der Hauptnachteil der Monokultur-System im Vergleich zu der Neurosphäre Assay ist, dass einzelne Vorläufer abgeleitete Klone werden nicht beobachtet und quantifiziert werden.
Ein Nachteil der meisten Protokolle für beide Arten von Kulturen war die Notwendigkeit, eine relativ große Anzahl von Tieren zu verwenden, da die Ausbeute der Isolation Strategien oft schlecht gewesen. Zur gleichen Zeit hat sich gezeigt, dass adulte Neurogenese trägt zur Individualisierung des Gehirns 9, was die Notwendigkeit für individuelle Ex-vivo-Modelle. Diese Bedürfnisse können durch "One-Maus-ein-Kultur" Protokolle wie in diesem Bericht beschrieben erfüllt werden.
Die folgende Sicht Protokoll beschreibt die gleichzeitige Erzeugung von neuralen Vorläuferkulturen sowohl aus der SVZ und der GD der einzelnen Tiere entweder als haft monolayers oder als Neurosphären. Die Erzeugung von Kulturen von individuellen Tieren ist besonders nützlich, wenn Vergleiche zwischen den einzelnen behandelten Tier oder verschiedenen individuellen transgenen und Wildtyp-Mäusen erforderlich sind. Dieses Protokoll enthält detaillierte Anweisungen für die gleichzeitige Mikrodissektion der SVZ und der GD Regionen aus erwachsenen Mäusen, deren Dissoziation in einer Einzelzellsuspension, in-vitro-Kultur als entweder adhärenten Monolayer-Kulturen oder Neurosphären und Analyse von multipotentiality und langfristiges Potenzial, die zwei Kardinal Eigenschaften eines Knochen-fide-Stammzelle.
Protokoll
1. Basic Setup und Vorbereitung von Kulturmedium
- Mindestens zwei Tage vor Beginn des Experiments vorbereitet Poly-D-Lysin (PDL) / Laminin beschichteten Platten für adhärente Monolayer-Kulturen. Zur Vorbereitung Wells / Kolben fügen Sie genug PDL (10 mg / ml in dH 2 O), um die Oberfläche und Inkubation über Nacht bei Raumtemperatur. Entfernen Sie die Lösung aus dem Gericht und dem Gericht waschen dreimal mit dH 2 O. An der Luft trocknen. In Laminin (5 mg / ml in kaltem DMEM: F12) und bei 37 ° C über Nacht. Entfernen Sie die Laminin und entweder die Platten sofort oder zu speichern mit dem Laminin bei -20 ° C, bis sie benötigt.
- Bereiten feuerpolierte Pipetten mit "mittel" und "klein" Bohrungen durch rotierende Glaspasteurpipetten in einer Flamme, bis die Kanten abgerundet werden. Autoklav zu sterilisieren.
- Am Tag der Präparation, bereiten Sie die entsprechende Menge an Kulturmedium durch Mischen Neural Basal Medium mit 2% B27, 1x Glutamax, 2 mg / ml Heparin, 50 Einheiten / ml Penicillin / Streptomycin, 20 ng / ml gereinigtem Maus-Rezeptor-Klasse epidermalen Wachstumsfaktor (EGF) und 20 ng / ml rekombinantem Rinder-Fibroblasten-Wachstumsfaktor (FGF-2). Erwärmen des Kulturmediums auf 37 º C in einem Wasserbad.
- Für die SVZ Dissoziation vorzubereiten 0,05% Trypsin-EDTA und 0,125 mg / ml Trypsin-Inhibitor, enthaltend 0,01 mg / ml DNaseI. Äquilibrieren dieser Lösungen auf 37 ° C
- Eine Dissektionsmikroskop Set und bereiten die notwendigen Werkzeuge, um das Gehirn (Schere und kleinen Spatel) zu entfernen und für SVZ und der GD Dissektionen (Skalpell, 27 G-Nadel auf 1 ml Spritze befestigt, 1 x Nr. 7 Zange, 1 x # 5/45 Zange) durch Eintauchen in 70% Ethanol.
2. Die Ernte der erwachsenen Maus Brains und SVZ / DG Mikrodissektionen
- Anesthetize einzelnen Erwachsenen (8 Wochen alt)-Mäusen nach den entsprechenden Richtlinien des Instituts. Führen Genickbruch.
- Sprühen Sie den Kopf mit 70% Ethanol, um den Bereich zu sterilisieren und die Menge von Pelz zu minimieren, dass eindHères der Schere und Gehirn. Mit einer scharfen Schere enthaupten das Tier an der Basis des Hirnstamms.
- Halten Sie den Kopf an der Basis des Schädels, schneiden Sie den Schädel zwischen den beiden Riechkolben, indem Sie ein Blatt eines kleinen Schere in jede Augenhöhle und Schneid koronal. Als nächstes stellen zwei seitliche Schnitte an der Basis des Schädels, gefolgt durch einen Längsschnitt durch den Schädel entlang der Pfeilnaht. Vorsicht: sicherzustellen, dass der Winkel der Schere so flach wie möglich zu beschädigen die zugrunde liegende Gehirn ist.
- Setzen Sie das Gehirn durch den Schädel zurück Peeling entweder mit der Klinge der Schere oder einem Paar von gebogenen Pinzette. Befreie das Gehirn aus dem Schädel mit einem kleinen Spachtel und Ort in kaltes PBS.
- Spülen mit PBS Gehirn, Blut und Fell zu entfernen.
- Übertragen Gehirn zu einer 10 cm Kunststoffpetrischale mit PBS
- Zeigen Petrischale mit dem Gehirn unter einem Binokular bei geringer Vergrößerung und die Position der brain auf der Bauchseite. Mit feinen gebogenen Pinzette entfernen Sie die Riechkolben, während das Gehirn hält in Position durch das Kleinhirn.
- Drehen Sie das Gehirn auf den dorsalen und mit einem Skalpell einen koronalen Schnitt durch das Gehirn auf der Ebene des Chiasma
- Um die SVZ microdissect (detaillierte Anleitung dazu finden Sie auch Azari et al. 10), legen Sie den rostralen Teil des Gehirns, so dass der Schnitt koronalen Oberfläche nach oben zeigt und sich das Mikroskop auf eine höhere Vergrößerung. Entfernen und Entsorgen der Scheidewand mit feinen gebogenen Pinzette.
- Präparieren Sie die SVZ (die dünne Schicht um den Ventrikel Gewebe), indem Sie die Spitze einer Klinge von einer feinen gebogenen Pinzette in der lateralen Ecke des lateralen Ventrikel unmittelbar unter dem Corpus callosum und den anderen etwa 1 mm in das Gewebe sofort angrenzend an den Ventrikel. Drücken Sie die Zange in Richtung der Basis der Schale und in Richtung der ventralen Aspekt der ventrkel, eine kleine dreieckige Stück Gewebe zu entfernen. Legen Sie die seziert SVZ in eine Petrischale auf Eis.
- Um die DG microdissect (detaillierte Anleitung dazu finden Sie auch Hagihara et al. 11), legen Sie die Schwanz Teil des Gehirns, in der Petrischale und entlang der Längsspalte mit einem Skalpell geschnitten.
- Unter einem Dissektionsmikroskop, entfernen Sie das Kleinhirn und Zwischenhirn mit einer Pinzette.
- Refocus das Mikroskop, so dass die Ränder um das DG sind nun sichtbar. Um den Gyrus dentatus zu entfernen, führen Sie die Spitze einer 27 G-Nadel und entlang der Grenze zwischen der DG und Ammonshorn. Mit den feinen Pinzette, befreit das DG aus dem umgebenden Gewebe.
3. SVZ Gewebedissoziation
- Mince das Gewebe mit einem Skalpell für ca. 1 min bis keine großen Stücke bleiben.
- Übertragen des zerkleinerten Gewebes mit einem 15-ml-Röhrchen mit 1 ml vorgewärmtes 0,05% Trypsin-EDTA und Inkubation für 7 min inein Wasserbad auf 37 ° C eingestellt
- Um die enzymatische Reaktion zu stoppen, 1 ml Trypsin-Inhibitor enthält DNaseI und mischen Sie den Inhalt durch Schwenken des Rohres.
- Pellet der Suspension durch Zentrifugation bei 300 g für 5 min und den Überstand verwerfen
- Das Pellet in 1 ml Wachstumsmedium und distanzieren sich ausdrücklich von sanft und Abpipettieren ca. 7-10x mit einem P1000 Pipette. Vorsicht: über Verreiben kann zu erhöhten Zelltod führen und sich negativ auf die nachfolgenden Zellwachstum auswirken.
- In Wachstumsmedium auf ein Gesamtvolumen von 5 ml und übergeben die Zellsuspension durch ein 40-mm-Sieb, um Schmutz und undissoziierten Gewebeklumpen zu entfernen.
- Zentrifuge bei 300 × g für 5 Minuten, Verwerfen des Überstandes und Resuspendieren der resultierenden Pellets in 200 ml Wachstumsmedium.
4. DG Gewebedissoziation
- Hackfleisch das Gewebe unter Verwendung einer Skalpellklinge für etwa 1 min bis keine große Stücke bleiben und TransferPDD in vorgewärmtem Enzym-Mix (Papain 2,5 U / ml Dispase 1 U / ml DNase I 250 U / ml). Inkubation für 20 min bei 37 ° C, Mischen durch Umdrehen des Röhrchens alle 3-5 min.
- Distanzieren das Gewebe mechanisch mit einer mittleren Bohrung, feuerpolierte, Pasteur-Pipette durch Auf-und Abpipettieren vorsichtig 10x.
- Inkubation für weitere 10 min bei 37 ° C, Mischen durch Umdrehen des Röhrchens alle 3-5 min.
- Weitere distanzieren das Gewebe mechanisch mit einer kleinen Bohrung, poliert Feuer Pasteur-Pipette durch Auf-und Abpipettieren vorsichtig 10x.
- Zentrifugieren bei 130 × g für 5 min.
- Entfernen des Überstandes und Resuspendieren des Pellets in 1 ml Pufferlösung (1x HBSS, 30 mM Glucose, 2 mM HEPES (pH 7,4), 26 mM NaHCO 3). Stellen Sie bis zu 10 ml mit Pufferlösung.
- Zentrifugieren bei 130 × g für 5 min.
- Überstand abnehmen und das Pellet in 5 ml 20% Percoll. (So bereiten 90% Percoll, fügen Sie 4,5 ml 100% Percoll zu 0,5 ml 10x PBS verdünnen diese dann weiter auf 20%durch Zugabe von 1,1 ml 90% Percoll auf 3,9 ml 1x PBS).
- Zentrifuge 450 g für 15 min.
- Entfernen des Überstandes und Resuspendieren des Pellets in 10 ml Puffer.
- Zentrifugieren bei 130 × g für 5 min.
- Das Pellet in 200 ul Wachstumsmedium.
5. Erzeugung von adhärenten Monolayer-Kulturen
- Platte der dissoziierten SVZ oder DG Gewebe in einem einzigen PDL / Laminin Vertiefung einer 96-Well-Platte beschichtet und bei 37 ° C mit 5% CO 2.
- Ungefähr 24 Stunden nach der Plattierung, wenn die Zellen an der beschichteten Oberfläche haftet, tauschen das Wachstumsmedium, um überschüssige Schmutz weiter zu entfernen.
- Jeder weitere 3-4 Tage, Austausch Hälfte des Wachstumsmediums mit frischem Medium, um die Wachstumsfaktoren wieder aufzufüllen.
- Wiederholen, bis die Zellen zu erreichen ca. 80% Konfluenz und sind bereit, agiert werden. Hinweis: die Zeit zwischen der Beschichtung und den ersten Durchgang kann bis zu 2-3 Wochen dauern.
- Wenn die Kulturen etwa 80% Konfluenz entfernen Sie das Medium aus dem Brunnen und waschen mit PBS.
Hinweis: Nicht in die Zellen zu 90% Konfluenz überschreiten, da dies zur Ablösung von Zellen und Neurosphärenbildung und darüber hinaus führen, erhöhte Zelltod. - 50 ml Accutase und bei 37 ° C für 2-3 min (zu überprüfen, ob die Zellen sind gerundet und Haus).
- Entfernen Sie die Zellen in ein 15-ml-Tube und waschen das auch einmal mit PBS und Transfer in das gleiche Rohr.
- Verdünnte Zellen mit 5 ml PBS und Zentrifuge 300 × g für 5 min.
- Für den ersten Durchgang, verdünnten Zellen auf 1 ml und die Platte in eine PDL / Laminin Vertiefung einer 24-Well-Platte überzogen.
- Für die folgenden Passagen, Die Zellen in 200 ml Wachstumsmedium und Zahl mit einer Zählkammer. Teller mit 1 x 10 4 Zellen / cm 2 in der entsprechenden Größe und beschichtete oder Kolben. i>
7. Differenzierung von adhärenten Monolayer-Kulturen
- Die anhaftenden Monolayer-Kulturen, Platte proliferierenden Zellen auf PDL / Laminin beschichteten Deckgläschen in einer Dichte von 1 x 10 4 Zellen / cm 2 in Wachstumsmedium mit 20 ng / ml EGF und 10 ng / ml bFGF unterscheiden.
- Wenn die Zellen etwa 80% Konfluenz (in der Regel 2 Tage) zu erreichen, ersetzen Sie das Wachstumsmedium mit Medium mit 5 ng / ml bFGF und 0 ng / ml EGF.
- Nach 2 Tage 5 ng / ml bFGF Ersetzen des Mediums mit Wachstumsmedium in Abwesenheit von beiden Mitogene für weitere 3 Tage Anmerkung:. Während dieser Zeit eine signifikante Menge an Zelltod auftritt.
- Nach insgesamt 5 Tage, waschen Sie die differenzierten Zellen mit PBS auf tote Zellen zu entfernen, dann fix mit 4% Paraformaldehyd (PFA) für 20 Minuten bei Raumtemperatur.
- Wieder mit PBS waschen, um alle PFA und speichern Deckgläser in Bohrlöchern in 1 ml PBS bei 4 ° C entfernen
- Verdünnt das dissoziierte SVZ oder DG Gewebe von einem Tier in 20 ml Kulturmedium und der Platte 200 ml / Vertiefung in eine 96-Well-Platte unter Verwendung einer 10 ml Pipette Multidoser.
- Inkubieren bei 37 ° C mit 5% CO 2 für 6-7 Tage SVZ abgeleiteten Neurosphären und 10-12 Tage für DG abgeleiteten Neurosphären.
Hinweis: Wachstum für mehr als diese empfohlenen Inkubationszeiten in Überwucherung führen und den Zelltod in der Mitte der Neurosphären und / oder spontane Anhaftung und Differenzierung führen. - Graf und messen den Durchmesser der Neurosphären mit einem Okular-Strichplatte in eine aufrechte Lichtmikroskop montiert
9. Passagieren der Neurosphären
Nachdem die primären Neurosphären wurden gezählt und ihre Größe aufgezeichnet sie über mehrere Passagen beginnen entweder mit einem einzelnen oder einer Neurosphäre Groß Kultur erweitert werden.
- Massenkultur Neurosphäre Expansion
- Um Durchgang kombiniert Neurosphären als Massenkultur, entfernen Sie das Medium, das die Neurosphären von der Platte, Transfer in ein 15-ml-Tube und Zentrifuge bei 300 xg für 5 min.
- Verwerfen des Überstandes und Resuspendieren der Neurosphären in 1 ml vorgewärmtes 0,05% Trypsin-EDTA und Inkubation bei Raumtemperatur für 3 min.
- Gleiches Volumen von Trypsin-Inhibitor enthält DNaseI und gut mischen.
- Zentrifuge für 5 min bei 300 g, der Überstand entfernt und 1 ml Wachstumsmedium.
- Man reibt auf und ab etwa 10x mit einem P1000 Pipette, um die Neurosphären zu trennen.
- Entfernen 10 ml der Zellsuspension und mit dem gleichen Volumen Trypanblau mischen und durchzuführen, eine Live-Zellzahl mit einer Zählkammer.
- Reseed die Zellen in einer Dichte von 1 x 10 4 Zellen / cm 2 in der geeigneten Größe der Zellkultur gut oder Kolben.
- Bei 37 ° Cmit 5% CO 2 bis sekundären Neurosphären bilden.
- Einzelneurosphäre Expansion
- Um einzelne Durchgang Neurosphären wählen Brunnen, die eine einzelne Neurosphäre enthalten und sorgfältig entfernen und entsorgen ca. 160 ul des Wachstumsmediums von jedem gut ohne die Neurosphäre zu stören.
- 100 ml von 0,05% Trypsin-EDTA zu jeder Vertiefung zu agiert werden und bei Raumtemperatur für 3 min.
- 100 l Trypsin-Inhibitor enthält DNAseI, um die Reaktion zu stoppen.
- Man reibt etwa 10 mal nach oben und unten mit einer Pipette auf P200 brechen die Neurosphäre.
- Übertragen Sie die 200 ml, der die dissoziierten Neurosphären zu einer neuen Vertiefung einer 24-Well-Platte mit 1,5 ml Wachstumsmedium. Bei 37 ° C mit 5% CO 2 bis sekundären Neurosphären bilden.
Hinweis: Um langfristige Potenzial, einer der Kardinal Eigenschaften eines echten Nerven s bestimmenTEM-Zelle sollte Neurosphären für mindestens 5-10 Passagen agiert werden. Siehe auch die Literatur zum Teil umstrittene Interpretation solcher Ergebnisse 14.12.
10. Differenzierung der Neurosphäre Kulturen
Primär oder agiert Neurosphären unterschieden multipotentiality zu bestimmen.
- Neurosphären in Suspension entfernen von ihren Kulturplatte oder Kolben und sie auf einer 10 cm Petrischale aus Kunststoff.
- Unter einem Dissektionsmikroskop entfernen ca. 15-20 Neurosphären aus dem Medium mit einer Pipette P20 und Transfer zu einer 24-Well-Platte, die die Kulturmedium ohne Wachstumsfaktoren und einer PDL / Laminin beschichteten Deckglas.
- Differenzierung für etwa 7 Tage bei 37 ° C mit 5% CO 2.
- Waschen Sie die differenzierten Neurosphären mit PBS auf tote Zellen zu entfernen, dann fix mit 4% PFA für 20 Minuten bei Raumtemperatur.
- Wieder mit PBS waschen rntfernen keine PFA und speichern Deckgläser in Bohrlöchern in 1 ml PBS bei 4 ° C
11. Immunfärbung von Neurosphäre und adhärenten Kulturen
Hinweis: Für die Färbung mit dem Antikörper O4 weglassen Triton aus den Sperr-und Färbeschritte und denken Sie daran, eine geeignete IgM Sekundärantikörper zu verwenden.
- Inkubiere die Deckgläser mit den differenzierten Neurosphären oder adhärente Monolayer-Kulturen in Blockierungslösung (10% normalem Eselserum in PBS, enthaltend 0,2% Triton X-100) für 60 min bei Raumtemperatur.
- Inkubation in frischem Blockierungslösung mit primären bIII-Tubulin, Map2a + b, saure Gliafaserprotein (GFAP) oder O4 Antikörper für 60min bei Raumtemperatur.
- 3x Waschen mit PBS.
- Inkubieren in frisch Blockierungslösung, die geeignete Fluoreszenz konjugierten sekundären Antikörpern und 4,6-Diamino-2-phenylindol (DAPI; 1:5000) für 30 min bei Raumtemperatur im Dunkeln.
- mit PBS waschen dreimal.
- Montieren Sie die Deckgläser auf Objektträger mittels Fluoreszenz-Eindeckmedium und an der Luft trocknen über Nacht im Dunkeln
- Ansicht und Bild mit einem Fluoreszenzmikroskop.
Ergebnisse
Obwohl die beiden neurogenen Regionen des adulten Maushirn enthalten beide neuralen Vorläuferzellen können diese Zellen sehr unterschiedlich verhalten, wenn sie in vitro kultiviert. Die adhärenten Monolayer-Kulturen von beiden Regionen erzielt erscheinen morphologisch (1A), aber die SVZ abgeleiteten adhärenten Kulturen vermehren sich schneller und müssen agiert werden im Durchschnitt 1-2 Tage früher als die von dem DG abgeleitet. Als Neurosphären, die SVZ abgeleiteten Vorläuferzellen schneller proliferieren und auch größer Neurosphären zu bilden (Fig. 1B) als die DG-abgeleiteten Vorläuferzellen (Fig. 1C). Während SVZ abgeleiteten Neurosphären werden in der Regel nach 6-7 Tagen in Kultur gezählt werden abgeleitet DG-Neurosphären in der Regel nach 10 bis 12 Tagen quantifiziert. Zusätzlich ist eine weit größere Anzahl von neuronalen Vorläuferzellen in der SVZ liegen im Vergleich zu der DG, wie durch die nahezu 10-fach höhere Anzahl von Neurosphären, die Gattungen sein kann bewiesenten aus der Region (SVZ: 1.173 ± 74,9 vs DG: 145,3 ± 26,4, p = <0,0001, n = 10 Tiere pro Gruppe; 2A).
Studien haben gezeigt, dass die Vorläuferzellen innerhalb des SVZ und DG reagieren auf verschiedene Reize. Die Vorläuferzellen in der DG durch bestimmte Typen von räumlichen Lernen und durch Reize wie Umwelt Anreicherung und Bewegung aktiviert, während die SVZ Vorläuferzellen werden durch Lernen und olfaktorische Geruchs Anreicherung aktiviert. In Übereinstimmung damit, einer von uns (TLW) zuvor gezeigt, dass die GD enthält eine Population von latenten Stamm-und Vorläuferzellen, die durch die Erregung aus 15-18 aktiviert werden können. Im Gegensatz dazu fanden wir, dass die SVZ Vorläuferzellen reagieren sehr unterschiedlich auf diesen Reiz, mit einer Abnahme der Neurosphäre Nummer in Reaktion auf depolarisierenden Stufen von KCl 17. Hier haben wir dieses Experiment wiederholt, Überzug Hälfte der isolierten Zellen aus der SVZ und der GD ind abgeleitetividual Tiere in depolarisierende Ebenen der KCl und die andere Hälfte in Steuer KCl Ebenen. Wir zeigen, wie früher, dass, während die DG-Vorläuferzellen werden durch Depolarisation (101,2 ± 17,4 vs 184,8 ± 12,5, p = 0,005, n = 5 Tiere) aktiviert ist, ist die Verbreitung der SVZ-abgeleiteten Zellen in der Tat deutlich gesunken ( 368,0 ± 62,9 vs 266,6 ± 41,6, p = 0,02, n = 5 Tiere; 2B).
Um langfristige Potenzial, einer der Kardinal für einen wahren Stammzelle, Einzelneurosphären oder adhärenten Monolayer-Kulturen bestätigen muss in der Lage erweiterte Expansion dh über mindestens 10 Passagen sein. Bei jedem Durchgang nach der Herstellung einer Einzelzellsuspension, die Anzahl der Zellen wird gezählt, und die Falte Expansion berechnet. Die theoretische Gesamt Zelle wird dann durch Multiplikation des fache Expansion in diesem Durchgang durch die theoretische Gesamt aus dem vorherigen Durchgang berechnet. Dies ist disp als Liniendiagramm mit der Anzahl Durchgang gelegt aufgetragen gegen den log10 der theoretischen Gesamtzellzahl (siehe Beispiel 3). Um multipotentiality bestätigen können beide Monolayer-Kulturen und Neurosphären durch Mitogen Rückzug differenziert und gezeigt Vorrücken in beiden Neuronen geben, und Glia (Abbildung 4).
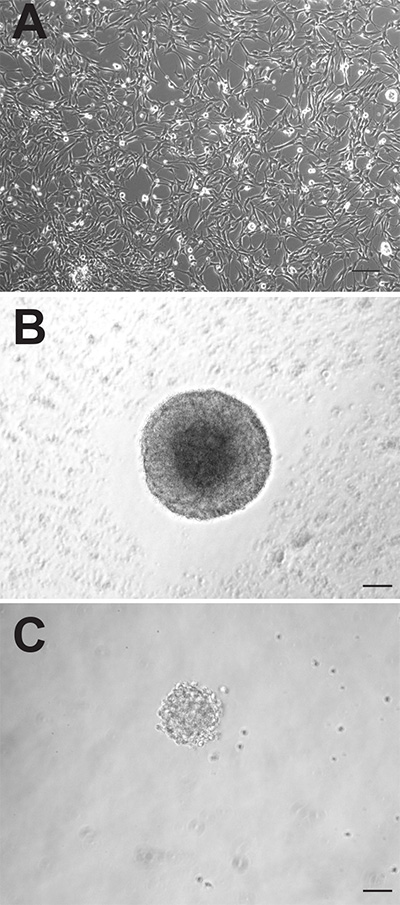
.. Abbildung 1 Erwachsener Maus Vorläuferzellen können als adhärente Monolayer-Kulturen (A) oder als Neurosphären (: SVZ, C: B DG) kultiviert werden. Maßstabsleiste ist 50 mm Klicken Sie hier für eine größere Ansicht.
load/51225/51225fig2highres.jpg "src =" / files/ftp_upload/51225/51225fig2.jpg "/>
Abbildung 2. Deutlich mehr Neurosphären werden von der SVZ erzeugt im Vergleich zu der DG von einzelnen Mäusen (A). Die SVZ und die GD-Vorläuferzellen reagieren unterschiedlich auf die in-vitro-Depolarisation (B).

3. Um Langzeitpotenzierung bestätigen, werden Neurosphären über 10 Passagen erweitert.

Abbildung 4. Neurosphären kann in bIII-rohr differenziert werdenlin + Neuronen (A: rot), GFAP + Astrozyten (A: grün), O4 + Oligodendrozyten (B: rot) und MAP2ab + Neuronen (C: rot). Klicken Sie hier für eine größere Ansicht.
Diskussion
Dieser Beitrag stellt ein ausführliches Protokoll für die Einleitung von neuralen Vorläufer Kulturen, sowohl als Monoschichten haft und Neurosphären, von den beiden großen neurogenen Regionen des adulten Gehirn der Maus. Es gibt eine Anzahl wichtiger Punkte, die, wenn versucht wird diesen beiden Kultursystemen gehalten werden müssen. Zum einen ist die Wahl der Dissoziation Verfahren sehr wichtig und ist gewebeabhängig. In unseren Händen, 0,05% Trypsin-EDTA sehr effektiv für die Dissoziation des SVZ Gewebe und führt zu einer höheren Anzahl von Neurosphären als bei Verwendung einer Papain-Spalttechnik basiert. Für die Dissoziation von DG Gewebe jedoch empfehlen wir dringend eine Papain-basierten Ansatz Dissoziation. Beim direkten Vergleich der beiden Methoden auf Dissoziation DG Gewebe beobachteten wir eine deutlich geringere Ausbeute der lebensfähigen Zellen und ca. 10-fach weniger Neurosphären bei der Verwendung von Trypsin. Dieser Unterschied in der Dissoziation kann durch den Unterschied in der Gewebe compositio seinn zwischen den beiden Regionen. Die kompakte Gewebe des DG ist durch umfangreiche Neuropil umgeben und umfangreiche Schäden zellulärer Prozesse während Dissoziation auftreten.
Ein zweiter wichtiger Punkt ist, dass, während der Neurosphäre Assay kann sinnvoll sein, quantitative Aussagen über die Anzahl der Vorläuferzellen in einem bestimmten Gewebeprobe Gegenwart zu machen, einige Vorsicht ist jedoch bei der Interpretation dieser absoluten Zahlen verwendet werden. Fusion von Neurosphären kann ein wichtiger Störfaktor sein. Mehrere Studien haben gezeigt, dass Neuronen sind sehr beweglich und kann auch unter welche angeblich "klonalen" Bedingungen 7,19 verschmelzen. Die daraus resultierende Neurosphäre Frequenz kann sehr abhängig von Faktoren, einschließlich der mittelfristigen Komponenten, Verfahren der Präparation und der Dissoziation Prozess sein. Auch zwischen erfahrenen Hand gewisse Variation in der Anzahl der Neurosphären von angeblich identischen Proben erzeugt ist offensichtlich (siehe 1A.) Mehr nützlich, ist ein direkter Vergleich der Vorläuferfrequenz zwischen zwei gegebenen Proben (dh Steuer vs behandelt oder Wildtyp-vs-Knock-out) von der gleichen Person in einem einzigen Experiment behandelt, sondern als eine quantitative Aussage der Gesamt Vorläufer-Zellzahl.
Bei der Entscheidung, welche der beiden Kulturverfahren am besten geeignet für ein bestimmtes Experiment ist es wichtig zu beachten, dass diese beiden Kultursysteme unterscheiden sich in der Homogenität der erzeugten Zelltypen. Im Vergleich zu vermehren adhärenten Zellkulturen, die eine ziemlich homogene Vorläuferzellpool (~ 98% der Zellen sind Sox2 +) zeigen 20 sind Neurosphären heterogener und enthalten sowie wuchernden Vorläuferzellen differenzierten Neuronen und Astrozyten 21,22. Es ist wichtig, dass die Neurosphären sind nicht für längere Zeiträume zwischen den Kanälen größer ist als die kultivierten Neurosphären werden, desto wahrscheinlicher ist es, um differenzierte Zelltypen in ihrem Kern zu finden.
Wir initiieren traditionell adhärenten Mono neuralen Vorläuferkulturen aus dem DG Gewebe zwischen 5-8 Mäusen. Deshalb, wenn Sie versuchen, die adhärenten Monolayer-Kulturen von der DG oder SVZ von einem einzigen Mausklick zu etablieren, muss die Sorgfalt während der Gewebedissoziation Verfahren, um zu treffen, um übermäßigen Zelltod durch über Verreiben des Gewebes zu vermeiden, oder sich verlängert Zeit zwischen der Präparation und letzten Kultivierungsschritte. Dieses Protokoll beschreibt zum ersten Mal die Erzeugung von adhärenten Monovorläuferkulturen vor der SVZ und DG einzelner Tiere. Es gibt viele Fälle, in denen der Vergleich der Vorläufer Proliferation und Differenzierung muss auf einem einzigen Tier Basis erfolgen. Dazu gehören die Möglichkeit, direkt zu vergleichen, die DG und SVZ der einzelnen Tiere mit gepaart Statistiken und Daten zur Kultur mit individuellen Verhaltens-oder physiologische Daten 9 koppeln. Einzeltier Kulturen auch alNieder der Einsatz von transgenen Tieren selten, wo alterspass einen Pool von 5-8 Spendern pro Kultur nicht möglich ist, sowie einzigartige Tiere (zB F2 oder Kreuze aus gezüchteten Tieren) für genetische Assoziationsstudien.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
TLW wurde durch ein Marie-Curie-Fellowship International Eingehendes unterstützt. Diese Arbeit wurde auch von der Grundlagen institutionellen Förderung finanziert, Bundesministerium für Bildung und Forschung (BMBF) die Finanzierung und teilweise mit Unterstützung von Schwerpunktprogramm (SFB) 655 bis GK. Die Autoren bedanken sich bei Anne Karasinsky für die Pflege und Wartung aller in dieser Studie verwendeten Tiere und Odette Leiter, Susann Ruhwald, Fanny Böhme und Richard Wetzel für die Zellkultur und Mikroskopie Unterstützung danken.
Materialien
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| poly-D-lysine | Sigma | P7280-5MG | |
| laminin | Roche | 11243217001 | |
| glass pastuer pipettes | Volac | BS5732 | |
| DMEM:F12 (1:1) 1X | Life Technologies | 21331-020 | |
| Neural Basal Medium (1X) | Life Technologies | 21103-049 | |
| B27 supplements (50X) | Life Technologies | 17504-044 | |
| Glutamax | Life Technologies | 35050-038 | |
| Heparain | Sigma | H3393 | |
| Penacillin/Streptomycin | Life Technologies | 15140-122 | |
| EGF | PeproTech | AF-100-15 | |
| bFGF | PeproTech | 100-18B | |
| 0.05% trypsin-EDTA | Life Technologies | 25300-054 | |
| trypsin inhibitor | Sigma | T6522 | |
| DNaseI | Roche | 10104159001 | |
| Accutase | PAA | L11-007 | |
| Papain | Worthington | LS003120 | |
| Dispase | Life Technologies | 17105-041 | |
| Percoll | GE Healthcare | 17-0891-02 | |
| HBSS (with Calcium & Magnesium) | Life Technologies | 14025-050 | |
| Glucose | Roth | X997.2 | |
| HEPES | Sigma | H3375-500G | |
| NaHCO3 | Merck | K39347429847 | |
| 1mL syringes | Braun | 2016-10 | |
| 27 Gauge needles | Braun | 4657705 | |
| scalpels (#22 disposable) | Braun | BA222 | |
| Dumont #7 forceps | FST | 11271-30 | |
| Dumont 5/45 forceps | FST | 11251-35 | |
| scissors | FST | 14060-10 | |
| Iris spatula | FST | 10093-13 | |
| 70% ethanol | |||
| PBS | Life Technologies | 14040-091 | |
| flasks/well plates | TPP | 92696 | |
| PFA (4%) | Sigma | P6148 | |
| hemocytometer | Marienfeld | 650010 | |
| trypan blue (0.4%) | Sigma | T8154 | |
| NDS | Millipore | 530 | |
| TritonX-100 | Sigma | T9284 | |
| mouse monoclonal bIII-tubulin antibody | Promega | G712A | |
| rabbit polyclonal glial fibrillary acidic protein antibody | Dako | 20334 | |
| O4 | R & D systems | MAB1326 | |
| Map2a+b | Sigma | M1406 | |
| donkey anti-mouse Cy3 antibody | Jackson ImmunoResearch | 715-505-151 | |
| donkey anti-rabbit Alexa488 | Dianova | 711-545-152 | |
| 4,6-diamidino-2-phenylindole (DAPI) | Invitrogen | 861405 | |
| Aqua Polymount | Polysciences Inc | 18606 | |
| 10 ml Combi tips | eppendorf | 30089677 | |
| plastic 10ml and 25mL serological pipettes | Corning | 4488/4489 | |
| EQUIPMENT | |||
| Pipetboy | Integra biosciences | 521942 | |
| multidoser pipette | eppendorf | ||
| 37C waterbath | |||
| dissecting microscope | |||
| 37C:5%Co2 incubator | |||
| centrifuge | eppendorf | 5810R |
Referenzen
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Reynolds, B. A., Weiss, S. Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell. Dev. Biol. 175, 1-13 (1996).
- Palmer, T. D., Ray, J., Gage, F. H. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol. Cell. Neurosci. 6, 474-486 (1995).
- Ray, J., Raymon, H. K., Gage, F. H. Generation and culturing of precursor cells and neuroblasts from embryonic and adult central nervous system. Methods Enzymol. 254, 20-37 (1995).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993, 18-29 (2003).
- Babu, H., Cheung, G., Kettenmann, H., Palmer, T. D., Kempermann, G. Enriched monolayer precursor cell cultures from micro-dissected adult mouse dentate gyrus yield functional granule cell-like neurons. PLoS One. 2, (2007).
- Jessberger, S., Clemenson, G. D., Gage, F. H. Spontaneous fusion and nonclonal growth of adult neural stem cells. Stem Cells. 25, 871-874 (2007).
- Reynolds, B. A., Tetzlaff, W., Weiss, S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes. J. Neurosci. 12, 4565-4574 (1992).
- Freund, J., et al. Emergence of individuality in genetically identical mice. Science. 340, 756-759 (2013).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J. Vis. Exp. , (2010).
- Hagihara, H., Toyama, K., Yamasaki, N., Miyakawa, T. Dissection of hippocampal dentate gyrus from adult mouse. J. Vis. Exp. , (2009).
- Jensen, J. B., Parmar, M. Strengths and limitations of the neurosphere culture system. Mol. Neurobiol. 34, 153-161 (2006).
- Pastrana, E., Silva-Vargas, V., Doetsch, F. Eyes wide open: a critical review of sphere-formation as an assay for stem cells. Cell. Stem Cell. 8, 486-498 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres- re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Walker, T. L., Turnbull, G. W., Mackay, E. W., Hannan, A. J., Bartlett, P. F. The latent stem cell population is retained in the hippocampus of transgenic Huntington's disease mice but not wild-type mice. PLoS One. 6, (2011).
- Walker, T. L., et al. Prolactin stimulates precursor cells in the adult mouse hippocampus. PLoS One. 7, (2012).
- Walker, T. L., et al. Latent stem and progenitor cells in the hippocampus are activated by neural excitation. J. Neurosci. 28, 5240-5247 (2008).
- Walker, T. L., et al. Prominin-1 allows prospective isolation of neural stem cells from the adult murine hippocampus. J. Neurosci. 33, (2013).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
- Babu, H., et al. A protocol for isolation and enriched monolayer cultivation of neural precursor cells from mouse dentate gyrus. Front. Neurosci. 5, 89 (2011).
- Parmar, M., Sjoberg, A., Bjorklund, A., Kokaia, Z. Phenotypic and molecular identity of cells in the adult subventricular zone in vivo and after expansion in vitro. Mol. Cell Neurosci. 24, 741-752 (2003).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99, 14506-14511 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten