A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الاستقرار البروتين المتواجد في الحي اسماك الزرد الأجنة عن طريق الإسفار تسوس بعد Photoconversion (FDAP)
In This Article
Summary
وغالبا ما ينظم مستويات البروتين في الخلايا والأنسجة بإحكام بواسطة ميزان إنتاج البروتين والتخليص. باستخدام الإسفار تسوس بعد Photoconversion (FDAP)، حركية إزالة البروتينات يمكن قياسها تجريبيا في الجسم الحي.
Abstract
استقرار البروتين يؤثر جوانب كثيرة من الأحياء، ويمكن قياس حركية إزالة البروتينات توفر معلومات هامة في النظم البيولوجية. في التجارب FDAP، يمكن قياس إزالة البروتينات داخل الكائنات الحية. والموسومة بروتين في المصالح مع بروتين فلوري photoconvertible، أعرب في الجسم الحي وphotoconverted، ويتم رصد انخفاض في إشارة photoconverted مع مرور الوقت. ثم تم تجهيز البيانات مع نموذج التخليص المناسب لتحديد بروتين نصف الحياة. الأهم من ذلك، يمكن فحص حركية تخليص السكان من البروتين في مقصورات مختلفة من الكائنات الحية بشكل منفصل من خلال تطبيق أقنعة المجزئ. وقد استخدم هذا الأسلوب لتحديد نصف العمر البينية وخارج الخلية من البروتينات مما يشير يفرز خلال تطوير الزرد. هنا، نحن تصف بروتوكول للتجارب FDAP في الأجنة الزرد. ينبغي أن يكون من الممكن استخدام FDAP لتحديد حركية تطهيرأي بروتين taggable في أي كائن الوصول بصريا.
Introduction
ويتم تحديد مستويات البروتينات في الخلايا والكائنات الحية بنسب إنتاجها والتخليص. يمكن أن البروتين نصف العمر تتراوح بين دقائق إلى أيام 1-4. في كثير من النظم البيولوجية، والاستقرار أو التخليص من البروتينات الرئيسية له آثار مهمة على النشاط الخلوي. مطلوب تعديل للاستقرار البروتين داخل الخلايا لتقدم دورة الخلية 5،6، مما يشير التنموية 7-9، موت الخلايا المبرمج 10، وظيفة عادية وصيانة الخلايا العصبية 11،12. يؤثر الاستقرار البروتين خارج الخلية توزيع وتوافر البروتينات يفرز مثل morphogens 13،14، داخل الأنسجة.
على مدى العقود القليلة الماضية، أساسا تم تقييم استقرار البروتين في زراعة الخلايا باستخدام المشع نبض وضع العلامات أو التجارب مطاردة سيكلوهيكسيميد 15. في مثل هذه التجارب نبض مطاردة، وإما عابر تتعرض الخلايا إلى "نبض" للالأمينية المشعالسلائف حمض التي يتم إدراجها في البروتينات تصنيعه حديثا، أو يتعرضون لسيكلوهيكسيميد، الذي يثبط تخليق البروتين. ثم يتم جمع الخلايا المستزرعة في نقاط زمنية مختلفة، ويستخدم إما مناعي تليها تصوير الإشعاع الذاتي (في المشعة التجارب نبض مطاردة) أو ويسترن النشاف (في التجارب سيكلوهيكسيميد) لقياس التخليص من البروتين مع مرور الوقت.
التقليدية المقايسات الاستقرار البروتين لديهم العديد من أوجه القصور. أولا، وغالبا ما تكون غير أعرب البروتينات في هذه المقايسات في بيئاتهم المحلية، وإنما في زراعة الأنسجة وأحيانا في الخلايا من الأنواع المختلفة. للبروتينات التي الاستقرار هو تعتمد على السياق، وهذا النهج هو إشكالية. ثانيا، ليس من الممكن لمتابعة إزالة البروتين في الخلايا الفردية أو الكائنات الحية على مر الزمن، والبيانات من هذه المقايسات يعكس ما معدله مجموعات مختلفة من الخلايا في نقاط زمنية مختلفة. منذ الخلايا الفردية قد بدأتمع كميات مختلفة من البروتين، قد اتخذوا التسمية المشعة أو سيكلوهيكسيميد في أوقات مختلفة، أو قد يكون حركية التخليص مختلفة، مثل هذه البيانات الإجمالية يمكن أن تكون مضللة. وأخيرا، في حالة من التجارب مطاردة سيكلوهيكسيميد، إضافة تخليق البروتين المانع قد يكون لها آثار فسيولوجية غير مقصودة يمكن أن يغير بشكل مصطنع الاستقرار بروتين 16-18. ويمكن تجنب هذه العيوب باستخدام الإسفار تسوس بعد Photoconversion (FDAP)، وهي تقنية تستخدم البروتينات photoconvertible لقياس إزالة بروتين حيوي في الكائنات الحية 19-25 (انظر مناقشة لقيود تقنية FDAP).
البروتينات Photoconvertible هي البروتينات الفلورية التي الإثارة وخصائص الانبعاثات تغيير بعد التعرض للموجات محددة من الضوء 26. واحدة البديل شيوعا هو Dendra2، وهو بروتين photoconvertible "الأخضر إلى الأحمر" الذي لديه في البداية السابقالاقتباس والانبعاثات خصائص مشابهة لالبروتينات الفلورية الخضراء، ولكن بعد التعرض للأشعة فوق البنفسجية ضوئية "photoconversion" -its الإثارة / خصائص الانبعاثات تصبح مماثلة لتلك التي من البروتينات الفلورية الحمراء 23،27. الأهم من ذلك، سوف تنتج البروتين الجديد بعد photoconversion ليس لديه نفس الخصائص الإثارة / الانبعاثات مثل البروتين photoconverted، مما يسمح للفصل الإنتاج والتخليص على photoconversion ومراقبة سوى مجموعة من البروتين photoconverted. علامات البروتينات في المصالح مع البروتينات photoconvertible بالتالي يوفر وسيلة مريحة لنبض التسمية البروتينات في الكائنات الحية سليمة، ويمكن الوصول إليها بصريا.
في المقايسات FDAP (الشكل 1A)، والموسومة بروتين في المصالح مع بروتين photoconvertible وأعرب في كائن حي (الشكل 1B). وphotoconverted البروتين الانصهار، ويتم رصد انخفاض في إشارة photoconverted مع مرور الوقت من قبل fluorescenم المجهري (الشكل 1C). ثم تم تجهيز البيانات مع نموذج مناسب لتحديد عمر النصف من البروتين الانصهار (الشكل 1D).
وقد تم تصميم مقايسة FDAP الموضحة هنا لتحديد الخلية أعمار النصف من يفرز البروتينات مما يشير في الأجنة الزرد خلال مرحلة التطور الجنيني المبكر 19. ومع ذلك، يمكن تكييف هذا النهج إلى أي كائن نموذج شفاف تتسامح التصوير الحي، ويمكن استخدامها لمراقبة إزالة أي البروتين داخل الخلايا أو الخلية taggable. وقد أجريت الاختلافات في تقنية الموضحة هنا في الخلايا المستزرعة 20،23 وذبابة الفاكهة 22 و الماوس 21 الأجنة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. توليد وPhotoconvertible فيوجن بناء والحقن Dechorionated اسماك الزرد الأجنة
- توليد بناء وظيفية تحتوي على البروتين من الفائدة تنصهر لبروتين photoconvertible الأخضر إلى الأحمر (انظر مناقشة)، ثم استخدام النسخ في المختبر لتوليد توج مرنا ترميز البروتين الانصهار كما هو الحال في مولر وآخرون، 2012 (19).
- استخدام pronase لإزالة chorions من حوالي 30 الأجنة الزرد في مرحلة خلية واحدة. بدلا من ذلك، dechorionate أجنة باستخدام ملقط 28 يدويا.
ملاحظة: يجب أن dechorionated الأجنة للتصوير لاحق. إذا رغبت في ذلك، يمكن حقن أجنة من خلال المشيمه وdechorionated في وقت لاحق، فقط قبل التصوير.- جعل 5 ملغ / مل من محلول المخزون pronase من المتسلسلة غريس في معيار الجنين الزرد المتوسطة 19. صخرة الحل بلطف في RT لمدة 10 دقيقة للسماح للالبروتيني إلى حل. قسامة 2 مل في أنابيب microcentrifuge وتجميد في -20 ° C.
- نقل مرحلة خلية واحدة الأجنة ليبلغ قطرها 5 سم من الزجاج أو البلاستيك طبق بتري المغلفة التي تحتوي على الاغاروز ~ 8 مل المتوسط الجنين. إضافة 2 مل من محلول المخزون إذابة pronase إلى الطبق واحتضان في RT لمدة 5 إلى 10 دقيقة.
- تجنب تعريض الأجنة إلى الهواء أو البلاستيك، والاتصال مع أي سيتسبب الأجنة dechorionated إلى تمزق. ملء كوب كوب 200 مل مع الجنين المتوسطة. نقل الأجنة إلى دورق عن طريق إمالة طبق بيتري في حين غمر في المتوسط.
- بعد أن استقر الأجنة إلى قاع الكأس، من اجل الخروج أكثر من المتوسط الجنين، ثم صب المتوسطة الجنين جديدة في الكأس. ويحوم خفيفة من المتوسط تصب في كوب تسبب الأجنة لانقاص chorions من ضعف.
- كرر الخطوة 1.2.4.
- نقل الأجنة dechorionated لحقن طبق المغلفة الاغاروز 29 باستخدام الزجاج ماصة باستير مع طرف ملتهب. ملتهبغيض ماصة يمنع حواف خشنة من أجنة إصابة.
- شارك في حقن مرنا و3 كيلو دالتون Alexa488-ديكستران المتقارن 29،30 (1B الشكل، وانظر مناقشة لمقترح مرنا وكميات Alexa488-ديكستران). حقن مباشرة في مركز الخلية (وليس صفار) لضمان حتى توزيع مرنا وصبغة الفلورسنت مرة واحدة تبدأ الانقسام.
ملاحظة: سيتم استخدام إشارة Alexa488 خلال تحليل البيانات لتوليد أقنعة المجزئ من أجل التمييز بين داخل وخارج الخلية مضان. - نقل الأجنة المحقونة إلى 1-2٪ المغلفة الاغاروز جيدا طبق ستة جيدا البلاستيك مليئة المتوسط الجنين. احتضان في الظلام في 28 ° C حتى وصلت إلى الأجنة في مرحلة متأخرة المجال 31 (حوالي 5 ساعة بعد الإخصاب). تحقق أجنة كل واحد إلى 2 ساعة تحت stereomicroscope وإزالة أي حطام الناتجة عن الأجنة التي لقوا حتفهم.
2. تركيب اسماك الزرد الأجنة لPhotoconversion والتصوير على مقلوب متحد البؤر المجهر
- استخدام stereomicroscope لتحديد 1-5 أجنة سليمة، واستخدام ماصة باستير الزجاج مع طرف ملتهب لإخراجها من الطبق.
- إخراج بلطف الأجنة في أنبوب microcentrifuge تحتوي ~ 1 مل من ذاب 1٪ نقطة انصهار منخفضة الاغاروز في 1X Danieau في المتوسط الجنين (انظر المواد القائمة) (الشكل 2A).
ملاحظة: يجب أن يكون لديك الاغاروز درجة حرارة تتراوح بين 40 و 42 درجة مئوية. يمكن أن ارتفاع درجات الحرارة يؤدي إلى تلف الأجنة. - رسم الأجنة مرة أخرى إلى ماصة جنبا إلى جنب مع بعض الاغاروز. إخراج بلطف الاغاروز والأجنة على الزجاج غطاء من صحن الزجاج السفلي (الشكل 2B). تأكد من أن سماكة الزجاج غطاء متوافق مع الهدف على المجهر متحد البؤر.
- إعادة استخدام ماصة الزجاج اذا شئت. لتنظيف الاغاروز المتبقية للخروج من ماصة ومنع انسداد، بسرعة ماصة الجنين المتوسطة صعودا وهبوطا.وضع أنبوب 15 مل مليئة ~ 5 مل من المتوسط الجنين بجوار stereomicroscope لهذا الغرض.
- استخدام مجس معدني لوضع الأجنة بحيث القطب الحيواني (الأريمة) يواجه غطاء زجاجي. العمل بسرعة منذ الاغاروز سوف يصلب في 20-30 ثانية. استخدام stereomicroscope لمراقبة المواقف الأجنة "وتعديل حسب الضرورة حتى يصلب الاغاروز.
- كرر الخطوات من 2،1-2،4 حتى يتم تركيبه العدد المرغوب فيه من الأجنة.
ملاحظة: في تجربة نموذجية، وأربعة قطرات الاغاروز تحتوي على أربعة أو خمسة أجنة كل تناسب بسهولة على غطاء زجاجي. ولا يمكن تصوير حوالي 16 الأجنة خلال تجربة مثالية واحدة (الشكل 2C). - عندما عززت agarose، وملء طبق من الزجاج السفلي مع 1X Danieau في المتوسط الجنين.
3. Photoconverting وقياس تصغير للPhotoconverted الإشارة
والهدف 25X 40X أو المياه طليالي يتناسب مع حجم ومعامل الانكسار من الأجنة الزرد. فمن الأفضل لاستخدام النفط الغمر مع نفس معامل الانكسار مثل الماء بدلا من الماء الفعلي، لأن المياه تتبخر خلال التجربة التي استمرت خمس ساعات. تأكد من أن النفط الغمر تم تصميم ليتم استخدامها مع هدف الماء (وليس النفط).
- وضع قطرة كبيرة من النفط الغمر على الهدف لضمان أن الفيلم النفط بين الهدف وغطاء زجاجي لن يكسر بينما يتحرك المرحلة في مناصب مختلفة الجنين أثناء التصوير. وضع آمن طبق من الزجاج السفلي على خشبة المسرح بحيث الطبق لا يتحول عندما يتحرك المرحلة. إذا كان ذلك ممكنا، استخدم مرحلة ساخنة في 28 درجة مئوية، ودرجة الحرارة المثلى للتنمية الزرد.
- تحديد موقف كل جنين في حزمة برامج المجهر متحد البؤر ل. ضبط ض متعمقة لكل الجنين، ومحاولة لاستهداف تقريبا نفس الطائرة في كل جنين.
ملاحظة: حوالي 30 ميكرون من القطب الحيواني هو الذهابعمق التطوير التنظيمي منذ في هذا العمق طبقة يغلف الجنين يمكن تجنبها، يتم تكبير مساحة التصوير، وتشتت الضوء هو الحد الأدنى. شريحة ضوئية واحدة مع سمك 3.3 ميكرون ~ توفر بيانات كافية. ليست هناك حاجة للحصول على كومة ض (انظر القسم 5). - جمع إشارتين خلال التجربة: إشارة "الخضراء" من Alexa488-ديكستران المكورات-التي سيتم استخدامها خلال تحليل البيانات لعزل خارج الخلية والخلايا مضان وإشارة "الحمراء" من البروتين الانصهار بعد photoconverted ذلك.
- تثير Alexa488 باستخدام الليزر 488 نانومتر، وجمع مضان المنبعثة بين ~ 500 و 540 نانومتر. ملاحظة: بعد photoconversion، وكثير الأخضر إلى الأحمر البروتينات photoconvertible (على سبيل المثال، Dendra2) يمكن أن تكون سعيدا مع ليزر 543 نانومتر، وتنبعث مضان بين ~ 550 و 650 نانومتر. ضبط حسب الضرورة بناء على البروتين photoconvertible المستخدمة.
- الحصول على "ما قبل photoconversion"الصور، وتكوين البرمجيات المجهر متحد البؤر لصورة كل موقع من المواقع المحددة سابقا (من الخطوة 3.2) مع الظروف التصوير المناسبة كل 10 دقيقة أو 20 لدورة الوقت خمس ساعات (انظر القسم 5 و المناقشة).
- لphotoconvert البروتين الانصهار، والتحول إلى هدف 10X وفضح مجموعات من الأجنة لضوء الأشعة فوق البنفسجية من مصباح قوس الزئبق مع فلتر ~ 300-400 نانومتر الإثارة في الانتاج بنسبة 100٪ لمدة 2 دقيقة. تحويل التركيز على طول المحور Z لتعزيز photoconversion موحد (انظر القسم 5). تأكد من أن النفط الغمر لا بالتنقيط على الهدف 10X خلال photoconversion.
ملاحظة: يمكن أن يكون آليا والتحول من التركيز خلال photoconversion من أجل تجنب التباين بين المجربون. - التبديل إلى الهدف 25X 40X أو مباشرة بعد photoconversion. تأكد من أن المواقف المحددة سابقا من الخطوة 3.2 لا تزال دقيقة. إذا تحول طبق خلال photoconversion، إعادة تحديد مواقف الأجنة.
- بدء تشغيل البرنامج تم إنشاؤه في الخطوة 3.4 والسماح لمواصلة التصوير لمدة 5 ساعة. لاحظ الوقت المنقضي بين photoconversion وبدء التصوير لكل الجنين.
- أحيانا اطمئنان على التجربة. رصد مستوى المتوسطة Danieau وإضافة المزيد إذا لزم الأمر. إعادة تشغيل البرنامج إذا لم تعثر عليه.
- من أجل تحديد القيم مضان الخلفية التي سيتم استخدامها خلال تحليل البيانات لتقدير الخط المقارب لنموذج تناقص بشكل كبير، وتشمل بعض الأجنة التي تم حقنها مع Alexa488-ديكستران ولكن ليس مرنا في التجربة. لتحديد الضوضاء الصك، والتي ستستخدم أيضا خلال تحليل بيانات لاحقة، والحصول على صورة في حالة عدم وجود عينة.
4. تحليل البيانات باستخدام PyFDAP
- تفقد البصر مجموعات البيانات بالطبع الوقت من كل جنين. تجاهل مجموعات البيانات من الأجنة التي توفيت خلال ايماججي، التي تحولت بشكل ملحوظ، والتي لديها مستويات منخفضة جدا من إشارة photoconverted، أو التي تحتوي على مناطق الخلايا التي تبدو غير عادية، وقد توقفت عن الحركة وتقسيم (نموذجي من الأجنة المصابة أو المريضة).
ملاحظة: أحيانا، فقاعات في مجال النفط الغمر أو سوف تظهر غيرها من الأعمال الفنية في واحد أو اثنين من الصور في مجموعة البيانات صالحة للاستعمال على خلاف ذلك. ملاحظة أي الصور التي تحتوي على القطع الأثرية. سيتم التخلص منها في وقت لاحق، ونقاط الوقت المتبقي من هذا مجموعة من البيانات لا يزال من الممكن تحليلها. - استخدام على بايثون حزمة برامج PyFDAP لتحليل البيانات FDAP. PyFDAP يحسب نصف العمر من خلال تحديد متوسط داخل الخلايا وخارج الخلية كثافة مضان أحمر في كل صورة وتركيب البيانات مع خفض أضعافا مضاعفة وظيفة 56 (الشكل 3).
- تحميل PyFDAP (انظر قائمة المواد).
- استخدام PyFDAP لفصل داخل وخارج الخلية إشارة photoconverted (الشكل 3A، B). لناالبريد إشارة Alexa488، والتي هي بدقة بين الخلايا، لإنشاء قناع داخل الخلايا. تطبيق هذا القناع إلى المقابلة صورة القناة الحمراء لمنع بكسل داخل الخلايا من التي يجري النظر فيها عند حساب متوسط كثافة الخلية. لقياس متوسط كثافة الخلايا، عكس القناع.
- في PyFDAP، عرض الصور ملثمين إنشاؤها في الخطوة 4.2.2. تفقد البصر هذه الصور وتجاهل مجموعات البيانات التي أقنعة لا تميز بدقة بين الخلايا من الفضاء خارج الخلية (هذا ينبغي أن يكون نادر، علما مدرجة أن أغشية الخلايا في الصور التي تم ملثمين الفضاء خارج الخلية، لكنها يمكن إزالتها عن طريق تغيير العتبة الخوارزمية أو عن طريق إدخال قناع غشاء (على سبيل المثال، وذلك باستخدام غشاء CFP)). أيضا تجاهل أي الصور واحدة تحتوي على التحف (على سبيل المثال، فقاعات في مجال النفط الغمر) التي تم تحديدها في الخطوة 4.1.
- استخدام PyFDAP لحساب متوسط كثافة مضان خارج الخلية والخلايا لمجموعة شرق افريقياح الصورة. PyFDAP تحسب هذه المتوسطات عن طريق جمع شدة بكسل التي تقع خارج نطاق القناع وقسمة العدد الكلي للبكسل لخص.
- احتواء البيانات مضان (الشكل 3C) مع الدالة الأسية التالية:
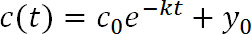
حيث t هو الوقت بعد photoconversion، ج (ر) هي شدة بقيمة معينة من ر، ج 0 هي كثافة في تي = 0، ك هو معدل إزالة مستمر، و y 0 هو الخط المقارب أن تقترب وظيفة مضان يقلل (1D الشكل). ذ 0 يمكن أن تكون مقيدة على أساس القياسات في الخطوة 3.8 19. - استخدام PyFDAP لحساب البروتين خارج الخلية والخلايا أعمار النصف (τ) من الثوابت معدل إزالة (ك) باستخدام العلاقة التالية:

5. تجارب مراقبة لتقييم photobleaching من، غافل Photoconversion، وPhotoconversion التوحيد
- تقييم photobleaching من
ملاحظة: photobleaching من يمكن أن تسبب انخفاضا مصطنعة في كثافة مضان التي تعكس خصائص التبييض من بروتين فلوري بالإضافة إلى التخليص من البروتين من الفائدة.- لتقييم احتمال photobleaching من، نفذ مجموعة واحدة من التجارب FDAP مع 10 دقيقة فترات بين التصوير ومجموعة ثانية مع 20 دقيقة فترات بين التصوير (الشكل 4). تحليل البيانات من كلتا المجموعتين من التجارب باستخدام PyFDAP كما هو موضح في القسم (4).
- قارن حياة نصف من التجارب فترة 10 دقيقة و 20. يعد نصف حياة من 20 دقيقة التجارب الفاصلة تشير photobleaching من كبير. إذا كانت أعمار النصف من كل التجارب متطابقة، فوتobleaching ليس مصدر قلق كبير.
- بدلا من ذلك، تقييم photobleaching من خلال الحصول على سلسلة من ~ 30 صورة مباشرة بعد photoconversion. انخفاض كبير في كثافة مضان يشير photobleaching من كبير.
- إذا تم الكشف عن photobleaching من، استخدام أقل قوة الليزر، وتقليل وقت التصوير، أو النظر في استخدام photoconvertible البروتين أكثر صامد 32.
- تقييم photoconversion غير مقصود.
ملاحظة: Dendra2 يمكن photoconverted باستخدام 488 نانومتر إضاءة 27. عندما Alexa488 المثير مع ليزر 488 نانومتر كما هو موضح في الخطوة 3.3.1، photoconversion غير مقصود، وبالتالي زيادة مصطنعة في الظاهر عمر النصف من البروتين من الفائدة هو ممكن. ومع ذلك، نحن وغيرنا 33 وقد وجد أن 488 نانومتر الإضاءة هي طريقة غير فعالة للphotoconversion في الأجنة الزرد.- استخدام التجربة السيطرة هو موضح في الخطوة 5.1.1 للكشف عن photoconversion غير مقصود. قارن حياة نصف من التجارب فترة 10 دقيقة و 20. أقصر نصف العمر من 20 دقيقة التجارب الفاصلة تشير photoconversion غير مقصود كبير. إذا كانت أعمار النصف من كل التجارب متطابقة، photoconversion غير مقصود ليست مصدر قلق كبير.
- إذا تم الكشف عن photoconversion غير مقصود، واستخدام أقل قوة الليزر 488 نانومتر والأوقات التصوير أقصر لتجنب عن غير قصد photoconverting Dendra2.
- تقييم photoconversion التوحيد.
ملاحظة: إذا كان متحيزا photoconversion نحو القطب الحيواني من الجنين، وسوف تتأثر الانخفاض في مضان من البروتين نشر أو حركة الخلية إلى طائرات أعمق (الشكل 5A).- لتحديد ما إذا photoconversion موحد، والتعبير عن بروتين يفرز photoconvertible (لاجراء تجارب مع البروتينات الانصهار خارج الخلية) أو البروتين photoconvertible هيولي (لاجراء تجارب مع البروتينات الانصهار داخل الخلايا). Photoconvert كالعادة، رالدجاجة تكتسب ض المكدس تشمل معظم الأريمة كل 20 دقيقة لمدة 80 دقيقة.
- إذا منحازة photoconversion نحو القطب الحيواني، فإن كثافة مضان في الطائرات أعمق تزيد بمرور الوقت بسبب نشر أو حركة الخلية (الشكل 5B). إذا تم الكشف غير موحدة photoconversion، والتركيز أعمق في الأجنة خلال photoconversion.
Access restricted. Please log in or start a trial to view this content.
النتائج
وقد استخدم FDAP لتحديد أعمار النصف من البروتينات مما يشير إلى خارج الخلية في الأجنة الزرد 19. واحدة من هذه البروتينات، الحول، يدفع التعبير عن الجينات mesendodermal خلال مرحلة التطور الجنيني 34. الحول-Dendra2 ينشط التعبير عن الجينات mesendodermal عند مستويات مماثلة لغير محدد ...
Access restricted. Please log in or start a trial to view this content.
Discussion
نجاح تجربة FDAP يعتمد على توليد وظيفية photoconvertible البروتين الانصهار. يمكن وضع علامات البروتين يؤثر على نشاطها البيولوجي و / أو الخصائص الفيزيائية الحيوية، بما في ذلك تمركز لها، والذوبان، والاستقرار 36-41. تكون على استعداد لاختبار النشاط من عدة ثوابت الانصهار مختلفة ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الكتاب ليس لديهم الصراعات في الكشف عنها.
Acknowledgements
فإن الكتاب أود أن أشكر جيفري فاريل، جيمس غانيون، وجنيفر بيرجمان للتعليق على المخطوطة. وأيد KWR من قبل البرنامج الوطني مؤسسة عليا العلوم بحوث زمالة خلال تطوير فحص FDAP. وأيد هذا العمل من المنح المقدمة من المعاهد الوطنية للصحة لAFS ومن المنح المقدمة من المؤسسة الألمانية للبحوث (برنامج نويثر إيمي)، وجمعية ماكس بلانك، وبرنامج الإنسان الحدودي العلوم (جائزة التطوير الوظيفي) لPM.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| PyFDAP (download from the following website: http://people.tuebingen.mpg.de/mueller-lab) | Install and operate using the instructions provided on the PyFDAP website; PyFDAP is compatible with Linux, Mac, and Windows operating systems. | ||
| mMessage mMachine Sp6 Transcription Kit | Life Technologies | AM1340 | To generate capped mRNA for injection into embryos |
| Alexa488-dextran conjugate, 3 kDa | Life Technologies | D34682 | Co-inject with mRNA to create intracellular and extracellular masks |
| 6-well plastic dish | BD Falcon | Incubate embryos in agarose-coated wells until ready for mounting | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Protease from Streptomyces griseus | Sigma | P5147 | Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos at the one-cell stage |
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 200 ml glass beaker | For embryo dechorionation | ||
| Microinjection apparatus | For injection of mRNA and dye into embryos at the one-cell stage | ||
| Stereomicroscope | For injecting and mounting embryos | ||
| 1x Danieau's medium | Dilute low melting point agarose and perform imaging in this medium; recipe: 0.2 mm filtered solution of 58 mM NaCl, 0.7 mM KCl, 0.4 mM MgSO4, 0.3 mM CaCl2, 5 mM HEPES pH 7.2 | ||
| UltraPure low melting point agarose | Invitrogen | 16520-100 | For mounting embryos; use at a concentration of 1% in Danieau's medium: add 200 mg to 20 ml Danieau's medium, microwave until dissolved, then aliquot 1 ml into microcentrifuge tubes; aliquots can be stored at 4 °C, re-melted at 70 °C, and cooled to 40–42 °C when ready to use |
| Glass Pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For mounting embryos; flame the tip to prevent jagged edges from injuring embryos |
| Metal probe | For positioning embryos during mounting | ||
| Glass bottom dishes | MatTek | P35G-1.5-14-C | Use the appropriate cover glass thickness for your objective; part number listed here is for cover glass No. 1.5 |
| 15 ml tube filled with ~5 ml embryo medium | BD Falcon | For rinsing residual agarose from the Pasteur pipette | |
| Inverted laser scanning confocal microscope | A mercury arc lamp, 488 nm laser, 543 nm laser, and the appropriate filter sets are required | ||
| Heated stage | To maintain embryos at the optimal temperature of 28 °C during the experiment | ||
| Confocal software capable of time-lapse imaging | Must be able to define multiple positions and automatically image them at defined intervals | ||
| 25X or 40X water objective | Objective for imaging | ||
| 10X air objective | Objective for photoconversion | ||
| Immersion oil | Immersion oil with the same refractive index as water |
References
- Schwanhäusser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Boisvert, F. M., et al. A Quantitative Spatial Proteomics Analysis of Proteome Turnover in Human Cells. Molecular & Cellular Proteomics. 11 (3), 011429(2012).
- Belle, A., Tanay, A., Bitincka, L., Shamir, R., O'Shea, E. K. Quantification of protein half-lives in the budding yeast proteome. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13004-13009 (2006).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Parry, D. H., O'Farrell, P. H. The schedule of destruction of three mitotic cyclins can dictate the timing of events during exit from mitosis. Current Biology. 11 (9), 671-683 (2001).
- Holloway, S. L., Glotzer, M., King, R. W., Murray, A. W. Anaphase is initiated by proteolysis rather than by the inactivation of maturation-promoting factor. Cell. 73 (7), 1393-1402 (1993).
- Dharmasiri, N., Estelle, M. Auxin signaling and regulated protein degradation. Trends Plant Sci. 9 (6), 302-308 (2004).
- MacDonald, B. T., Tamai, K., He, X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Developmental Cell. 17 (1), 9-26 (2009).
- Chen, X., et al. Processing and turnover of the Hedgehog protein in the endoplasmic reticulum. The Journal of Cell Biology. 192 (5), 825-838 (2011).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicologic Pathology. 35 (4), 495-516 (2007).
- Yi, J. J., Ehlers, M. D. Emerging Roles for Ubiquitin and Protein Degradation in Neuronal Function. Pharmacological Reviews. 59 (1), 14-39 (2007).
- Rubinsztein, D. C. The roles of intracellular protein-degradation pathways in neurodegeneration. Nature. 443 (7113), 780-786 (2006).
- Müller, P., Schier, A. F. Extracellular Movement of Signaling Molecules. Developmental Cell. 21 (1), 145-158 (2011).
- Eldar, A., Rosin, D., Shilo, B. -Z., Barkai, N. Self-enhanced ligand degradation underlies robustness of morphogen gradients. Developmental Cell. 5 (4), 635-646 (2003).
- Zhou, P. Determining protein half-lives. Methods In Molecular Biology. 284, 67-77 (2004).
- Woodside, K. H. Effects of cycloheximide on protein degradation and gluconeogenesis in the perfused rat liver. Biochim Biophys Acta. 421 (1), 70-79 (1976).
- Schimke, R. T., Doyle, D. Control of enzyme levels in animal tissues. Annual Review of Biochemistry. 39, 929-976 (1970).
- Kenney, F. T. Turnover of rat liver tyrosine transaminase: stabilization after inhibition of protein synthesis. Science. 156 (3774), 525-528 (1967).
- Müller, P., et al. Differential Diffusivity of Nodal and Lefty Underlies a Reaction-Diffusion Patterning System. Science. 336 (6082), 721-724 (2012).
- Kiuchi, T., Nagai, T., Ohashi, K., Mizuno, K. Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension. The Journal of Cell Biology. 193 (2), 365-380 (2011).
- Plachta, N., Bollenbach, T., Pease, S., Fraser, S. E., Pantazis, P. Oct4 kinetics predict cell lineage patterning in the early mammalian embryo. Nature Cell Biology. 13 (2), 17-123 (2011).
- Drocco, J. A., Grimm, O., Tank, D. W., Wieschaus, E. Measurement and Perturbation of Morphogen Lifetime: Effects on Gradient Shape. Biophys J. 101 (8), 1807-1815 (2011).
- Zhang, L., et al. Method for real-time monitoring of protein degradation at the single cell level. BioTechniques. 42 (4), 446-450 (2007).
- Miyawaki, A. Proteins on the move: insights gained from fluorescent protein technologies. Nat Rev Mol Cell Biol. 12 (10), 636-668 (2011).
- Pantazis, P., Supatto, W. Advances in whole-embryo imaging: a quantitative transition is underway. Nat Rev Mol Cell Biol. 15 (5), 327-339 (2014).
- Lukyanov, K. A., Chudakov, D. M., Lukyanov, S., Verkhusha, V. V. Innovation: Photoactivatable fluorescent proteins. Nat Rev Mol Cell Biol. 6 (11), 885-891 (2005).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nature Biotechnology. 24 (4), 461-465 (2006).
- Zou, J., Wei, X. Transplantation of GFP-expressing Blastomeres for Live Imaging of Retinal and Brain Development in Chimeric Zebrafish Embryos. Journal of Visualized Experiments. (41), (2010).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. Journal of Visualized Experiments. (27), (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. Journal of Visualized Experiments. (25), (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), (1995).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nature Methods. 6 (2), 131-133 (2009).
- Dempsey, W. P., Qin, H., Pantazis, P. In Vivo Cell Tracking Using PhOTO Zebrafish. Methods in Molecular Biology. 1148, 217-228 (2014).
- Schier, A. F. Nodal Morphogens). Cold Spring Harbor Perspectives in Biology. 1 (5), a003459-a003459 (2009).
- Otsu, N. A threshold selection method from gray-level histograms. IEEE Trans Syst Man Cybern. 9 (1), 62-66 (1979).
- Pédelacq, J. -D., Cabantous, S., Tran, T., Terwilliger, T. C., Waldo, G. S. Engineering and characterization of a superfolder green fluorescent protein. Nature Biotechnology. 24 (1), 79-88 (2005).
- Swulius, M. T., Jensen, G. J. The Helical MreB Cytoskeleton in Escherichia coli MC1000/pLE7 Is an Artifact of the N-Terminal Yellow Fluorescent Protein Tag. Journal of Bacteriology. 194 (23), 6382-6386 (2012).
- Landgraf, D., Okumus, B., Chien, P., Baker, T. A., Paulsson, J. Segregation of molecules at cell division reveals native protein localization. Nature Methods. 9 (5), 480-482 (2012).
- Stadler, C., et al. Immunofluorescence and fluorescent-protein tagging show high correlation for protein localization in mammalian cells. Nature Methods. 10 (4), 315-323 (2013).
- Quattrocchio, F. M., Spelt, C., Koes, R. Transgenes and protein localization: myths and legends. Trends Plant Sci. 18 (9), 473-476 (2013).
- Morimoto, Y. V., Kojima, S., Namba, K., Minamino, T. M153R Mutation in a pH-Sensitive Green Fluorescent Protein Stabilizes Its Fusion Proteins. PLoS ONE. 6 (5), e19598(2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Waters, J. C. Accuracy and precision in quantitative fluorescence microscopy. The Journal of Cell Biology. 185 (7), 1135-1148 (2009).
- Moll, U. M., Petrenko, O. The MDM2-p53 interaction. Mol Cancer Res. 1 (14), 1001-1008 (2003).
- Auer, T. O., Duroure, K., De Cian, A., Concordet, J. P., Del Bene, F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair. Genome Research. 24 (1), 142-153 (2014).
- Bedell, V. M., et al. In vivo genome editing using a high-efficiency TALEN system. Nature. 491 (7422), 114-118 (2012).
- Hruscha, A., et al. Efficient CRISPR/Cas9 genome editing with low off-target effects in zebrafish. Development. 140 (24), 4982-2987 (2013).
- Hwang, W. Y., et al. Heritable and Precise Zebrafish Genome Editing Using a CRISPR-Cas System. PLoS ONE. 8 (7), 68708(2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology. 31 (3), 227-229 (2013).
- Zu, Y., et al. TALEN-mediated precise genome modification by homologous recombination in zebrafish. Nature Methods. 10 (4), 329-331 (2013).
- Keller, P. J., Schmidt, A. D., Wittbrodt, J., Stelzer, E. H. K. Reconstruction of Zebrafish Early Embryonic Development by Scanned Light Sheet Microscopy. Science. 322 (5904), 1064-1069 (2008).
- Blanchet, M. H., et al. Cripto Localizes Nodal at the Limiting Membrane of Early Endosomes. Science Signaling. 1 (45), ra13-ra13 (2008).
- Jullien, J., Gurdon, J. Morphogen gradient interpretation by a regulated trafficking step during ligand-receptor transduction. Genes & Development. 19 (22), 2682-2694 (2005).
- Incardona, J. P., et al. Receptor-mediated endocytosis of soluble and membrane-tethered Sonic hedgehog by Patched-1. Proceedings of the National Academy of Sciences of the United States of America. 97 (22), 12044-12049 (2000).
- Scholpp, S., Brand, M. Endocytosis Controls Spreading and Effective Signaling Range of Fgf8 Protein. Current Biology. 14 (20), 1834-1841 (2004).
- Bläßle, A., Müller, P. PyFDAP: Automated analysis of Fluorescence Decay After Photoconversion (FDAP) experiments. Bioinformatics. In Press, forthcoming (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved